不同脱色方法对油莎豆 多糖抗氧化与降血糖活性研究
2022-09-21张润阳蔡小双王祖斌廖树强刘华敏
陈 岩,张润阳,蔡小双,王祖斌,廖树强,刘华敏
(河南工业大学 粮油食品学院,河南郑州 450001)
中国是世界上油料需求最大的国家之一。近年来,中国油料产量虽连年递增,但缺口始终很大,中国每年大豆净进口量约占全球总贸易量的2/3,对外进口的依赖性非常大[1]。“油莎豆”(Cyperus esculentusL.)是油莎草的地下块茎,具有耐盐碱且含油量高(20%~36%)的特点,是集粮、油、牧、饲于一体的经济作物。其油脂中含有75%以上的不饱和脂肪酸,具有较高的营养价值,在油料行业应用前景广阔[2]。据报道,油莎豆具有降血糖、降血脂、保肝以及抗氧化等生理功能[3]。多糖作为油莎豆的主要成分之一,具有重要的生物活性,如免疫调节、降血糖、抗病毒等生物活性功能,具有较大的开发意义[4]。
一般在多糖的提取过程中,多糖中会混有大量色素,这些色素不仅会降低多糖的纯度,也会对多糖的活性和结构鉴定造成严重影响,因此脱色是对多糖深入研究中必不可少的步骤。多糖脱色的方法有很多,包括活性炭脱色、双氧水脱色、大孔树脂脱色等[5]。不同色素脱除的难易程度和最适合的脱除方法是不同的,因此本实验采用了多种脱色方法对油莎豆多糖进行脱色,并对脱色前后的多糖保留率、抗氧化活性、降血糖活性等指标进行测定,对比得出最适宜的脱色方法。而有关不同脱色方法对油莎豆多糖活性的影响在文献中未见报道,因此本实验将为油莎豆多糖的深入研究和应用提供基础。
1 材料与方法
1.1 试验材料
油莎豆采购自河北沧州市场,油莎豆经粉碎后过40目孔径筛,索氏抽提后得脱脂油莎豆粉[6];反式-1,2-环己二胺四乙酸、葡萄糖、浓硫酸、硫酸亚铁、水杨酸、双氧水、乙酸钠、氯化铁、1,1-二苯基-2-三硝基苯肼(DPPH)及抗坏血酸等均为分析纯;N,N-二甲基对苯二胺二盐酸盐(1,4-Amino-N,N-dimethylaniline,dihydrochloride,DMPD)采购于麦克林生化科技有限公司;透析袋(1000 Da),植物总酚(Total Phenols,TP)含量检测试剂盒,活性炭粉(CAS:7440-44-0),对硝基苯基-β-D-吡喃葡萄糖苷(PNPG),D900大孔弱碱性阴离子交换树脂,AB-8弱极性大孔吸附树脂,XAD-2非极性大孔吸附树脂,HPD5000极性大孔吸附树脂,D101非极性大孔吸附树脂,糖化酶,采购于索莱宝科技有限公司。
1.2 仪器与设备
HL-2B数显恒流泵,上海沪西分析仪器有限公司;BSZ-100数显自动收集器,上海沪西分析仪器有限公司;LGJ18C冷冻干燥机,北京四环科学仪器厂;UV-6000PC紫外可见分光光度计,上海元析仪器有限公司;1410101酶标仪,赛默飞世尔科技公司等。
1.3 试验方法
1.3.1 油莎豆多糖的提取
提取过程根据参考文献[7],将0.05 mol/L碳酸钠溶液与脱脂油莎豆粉按照1∶15(mL∶g)的液料比混合,搅拌24 h后在4500 r/min的条件下离心20 min,收集上清液后使用6 mol/L盐酸调其pH值至4.5,搅拌30 min,在4500 r/min的条件下离心 20 min,舍弃下层的蛋白质沉淀,只收集上清液,将上清液抽滤,滤液调pH值至中性,真空旋蒸浓缩至原体积的1/10,加3倍95%乙醇,4 ℃醇沉3 h[8]。沉淀溶于适量水后用1000 Da的透析袋进行流水透析,冻干得到油莎豆粗多糖。
1.3.2 油莎豆多糖的脱色
(1)活性炭脱色。配制1 mg/mL的多糖溶液,加入1%的活性炭,在40 ℃条件下慢速搅拌3 h[9],冰水浴后在4800 r/min条件下离心30 min,取上清液在45 ℃条件下真空旋蒸浓缩,冻干即得活性炭脱色后的多糖。
(2)大孔树脂脱色。先对树脂进行预处理[10],然后装柱。配制30 mg/mL的多糖溶液,分别用5种大孔树脂进行脱色,蠕动泵转速为30 r/min,收集多糖溶液。在45 ℃条件下真空旋蒸浓缩,冻干后即得树脂脱色后的多糖。
1.3.3 多糖保留率和蛋白质脱除率的测定
以葡萄糖的浓度(mg/mL)为横坐标,以吸光度为纵坐标,制作标准曲线[11],采用苯酚硫酸法测定多糖含量,多糖保留率按式(1)计算。

式中:m1为脱色后得到的多糖质量,mg;m2为脱色前的粗多糖质量,mg。
蛋白质含量的测定采用《出口乳、蛋、豆类食品中蛋白质含量的测定 考马斯亮蓝法》(SN/T 3926—2014)考马斯亮蓝法,蛋白质脱除率按式(2)计算。

1.3.4 色素去除率的测定
脱色前后的多糖配制成10 mg/mL的多糖溶液,利用紫外分光光度计,在470 nm处测定吸光度,色素去除率按式(3)计算[12]。

1.3.5 总酚含量的测定
使用植物总酚(Total Phenols,TP)含量检测试剂盒进行测定,先绘制标准曲线,测定油莎豆多糖中总酚含量时取500 μL多糖溶液,加入2.5 mL检测试剂盒中的提取液,超声提取30 min后在4800 r/min的条件下离心10 min,取上清液,配制混合溶液,在760 nm处测定吸光度,根据标准曲线进行计算。
1.3.6 抗氧化活性的测定
(1)羟基自由基清除率的测定。分别取10 μL 0.1 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL、 3.0 mg/mL、4.0 mg/mL和5.0 mg/mL的多糖样品溶液, 加入50 μL 1.8 mmol/L硫酸亚铁溶液、50 μL 1.8 mmol/L 水杨酸乙醇溶液,再加入50 μL 0.3 %双氧水启动反应,铝箔纸封盖,在37 ℃烘箱反应35 min,于510 nm处测定吸光度[12]。以蒸馏水代替多糖样品溶液为空白,以蒸馏水代替双氧水为对照。以维生素C作为阳性对照,按式(4)进行计算。

(2)DPPH自由基清除率的测定。以无水乙醇为溶剂,配制0.1 mmol/L的DPPH溶液,取25 μL多糖溶液和50 μL 0.1 mmol/L DPPH溶液,避光反应 30 min,于520 nm处测定吸光度。以无水乙醇代替多糖样品溶液为空白,以无水乙醇代替DPPH溶液为对照[13]。以维生素C作为阳性对照,按式(5)进行计算。
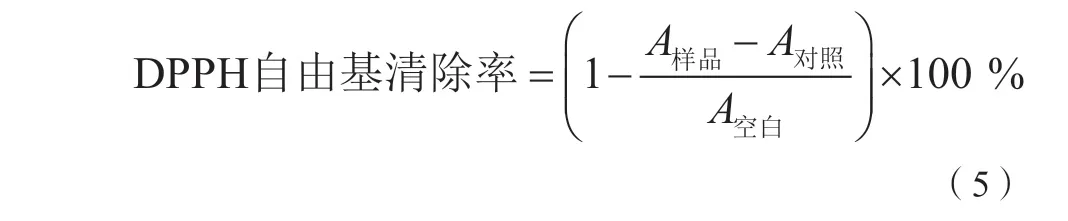
(3)DMPD自由基清除率的测定。将1 mL 0.05 mol/L DMPD溶液与100 mL 0.2 mol/L醋酸盐缓冲液混合均匀,加入0.2 mL 0.05 mol/L FeCl3溶液启动反应,制备成DMPD+溶液。取25 μL多糖溶液和 200 μL DMPD+溶 液,在 室 温 下 反 应10 min,于 510 nm处测定吸光度。以缓冲液代替多糖样品溶液为空白,以缓冲液代替DMPD+溶液为对照[14]。以维生素C作为阳性对照,按式(6)进行计算。
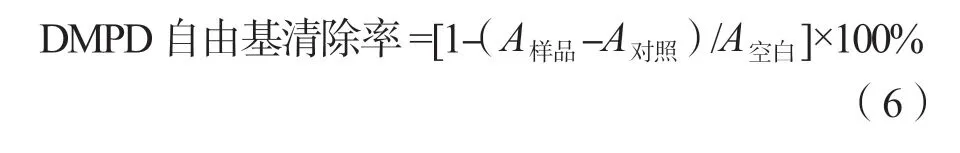
1.3.7 α-葡萄糖苷酶抑制率的测定
取5 μL多糖溶液、25 μL 500 U/mL α-葡萄糖苷酶、140 μL 0.1 mol/L磷酸盐缓冲液(pH=6.8)混合,在37 ℃烘箱内反应5 min,再加入25 μL 24 mmol/L PNPG溶液,在37 ℃烘箱内反应15 min,最后加入100 μL 0.2 mol/L Na2CO3终止液,于405 nm处测定吸光度。以蒸馏水代替样品溶液为空白,以蒸馏水代替α-葡萄糖苷酶为对照[15]。按式(7)进行计算。
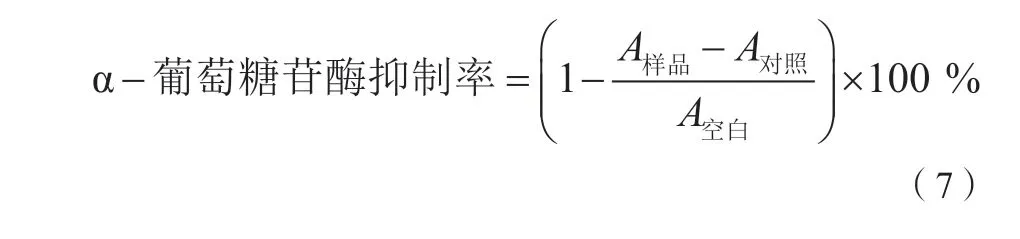
2 结果与分析
2.1 不同脱色方法对多糖保留率和蛋白质脱除率的影响
在多糖的提取过程中,常会有大量色素溶出并混入多糖,为了避免这些色素对多糖成品色泽、稳定性、功能性的影响,一般要进行脱色处理,且脱色的重要原则是多糖保留率高、色素去除率高。如图1所示,AB-8脱色后的多糖保留率最高(71.0%),D900脱色后的多糖保留率最低(11.3%)。这是因为采用的大孔树脂极性不同,D900是大孔弱碱性阴离子交换树脂,其脱色后多糖保留率较低,这与D900的表面电特性和氢键相互作用有关[16]。AB-8是弱极性大孔吸附树脂,它比非极性大孔吸附树脂XAD-2和D101表现出更高的多糖保留率,可能是因为AB-8在脱色过程中多糖溶液中的色素和蛋白质易受到强偶极离子力的作用而被吸附,导致AB-8对多糖的吸附较少[17]。XAD-2是一种非极性的大网格树脂,以二乙烯苯为骨架结构,对于一些性质相近的分子和多种环状芳香族化合物有很强的吸附能力。与XAD-2类似,D101大孔吸附树脂是苯乙烯型非极性共聚体,对于不带极性的有机化合物有良好的吸附效果。但是二者孔径相差很大,XAD-2的孔径一般在0.9 μm左右,而D101的孔径只有9~10 nm。因此,XAD-2的吸附量更大,导致多糖保留率低于D101。

图1 不同脱色方法对油莎豆多糖保留率的影响
从天然产物中提取的多糖,常含有蛋白质,给后续多糖的分析带来困难,大孔树脂和活性炭在对多糖脱色的过程中还可以脱除一定量的蛋白质,因此蛋白质脱除率也是衡量脱色效果的重要指标。脱色前油莎豆多糖中的蛋白质含量为1.7%,如图2所示,AB-8脱色后的多糖蛋白质脱除率最高(91.1%),其次是XAD-2(88.5%),不同方法脱色后的多糖蛋白质脱除率存在差异,这与树脂的物理结构和被吸附物质的物理和化学特性有关[18]。D101和XAD-2都是非极性大孔吸附树脂,而D101脱色后的多糖蛋白质脱除率最低(21.4%),这是因为D101比XAD-2的孔径小,导致D101对蛋白质的吸附量少,因此蛋白质脱除率较低。活性炭一般被认为具有良好的脱色能力,在本研究中活性炭对多糖中的蛋白质也有一定的脱除效果,可能因为多糖中有一部分色素和蛋白质以结合状态存在,活性炭在吸附色素的同时脱除了部分蛋白质[19]。
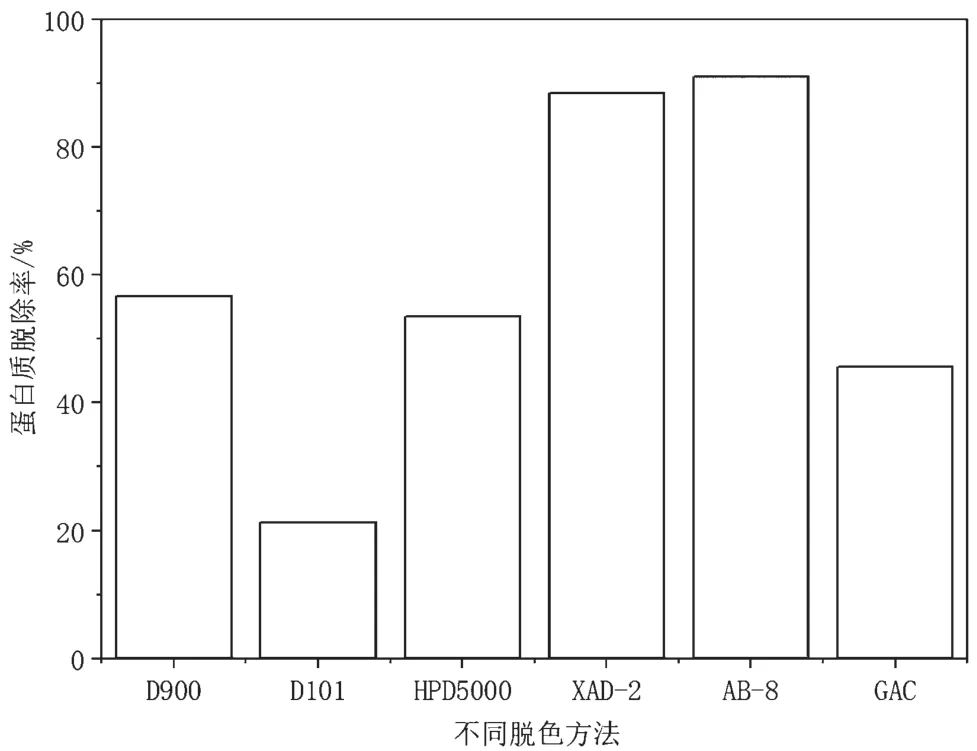
图2 不同脱色方法对油莎豆多糖中蛋白质脱除率的影响
2.2 不同脱色方法对多糖色素去除率的影响
如图3所示,活性炭脱色后的多糖色素去除率最高(84.5%),其次是AB-8(75.2%),而HPD5000 脱色后的多糖色素去除率最低(60.1%)。活性炭具有较高的色素去除率,可能是由于其表面的碳原子是不饱和碳,它能与其他的原子或基团结合形成大量的化学基团,比如羟基、羧基、酯基、羰基和氨基等,因此多糖中的色素容易被活性炭吸附,此外,活性炭因立体网状结构而具有较大的比表面积,这也有利于它对色素的吸附作用[20-21]。AB-8是弱极性大孔吸附树脂,多糖中的色素可能大多数为弱极性色素,易被AB-8吸附,导致AB-8脱色后的多糖色素去除率高。

图3 不同脱色方法对油莎豆多糖色素去除率的影响
同时对脱色前后10 mg/mL的油莎豆多糖溶液进行全波长扫描,如图4所示,脱色后的多糖溶液最大吸收波长均小于脱色前(354 nm),这可能是因为脱色过程中多糖、蛋白质、色素、酚类物质等被不同程度地吸附脱除,导致脱色后的最大吸收波长减小。活性炭和D101、HPD5000脱色后的多糖溶液最大吸收波长分别为233 nm、243 nm、237 nm,与脱色前的相差较大,可能因为这些方法脱色后多糖中的酮类或酚类物质损失较多[22],导致最大吸收波长与脱色前的存在较大差别。此外,除了活性炭,脱色前后的多糖溶液在200~400 nm存在两个吸收峰,而活性炭只在233 nm存在最大吸收峰,这可能是因为多糖中的色素吸收峰在345 nm左右,而活性炭脱色后的多糖色素去除率较高,导致脱色后的多糖溶液在345 nm左右未出峰。

图4 脱色前后油莎豆多糖溶液的全波长扫描
2.3 不同脱色方法对多糖中总酚含量的影响
酚类物质大多具有抗氧化、抗癌、抗逆等作用[23]。如图5所示,脱色后的油莎豆多糖中总酚含量低于脱色前,其中D900脱色后的多糖总酚含量损失最少,XAD-2脱色后的多糖总酚含量损失较多,XAD-2是非极性大孔吸附树脂,可能因为多糖中的酚类物质大多为非极性,XAD-2对其有较强的吸附作用,导致脱色后酚类物质损失较多。与多糖保留率和蛋白质脱除率的情况相似,同样也是非极性大孔吸附树脂的D101由于孔径较小,对酚类物质的吸附量比XAD-2少,导致总酚含量大于XAD-2。同时,因为活性炭对羰基、羧基、内酯基、酚羟基等有一定的吸附作用[24],导致活性炭脱色后的多糖酚类物质损失较多。此外,与靖边黑豆的总酚含量(5.1 mg/g)[25]、灰枣的总酚含量(8.8 mg/g)[26]相比,脱色前的油莎豆多糖中总酚含量较高(10.6 mg/g),表明油莎豆多糖具有一定营养价值和生物活性。
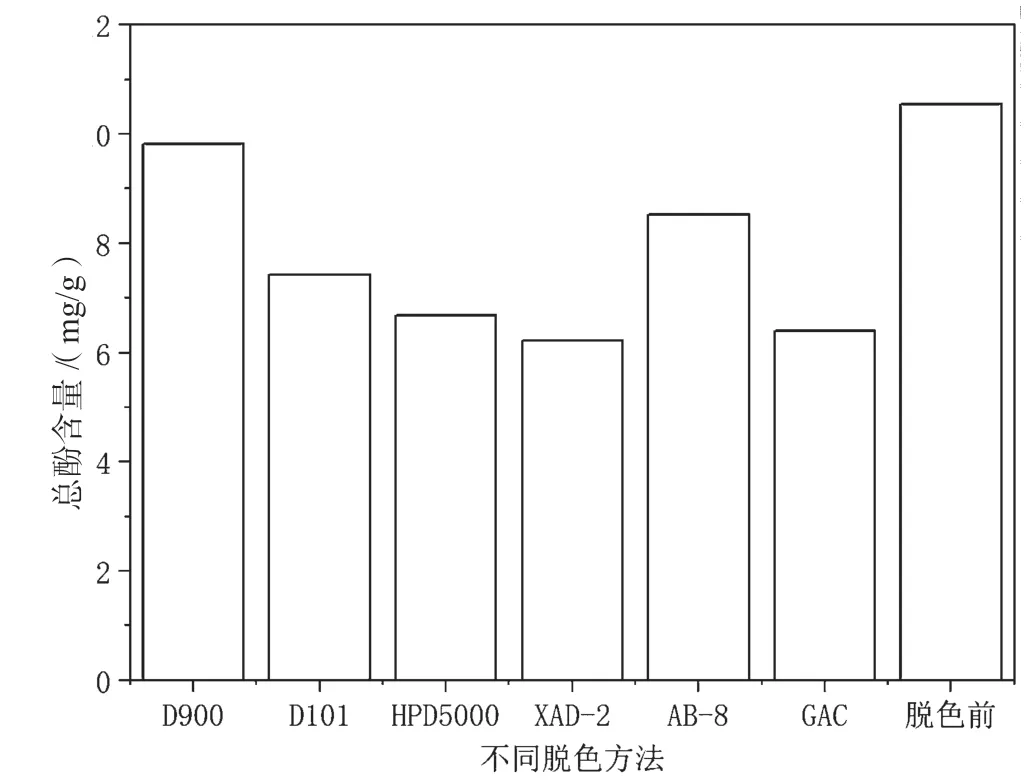
图5 不同脱色方法对油莎豆多糖中总酚含量的影响
2.4 不同脱色方法对多糖的羟基自由基清除率的影响
过量的羟基自由基是造成生物有机体氧化损伤的原因之一,并能对人体造成一定程度的危害[27]。如图6所示,随着油莎豆多糖浓度的增加,羟基自由基清除率也不断增加。脱色后多糖的羟基自由基清除率总体上大于脱色前,这是脱色后多糖得到了纯化和富集所导致的,同时也说明了油莎豆多糖比其所含有的色素有更强的羟基自由基清除率[28]。多糖浓度为5 mg/mL时,活性炭脱色后的多糖羟基自由基清除率为99.6%,这可能是因为活性炭脱色后的多糖色素去除率最高,多糖暴露出了更多的活性位点[12],使其对羟基自由基有良好的清除效果。相对于其他的脱色方法,D900脱色后的多糖羟基自由基清除率较低,这是因为D900脱色后的多糖保留率低,较多的多糖被D900吸附,导致脱色后的多糖对羟基自由基的清除效果较差。D101和XAD-2都是非极性大孔吸附树脂,且D101脱色后的多糖保留率大于XAD-2,但当多糖浓度为0.5~4.0 mg/mL时,D101脱色后的多糖羟基自由基清除率小于XAD-2,这可能和脱色后的多糖纯度及其空间构象等有关[29]。此外,在测定范围内,脱色前后的油莎豆多糖清除羟基自由基的能力大于维生素C,表明其具有较强的清除羟基自由基的能力。
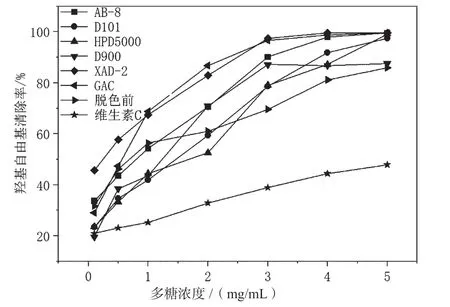
图6 不同脱色方法对油莎豆多糖清除羟基自由基能力的影响
2.5 不同脱色方法对多糖的DPPH自由基清除率的影响
如图7所示,随着油莎豆多糖浓度的增加,DPPH自由基清除率也不断增加。脱色后多糖的DPPH自由基清除率明显小于脱色前,这可能是脱色前的粗多糖和色素、蛋白质、酚等物质的共同作用[30],使得DPPH自由基清除率较高,而脱色后这些物质减少,DPPH自由基清除率也减小。多糖浓度为 5 mg/mL时,AB-8脱色后的多糖DPPH自由基清除率较大(84.1%),这可能是因为AB-8脱色后的多糖保留率高,活性基团损失少,使它对DPPH自由基的清除效果比其他脱色方法更好。HPD5000脱色后的多糖保留率仅次于AB-8,但HPD5000脱色后多糖的DPPH自由基清除率最小(42.6%),可能因为其脱色后的多糖总酚含量较少,而酚类物质有较强的抗氧化活性[23]。此外,脱色前的油莎豆多糖浓度在3~5 mg/mL时,DPPH自由基清除率和维生素C相当,表明脱色前的油莎豆多糖具有良好的DPPH自由基清除能力。
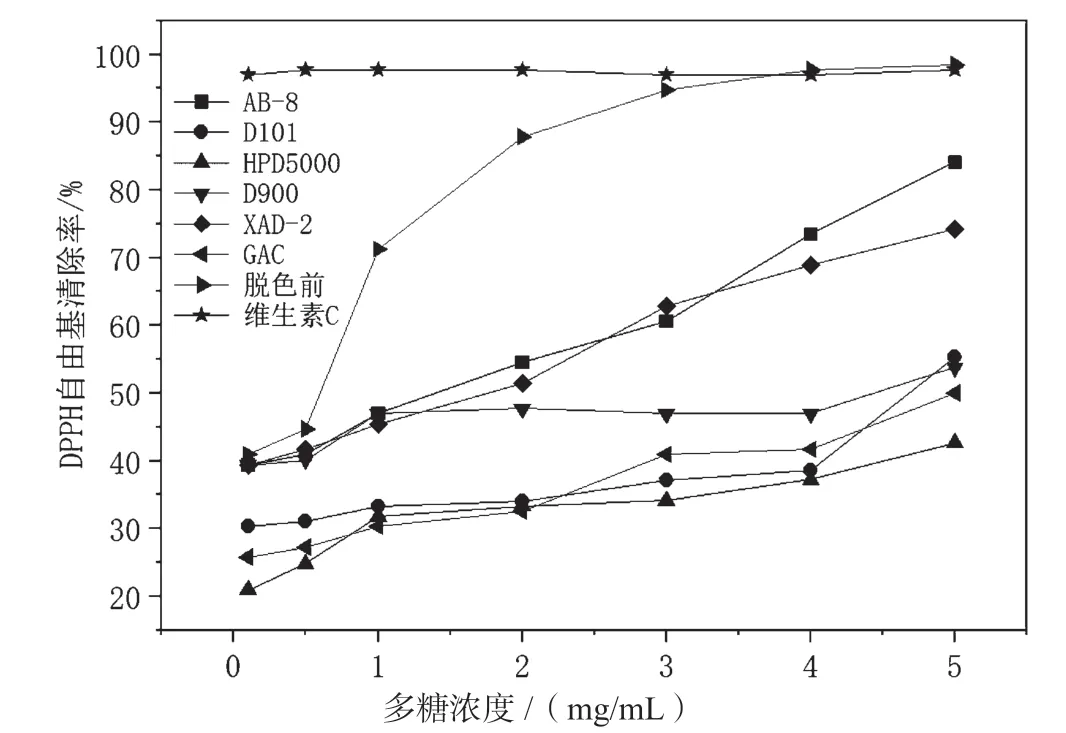
图7 不同脱色方法对油莎豆多糖清除DPPH自由基能力的影响
2.6 不同脱色方法对多糖DMPD自由基清除率的影响
如图8所示,随着油莎豆多糖浓度的增加,DMPD自由基清除率也不断增加。除D900外,其他方法脱色后多糖的DMPD自由基清除率总体大于脱色前,与油莎豆多糖对羟基自由基的清除率类似,这可能是脱色后多糖得到了纯化和富集的结果[28]。多糖浓度为5 mg/mL时,活性炭脱色后的多糖DMPD自由基清除率最大(81.3%),D900脱色后的多糖DMPD自由基清除率最小(35.5%),不同方法脱色后的多糖DMPD自由基清除率存在一定差异,这和多糖的组成和结构有很大关系,其因素包括单糖组成、糖苷键种类、糖醛酸的含量等[31]。在测定的浓度范围内,D900脱色后的多糖DMPD自由基清除率始终最小,这是因为D900脱色后的多糖保留率较低,脱色过程中有较多的多糖损失,损失的多糖可能具有较强的DMPD自由基清除率[30]。脱色后的多糖浓度为5 mg/mL时,DMPD自由基清除率最大为81.3%,对DMPD自由基有良好的清除 效果。
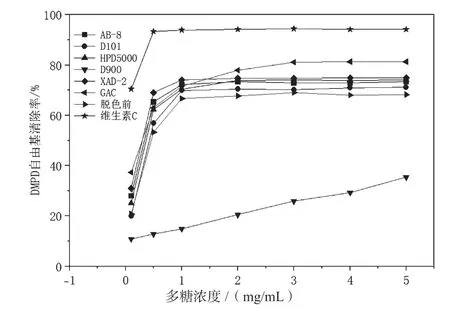
图8 不同脱色方法对油莎豆多糖清除DMPD自由基能力的影响
2.7 不同脱色方法对多糖的α-葡萄糖苷酶抑制率的影响
α-葡萄糖苷酶抑制剂可延缓或者抑制葡萄糖在肠道内的吸收,是治疗糖尿病的理想物质[32]。如图9所示,随着油莎豆多糖浓度的增加,α-葡萄糖苷酶抑制率增长缓慢。除XAD-2外,脱色后多糖的α-葡萄苷糖酶抑制率总体小于脱色前,在测定的浓度范围内,XAD-2脱色后的多糖α-葡萄糖苷酶抑制率最大,可能因为XAD-2脱色后多糖中与α-葡萄糖苷酶的作用位点暴露出来,两者通过相互作用结合形成了复合物,同时α-葡萄糖苷酶的蛋白质结构展开,使多糖对α-葡萄糖苷酶的抑制作用变得容易[31]。除XAD-2外,其他方法脱色后的多糖α-葡萄糖苷酶抑制率较小,这可能是因为脱色后多糖中的黄酮类物质减少,而这类物质可以通过非共价作用和蛋白质结合形成复合物,脱色前多糖中的黄酮类物质含量相对较多,容易通过非共价作用和α-葡萄糖苷酶结合抑制酶的活性[33]。
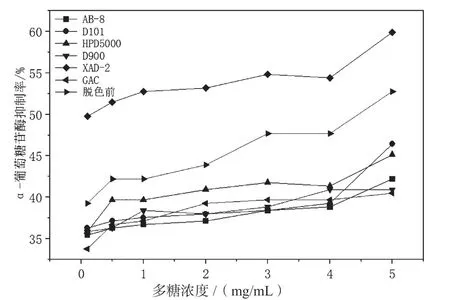
图9 不同脱色方法对油莎豆多糖抑制α-葡萄糖苷酶的影响
3 结论
本研究在提取油莎豆多糖后,选用6种不同的方法进行脱色,比较脱色效果、脱色前后多糖的抗氧化活性和α-葡萄糖苷酶抑制率。结果表明,AB-8综合效果最佳,脱色后多糖保留率和蛋白质脱除率分别为71.0%、91.1%,色素去除率为75.2%,总酚含量为8.5 mg/mL,多糖浓度为5 mg/mL时,羟基自由基清除率、DPPH自由基清除率和DMPD自由基清除率分别为99.6%、84.1%、73.3%,α-葡萄糖苷酶抑制率为42.2%。脱色前后的油莎豆多糖具有一定的抗氧化活性和α-葡萄糖苷酶抑制力,且随着多糖浓度的增加清除率和抑制力也不断增加,其中脱色后的多糖羟基自由基清除率和DMPD自由基清除率大于脱色前,而DPPH自由基清除率和α-葡萄糖苷酶抑制率总体上小于脱色前。此外,油莎豆多糖清除羟基自由基的能力较强,并且总酚含量较高,表明油莎豆多糖在未来有望作为天然的抗氧化剂应用于食品和医疗行业,具有广阔的应用前景。
