不同碳源条件下复合脱氮菌的脱氮性能研究
2022-09-20赫玲玲方玉美黄玉喜程顺利彭子涵肖进彬
赫玲玲, 方玉美, 黄玉喜, 程顺利, 彭子涵, 肖进彬
(河南省高新技术实业有限公司,郑州 450002)
伴随着我国工农业的不断发展,越来越多的生活污水、工业废水、农田施肥灌溉用水、水产及畜禽养殖粪污等污水排放到各类水体中,造成我国水体中的氮素输入量不断增加,甚至超出了水体的自净能力,严重污染了我国的淡水资源[1]. 水体中氮含量过高会引发一系列水生态和水环境问题,如水体富营养化、水体溶解氧降低、有害藻类大面积生长等,进而会造成水生动物缺氧死亡、水体黑臭,甚至会对人类健康造成威胁[2].
生物脱氮技术具有环境友好、无二次污染、安全高效、投资成本低等优点,被认为是最具发展前景的污水脱氮技术[3-5]. 在微生物菌群的作用下,污水中的氮素经过氨化、硝化、反硝化等过程后会转化为氮气而被去除[6-8]. 已有研究表明,复合菌株的脱氮效果明显好于单一菌株,因此关于使用复合菌株处理高氮废水的研究也越来越多. 吴岩等[9]将复合微生物菌剂BMc-1用于处理高浓度氨氮废水,结果发现该复合微生物菌剂具有强化生物工艺脱氮能力的作用;马梦雪等[10]对比了单一菌剂和复合菌剂对废水中总氮的去除效果,结果发现复合菌剂对总氮的去除率显著高于单一菌剂;田凤荣等[11]研究了菌株LH-N7、LH-N29及两株菌混合后的复合菌剂的脱氮性能,结果表明在最佳脱氮配比条件下,复合菌剂的脱氮效果明显提升. 实际上,在对含氮污水进行生物脱氮处理的过程中,因碳氮比失衡、有机碳源匮乏、脱氮菌群数量少等原因,大多数菌株的脱氮效率偏低. 因此,寻找优质高效的脱氮菌株不仅有助于提升生物脱氮效率,而且对含氮污水的处理具有重要的现实意义.
本研究以市售复合脱氮菌为研究对象,分析了其在不同碳氮源条件下的生长特性及脱氮效果,以期为该菌剂在污水处理中的实际应用提供参考.
1 材料与方法
1.1 菌株来源
复合脱氮菌为市场采购,由武汉水之国科技有限公司生产,其主要成分为芽孢杆菌属微生物及营养剂,有效活菌数≥2×1010cfu/g.
1.2 培养基
富集培养基:胰蛋白胨10 g,牛肉膏3 g,NaCl 5 g,去离子水1 L,pH 7.0,121 ℃灭菌25 min.
含氮培养基:(NH4)2SO40.47 g,KNO30.72 g,NaNO20.49 g,葡萄糖1.46 g,MgSO40.03 g,FeSO4·7H2O 0.01 g,CaCl20.05 g,K2HPO40.5 g,KH2PO40.25 g,去离子水1 L,pH 7.5,121 ℃灭菌25 min.
脱氮培养基:KNO30.72 g,葡萄糖1.46 g,MgSO40.03 g,FeSO4·7H2O 0.01 g,CaCl20.05 g,K2HPO40.5 g,KH2PO40.25 g,去离子水1 L,pH 7.5,121 ℃灭菌25 min.
1.3 不同培养条件下复合脱氮菌的生长特性及脱氮性能分析
1.3.1 复合脱氮菌生长曲线的绘制
取0.2 g复合脱氮菌加入含有100 mL富集培养基的250 mL锥形瓶中,在30 ℃、160 r/min条件下培养36 h,每3 h取一次样,并用紫外分光光度计测试其在600 nm处的吸光值(OD600),然后绘制出其生长曲线.
1.3.2 好氧条件下复合脱氮菌的生长特性及脱氮性能分析
取培养至对数期的复合脱氮菌菌液进行离心,弃上清液后用无菌水冲洗3次,再加入无菌水混匀即可制备成菌悬液,保存备用. 取5 mL 复合脱氮菌菌悬液加入含有100 mL 含氮培养基的250 mL 锥形瓶中,在30 ℃、160 r/min条件下培养6 d,定时取样测定其OD600值,同时将样品离心后测定上清液中的氨氮、硝态氮、亚硝态氮及总氮含量. 设计培养基初始碳氮比为5,氨氮、硝态氮、亚硝态氮的初始质量浓度均为100 mg/L.
1.3.3 厌氧条件下复合脱氮菌的生长特性及脱氮性能分析
取培养至对数期的复合脱氮菌菌液进行离心,弃上清液后用无菌水冲洗3次,再加入无菌水混匀即可制备成菌悬液,保存备用. 取10 mL 复合脱氮菌菌悬液加入含有200 mL 含氮培养基的250 mL 锥形瓶中,在30 ℃、60 r/min条件下培养6 d,定时取样测定其OD600值,同时将样品离心后测定上清液中的氨氮、硝态氮、亚硝态氮及总氮含量. 设计培养基初始碳氮比为5,氨氮、硝态氮、亚硝态氮的初始质量浓度均为100 mg/L.
1.4 厌氧条件下不同碳源条件对复合脱氮菌生长特性和脱氮效果的影响
1.4.1 厌氧条件下不同单一碳源对复合脱氮菌生长特性和脱氮效果的影响
首先在脱氮培养基中分别加入不同质量的葡萄糖、蔗糖、糖蜜、乙酸、乙酸钠、柠檬酸钠、淀粉、甲醇作为单一碳源处理组,并且设一组不加碳源的脱氮培养基作为空白对照,脱氮培养基中的初始碳氮比均为5,硝态氮初始质量浓度均为100 mg/L. 然后取10 mL复合脱氮菌菌悬液加入含有200 mL脱氮培养基的250 mL锥形瓶中,在30 ℃、60 r/min条件下培养6 d,定期取样测定其OD600值,同时将样品离心后测定上清液中的氨氮、硝态氮、亚硝态氮及总氮含量. 每组试验均设3个平行样.
1.4.2 厌氧条件下不同混合碳源对复合脱氮菌生长特性和脱氮效果的影响
首先按照表1 中的配比制备不同的混合碳源.然后将制备好的混合碳源分别加入脱氮培养基中,使脱氮培养基中的初始碳氮比均为5,硝态氮初始质量浓度均为100 mg/L. 最后取10 mL 复合脱氮菌菌悬液加入到含有200 mL 脱氮培养基的250 mL 锥形瓶中,在30 ℃、60 r/min 条件下培养4 d,定期取样测定其OD600值,同时将样品离心测定上清液中的氨氮、硝态氮、亚硝态氮及总氮含量. 每组试验均设3个平行样.

表1 不同混合碳源的配比设计Tab.1 Mix proportion design of different mixed carbon sources
1.4.3 厌氧条件下不同碳氮比对复合脱氮菌生长特性和脱氮效果的影响
首先分别向硝态氮初始质量浓度均为100 mg/L 的脱氮培养基中加入不同质量的混合碳源(即蔗糖+乙酸钠+柠檬酸钠),使脱氮培养基中的碳氮比(碳元素与氮元素的质量比,C/N)分别为5、10、15. 然后取10 mL复合脱氮菌菌悬液加入含有200 mL脱氮培养基的250 mL锥形瓶中,在30 ℃、60 r/min条件下培养3 d,定期取样测定其OD600值,同时将样品离心测定上清液中的氨氮、硝态氮、亚硝态氮及总氮含量. 每组试验均设3个平行样.
1.5 氨氮、硝态氮、亚硝态氮及总氮含量的测定方法
氨氮、硝态氮、亚硝态氮及总氮含量的测定分别采用纳氏试剂分光光度法[12]、双波长双光束分光光度法[13]、格里斯试剂分光光度法、碱性过硫酸钾消解紫外分光光度法[14].
1.6 数据分析
采用Origin 2018软件对数据进行分析.
2 结果与分析
2.1 不同培养条件下复合脱氮菌的生长特性及脱氮性能分析
2.1.1 复合脱氮菌生长曲线的绘制
图1为复合脱氮菌的生长曲线. 由图1可以看出,复合脱氮菌在0~3 h处于生长延滞期,菌体生长缓慢,3 h后进入对数生长期,菌群数量呈对数生长,15 h后菌体生长速度有所减缓,24 h后进入生长稳定期,菌体的生长速度与衰老速度达到动态平衡. 在使用该菌剂处理含氮污水时,建议先采用活化剂对其进行活化处理,再将其投入含氮污水中,因为活化处理可以使菌体密度增加,同时可增强菌体的生长活性,使其在污水环境中较快地起到脱氮作用.

图1 复合脱氮菌的生长曲线Fig.1 Growth curve of compound denitrifying bacteria
2.1.2 不同培养条件下复合脱氮菌的生长特性及脱氮性能分析
不同培养条件(厌氧条件及好氧条件)下复合脱氮菌的生长特性及脱氮性能如图2~3 所示. 由图2 可以看出,好氧条件下复合脱氮菌的生长速度明显快于厌氧条件. 好氧条件下,复合脱氮菌在0~1 d处于生长延滞期,1 d后进入对数生长期,3 d后进入生长稳定期,培养5 d时的菌体密度最大,此时的OD600值为1.212,5 d后进入生长衰退期;厌氧条件下,复合脱氮菌在0~2 d处于生长延滞期,2 d后对数生长期,5 d后进入生长稳定期,培养6 d时的菌体密度最大,此时的OD600值为0.744.基于此,推断该复合脱氮菌为异养型兼性厌氧菌.

图2 不同培养条件下复合脱氮菌的生长特性Fig.2 Growth characteristics of compound denitrifying bacteria under different cultural conditions
由图3 可以看出,复合脱氮菌在好氧条件下对氨氮的去除效果明显好于厌氧条件. 好氧条件下,培养1 d后氨氮浓度开始快速下降,3 d 后氨氮浓度的下降速度变缓,5 d 时氨氮的去除率最高,为49.7%;厌氧条件下,整个培养过程中虽然氨氮浓度有所降低,但变化并不明显,5 d 时氨氮的去除率最高,为17.5%. 复合脱氮菌在厌氧条件下对硝态氮的去除效果明显好于好氧条件;厌氧条件下,培养1 d 后硝态氮浓度开始快速下降,3 d 后硝态氮浓度的下降速度变缓,4 d 时硝态氮的去除率最高,为70.4%;好氧条件下,整个培养过程中虽然硝态氮浓度有所降低,但变化并不明显,6 d时硝态氮的去除率最高,为18.8%. 不同培养条件下,在整个培养过程中亚硝态氮浓度都一直处于增加状态;好氧条件下培养6 d时亚硝态氮的积累率最高,为40.5%;厌氧条件下培养6 d 时亚硝态氮的积累率最高,为52.8%. 不同培养条件下培养的前4 d,总氮浓度均一直处于下降状态,4 d后总氮浓度则均不再下降且保持稳定,推测产生这一现象的原因是:培养4 d后培养基中的营养物质大量减少,无法有效满足菌体的生长及代谢,从而导致复合脱氮菌的脱氮效率降低.

图3 不同培养条件下复合脱氮菌的脱氮效果Fig.3 Nitrogen removal efficiencies of compound denitrogenation bacteria under different cultural conditions
综上所述,在好氧条件下,复合脱氮菌对氨氮的去除效果较好,培养5 d时其对氨氮的去除率为49.7%,对总氮的去除率为20.8%;在厌氧条件下,复合脱氮菌对硝态氮的去除效果较好,培养4 d时其对硝态氮的去除率为70.4%,对总氮的去除率为25.6%.
生物脱氮可以发生在菌体生长的任何一个时期,具体因菌种的不同略有差异. 黄廷林等[3]研究发现,皮特不动杆菌(Acinetobacter pittii)的生物脱氮过程主要发生在其对数生长期;郭强等[4]研究发现,地衣芽孢杆菌(Bacillus licheniformis)的硝化和反硝化过程主要发生在其对数生长期和生长稳定期. 本研究中,复合脱氮菌对氨氮、硝态氮和总氮的去除过程与菌体的生长过程基本保持一致,主要发生在其对数生长期.
2.2 厌氧条件下不同碳源条件对复合脱氮菌生长特性和脱氮效果的影响
2.2.1 厌氧条件下不同单一碳源对复合脱氮菌生长特性和脱氮效果的影响
实际含氮污水中的碳氮比相对较低,导致水中微生物对氮素的利用率和转化率较低,因此外加碳源也是一种重要的促进生物氮循环的方式. 当前,在污水处理中常用的外加碳源种类较多,有含碳量较高的污水、糖类、低分子有机物和天然有机质等[15]. 本研究共选取了8种不同的物质作为外加碳源,以研究不同单一碳源对复合脱氮菌生长特性和脱氮效果的影响. 从2.1.2小节分析结果可知,复合脱氮菌在厌氧条件下对硝态氮和总氮的去除效果较好,故后续试验均在厌氧条件下进行.
由图4可以看出,在整个培养过程中,空白对照组中的OD600值、硝态氮浓度、亚硝态氮浓度、总氮浓度均无明显变化,而添加单一碳源后各处理组中的OD600值、硝态氮浓度、亚硝态氮浓度、总氮浓度均发生明显变化,且不同单一碳源对复合脱氮菌的OD600值及其脱氮效果的影响不同. 分析原因可能是:一方面,不同的碳源在为菌株的生长提供必要的能量时,因具有不同的氧化还原电位,可不同程度地提升微生物在反硝化过程中对氮的还原能力[16];另一方面,菌体在反硝化过程中因可利用的碳源种类不同而会参与不同的代谢途径,从而导致产生反硝化酶的种类和活性不同,最终会对菌体的脱氮效果产生不同的影响[17-18].
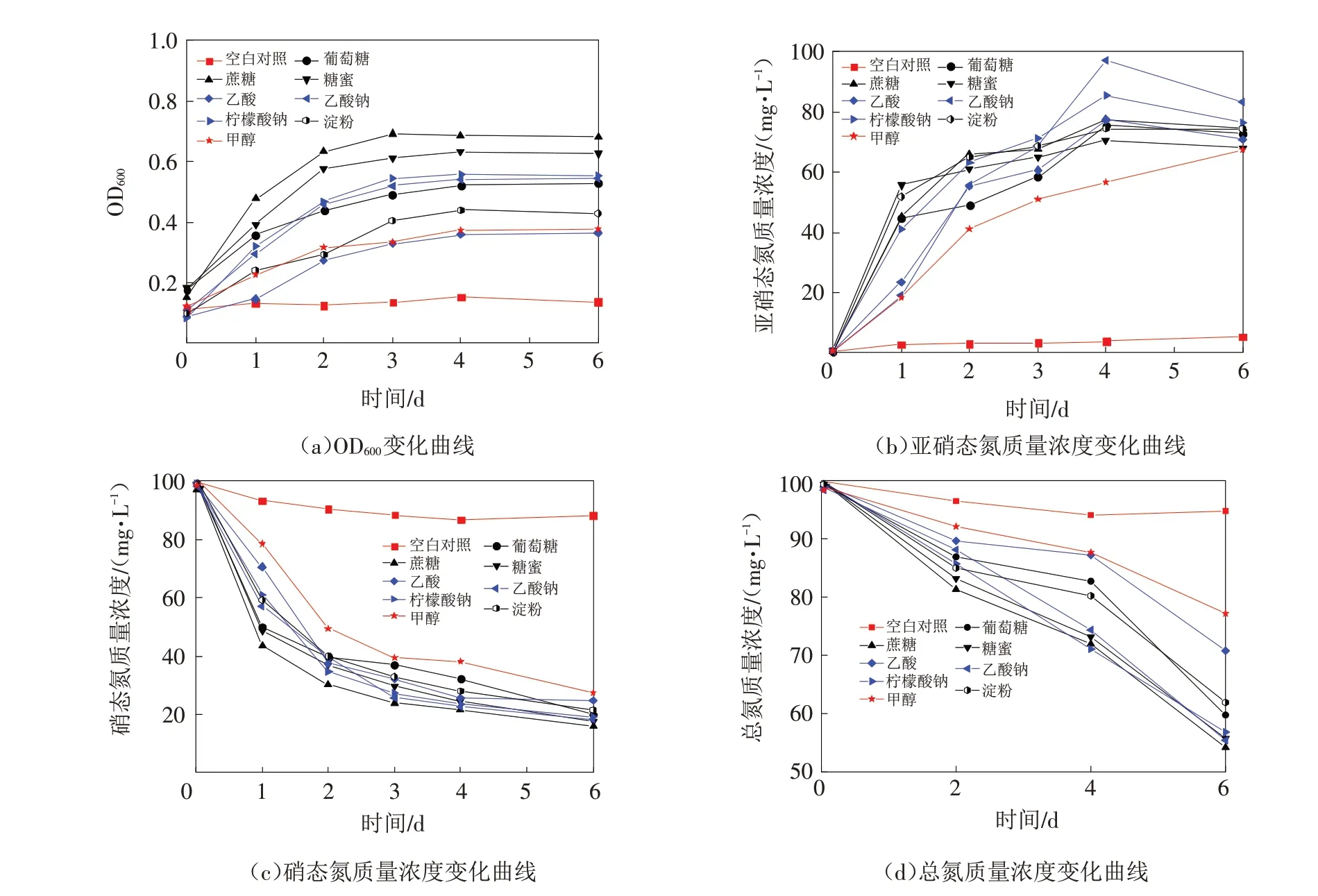
图4 厌氧条件下不同单一碳源对复合脱氮菌生长特性及脱氮效果的影响Fig.4 Effects of different single carbon sources on growth characteristics and nitrogen removal efficiencies of compound denitrifying bacteria under anaerobic condition
由图4可以看出,在以糖类(葡萄糖、蔗糖、糖蜜、淀粉)作为单一碳源的处理组中,复合脱氮菌的菌体密度更大,生长更好,能更早地进入对数生长期,且脱氮启动更快、脱氮效率更高. 由图4(b)和图4(c)可以看出,在以糖类作为单一碳源的处理组中,亚硝态氮浓度在培养的0~1 d内快速增加,1 d后增加速度变缓,4 d后保持稳定;硝态氮浓度在培养的0~1 d内迅速降低,1 d后降低速度变缓,4 d后基本保持稳定;在单一碳源为蔗糖、糖蜜、葡萄糖、淀粉的处理组中,硝态氮的最终去除率分别为84.2%、82.7%、80.0%、79.1%;在以乙酸钠、柠檬酸钠等低分子有机物作为单一碳源的处理组中,亚硝态氮浓度在培养的0~2 d内明显升高,2 d后增加速度变缓,4 d 后有下降趋势;硝态氮浓度在培养的0~2 d 内迅速降低,2 d 后降低速度变缓,4 d 后基本保持稳定;在单一碳源为乙酸钠、柠檬酸钠、乙酸、甲醇的处理组中,硝态氮的最终去除率分别为81.5%、80.9%、76.5%、73.3%. 以上结果说明,复合脱氮菌的脱氮过程主要为:菌体先将硝态氮还原为亚硝态氮,再将亚硝态氮还原为氮气逸出,且这个过程中几乎不产生氨氮. 理论上,碳源分子越小,越容易被反硝化菌利用,则菌株对污水的脱氮效果越好,但甲醇有弱毒性,会在一定程度上抑制菌体内的反硝化酶,从而影响反硝化反应的进行. 由图4(d)可以看出,除乙酸和甲醇处理组外,其他处理组中的复合脱氮菌在培养6 d 时对总氮的去除率在39.4%~46.5%之间.
综上可知,在以蔗糖为单一碳源的处理组中,复合脱氮菌的生长速度最快,菌体密度最大,培养3 d时其OD600值最大,为0.692,且在整个培养过程中复合脱氮菌一直表现出较好的硝态氮脱除效果;培养1 d时其对硝态氮的去除率为56.8%,培养3 d 时其对硝态氮的去除率为76.2%,培养6 d 时其对硝态氮的去除率为84.2%、对总氮的去除率为46.5%. 故建议选择蔗糖作为复合脱氮菌的单一外加碳源.
2.2.2 厌氧条件下不同混合碳源对复合脱氮菌生长特性和脱氮效果影响
研究表明,混合碳源可以为多种类型的细菌提供所需的能量,所以与外加单一碳源相比,外加混合碳源可以进一步提高微生物的脱氮效果,且可使亚硝态氮的最大积累量和积累率降低[19-20]. 熊子康等[21]研究发现,以混合碳源作为反硝化反应的电子供体时,多种类型的反硝化菌可以利用不同的物质获得所需能量,从而可增加反硝化菌的丰度、改变菌落结构、提高脱氮效果.
因为本研究中的复合脱氮菌是由多种芽孢杆菌属微生物组成,所以推测其在混合碳源系统中参与反硝化反应的微生物应多于单一碳源系统. 为了使复合脱氮菌在处理含氮污水时发挥更大的作用、提高其脱氮效率,同时为了降低单一碳源的投加成本,按照1.4.2小节中的方法进行试验,以研究不同混合碳源对复合脱氮菌生长特性和脱氮效果的影响,结果如图5所示.
由图5可以看出,在不同的混合碳源处理组中,复合脱氮菌均在培养的12 h左右就开始快速生长繁殖,2 d后菌株的生长基本都趋于稳定;硝态氮浓度在培养的0~2 d内快速降低,2 d后则均基本保持稳定;亚硝态氮浓度在培养的0~2 d内均快速增加,2 d后则均有下降趋势;总氮浓度在整个过程中均保持快速下降趋势.其中在蔗糖+乙酸钠+柠檬酸钠的处理组中,复合脱氮菌的菌体生长速度最快,菌体密度最大,且其在培养4 d时对硝态氮和总氮的去除率最高,分别为77.9%、26.8%. 综合分析,建议选择蔗糖+乙酸钠+柠檬酸钠(按照质量比为1∶1∶1的比例进行混合)作为复合脱氮菌的混合外加碳源.

图5 厌氧条件下不同混合碳源对复合脱氮菌生长特性及脱氮效果的影响Fig.5 Effects of different mixed carbon sources on growth characteristics and nitrogen removal efficiencies of compound denitrifying bacteria under anaerobic condition
2.2.3 厌氧条件下不同碳氮比对复合脱氮菌生长特性和脱氮效果的影响
碳氮比也是影响微生物脱氮效果的重要因素之一. 苏兆鹏等[22]研究表明,随着碳氮比的逐渐降低,菌株GJWA3对氨氮和亚硝态氮的去除率呈现出不断降低的趋势. 从2.2.1小节和2.2.2小节分析结果可知,复合脱氮菌在培养的3~5 d时便对硝态氮表现出明显的去除效果,故后续试验均培养3~5 d即可. 按照1.4.3小节中的方法进行试验以研究不同碳氮比对复合脱氮菌生长特性和脱氮效果的影响,结果如图6所示.

图6 厌氧条件下不同碳氮比对复合脱氮菌生长特性及脱氮效果的影响Fig.6 Effects of different ratios of carbon to nitrogen on growth characteristics and nitrogen removal efficiencies of compound denitrifying bacteria under anaerobic condition
由图6(a)可以看出,在培养的0~12 h内,不同处理组中复合脱氮菌的OD600值均迅速增加,12 h后复合脱氮菌的OD600值增加速度相对放缓,且碳氮比越大的处理组中复合脱氮菌的OD600值越大;当碳氮比为15时,复合脱氮菌在培养2 d时的OD600值最大,为0.828. 由图6(b)可以看出,除碳氮比为5的处理组外,其他处理组中亚硝态氮的积累均发生在培养的0~12 h内,12 h后亚硝态氮浓度均开始缓慢降低,2 d后则均开始快速降低,且碳氮比为15的处理组中,亚硝态氮浓度的降低速率最快. 由图6(c)可以看出,各处理组中,硝态氮浓度在培养的0~1 d内均快速降低,1 d后均相对稳定,2 d后则均有下降趋势. 由图6(d)可以看出,各处理组中的总氮浓度均在1 d后快速降低,且在碳氮比为15的处理组中,总氮浓度的降低速率最快.
综上可知,当碳氮比为15时,复合脱氮菌对硝态氮和总氮的去除效果最好,培养3 d时其对硝态氮和总氮的去除率分别是94.5%、68.6%;当碳氮比为10 时,培养3 d 时其对硝态氮和总氮的去除率分别为86.6%、45.5%;当碳氮比为5时,培养3 d时其对硝态氮和总氮的去除率分别为79.6%、26.2%. 以上结果说明,随着碳氮比的增加,复合脱氮菌的脱氮效果随之增加,即复合脱氮菌对硝态氮和总氮的去除率随碳氮比的增加而增大,分析原因可能是:一方面,碳氮比较高时,碳源相对充足,能促进反硝化阶段基因的表达,使得反硝化效率得以提高[23];另一方面,随着碳氮比的降低,异养反硝化反应电子供体出现由外碳源向内碳源和胞外聚合物的转换,但由于内碳源降解速率慢且含量有限,导致相关酶活性随碳源减少而降低[24].
3 结论
1)复合脱氮菌为异养型兼性厌氧菌,其在好氧条件下的生长速度优于厌氧条件.
2)复合脱氮菌的脱氮过程主要发生在其对数生长期,且菌体生长越好,其脱氮效果越好. 复合脱氮菌在好氧条件下对氨氮的去除效果较好,培养5 d时其对氨氮的去除率为49.7%、对总氮的去除率为20.8%;在厌氧条件下复合脱氮菌对硝态氮的去除效果较好,培养4 d时其对硝态氮的去除率为70.4%、对总氮去除率为25.6%.
3)分别以蔗糖、糖蜜、乙酸钠、柠檬酸钠为单一碳源,在厌氧条件下培养6 d时复合脱氮菌对硝态氮的去除率分别为84.2%、82.7%、81.5%、80.9%. 其中以蔗糖为单一碳源时,复合脱氮菌的菌体生长速度最快,菌体密度最大,且其对硝态氮和总氮的去除率最高,培养3 d时复合脱氮菌的OD600值为0.692,培养6 d时其对硝态氮和总氮的去除率分别为84.2%、46.5%.
4)厌氧条件下,将蔗糖、乙酸钠和柠檬酸钠三种碳源按照质量比为1∶1∶1的比例进行混合并作为外加混合碳源时,复合脱氮菌的菌体生长速度最快,菌体密度最大,且其对硝态氮和总氮去除率最高,培养3 d时复合脱氮菌的OD600值为0.612,培养4 d时其对硝态氮和总氮的去除率分别为77.9%、26.8%.
5)厌氧条件下,以蔗糖+乙酸钠+柠檬酸钠(按照质量比为1∶1∶1的比例进行混合)作为复合脱氮菌的混合外加碳源,在碳氮比为5~15的范围内,复合脱氮菌的OD600值和脱氮能力随碳氮比的增加而增大. 当碳氮比为15时,复合脱氮菌的菌体生长速度最快,菌体密度最大,且其对硝态氮和总氮去除率最高,在培养2 d时复合脱氮菌的OD600值为0.828,培养3 d时其硝态氮与总氮的去除率分别为94.5%、68.6%.
