基于UHPLC-Q-Orbitrap HRMS和生物信息学探讨瓜蒌薤白汤治疗冠心病的潜在药效物质基础和作用机制
2022-09-20张媛媛周胜楠刘丽伟包晓悦程文播李小强左莉华
孙 志,张媛媛,周胜楠,刘丽伟,包晓悦,程文播,李小强,王 靖,左莉华
基于UHPLC-Q-Orbitrap HRMS和生物信息学探讨瓜蒌薤白汤治疗冠心病的潜在药效物质基础和作用机制
孙 志1, 2,张媛媛1, 2,周胜楠1, 2,刘丽伟1, 2,包晓悦1, 2,程文播3,李小强3,王 靖1, 2,左莉华1, 2
1. 郑州大学第一附属医院 药学部,河南 郑州 450052 2. 河南省精准医学临床质谱工程研究中心,河南 郑州 450052 3. 中国科学院苏州生物医学工程技术研究所,江苏 苏州 215163
系统分析并识别瓜蒌薤白汤主要化学成分和入血成分,预测其防治冠心病的药效物质基础和作用机制。采用超高效液相色谱-四级杆/静电场轨道阱高分辨质谱(UHPLC-Q-Orbitrap HRMS)进行瓜蒌薤白汤体内外成分分析,结合色谱峰保留时间、精确相对分子质量、碎片离子、中性丢失等信息进行化合物指认。使用生物信息学方法,对潜在靶点进行GO和KEGG富集分析,借助Cytoscape软件构建瓜蒌薤白汤“活性成分-核心靶点-通路”网络图,对潜在活性成分和作用通路进行预测。利用AutoDock Tools 1.5.6软件对其活性成分与核心靶点进行分子对接验证。瓜蒌薤白汤体外定性得到了68个化学成分,大鼠ig给药后在血清样本中检测到23个入血成分。其中芹菜素、木犀草素、酒渣碱、亚油酸等化合物为瓜蒌薤白汤发挥治疗冠心病药效的关键成分,前列腺素内过氧化物合成酶2(prostaglandin-endoperoxidesynthase 2,PTGS2)、肿瘤坏死因子(tumor necrosis factor,TNF)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、半胱氨酸蛋白水解酶3(cysteine-containing aspartate-specific protease 3,CASP3)等为瓜蒌薤白汤治疗冠心病的主要靶点,涉及到脂质与动脉粥样硬化、癌症的途径、TNF信号通路、NF⁃κB信号通路、MAPK信号通路。初步鉴定了瓜蒌薤白汤防治冠心病的潜在药效成分并预测其作用靶点,为该方药效物质基础及作用机制的深入研究提供参考。
瓜蒌薤白汤;UHPLC-Q-Orbitrap HRMS;入血成分;网络药理学;分子对接;芹菜素;木犀草素;酒渣碱
冠心病(coronary heart disease,CHD)是一种与人体多系统相关的慢性复杂疾病,已成为世界范围内的主要死亡原因之一[1],寻求安全有效的治疗方法改善冠心病的症状十分必要。中药复方在我国临床实践了数千年,体现了“辨证论治”的治疗原则,对维持中国人民的健康起着至关重要的作用。瓜蒌薤白汤源自张仲景的《金匮要略·胸痹心痛短气病脉证治》[2],具有通心阳、散瘀滞、止痹痛的功效[3],与现代医学的冠心病心绞痛、冠脉痉挛、心律失常、心肌梗死等症状一致。瓜蒌薤白汤由瓜蒌、薤白、白酒煎煮而成,现代药理学研究表明,瓜蒌薤白汤具有多种生物活性,如心肌保护[4]、抗氧化[5]、抗炎[6]、干预慢性阻塞性肺病[7]等。尽管瓜蒌薤白汤已有广泛的临床应用和大量的药理学研究,但关于其有效化学成分的数据并不充足,也尚未深入探索其治疗冠心病的具体作用机制。
超高效液相色谱-四级杆-静电场轨道阱高分辨质谱技术具有高分离能力、高准确性、高分辨率、低基质效应等特点,已逐步成为中药药效成分快速准确鉴定的重要手段[8]。药物成分只有经消化道吸收入血到达靶器官或靶点才能在体内发挥相应的药效[9],因此挖掘药物入血成分对于明确药效成分、阐明药效物质基础具有重大的意义。生物信息学整体性、系统性的特点与中医药整体观、辩证论治原则相符,已被广泛用于中药复方协同作用的研究中。基于此,本研究采用UHPLC-Q-Orbitrap HRMS技术对瓜蒌薤白汤化学成分、入血成分进行鉴定,选择入血成分进行网络药理学分析,构建“活性成分-核心靶点-通路”网络图,探讨其药效物质基础和潜在作用机制,为其临床应用提供科学依据。
1 材料
1.1 仪器
Ultimate 3000超高效液相色谱仪(美国Dionex公司);Q-Exactive质谱仪(美国Thermo Scientific公司);ACQUITY UPLC®HSS C18柱(100 mm×2.1 mm,1.8 μm);万分之一分析天平(瑞士Mettler Toledo公司);Heraeus Fresco 17 Centrifuge型微量冷冻离心机(美国Thermo Scientific公司);BX7200HP型超声波清洗器(上海CIMO医疗器械制造有限公司);N-1300旋转蒸发仪(上海爱朗仪器有限公司)。
1.2 药材与试剂
瓜蒌、薤白购于张仲景大药房,经河南中医药大学中药学教授李寒冰鉴定分别为葫芦科植物栝楼Maxim的成熟果实、百合科植物小根蒜Bge.的干燥鳞茎。
对照品芦丁(批号MUST-1603181)、木犀草苷(批号MUST-15012204)、木犀草素(批号MUST-21072311)、芹菜素(批号MUST-16061301)、5-羟甲基糠醛(批号MUST-16031202),均购于成都曼思特生物有限公司,质量分数均≥98%。精氨酸(批号11009,质量分数≥99.5%),缬氨酸(批号94619,质量分数≥99.5%),色氨酸(T0254,质量分数≥98%),均购自美国Sigma公司。白酒购自张仲景大药房,甲醇、乙腈均为质谱级,购自美国Thermo Fisher公司。
1.3 动物
雄性SD大鼠12只,体质量(210~250 g)购自济南朋悦实验动物繁育有限公司,生产许可证号SCXK(鲁)20190003。实验前在12 h昼夜循环的动物房内适应性喂养7 d,自由获取饲料和饮用水。动物实验由河南省实验动物中心实验动物伦理委员会审查并批准(批件号ZZU-LAC20220225[13])
1.4 数据库与软件
SwissTargetPrediction(http://www.swisstarget prediction.ch/),人类基因数据库(GeneCards, https:// www.genecards.org/),人类孟德尔遗传数据库(OMIM,https://www.omim.org/),DrugBank数据库(https://go.drugbank.com/),DisGeNET数据库(https://www.disgenet.org/),STRING数据库(https:// string db.org/),Metascape数据库(http://metascape.org/),蛋白数据库RCSB PDB(https://www.rcsb.org/),微生信(http://www.bioinformatics.com.cn/)。Thermo Xcalibur 3.0软件,Mass Frontier 7.0软件,Cytoscape 3.7.2软件,AutoDock Tools 1.5.6软件,PyMOL 2.4.1软件。
2 方法
2.1 体内外成分分析
2.1.1 供试品溶液的制备 取瓜蒌30 g、薤白15 g与1400 mL白酒共煎,武火煎沸后转文火煎煮90 min,滤过药渣后得到约450 mL(含生药量0.1 g/mL)瓜蒌薤白汤。取适量上述汤剂,3500 r/min离心10 min,取上清液,过0.22 μm微孔滤膜,即得瓜蒌薤白汤体外定性供试品溶液。取适量上述所得瓜蒌薤白汤,置于旋转蒸发仪,浓缩20倍,得到生药量为2 g/mL大鼠ig液。
2.1.2 对照品溶液的制备 精密称定各对照品1.0 mg,分别置于10 mL量瓶中,甲醇溶解并稀释至刻度,摇匀,制备成质量浓度为0.1 mg/mL的单一对照品储备液;分别精密移取上述储备液适量,加甲醇稀释,最终得到质量浓度为1 μg/mL的混合对照品溶液。
2.1.3 动物分组、给药及样本处理 12只大鼠随机分为对照组和瓜蒌薤白汤给药组,适应性饲养1周。给药前12 h大鼠禁食不禁水。按10 mL/kg ig 给药,对照组给予等体积的生理盐水。于给药后0.5、1、2、3、4 h,采用眼眶取血的方式各取1 mL于含有肝素钠的EP管中,静置约1 h,4 ℃、3500 r/min离心10 min,取上清液,空白组血浆处理方法与给药组一致。取不同采血点上清各100 μL,涡旋30 s,加3倍量乙腈,涡旋3 min,4 ℃、13 000 r/min离心10 min,取200 μL进样。
2.1.4 液质联用条件 色谱条件:ACQUITY UPLC®HSS C18柱(100 mm×2.1 mm,1.8 μm),柱温40 ℃,体积流量0.2 mL/min,进样量5 μL。流动相为0.1%甲酸水溶液(A)-乙腈(B),瓜蒌薤白汤体外成分鉴定含药血清成分鉴定试验梯度洗脱程序为:0~4.0 min,5%B;4.0~51.0 min,5%~100%B;51.0~56.0 min,100%B;56.0~56.2 min,100%~5%B。
质谱条件:ESI电离源,正、负离子模式分开扫描。离子传输管温度320 ℃,辅助气温度为300 ℃,鞘气、辅助气的体积流量分别为45、15 μL/min;碰撞能梯度为20、40、60 eV,质荷比窗口宽度设置为2,质量扫描范围/80~1200。
2.1.5 瓜蒌薤白汤体内外代谢产物鉴定 根据“2.1.4”项下的色谱、质谱条件进样,结合色谱峰保留时间、精确相对分子质量、碎片离子、中性丢失等信息进行瓜蒌薤白汤化学成分体外定性。给药组和空白组样本进行对比分析,提取2组间差异质谱峰,并结合保留时间、加荷离子信息和离子碎片,进行瓜蒌薤白汤体内入血成分鉴定。
2.2 生物信息学研究
2.2.1 入血成分靶点搜集 在PubChem数据库中下载23个入血成分的2D结构,导入SwissADME网站进行筛选,标准为Pharmacokinetics项目中GI absorption为“High”,Druglikeness项中满足2个指标为“Yes”,通过筛选的化合物在SwissTarget Prediction数据库进行靶点预测。
2.2.2 冠心病相关靶点的筛选 基于GeneCards、OMIM、DrugBank和DisGeNET数据库,以“coronary heart disease,CHD”为关键词,获取冠心病相关的疾病靶点。
2.2.3 “药物-活性成分-靶点-疾病”网络的构建 将上述得到的药物靶点和疾病靶点各自删除重复后,求交集得到瓜蒌薤白汤和冠心病共同作用的靶点。将瓜蒌薤白汤的活性成分、冠心病,交集基因分别归类于“Drug”“Disease”“Gene”,建立Network和Type文件,导入Cytoscape 3.7.2软件构建“药物-成分-靶点-疾病”网络。
2.2.4 蛋白质互作网络(protein-protein interaction network,PPI)的构建 将上述得到的共有靶点导入STRING数据库构建PPI网络,蛋白种属为“homo sapiens”,置信度为0.4,其他参数不变,得到蛋白相互作用关系的网络图,下载TSV格式。将该TSV文件导入到Cytoscape 3.7.2软件,并使用cytoHubba插件进行拓扑分析,获得瓜蒌薤白汤治疗冠心病的关键靶点。
2.2.5 基因本体论(gene ontology,GO)与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析 将瓜蒌薤白汤治疗冠心病的相关靶点上传到Metascape平台中进行GO和KEGG富集分析,设定参考值<0.05、富集因子>1.5、最小计数值为3。最后在微生信网站进行GO和KEGG富集分析可视化。
2.2.6 “成分-靶点-通路”网络的构建 将瓜蒌薤白汤活性成分、治疗冠心病的关键靶点、KEGG富集通路分别归类为“Drug”“Gene”“Pathway”,建立Network和Type文件,导入Cytoscape 3.7.2软件,构建“成分-靶点-通路”网络。
2.3 分子对接验证
根据“成分-靶点-通路”网络图筛选degree值较高的靶点,从PDB数据库下载该蛋白靶点的3D晶体结构pdb文件。根据“药物-活性成分-靶点-疾病”网络筛选关键活性成分,从PubChem数据库中下载活性成分对应的SDF文件。通过Chem 3D软件将2D结构优化并保存为3D结构的mol2格式。在AutoDockTools 1.5.6使用Vina软件进行分子对接,最后使用Pymol软件进行分子可视化。
3 结果与分析
3.1 体内外成分鉴定结果
3.1.1 体外化学成分鉴定 瓜蒌薤白汤正、负离子模式下的总离子流图如图1所示。共鉴定出68种化学成分,8种成分经对照品比对,详见表1。包括黄酮类6个、氨基酸类10个、有机酸14个、核苷类4个、生物碱及含氮类11个、皂苷类6个、挥发油3个、糖类6个、其他类8个。

图1 瓜蒌薤白汤在正离子模式(A) 和负离子模式(B) 下的总离子流图
表1 瓜蒌薤白汤68个化学成分质谱信息
Table 1 Mass spectrum information of 68 chemical components of Gualouxiebai Decoction
编号成分名称分子式tR/min离子模式理论值实测值误差(×10−6)二级离子碎片来源 F1*芦丁C27H30O1620.27[M+H]+611.160 66611.159 85−1.33465.10, 303.05, 285.04, 153.01GL F2*木犀草苷C21H20O1121.57[M-H]−447.093 28447.093 351.16 327.05, 285.04, 151.00GL F3香叶木素-7-O-β-D-葡萄糖苷C22H22O1126.60[M-H]−461.108 93461.109 072.67 298.05,283.02,269.042 55.03GL F4*木犀草素C15H10O632.16[M+H]−285.040 46285.040 473.88 267.03, 151.00, 133.03, 87.04GL F5*芹菜素C15H10O537.45[M-H]−269.045 54269.045 654.46 225.06, 151.00, 107.01GL F6香叶木素C16H12O614.49[M+H]+301.070 66301.068 94−5.73151.00, 107.01GL A1*精氨酸C6H14N4O21.50[M+H]+175.118 95175.118 90−0.30158.09, 130.10, 116.07, 112.09GL、XB A2*缬氨酸C5H11NO21.58[M+H]+118.086 25118.086 18−0.6472.08, 57.06, 55.05GL、XB A3谷氨酰胺C5H9NO41.21[M+H]+148.060 43148.060 10−2.26130.05, 120.08, 102.05, 84.04GL、XB A4蒜氨酸C6H11NO3S1.54[M+H]+178.053 24178.053 22−0.12160.04, 91.02, 88.04XB A5L-亮氨酰-L-脯氨酸C11H20N2O31.65[M+H]+229.154 66229.154 60−0.30116.07, 86.10, 70.07GL A6脯氨酸C5H9NO21.53[M+H]+116.070 60116.070 48−1.0898.06, 74.02, 70.07GL A7焦谷氨酸C5H7NO31.66[M+H]+130.049 86130.049 930.46 112.05, 102.05, 84.04GL A8亮氨酸C6H13NO21.78[M+H]+132.101 90132.101 85−0.4286.10, 69.07GL
续表1

编号成分名称分子式tR/min离子模式理论值实测值误差(×10−6)二级离子碎片来源 A9苯丙氨酸C9H11NO22.37[M+H]+166.086 25166.086 320.39149.06, 131.05, 120.08, 79.05GL A10*色氨酸C11H12N2O24.48[M+H]+205.097 15205.097 03−0.61188.07, 170.06, 118.06XB O1烟酸C6H5NO21.63[M+H]+124.039 30124.039 310.0480.05GL O24-羟基-烟酸C6H5NO31.67[M+H]+140.034 21140.034 18−0.28121.03, 94.03GL O3肉桂酸C9H8O22.36[M+H]+149.059 70149.059 750.30131.05, 103.05, 79.05GL O4原儿茶酸C7H6O423.62[M+H]+155.033 88155.033 80−0.06135.01, 109.03, 91.09GL O5香草酸C8H8O48.47[M+H]+169.049 53169.049 791.51152.01, 123.04, 108.02GL O69-氧代壬酸C9H16O342.94[M+H]+173.117 22173.116 87−2.21153.09, 125.10GL O8水杨酸C7H6O319.90[M-H]−137.024 41137.024 297.08 109.03, 93.03GL O99S,13R-12-oxophytodienoic acidC18H28O340.92[M+H]+293.211 12293.210 69−1.47275.20, 219.17, 205.16, 149.10GL O10天师酸C18H34O542.71[M-H]−329.233 34329.233 373.40 311.22, 293.21, 229.14, 171.10GL O112-羟基-6-(4-羟基苯乙基)苯甲酸C15H14O441.50[M-H]−257.081 93257.081 944.30 213.09, 107.05, 93.03XB O12十八碳三烯酸C18H30O347.35[M+H]+295.226 77295.226 26−1.73277.22, 259.20, 99.08GL O133-甲酰基-2-甲基苯甲酸C9H8O31.69[M+H]+165.054 62165.054 60−0.13150.03, 122.04, 79.05XB O14亚油酸C18H32O29.62[M-H]−279.232 95279.232 572.55279.23GL、XB O15瓜蒌酸C18H30O250.06[M+H]+279.231 85279.231 35−1.82261.22, 137.13, 123.12, 109.10GL N1腺苷C10H13N5O41.63[M+H]+268.104 03268.103 91−0.45136.06, 119.03GL、XB N3腺嘌呤C5H5N51.56[M+H]+136.061 77136.061 72−0.38119.03, 94.04, 67.03GL、XB N4鸟嘌呤核苷C10H13N5O51.70[M+H]+284.098 94284.098 72−0.79152.06, 135.03, 110.03GL、XB N5胸腺嘧啶核苷C10H14N2O52.31[M-H]−241.082 99241.082 412.12151.05, 125.04GL AN2葫芦巴碱C7H7NO26.34[M+H]+138.054 95138.054 980.18120.04, 110.06, 94.06GL AN31-羟甲基-2-吡咯醛C6H7NO23.74[M+H]+126.054 95126.054 67−2.26108.04, 98.06, 80.05XB AN42,3,4,9-四氢-1H-β-咔啉-3-甲酸C12H12N2O28.40[M+H]+217.097 15217.097 431.27171.09, 144.08, 130.07, 86.02XB AN59H-吡啶并[2,3-B]吲哚C11H8N212.23[M+H]+169.076 02169.075 96−0.38169.07, 93.03XB AN64-[2-甲酰基-5-(羟甲基)-1H-吡咯-1-基]丁酸C10H13NO410.54[M-H]−210.077 18210.077 014.41124.04, 94.03, 66.03GL AN71-甲基-2,3,4,9-四氢-1H-β-咔啉-羧酸C13H14N2O29.52[M+H]+231.112 80231.112 69−0.49214.09, 144.08, 130.06, 102.06XB AN9正香豆酰酪胺C17H17NO328.24[M+H]+284.128 11284.127 90−0.77164.07, 147.04, 121.06, 103.05XB AN10顺式-N-阿魏酰酪胺C18H19NO430.03[M+H]+314.138 68314.138 61−0.24177.05, 149.06, 121.06, 93.07GL AN111-羧丙基-5-乙氧甲基-1H-吡咯-2-醛-吡咯C12H17NO41.89[M+H]+240.123 03240.122 96−0.31124.04, 94.03, 66.03GL AN124-氨基苯甲酸丁酯C11H15NO230.07[M+H]+194.117 55194.117 740.95138.05, 110.06, 94.07GL AN13酒渣碱C17H12N2O431.59[M+H]+309.086 98309.086 70−0.92281.09, 263.08, 235.09, 206.08GL S1知母皂苷CC45H74O1835.61[M+H]+903.494 79903.494 20−0.66741.44, 579.39, 435.28, 417.34XB S2知母皂苷A-IIIC39H64O1336.61[M+H]+741.441 96741.440 43−2.08579.39, 435.27, 417.34, 273.22XB S3薯蓣皂苷元-3-O-β-D-吡喃-葡萄糖苷C33H52O841.72[M+H]+577.373 49577.373 05−0.77415.32, 273.22, 255.21XB S47-羟基色原酮C9H6O314.76[M-H]−161.024 41161.024 326.21161.02 S5gitogeninC27H44O445.50[M+H]+433.331 23433.330 57−1.54415.32, 397.31, 289.22, 271.20XB
续表1
*由对照品比对确定 F-黄酮类 A-氨基酸类 O-有机酸类 N-核苷类 AN-生物碱及含氮类 S-皂苷类 V-挥发油类 C-糖类 Other-其他类 GL-瓜蒌药材 XB-薤白药材 GXD-瓜蒌薤白汤
*determined by reference substance F-flavonoids A-amino acids O-organic acids N-nucleoside AN-alkaloids and nitrogens S-saponins V-volatile oils C-carbohydrate Other-other classes GL-XB-GXD-Gualouxiebai Decoction
3.1.2 体内入血成分鉴定 给药组血清总离子流图如图2所示,共鉴定出23个入血成分,详见表2。
3.1.3 体内外成分鉴定 瓜蒌薤白汤中共鉴定出68个成分,入血成分中鉴定出23个,以黄酮类F4为例,该化合物在正离子模式下分子离子峰为287.05,经Xcalibur软件拟合得到其对应分子式C15H10O6,通过分析其二级并通过对照品比对,鉴定F4为木犀草素,裂解规律见图3-A。以有机酸类O5在负离子模式下分子离子峰为152.01,经Xcalibur软件拟合得到其对应分子式为C8H8O4,根据该化合物的精确相对分子质量、断裂方式,分析其二级碎片离子信息,最终确定O5为香草酸,裂解规律见图3-B。
3.2 生物信息学研究
3.2.1 瓜蒌薤白汤活性成分的筛选与靶点的预测 瓜蒌薤白汤入血成分均通过SwissADME筛选,利用SwissTargetPrediction数据库,下载活性成分的靶点表格,规定probability≥1倍中位数为筛选条件,合并去重后得到396个瓜蒌薤白汤潜在作用靶点。
3.2.2 冠心病靶点的筛选 在GenenCards数据库中,以“coronary heart disease”为关键词,设置relevance score≥30为筛选条件,得到靶点379个。同样将以上关键词输入到OMIM和DrugBank数据库,分别得到553、35靶点。在DisGeNET数据库中,筛选出score值大于等于2倍中位数的靶点415个。最后将4个数据库得到的靶点求并集,删去重复项后共得到1185个冠心病候选靶点。
3.2.3 核心靶点的筛选及PPI网络图的构建 将瓜蒌薤白汤活性成分对应的396个靶点与冠心病相关的1185个疾病靶点取交集,得到70个瓜蒌薤白汤防治冠心病的潜在靶点(图4)。将获得的70个核心靶点上传至STRING数据库,蛋白种属为“homo sapiens”,置信度为0.4,删除游离靶点,得到PPI网络的TSV文件,将其导入Cytoscape 3.7.2构建PPI网络(图5)。该网络共有67个节点,492条边。

A-空白血清正离子模式 B-含药血清正离子模式 C-空白血清负离子模式 D-含药血清负离子模式
表2 瓜蒌薤白汤23个入血成分质谱信息
Table 2 Mass spectrum information of 23 absorbed components of Gualouxiebai Decoction in plasma
编号鉴定成分分子式tR/min离子模式理论值实测值误差(×10−6)碎片离子 F4木犀草素C15H10O66.91[M+H]+287.055 01287.054 32−2.40287.05, 269.04, 153.02, 135.04, 89.04 F5芹菜素C15H10O531.44[M+H]+271.060 09271.058 41−6.24271.06, 153.02, 91.05 A2缬氨酸C5H11NO21.24[M+H]+118.086 25118.086 15−0.11118.09, 57.06 A4蒜氨酸C6H11NO3S1.32[M+H]+178.053 24178.053 421.01132.04, 91.02, 88.04 A7焦谷氨酸C5H7NO31.17[M+H]+130.049 86130.049 930.46130.05, 84.04 A9苯丙氨酸C9H11NO21.37[M+H]+166.086 25166.086 14−0.69149.06, 131.05, 120.08, 79.05 A10色氨酸C11H12N2O21.37[M+H]+205.097 15205.096 97−0.90205.10, 188.07, 170.06, 118.06 O3肉桂酸C9H8O236.16[M+H]+149.059 70148.051 88−0.98149.06, 103.05, 79.05 O5香草酸C8H8O41.35[M-H]−167.03498167.034 745.12152.01, 123.04, 108.02 O8水杨酸C7H6O314.89[M+H]+139.038 97139.038 970.86109.03, 93.03 O10天师酸C18H34O521.70[M-H]−329.233 34329.233 281.03229.14, 211.13, 171.10 O12十八碳三烯酸C18H30O337.82[M+H]+295.226 77295.227 170.40259.20, 99.08, 81.07 O14亚油酸C18H32O243.92[M-H]−279.232 95279.231 841.05279.23, 261.22 O15瓜蒌酸C18H30O228.88[M+H]+279.231 85279.231 41−1.60279.23, 149.02, 121.03 AN2葫芦巴碱C7H7NO21.21[M+H]+138.054 95138.054 95−0.04110.06, 94.07 AN124-氨基苯甲酸丁酯C11H15NO28.41[M-H]−192.103 00192.102 392.52138.05, 110.06, 94.07 AN13酒渣碱C17H12N2O418.61[M+H]+309.086 98309.086 00−3.18281.09, 263.08, 235.09, 206.08 S47-羟基色原酮C9H6O316.82[M-H]−161.024 41161.024 406.70161.02 S5gitogeninC27H44O433.74[M-H]−431.316 68431.317 384.16431.32 V2邻苯二甲酸二丁酯C16H22O437.66[M+H]+279.159 08279.159 00−0.31167.03, 149.02, 121.03, 93.03 C3半乳糖酸-γ-内酯C6H10O61.16[M-H]−177.040 46177.040 456.13177.04 Other6黑麦草内酯C11H16O38.98[M+H]+197.117 22197.117 11−0.56197.12, 151.11 Other8前列腺素E1C20H35O424.47[M+H]+355.247 90355.245 18−2.72355.24

A-木犀草素裂解途径 B-香草酸裂解途径
3.2.4 生物过程和通路富集分析 通过Metascape数据库对70个核心靶点进行KEGG富集分析,共获得158条结果(<0.01),根据值排序结果,筛选出10条排名最高的富集通路(表3),包括脂质与动脉粥样硬化(lipid and atherosclerosis)、癌症的途径(pathways in cancer)、肿瘤坏死因子信号通路(TNF signaling pathway)、IL-17信号通路(IL-17 signaling pathway)、核因子κB信号通路(NF⁃κB signaling pathway)、丝裂原激活蛋白激酶信号通路(MAPK signaling pathway)、PPAR信号通路(PPAR signaling pathway)等,见图6。GO功能富集分析,主要包括生物过程(biological process,BP)、细胞组成(cellular component,CC)与分子功能(molecular function,MF)。共获得640个GO富集分析结果(<0.01),根据值简单排序后,选取前15个生物过程、前10个细胞组成和前10个分子功能组成GO富集分析柱形图,见图7。GO-BP分析可得到447个条目,发现瓜蒌薤白汤防治冠心病富集在循环系统进程、蛋白质磷酸化的正调控、激素水平调节、激素应答等BP;GO-CC分析得到90个条目,发现其富集在脂筏、膜侧、受体复合物、细胞质核周区等CC;GO-MF分析得到103个条目,发现其富集在脂质结合、内太酶活力以及蛋白域特异结合等MF。
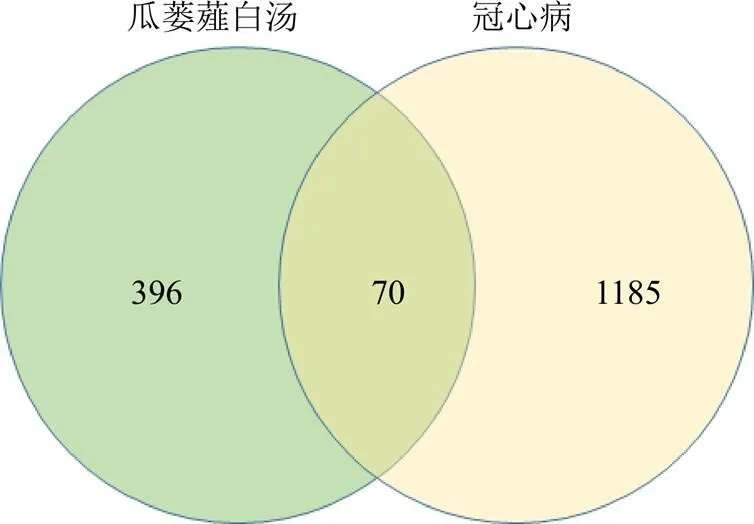
图4 瓜蒌薤白汤活性成分靶点与冠心病靶点韦恩图

图5 瓜蒌薤白汤治疗冠心病的PPI网络
表3 瓜蒌薤白汤治疗冠心病的核心靶点拓扑参数
Table 3 Topological parameters of core target points of GXD in the treatment of CHD
靶点名称节点连接度中介中心度接近中心度 TNF480.154 478 820.295 212 77 EGFR380.076 417 900.371 266 00 PTGS2370.063 171 650.411 411 41 MMP9330.023 187 930.492 424 24 ACE320.064 436 540.425 403 23 CASP3320.045 133 930.453 629 03 ICAM1300.022 580 280.487 356 32 TLR4290.026 208 550.482 758 62 ESR1280.041 416 950.410 052 91 PPARG270.041 175 000.424 501 42
3.2.5 “活性成分-核心靶点-通路”网络图的构建 将瓜蒌薤白汤活性成分、信号通路、核心靶点导入Cytoscape 3.7.2软件,得“活性成分-核心靶点-通路”网络图,见图8。网络图中包括99个节点(包括65个核心靶点,23个活性成分,10个通路节点)和193条边。成分-靶点-通路网络图靶点最大degree值为25,最小为1。平均度值4,平均介数为0.037,平均接近值为0.31,其中有5个成分、10个靶基因,5条通路在平均值以上。推测前列腺素E1(Other8)、芹菜素(F5)、木犀草素(F4)、亚油酸(O14)、酒渣碱(AN13)为瓜蒌薤白汤治疗冠心病的关键成分。PTGS2、TNF、MMP9、EGFR、CASP3、AR、ACE、ESR2、MMP2、F2为瓜蒌薤白汤治疗冠心病的主要靶点。通路方面则集中在脂质与动脉粥样硬化(lipid and atherosclerosis)、癌症的途径(pathways in cancer)、肿瘤坏死因子信号通路(TNF signalingpathway)、核因子κB信号通路(NF⁃κB signaling pathway)、丝裂原激活蛋白激酶信号通路(MAPK signaling pathway)。

图6 瓜蒌薤白汤防治冠心病核心靶点KEGG富集分析
3.3 分子对接验证
以前列腺素E1、芹菜素、木犀草素、酒渣碱为配体,PTGS2、TNF、MMP9、EGFR为受体进行结合能力预测,见图9。对接结果只保留每对分子对接的predicted binding affinity绝对值最高的。一般认为结合能小于−4.25 kJ/mol提示配体与受体有一定的结合活性,小于−5.0 kJ/mol有较好的结合活性,小于−7.0 kJ/mol有强烈的结合活性[10]。本实验对接得分均≤−4.25 kJ/mol,其中对接得分≤−9.0 kJ/mol的成分占37.5%,对接得分在−9.0~−7.0 kJ/mol的成分也占37.5%。木犀草素和PTGS2、EGFR对接得分最高,可视化结果见图10。

图7 瓜蒌薤白汤防治冠心病核心靶点的GO富集分析

圆形节点为活性成分 矩形为靶点 菱形为通路
4 讨论
瓜蒌薤白汤具有振奋胸阳,行气散结的功效,是治疗冠心病的经典方剂,临床应用广泛且疗效显著。本研究采用液质联用技术对瓜蒌薤白汤体内外成分进行全面鉴定,并基于多成分、多靶点的研究思路,应用网络药理学技术,分析瓜蒌薤白汤治疗冠心病的关键靶点,阐述其作用机制,为瓜蒌薤白汤的临床应用提供科学依据。

图9 靶蛋白-活性成分分子对接得分热图
本实验体外共识别出包括黄酮类、氨基酸类、有机酸类等68个化学成分,随后在大鼠给药血清样本中捕捉到了23个入血成分。网络药理学研究结果表明瓜蒌薤白汤可以通过多通路多靶点发挥疗效,“活性成分-核心靶点-通路”网络图提示,前列腺素E1(Other8)、芹菜素(F5)、木犀草素(F4)、酒渣碱(AN13)、亚油酸(O14)可能是瓜蒌薤白汤治疗冠心病的关键成分。前列腺素E1(Other8)属于血管活性药物,可以抑制血小板活化,改善红细胞变形能力[11];同时可以抑制血管平滑肌细胞内钙离子内流,使血管平滑肌舒张[12];此外临床研究表明前列腺素E1能抑制动脉粥样硬化斑块的形成[13]。黄酮类成分在瓜蒌薤白半夏汤治疗冠心病中起到了较为重要的作用,芹菜素、木犀草素是2种天然的类黄酮化合物。有研究发现[14],芹菜素通过抑制NF-κB信号通路,显著降低NF-κB、COX-2、TNF-α的水平,提高IL-10的水平,发挥抗动脉粥样硬化的效果。木犀草素具有抗动脉粥样硬化[15]、维持Ca2+的平衡[16]、心肌细胞保护[17]等作用。由此可知PTGS2、TNF、MMP9、EGFR、CASP3、AR、ACE、ESR2、MMP2、F2可能为瓜蒌薤白汤治疗冠心病的主要靶点。PTGS2也被称为环氧化酶2(cyclooxygenase-2,COX-2),可以引起前列腺素(prostaglandin E1,PGE1)、PEG2和PGI2等含量升高,导致炎症反应,研究发现COX-2抑制药可减轻炎症,舒张血管平滑肌[18]。TNF能诱导白细胞介素- 6(interleukin 6,IL-6)的产生,导致血管内粥样硬化斑块的形成[19]。有研究发现[20-21],冠心病患者的平滑肌细胞中MMP2和MMP9的表达显著增加,提示MMP2/MMP9在冠心病的发病过程中起着重要的作用。

图10 靶蛋白-活性成分分子对模式图
综上所述,瓜蒌薤白汤中芹菜素、木樨草素、酒渣碱、亚油酸等核心功效成分作用于PTGS2、TNF、MMP9等靶点,通过脂质与动脉粥样硬化、癌症的途径、肿瘤坏死因子信号通路、NF⁃κB信号通路、MAPK等信号通路发挥治疗冠心病的功效。该研究体现了中药复方多成分、多靶点、多途径的特点,可为临床上的合理应用提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Widimsky P, Crea F, Binder R K,. The year in cardiology 2018: Acute coronary syndromes [J]., 2019, 40(3): 271-282.
[2] Lin P, Wang Q, Liu Y H,. Qualitative and quantitative analysis of the chemical profile for Gualou-Xiebai-Banxia Decoction, a classical traditional Chinese medicine formula for the treatment of coronary heart disease, by UPLC-Q/TOF-MS combined with chemometric analysis [J]., 2021, 197: 113950.
[3] 张恒勋, 李海龙, 刘小锋. 瓜蒌薤白桂枝汤对老年冠心病患者的临床观察[J]. 世界中医药, 2020, 15(8): 1157-1161.
[4] 李明明, 黄芳, 韩林涛, 等. 瓜蒌薤白白酒汤对大鼠心肌缺血再灌注损伤的保护作用 [J]. 中国实验方剂学杂志, 2013, 19(16): 188-192.
[5] 周波, 陈飞, 仲维娜, 等. 从NO、NOS变化探讨瓜蒌薤白白酒汤对心肌缺血再灌注损伤的防治作用 [J]. 中医药学报, 2010, 38(3): 36-38.
[6] 卞海, 宋燕, 王雅娟, 等. 瓜蒌薤白白酒汤对硬膜下血肿模型大鼠血清炎症因子影响的实验研究 [J]. 中成药, 2014, 36(5): 1051-1053.
[7] 谈晓莹, 李丹, 刘培, 等. 基于网络药理学及斑马鱼模型的瓜蒌薤白半夏汤干预慢性阻塞性肺疾病的作用机制研究 [J]. 中草药, 2021, 52(17): 5233-5243.
[8] 于燕乔, 史大卓, 曲华, 等. 定性研究方法在中医药领域的应用与思考[J]. 世界中医药, 2021, 16(13): 2058-2060.
[9] 许雅婧, 乐心逸, 葛一蒙, 等. 复方芩兰口服液的体内外成分分析和网络药理学研究 [J]. 中草药, 2022, 53(9): 2623-2632.
[10] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[11] 汪毓君, 喻莉. 前列腺素E1联合血必净对脓毒症患者炎症反应进程及靶器官功能的影响 [J]. 海南医学院学报, 2018, 24(4): 537-540.
[12] 吴可光, 刘洪琴. 前列腺素E1在心血管疾病中的应用及评价 [J]. 实用内科杂志, 1993, 13(5): 60-61.
[13] 王淼, 荣阳, 荣根满. 前列腺素E1治疗脑梗死合并冠心病的疗效分析与临床研究 [J]. 中国医药指南, 2016, 14(15): 79-80.
[14] Kumar K S, Sabu V, Sindhu G,. Isolation, identification and characterization of apigenin fromand its anti-inflammatory activity [J]., 2018, 59: 157-167.
[15] Jia Z Q, Nallasamy P, Liu D M,. Luteolin protects against vascular inflammation in mice and TNF-alpha-induced monocyte adhesion to endothelial cells via suppressing IΚBα/NF-κB signaling pathway [J]., 2015, 26(3): 293-302.
[16] Hu W J, Xu T D, Wu P,. Luteolin improves cardiac dysfunction in heart failure rats by regulating sarcoplasmicCa2+-ATPase 2a [J]., 2017, 7: 41017.
[17] 王清岑, 殷新, 周罗慧, 等. 木犀草素心血管保护作用研究进展 [J]. 中国现代医学杂志, 2020, 30(11): 57-60.
[18] Chenevard R, Hürlimann D, Béchir M,. Selective COX-2 inhibition improves endothelial function in coronary artery disease [J]., 2003, 107(3): 405-409.
[19] Ghosh C, Bishayi B. Toll-like receptor 2 and 6 interdependency in the erosive stage ofinduced septic arthritis mediated by IFN-γ and IL-6: A possible involvement of IL-17 in the progression of the disease [J]., 2015, 220(7): 910-923.
[20] Manginas A, Bei E, Chaidaroglou A,. Peripheral levels of matrix metalloproteinase-9, interleukin-6, and C-reactive protein are elevated in patients with acute coronary syndromes: Correlations with serum troponin I [J]., 2005, 28(4): 182-186.
[21] 张驰, 李晓怡, 杨蓓, 等. 联合检测MMP2和MMP9在冠状动脉粥样硬化性心脏病患者中的临床意义 [J]. 东南大学学报: 医学版, 2019, 38(1): 51-56.
Explore potential pharmacodynamic substances basis and mechanism of Gualouxiebai Decoction in treatment of coronary heart disease based on UHPLC-Q-Orbitrap HRMS and bioinformatics
SUN Zhi1, 2, ZHANG Yuan-yuan1, 2, ZHOU Sheng-nan1, 2, LIU Li-wei1, 2, BAO Xiao-yue1, 2, CHENG Wen-bo3, LI Xiao-qiang3, WANG Jing1, 2, ZUO Li-hua1, 2
1. Department of Pharmacy, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China 2. Henan Engineering Research Center of Clinical Mass Spectrometry for Precision Medicine, Zhengzhou 450052, China 3. Suzhou Institute of Biomedical Engineering Technology, Chinese Academy of Sciences, Suzhou 215163, China
To systematically analyze and identify chemical constituents of Gualouxiebai Decoction, and predict the pharmacological basis and mechanism of its prevention and treatment of coronary heart disease.Gualouxiebai Decoction and drug-containing serum were analyzed by UHPLC-Q-Orbitrap HRMS, and the identification ofandcomponents were carried out with retention time, precise molecular weight, fragment ions and neutral loss. Bioinformatics methods were used to enrich the GO and KEGG pathways of potential targets. The network diagram of "active component-key target-pathway" of Gualouxiebai Decoction was constructed with Cytoscape 3.7.2 to predict potential active ingredients and pathways. AutoDock Tools 1.5.6 was used to verify the molecular docking between active ingredients and core targets.A total of 68 chemical components were identified, and 23 components were detected in serum samples of rats after gaved Gualouxiebai Decoction. Among them, apigin, luteolin, leae alkaloid, linoleic acid and other compounds are the key components of Gualouxiebai Decoction in the treatment of coronary heart disease, and PTGS2, TNF, MMP9, EGFR, CASP3 are the main targets. It involves the pathways of lipid and atherosclerosis, pathways in cancer, TNF signaling pathway, NF-κB signaling pathway and MAPK signaling pathway.This study preliminarily identified the potential effective components of Gualouxiebai Decoction in the prevention and treatment of coronary heart disease, and predicted the target of action, providing a reference for the further study of the pharmacodynamic substance basis and action mechanism of this prescription.
Gualouxiebai Decoction; UHPLC-Q-Orbitrap HRMS; absorbed components in the blood; bioinformatics; molecular docking;apigin; luteolin; leae alkaloid
R284.1
A
0253 - 2670(2022)18 - 5613 - 12
10.7501/j.issn.0253-2670.2022.18.004
2022-05-11
河南省重点研发与推广专项(科技攻关)(202102310187);国家重点研发计划资助项目(2021YFC2401105);河南省中青年卫生健康科技创新优秀青年人才培养项目(YXKC2020058);国家自然科学基金资助项目(82003921)
孙 志,博士,研究方向为中药药物代谢。Tel: (0371)66862570 E-mail: sunzhi2013@163.com
[责任编辑 王文倩]
