脑小血管病实验动物模型及制备方法研究进展
2022-09-20王香元佘瑞宁葛金文梅志刚
王香元,佘瑞宁,方 锐,葛金文,梅志刚
·综 述·
脑小血管病实验动物模型及制备方法研究进展
王香元,佘瑞宁,方 锐,葛金文*,梅志刚*
湖南中医药大学中西医结合学院 中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208
脑小血管病(cerebral small vessel disease,CSVD)是由于颅内微小血管的动态弥漫性病变所致的脑微血管疾病,是脑卒中和血管性痴呆的主要病因,具有高隐匿性、高发病率、高致残率等特点,发病机制可能与脑血流量减少或慢性大脑低灌注、内皮功能障碍、血-脑脊液屏障功能受损、炎症反应和遗传等因素有关。为有效探寻CSVD的中西医病理机制及防治方法,制备合适的且能展示中医药特色优势的动物模型尤为重要。当前构建的CSVD动物模型有低灌注损伤CSVD模型、高血压靶器官损伤CSVD模型、基因修饰CSVD模型、微小栓子栓塞CSVD模型等。从CSVD模型的建立、行为学与病理改变、模型的优缺点等角度综述了近年来国内外有关CSVD动物模型的研究进展,旨在为深入探索CSVD的发病机制和靶向防治脑小血管病的创新药物研发提供模式动物参考。
脑小血管病;动物模型;中医药;低灌注损伤脑小血管病模型;高血压靶器官损伤脑小血管病模型;基因修饰脑小血管病模型;微小栓子栓塞脑小血管病模型
脑小血管病(cerebral small vessel disease,CSVD)是由各种病因影响脑内小动脉、微动脉、毛细血管、小静脉和微静脉所导致的一系列临床、影像、病理综合征[1]。CSVD占所有缺血性卒中的25%,也是血管性痴呆的主要原因。与正常人相比,CSVD患卒中的风险会增加1倍,发展成血管性痴呆的风险会增加3倍[2]。该病临床表现不一,急性CSVD可表现为腔隙综合征,慢性CSVD隐匿起病,可无临床症状,随着病变进展患者可出现认知、运动、情感和二便障碍等表现。CSVD临床诊断主要依靠影像学检查,尚缺乏规范诊断的金标准,也无特异性治疗药物[1]。近年来中医药在CSVD的干预治疗中提供了新的切入点并展现出良好的成效[3],目前对CSVD的病因病机虽无统一认识,但多数现代医家认为CSVD病位在脑和络脉,与肝、脾、肾及督脉密切相关,病性属虚实夹杂之证,以肝、脾、肾等脏腑亏损,精血亏虚为本,痰浊、瘀血为标,病机为脏腑功能失调及夹痰、夹瘀血上扰脑窍[4],采用补肾填精固本、健脾益气化痰、活血化瘀通络等法进行辨证论治均收到良好效果[5]。为进一步探索CSVD的中西医病理机制和防治,复制具有CSVD病理特点和临床表现的动物模型是关键。目前研究人员构建CSVD模型的方法有阻塞颈动脉致脑低灌注损伤、模拟慢性高血压脑损伤、基因修饰、微小栓子栓塞等,模型病理观察可见小血管病变、腔隙性脑梗死和脑白质病变3种主要病变[6]。本文综述了4种CSVD病理模型的建立、动物行为学与组织病理改变、模型优缺点等,以期为研究CSVD的中西医发病机制和药物防治提供建模参考。
1 低灌注损伤CSVD模型
1.1 双侧颈总动脉闭塞(bilateral carotid artery occlusion,BCAO)或狭窄模型
BCAO模型是采用外科缝线永久性结扎大鼠双侧颈总动脉而建立的[7]。造模后即刻皮质脑血流量下降超过70%[8],2~3个月逐渐恢复至基线的50%~90%[7,9]。术后4~5周会出现空间学习能力和记忆能力受损相关的认知障碍[10]。术后3~7 d,病理观察可见视神经和视束、侧脑室、胼胝体、内囊和尾壳纤维束出现白质病变,尤以视神经和视束最为明显[11]。双侧颈总动脉狭窄(bilateral common carotid artery stenosis,BCAS)模型是将内径0.18 mm、节距0.50 mm、总长度2.5 mm的微线圈缠绕在C57Bl/6小鼠一侧颈总动脉分叉附近,间隔半小时后,将另一微线圈缠绕在对侧颈总动脉对称的位置而构建[12](图1)。
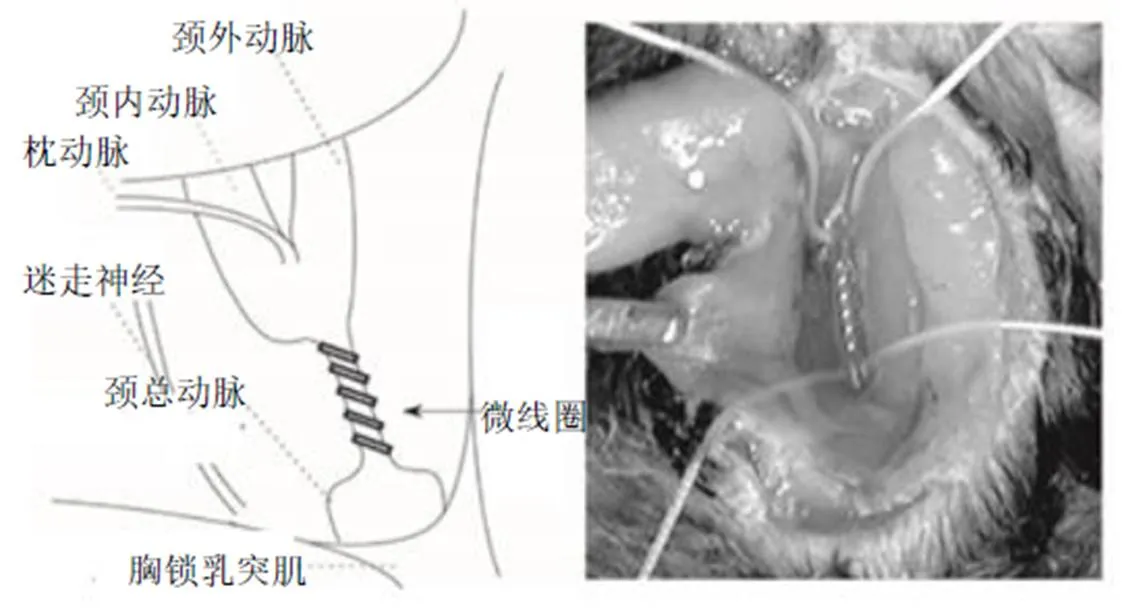
图1 BCAS模型[12]
术后2 h,脑血流量降至67%,术后1 d脑血流量开始恢复[12]。术后22 d小鼠表现出明显的短期记忆缺陷[13]。术后1个月病理可见胼胝体、尾壳核、内囊和视束发生白质病变,且以胼胝体最为显著,同时可见小胶质细胞和星形胶质细胞激活增殖[12]。术后6个月小鼠磁共振成像(magnetic resonance imaging,MRI)检测可见严重的白质病变、脑萎缩、多发性局灶性皮质下梗死,同时病理可见血管破裂伴有胶原堆积、管壁增大、纤维蛋白沉积和血管纤维素样坏死[14]。双侧颈总动脉不对称狭窄模型(asymmetrical common carotid artery stenosis,ACAS)的构建方法是将微线圈(内径0.18 mm)缠绕在C57BL/6J小鼠左侧颈总动脉,同时将Ameroid 慢性缩窄环(内径0.5 mm、外径3.25 mm、长度1.28 mm)植入右侧颈总动脉对称的位置(图2)。术后28 d植入Ameroid侧颈总动脉完全闭塞,脑血流量为73%。微线圈侧脑血流量为75%。在神经功能和行为方面,小鼠术后14 d出现运动失调和神经肌肉无力,28 d出现认知功能障碍,病理改变可见右侧皮质下多处缺血性梗死灶,左侧脑白质稀疏和神经胶质增生[15]。
综上,3种模型均可见白质病理改变,可作为研究CSVD白质损伤伴有认知障碍的模型。虽然BCAO模型操作简单成本低,但大鼠死亡率较高且缺血损伤视神经会对认知功能评估造成影响[15],不适合推广应用。为降低BCAO模型的死亡率,有学者在BCAO模型的基础上发明了改良两血管闭塞模型(modified 2 vessel occlusion,Modified 2VO),本模型是用外科缝线先结扎大鼠一侧颈总动脉,间隔1周后再结扎对侧颈总动脉而建立的,大鼠在行为和形态学方面表现与BCAO相似[16-17],但死亡率显著下降。BCAS模型操作简单、成本和死亡率低且几乎不损伤视神经,推荐使用内径为0.18 mm微线圈造模,其模型重复性较高,比较适合研究的广泛应用。ACAS模型术后死亡率约为20%,可造成小鼠白质梗死伴认知功能障碍,由于双侧颈总动脉使用不同的造模装置可造成2侧大脑半球缺血程度的不同,因此可以作为评价某些药物对缺血疗效的实验模型。局限性在于模型制作成本高且未见微血管病变[15]。低灌注损伤CSVD模型与中医瘀阻脑络证型病理机制相似,瘀血阻于脑脉,气血不通,脑髓失养,则出现神识不清、痴呆等症状,可用于瘀阻脑络型CSVD的相关研究[5]。

图2 ACAS模型[15]
1.2 立体定向药物注射模型
立体定向药物注射模型是通过立体定向将内皮素-1和一氧化氮合酶抑制剂N(G)硝基--精氨酸甲酯(-NAME)联合注入重度联合免疫缺陷小鼠内囊后肢造成脑血管收缩降低脑血流量建立的。造模成功后,小鼠可出现显著的神经功能障碍,术后1 d MRI弥散加权成像显示内囊后肢高信号。术后8周病理可见局限性轴突和髓鞘丢失,周围有反应性胶质增生,微血管收缩,微梗塞形成,此方法可复制CSVD皮质下微梗死模型[18]。当内皮素-1或-N5-(1-亚氨基乙基)鸟氨酸(-NIO)注射到小鼠的脑室周围白质或皮质下白质时,小鼠未见神经功能障碍,但可见局部白质病变,此方法可复制CSVD白质病变模型[19]。本模型建模的优点在于定位准确,局限性在于缩血管药物渗漏到脑室会造成高死亡率,有文献报道当针头与大脑矢状面成30°针刺夹角时可明显降低死亡率[20]。
2 高血压相关性CSVD模型
2.1 自发性高血压大鼠(spontaneous hypertensive rat,SHR)模型
SHR是由患有高血压的成年Wistar大鼠培育获得。12周龄SHR的收缩压>200 mm Hg(1 mm Hg=133 Pa)。30~34周龄SHR出现非空间工作记忆受损。35周龄SHR行MRI检查可见大脑萎缩和白质丢失,组织学分析证实了白质脱髓鞘和局限性血脑屏障功能障碍,并伴有皮质深层的小胶质细胞和大胶质细胞活化[21],甚至出现大脑皮层梗死出血,血管周围间隙明显增大等[22-23]。幼年SHR出现明显的脑部宏观和微观结构的改变,表明SHR可能是一种早期CSVD的有效实验动物模型[21]。高盐饮食喂养SHR能加重血管病变,HE染色可见小动脉同心性透明增厚,管腔狭窄,血管周围增大,与人类动脉硬化性CSVD的血管病理结果相似,可作为模拟动脉硬化性CSVD动物模型[24]。Kitamura等[25]将CSVD危险因素高血压和脑低灌注损伤因素相结合构建了自发性高血压大鼠/双侧颈动脉逐渐闭塞(SHRs subjected to the bilateral common carotid artery gradual occlusion,SHR-2VGO)模型,其建模方法是将Ameroid慢性缩窄环(内径0.5 mm)分别植入SHR双侧颈总动脉对称的位置。造模后7 d脑血流量缓慢下降到基线水平的68%,28 d脑血流量逐渐恢复基线水平的82%,大鼠空间工作记忆明显损伤,白质病变突出,病理观察到胶质纤维酸性蛋白免疫阳性星形胶质细胞和促炎因子明显增加,但未见明显的血脑屏障破坏,推测可能是由于小血管病理损伤较轻。SHR和SHR-2VGO模型都可作为研究CSVD白质病变的模型,但后者更符合CSVD临床病理演变的过程且能缩短模型实验周期。
2.2 易卒中自发性高血压性CSVD模型
易卒中自发性高血压大鼠(stroke-prone spontaneously hypertensive rat,SHRSP)是在SHR基础上培育出的亚系。雄性SHRSP卒中自发率高达80%,3月龄SHRSP收缩压约为200 mm Hg。24周龄SHRSP非空间记忆能力显著下降,而空间学习能力受损不明显[21],4~5个月开始出现脑白质变化,9个月时出现梗死和出血[26]。病理可见内皮损伤,血脑屏障功能障碍,小动脉壁增厚、变性和血管周围组织改变,最终导致血管破裂和微出血。SHRSP高盐暴露会加速高血压和梗死的发展,高盐摄入可能会增加血脑屏障通透性,增加活性氧的产生,并导致大鼠过早死亡[27-28]。因此将SHRSP作为CSVD动物模型时应该避免动物盐暴露[29]。此模型具有明显的白质疏松及小血管病变,是良好的高血压性CSVD白质病变模型[30]。
2.3 易卒中肾血管性高血压性CSVD模型
易卒中肾血管性高血压大鼠(stroke-prone renovascular hypertensive rat,RHRSP)模型是用银夹(内径0.3 mm)夹闭SD大鼠双侧肾动脉根部诱发高血压构建的。RHRSP卒中自发率约为62%。术后12周RHRSP收缩压维持在200 mm Hg左右。20周龄RHRSP出现空间学习和记忆障碍。6周龄RHRSP病理可见明显局灶性脑损伤(脑梗死、脑出血、蛛网膜下腔出血)和神经功能缺陷(偏瘫癫痫等)。20周龄RHRSP通过MRI T2加权像检测出了弥漫性、融合性白质高信号,以穹窿部最为显著。病理学方面可见白质明显疏松且有空泡形成,白质髓鞘和神经纤维消失,支持神经影像学的发现。同时也观察到脑内小动脉纤维蛋白样坏死、透明质增生和血管重塑,血脑屏障破坏和血浆白蛋白漏入组织间隙的病理表现。此模型符合CSVD的白质病变和小血管病理改变[31-32]。此外,有学者在构建RHRSP的基础上用5-0的丝线先结扎大鼠右侧颈总动脉,间隔1周后再结扎左侧颈总动脉,建立了易卒中肾血管性高血压大鼠/改良双侧颈总动脉闭塞复合动物模型(stroke-prone renovascular hypertensive rat/modified 2 vessel occlusion,RHRSP/Modified 2VO)。术后12周大鼠收缩压>180 mm Hg,大鼠存在明显的空间认知障碍。病理改变可见弥漫性白质病变,明显的脱髓鞘、空泡形成和神经纤维消失,尤以侧脑室旁的胼胝体最为明显,在胼胝体内可见I型和IV型静脉胶原沉积。白质区的小血管可观察到管壁向心性增厚、血管重塑和管腔狭窄[33]。RHRSP和RHRSP/Modified 2VO模型均可见到符合CSVD的白质病变和小血管病理改变,可作为研究CSVD白质病变伴认知障碍模型,模型易于建立,成本低,缺陷在于大鼠体型差异难以控制肾动脉狭窄程度,可能会造成肾功能损害[10]。
2.4 血管紧张素II诱导高血压性CSVD模型
血管紧张素II诱导高血压性CSVD模型是在C57BL/6N小鼠皮下植入含有AngII微型泵[1000 ng/(kg·min),输注率为11 μL/h]并在饮水中加入-NAMEL(100 mg/kg),从而诱发高血压建立。持续给药4周后收缩压可达150 mm Hg左右。模型小鼠在行为学方面表现出认知功能和记忆明显下降。MRI检查可见脑室增大和海马萎缩、散发性小梗死和微出血,但未见明显的白质损伤,弥散张量成像可见白质密度显著降低,推测可能与实验诱导的高血压周期太短有关(4周)。病理可见脑血管壁肥厚、神经血管单位结构损伤、小胶质细胞激活、血脑屏障渗漏、内皮细胞活化和免疫细胞聚集。该模型有类似于早发CSVD的关键特征,包括动脉病变、血脑屏障损伤、神经炎症、白质改变的早期迹象,并具有典型的CSVD神经心理学特征,可作为高血压相关早发性CSVD的小鼠模型[34]。本模型的局限性在于药量需求大,成本较高,不能模拟慢性高血压长期损害的病理过程。
2.5 主动脉缩窄高血压性CSVD模型
主动脉缩窄高血压性CSVD模型是通过手术将恒河猴胸主动脉前2~4 cm的血管直径缩小到2.0~2.5 mm从而诱发高血压建立的(图3)。术后1年发现收缩压>150 mm Hg的恒河猴在注意力、记忆力、执行力等认知和行为方面都有显著的损害,而收缩压<150 mm Hg的恒河猴认知损害不明显,表明认知功能损害与血压升高相关[35]。神经病理学上,最显著的病变是形状不规则的微梗死(直径<500 μm),伴有局灶性胶质细胞增生,散在分布于大脑皮质、脑干和小脑的灰质和白质,尤其是前脑白质[36-38]。小动脉病变可见血管壁增厚。此方法可复制CSVD相关的白质微血栓伴认知功能障碍模型。本模型的优点在于使用灵长类动物造模更能模拟人类病理状态,局限性在于动物伦理要求更严,成本更高。
3 基因修饰相关CSVD模型
3.1 内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)基因缺陷小鼠模型
一氧化氮是脑血管功能的关键调节因子,能激活中枢神经系统中的鸟苷环偶联受体,参与脑血流的自动调节和神经元突触前适应性调节。eNOS是血管中一氧化氮的主要来源。有学者通过基因工程技术敲除小鼠基因构建了基因缺陷小鼠模型。幼年小鼠出现脑灌注不足、氧化应激、星形胶质细胞增生和血脑屏障渗漏,渗漏以额叶和顶叶皮质为主,随着年龄的增长,可扩展到大脑深部区域(如颞顶叶皮质和海马),还可见到CSVD相关的临床表现如脑淀粉样血管病(cerebral amyloid angiopathy,CAA)、微出血、微梗死和白质病变。中年小鼠可见严重的白质病变、皮质层II/III和V锥体神经元神经变性以及步态障碍。老年小鼠出现海马依赖性记忆障碍。此模型直接将慢性低灌注和脱髓鞘与神经变性联系起来可作为年龄依赖性自发性CSVD模型,该模型的局限性在于微梗死的偶发性并且很难确定低灌注程度[39]。
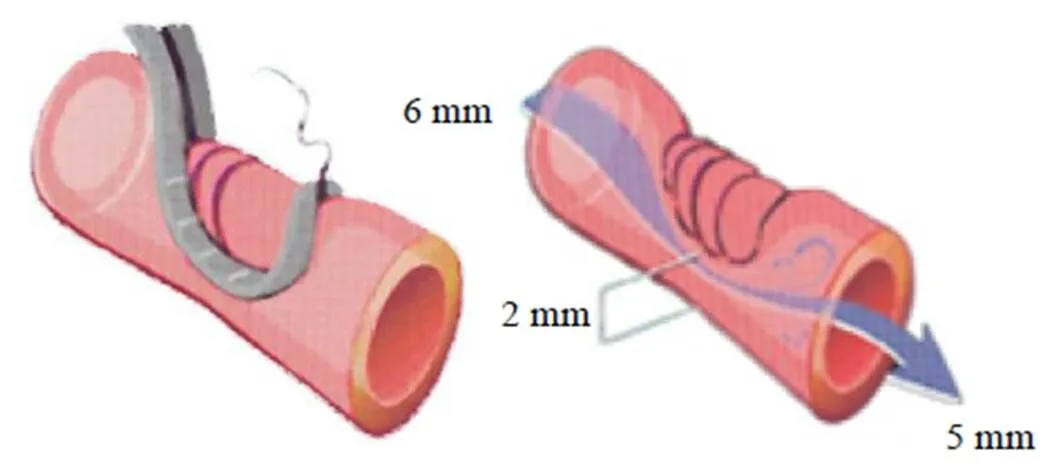
图3 胸主动脉缩窄示意图[35]
3.2 CAA模型
CAA是β-淀粉样蛋白(amyloid β protein,Aβ)在软脑膜和皮质层的中小动脉以及脑毛细血管内沉积为主要病理特征的CSVD[40-41]。有学者将人APP770SwDI构建物通过显微镜注射到SD大鼠的卵母细胞中构建了rTg DI转基因大鼠CAA模型,大鼠3个月时在大脑皮质、海马和丘脑可见早期和进行性脑微血管Aβ蓄积,星形胶质细胞和小胶质细胞激活,并伴有早期和持续性的行为障碍。12个月时大脑微血管Aβ沉积会导致毛细血管结构改变,产生血管周围神经炎,还可见微出血和小血管闭塞(丘脑为主),另外还能观察到血管周细胞变性,星形胶质细胞中细胞凋亡蛋白酶-3激活,以及神经元轴突完整性的破坏,这些结构改变都很容易被MRI检测到[42-43]。该模型大鼠在脑中产生低水平的人类家族性CAA荷兰/爱荷华州E22Q/D23N突变的Aβ,可作为遗传性CAA荷兰型的实验模型。本模型选用大鼠作为建模动物相较于小鼠更有优势,因为大鼠与人类更接近。大鼠为研究小血管CAA和微出血的发病机制和测试干预治疗措施提供了一种新的模型[42]。
3.3 丝氨酸蛋白酶1(high-temperature requirement A serine peptidase 1,HTRA1)基因重组小鼠模型
基因突变可导致单基因遗传性CSVD即伴皮质下梗死和白质脑病的常染色体隐性遗传性脑动脉病(cerebral autosomal recessive arteriopathy with subcortical infarcts and leuconcephalopathy,CARASIL)。基因突变导致HTRA1酶活性下降、功能丧失[44],使脑小血管平滑肌细胞(vascular smooth muscle cells,VSMCs)中膜丢失变薄、内弹力层断裂、外膜的细胞外基质变薄、基质中纤维玻璃样物质沉积,随后小动脉管腔狭窄或扩张导致缺血或出血性病变。Li等[45]利用成簇规律间隔的短回文重复序列及其相关系统(clustered regularly interspaced short palindromic repeats/CRISPR-associated 9,CRISPR/)基因编辑技术建立了一种表达人基因L364P突变体的重组小鼠模型。观察到人基因主要在小鼠VSMCs细胞质中表达,诱导VSMCs凋亡,导致VSMCs大量丢失,还可见与CARASIL患者类似的卒中、脱毛、脑动脉向心性增厚和结构紊乱等临床表现和血管病理改变。该模型小鼠有助于阐明CARASIL的病理机制,为临床治疗提供新的治疗靶点。
3.4 伴皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy,CADASIL)基因突变小鼠模型
基因错义突变可导致一种常见的遗传性CSVD即CADASIL[46]。CADASIL病理特点是在中小型动脉中聚集颗粒状嗜锇物质,进而导致VSMCs的进行性退化。TgNotch3R90C、TgNotch3C428S、TgNotch3R169C、TgNotch3R1031C、TgNotch3C455R均可见NOTCH3ECD积聚和嗜锇物质沉积,其中R169C表型还可见白质损伤及严重的认知功能下降[47]。WT人Notch3、WT鼠Notch3、TgNotch3R142C均未见血管病理表现,也无白质病变和缺血事件发生。TgNotch3R170C小鼠可出现嗜锇物质沉积、VSMCs结构异常、细胞间隙扩大、微出血、微梗死、纤维胶质增生病理改变和共济失调、瘫痪等神经学特征[48]。由于TgNotch3R182C小鼠表现出随着年龄和RNA表达水平的递增,嗜锇物质不断在血管沉积,然而并没有脑实质损害发生[49],因此认识到“Notch3评分”是CADASIL的定量生物标记物,可以试图将CADASIL转基因小鼠用于临床治疗前测试模型[50]。
3.5 Ⅳ型胶原蛋白α1(α1 type IV collagen,COL4A1)基因突变小鼠模型
基因编码COL4A1链,COL4A1是基底膜的主要结构成分,基因突变大部分是由胶原结构域内Gly-X-Y重复序列内高度保守的甘氨酸残基改变所致[51],临床表现为成人小血管疾病、家族性孔脑畸形、遗传性的血管病肾病动脉瘤和肌肉痛性痉挛综合征[52]。Gould等[53]将突变雄性小鼠的精子与C57BL/6J雌性小鼠卵母细胞进行体外受精,然后将胚胎移植到FVB/NJ雌性小鼠体内分娩产生杂合子+/Δex40小鼠。小鼠容易发生自发性多灶性脑出血,以基底节区为主,导致脑出血的原因可能由于突变基因导致血管生成异常和细胞内胶原增加相关,除此之外还与环境因素(如出生创伤)有一定关系。成年小鼠中可出现明显的神经功能缺陷,包括癫痫发作和偏瘫。此外还可见到本病的其他表型如视网膜血管扭曲、肾小球基底膜缺陷以及微量白蛋白尿。此模型可复制基因突变相关CSVD的脑出血模型。
4 微小栓子栓塞CSVD模型
4.1 微球注射微梗死模型
Silasi等[54]通过弹枪将2000颗小荧光微球(直径约20 μm)注射到Thy1-GFP转基因小鼠单侧颈总动脉,同时短暂阻断翼腭动脉和颈外动脉,构建了CSVD微梗死模型(图4)。微球的直径以接近啮齿动物穿透小动脉的大小(10~20 μm)为宜。微球滞留在大脑中的分布以大脑皮质和丘脑居多,微球滞留导致7%的微梗死,16%的神经元结构损伤,21%的微球引发了小胶质细胞的激活。术后4周小鼠出现了显著的粗大运动障碍和认知功能损害。病理可见微闭塞的海马区细胞丢失或神经元萎缩,白质束内的轴突以及纹状体和丘脑出现气泡或破坏,还可见血管损伤。此模型优势在于可以研究微梗死的分布区域,局限性在于操作技术要求较高[54-55]。
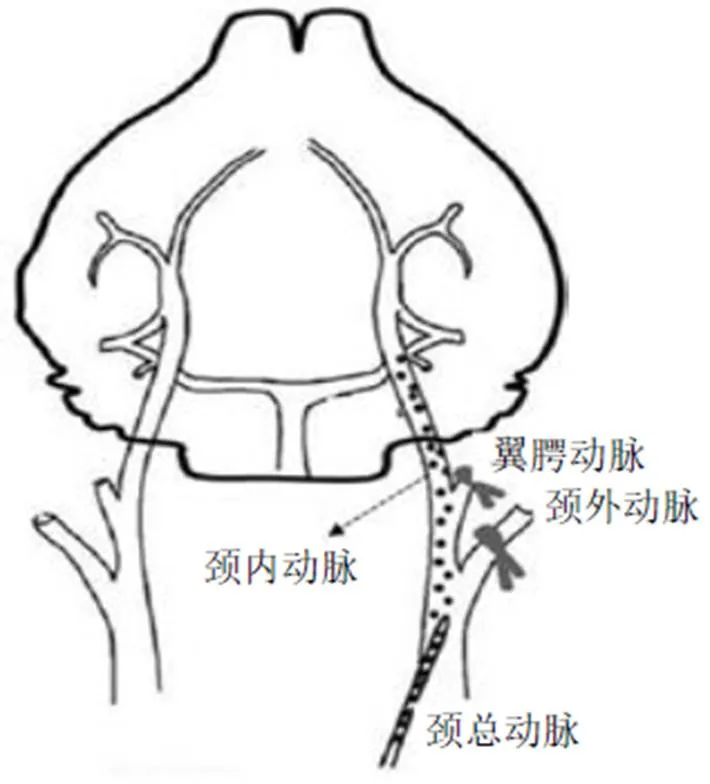
图4 微球注射微梗死模型[54]
4.2 高胆固醇血症栓塞模型
由于高胆固醇血症在微血管病理性脑缺血发展中的作用存在争议,因此Kraft等[56]给予低密度脂蛋白受体(low density lipoprotein receptor,LDLR)缺失转基因小鼠动脉粥样硬化饮食(15%乳脂和1.25%胆固醇)9周可诱导小鼠患高胆固醇血症进而导致血栓栓塞而构建此模型。该研究未报告模型小鼠认知及神经功能表现。在6月龄LDLR−/−小鼠中发现毛细血管内红细胞凝集素明显增高,12月龄LDLR−/−小鼠中红细胞凝集素明显减少,而纤维蛋白血栓显著增加。此模型表明了高胆固醇血症与血栓性CSVD表型有关,LDLR−/−小鼠似乎是研究微闭塞CSVD的合适动物模型。本模型的优点在于造模方法简便可行,缺陷在于同时也能造成大血管的动脉粥样硬化,增加模型的复杂性。中医认为年老体虚、饮食不节会损伤脾胃导致脾失健运,痰浊内生,气机升降失调,气血运行受阻日久而成瘀。而本模型是通过高脂饮食诱发高胆固醇血症损伤血管内皮导致动脉粥样硬化而诱发的栓塞,与中医“饮食不节,恣食肥甘”损伤脾胃导致的痰瘀互结证候有相类似的病机改变,可用于痰瘀互结型CSVD的生物学机制研究。
5 结语
CSVD是由于颅内微小血管的动态弥漫性病变所致的脑微血管疾病,是脑卒中和血管性痴呆的主要病因,具有高隐匿性、高发病率、高致残率等特点,发病机制可能与脑血流量减少或慢性大脑低灌注、内皮功能障碍、血-脑脊液屏障功能受损、炎症反应和遗传等因素有关。为有效探寻CSVD的中西医病理机制及防治方法,制备合适的且能展示中医药特色优势的动物模型尤为重要。目前针对CSVD模型的动物种属主要是啮齿类动物,其中大鼠、小鼠、沙鼠应用较多,非人灵长类动物应用较少,却具有啮齿类动物无法比拟的优势,大脑与人类更相似,可以作为未来相关研究的主要动物选择。虽然本文综述了4种与CSVD相关的动物模型(低灌注损伤CSVD模型、高血压靶器官损伤CSVD模型、基因修饰CSVD模型、微小栓子栓塞CSVD模型),其特征见表1,但迄今为止尚没有任何一种动物模型能够完全复制CSVD的病理特点,且大部分是通过单一因素造模,针对复合因素制备的模型不多,故仍需深入探索符合临床特点并能模拟临床病理演变过程的动物模型开发。基于多因素多靶点制备的复合型CSVD动物模型,将有助于推动CSVD发病机制研究,促进防治本病的中医药创新药物研发,凸显中医药的临床优势。
表1 CSVD动物模型特征
Table 1 Characteristics of animal models of CSVD
模型造模方法临床病理认知功能障碍神经功能缺陷文献 血管损伤白质病变微梗死脑微出血/脑出血 低灌注损伤 1外科缝线永久性结扎大鼠双侧颈总动脉−+−−+−7-11 2微线圈缠绕在C57Bl/6小鼠一侧颈总动脉分叉附近,间隔半小时后,将另一个同样大小的微线圈缠绕在对侧颈总动脉相同的位置+++−+−12-14 3C57BL/6J小鼠左侧颈总动脉缠绕微线圈(内径0.8 mm),右侧颈总动脉相同的位置放置Ameroid慢性缩窄环(内径0.5 mm)/++/++15 4通过立体定向仪将缩血管药物注射到大鼠相应的大脑部位−++−−+18-20 高血压损伤 5杂交培育+++++/21-24 6Ameroid慢性缩窄(内径0.5 mm)环植入SHR双侧颈总动脉++//+/25 7杂交培育+++++/21,26-28 8银夹(内径0.3 mm)夹闭SD大鼠双侧肾动脉根部++++++31-32 9银夹(内径0.3 mm)夹闭SD大鼠双侧肾动脉根部再用5-0的丝线先结扎右侧颈总动脉,1周后以同样的方式在同样的位置结扎左侧颈总动脉++−/+/33 10C57BL/6N小鼠皮下植入含有AngII的渗透微型泵并在饮水中加入NOS抑制剂L-NAMEL+++++/34 11通过手术将恒河猴胸主动脉前2~4 cm处血管直径缩小到2.0~2.5 mm+−+/+/35-38 基因修饰 12敲除小鼠eNOS基因++++++39 13将人APP770SwDI构建物注射到SD大鼠卵母细胞中+/+++/42-43 14利用Donor & CRISPR/Cas9技术构建表达人HTRA1基因L364P突变体的重组小鼠+/+///45 15转基因或基因敲入++++++47-50 16COL4A1突变小鼠的精子与C57BL/6J雌性小鼠卵母细胞进行体外受精,然后将胚胎移植到FVB/NJ雌性小鼠体内,通过分娩产生+−/+/+53 小栓子栓塞 17转基因小鼠单侧颈总动脉注射小荧光微球(直径20 μm),同时短暂阻断翼腭动脉和颈外动脉+++/++54-55 18LDLR−/−小鼠配合动脉粥样硬化饮食−/+−//56
1-BCAO模型 2-BCAS模型 3-ACAS模型 4-立体定向药物注射模型 5-SHR模型 6-SHR-2VGO模型 7-易卒中自发性高血压性CSVD模型 8-易卒中肾血管性高血压性CSVD模型 9-RHRSP/Modified 2VO模型 10-血管紧张素II诱导高血压性CSVD模型 11-主动脉缩窄高血压性CSVD模型 12-基因缺陷小鼠模型 13-CAA模型 14-基因重组小鼠模型 15-CADASIL基因突变小鼠模型 16-基因突变模型 17-微球注射微梗死模型 18-高胆固醇血症栓塞模型;+-有相关病变 −-无相关病变 /-未报告
-BCAO model 2-BCAS model 3-ACAS model 4-stereotactic drug injection model 5-SHR model 6-SHR-2VGO model 7-stroke prone spontaneous hypertensive CSVD model 8- CSVD model of renal vascular hypertension prone to stroke 9-RHRSP/Modified 2VO model 10- angiotensin II-induced hypertensive CSVD model 11-hypertensive CSVD model of aortic coarctation 12-genetically defective mouse model 13-CAA model 14-recombinant mouse model 15-CADASIL gene mutant mouse model 16-gene mutation model 17-microinfarct model by microsphere injection 18-hypercholesterolemia embolization model; +-there are associated lesions −-there are no associated lesions /-not reported
利益冲突 所有作者均声明不存在利益冲突
[1] 中国研究型医院学会脑小血管病专业委员会《中国脑小血管病诊治专家共识》编写组. 中国脑小血管病诊治专家共识2021 [J]. 中国卒中杂志, 2021, 16(7): 716-726.
[2] Rajani R M, Williams A. Endothelial cell-oligodendrocyte interactions in small vessel disease and aging [J]., 2017, 131(5): 369-379.
[3] 李婷婷, 孙千惠, 王博远, 等. 中医药防治脑小血管病的CiteSpace知识图谱分析 [J]. 中国中药杂志, 2022, 47(8): 2228-2236.
[4] 李歌, 代云, 冀梁, 等. 脑小血管病的中医病因病机及治法探讨 [J]. 中医临床研究, 2021, 13(20): 91-93.
[5] 杨静, 杨晖, 吴荣东. 脑小血管病的中医药诊疗概况 [J]. 中医临床研究, 2021, 13(21): 34-37.
[6] Hainsworth A H, Markus H S. Doexperimental models reflect human cerebral small vessel disease? A systematic review [J]., 2008, 28(12): 1877-1891.
[7] Farkas E, Luiten P G M, Bari F. Permanent, bilateral common carotid artery occlusion in the rat: A model for chronic cerebral hypoperfusion-related neurodegenerative diseases [J]., 2007, 54(1): 162-180.
[8] Tomimoto H, Ihara M, Wakita H,. Chronic cerebral hypoperfusion induces white matter lesions and loss of oligodendroglia with DNA fragmentation in the rat [J]., 2003, 106(6): 527-534.
[9] Sun Z Y, Gao C H, Gao D D,. Reduction in pericyte coverage leads to blood-brain barrier dysfunction via endothelial transcytosis following chronic cerebral hypoperfusion [J]., 2021, 18(1): 21.
[10] 陆正齐, 陈小东, 杨钰华. 脑小血管病动物模型的现状和未来 [J]. 中华医学杂志, 2019, 99(9): 644-646.
[11] Wakita H, Tomimoto H, Akiguchi I,. Axonal damage and demyelination in the white matter after chronic cerebral hypoperfusion in the rat [J]., 2002, 924(1): 63-70.
[12] Shibata M, Ohtani R, Ihara M,. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion [J]., 2004, 35(11): 2598-2603.
[13] Patel A, Moalem A, Cheng H,. Chronic cerebral hypoperfusion induced by bilateral carotid artery stenosis causes selective recognition impairment in adult mice [J]., 2017, 39(10): 910-917.
[14] Holland P R, Searcy J L, Salvadores N,. Gliovascular disruption and cognitive deficits in a mouse model with features of small vessel disease [J]., 2015, 35(6): 1005-1014.
[15] Hattori Y, Enmi J I, Kitamura A,. A novel mouse model of subcortical infarcts with dementia [J]., 2015, 35(9): 3915-3928.
[16] Cechetti F, Worm P V, Pereira L O,. The modified 2VO ischemia protocol causes cognitive impairment similar to that induced by the standard method, but with a better survival rate [J]., 2010, 43(12): 1178-1183.
[17] Cechetti F, Worm P V, Elsner V R,. Forced treadmill exercise prevents oxidative stress and memory deficits following chronic cerebral hypoperfusion in the rat [J]., 2012, 97(1): 90-96.
[18] Uchida H, Sakata H, Fujimura M,. Experimental model of small subcortical infarcts in mice with long-lasting functional disabilities [J]., 2015, 1629: 318-328.
[19] Ahmad A S, Satriotomo I, Fazal J A,. Optimization of a clinically relevant model of white matter stroke in mice: Histological and functional evidences [J]., 2015, 2(2): 114.
[20] Ono H, Imai H, Miyawaki S,. Rat white matter injury model induced by endothelin-1 injection: Technical modification and pathological evaluation [J]., 2016, 76(3): 212-224.
[21] Kaiser D, Weise G S, Möller K,. Spontaneous white matter damage, cognitive decline and neuroinflammation in middle-aged hypertensive rats: An animal model of early-stage cerebral small vessel disease [J]., 2014, 2: 169.
[22] Jiwa N S, Garrard P, Hainsworth A H. Experimental models of vascular dementia and vascular cognitive impairment: A systematic review [J]., 2010, 115(4): 814-828.
[23] Xue Y, Liu N, Zhang M Y,. Concomitant enlargement of perivascular spaces and decrease in glymphatic transport in an animal model of cerebral small vessel disease [J]., 2020, 161: 78-83.
[24] Liu N, Xue Y, Tang J,. The dynamic change of phenotypic markers of smooth muscle cells in an animal model of cerebral small vessel disease [J]., 2021, 133: 104061.
[25] Kitamura A, Saito S, Maki T,. Gradual cerebral hypoperfusion in spontaneously hypertensive rats induces slowly evolving white matter abnormalities and impairs working memory [J]., 2016, 36(9): 1592-1602.
[26] Bailey E L, Smith C, Sudlow C L M,. Is the spontaneously hypertensive stroke prone rat a pertinent model of sub cortical ischemic stroke? A systematic review [J]., 2011, 6(5): 434-444.
[27] Ishizuka T, Niwa A, Tabuchi M,. Involvement of thromboxane A2 receptor in the cerebrovascular damage of salt-loaded, stroke-prone rats [J]., 2007, 25(4): 861-870.
[28] Kim-Mitsuyama S, Yamamoto E, Tanaka T,. Critical role of angiotensin II in excess salt-induced brain oxidative stress of stroke-prone spontaneously hypertensive rats [J]., 2005, 36(5): 1083-1088.
[29] Bailey E L, McBride M W, McClure J D,. Effects of dietary salt on gene and protein expression in brain tissue of a model of sporadic small vessel disease [J]., 2018, 132(12): 1315-1328.
[30] 蓝琳芳, 范玉华. 脑白质病变动物模型的研究进展 [J]. 中华脑血管病杂志: 电子版, 2013, 7(6): 337-341.
[31] Zeng J, Zhang Y, Mo J,. Two-kidney, two clip renovascular hypertensive rats can be used as stroke-prone rats [J]., 1998, 29(8): 1708-1713.
[32] Fan Y H, Lan L F, Zheng L,. Spontaneous white matter lesion in brain of stroke-prone renovascular hypertensive rats: A study from MRI, pathology and behavior [J]., 2015, 30(6): 1479-1486.
[33] Lin J, Lan L F, Wang D L,. Cerebral venous collagen remodeling in a modified white matter lesions animal model [J]., 2017, 367: 72-84.
[34] Meissner A, Minnerup J, Soria G,. Structural and functional brain alterations in a murine model of angiotensin II-induced hypertension [J]., 2017, 140(3): 509-521.
[35] Moss M B, Jonak E. Cerebrovascular disease and dementia: A primate model of hypertension and cognition [J]., 2007, 3(2 Suppl): S6-S15.
[36] Kemper T, Moss M B, Hollander W,. Microinfarction as a result of hypertension in a primate model of cerebrovascular disease [J]., 1999, 98(3): 295-303.
[37] Kemper T L, Blatt G J, Killiany R J,. Neuropathology of progressive cognitive decline in chronically hypertensive rhesus monkeys [J]., 2001, 101(2): 145-153.
[38] Moore T L, Killiany R J, Rosene D L,. Impairment of executive function induced by hypertension in the rhesus monkey () [J]., 2002, 116(3): 387-396.
[39] Liao F F, Lin G, Chen X Y,. Endothelial nitric oxide synthase-deficient mice: A model of spontaneous cerebral small-vessel disease [J]., 2021, 191(11): 1932-1945.
[40] Attems J, Jellinger K, Thal D R,. Review: Sporadic cerebral amyloid angiopathy [J]., 2011, 37(1): 75-93.
[41] Rensink A A M, de Waal R M W, Kremer B,. Pathogenesis of cerebral amyloid angiopathy [J]., 2003, 43(2): 207-223.
[42] Davis J, Xu F, Hatfield J,. A novel transgenic rat model of robust cerebral microvascular amyloid with prominent vasculopathy [J]., 2018, 188(12): 2877-2889.
[43] Zhu X Y, Hatfield J, Sullivan J K,. Robust neuroinflammation and perivascular pathology in rTg-DI rats, a novel model of microvascular cerebral amyloid angiopathy [J]., 2020, 17(1): 78.
[44] Nozaki H, Nishizawa M, Onodera O. Features of cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy [J]., 2014, 45(11): 3447-3453.
[45] Li C F, Jin W, Wang X L,. Establishment and identification of a novel HTRA1 mutation mice model [J]., 2019, 20(3): 179-186.
[46] 陈美林, 何志义. 单基因遗传性脑小血管病诊断与鉴别诊断 [J]. 中国实用内科杂志, 2021, 41(1): 30-34, 39.
[47] Monet-Leprêtre M, Bardot B, Lemaire B,. Distinct phenotypic and functional features of CADASIL mutations in the Notch3 ligand binding domain [J]., 2009, 132(Pt 6): 1601-1612.
[48] Wallays G, Nuyens D, Silasi-Mansat R,. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy [J]., 2011, 31(12): 2881-2888.
[49] Gravesteijn G, Munting L P, Overzier M,. Progression and classification of granular osmiophilic material (GOM) deposits in functionally characterized human NOTCH3transgenic mice [J]., 2020, 11(3): 517-527.
[50] Rutten J W, Klever R R, Hegeman I M,. The NOTCH3 score: A pre-clinical CADASIL biomarker in a novel human genomic NOTCH3 transgenic mouse model with early progressive vascular NOTCH3accumulation [J]., 2015, 3: 89.
[51] Kitzler T M, Schneider R, Kohl S,. COL4A1 mutations as a potential novel cause of autosomal dominant CAKUT in humans [J]., 2019, 138(10): 1105-1115.
[52] van Agtmael T, Bailey M A, Schlötzer-Schrehardt U,. COL4A1 mutation in mice causes defects in vascular function and low blood pressure associated with reduced red blood cell volume [J]., 2010, 19(6): 1119-1128.
[53] Gould D B, Phalan F C, van Mil S E,. Role of COL4A1 in small-vessel disease and hemorrhagic stroke [J]., 2006, 354(14): 1489-1496.
[54] Silasi G, She J, Boyd J D,. A mouse model of small-vessel disease that produces brain-wide-identified microocclusions and regionally selective neuronal injury [J]., 2015, 35(5): 734-738.
[55] Balbi M, Vanni M P, Vega M J,. Longitudinal monitoring of mesoscopic cortical activity in a mouse model of microinfarcts reveals dissociations with behavioral and motor function [J]., 2019, 39(8): 1486-1500.
[56] Kraft P, Schuhmann M K, Garz C,. Hypercholesterolemia induced cerebral small vessel disease [J]., 2017, 12(8): e0182822.
Research progress on experimental animal models and preparation methods of cerebral small vessel disease
WANG Xiang-yuan, SHE Rui-ning, FANG Rui, GE Jin-wen, MEI Zhi-gang
Key Laboratory of Hunan Province for Integrated Traditional Chinese and Western Medicine on Prevention and Treatment of Cardio-cerebral Diseases, College of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha 410208, China
Cerebral small vessel disease (CSVD) is a cerebrovascular disease caused by dynamic diffuse lesions of intracranial microvascular. It is the main cause of stroke and vascular dementia, with high concealment, high incidence rate and high disability rate. Its pathogenesis may be related to reduced cerebral blood flow or chronic cerebral hypoperfusion, endothelial dysfunction, impaired blood-cerebrospinal fluid barrier function, inflammatory response and heredity. Therefore, in order to effectively explore the pathological mechanism and prevention methods of CSVD in traditional Chinese and Western medicine, it is particularly important to prepare suitable animal models that can demonstrate the characteristics and advantages of traditional Chinese medicine. The current CSVD animal models include low perfusion injury CSVD model, hypertension target organ injury CSVD model, gene modified CSVD model, and microembolization CSVD model. Research progress on animal models of CSVD at home and abroad in recent years from the perspectives of model establishment, behavior, pathological changes, and advantages and disadvantages of models were reviewed in this paper, in order to provide model animal reference for in-depth exploration of the pathogenesis of CSVD and for innovative drug research and development for the prevention and treatment of the disease.
cerebral small vessel disease; animal models; traditional Chinese medicine; low perfusion injury CSVD model; hypertension target organ injury CSVD model; gene modified CSVD model; microembolization CSVD model
R285.51
A
0253 - 2670(2022)18 - 5851 - 10
10.7501/j.issn.0253-2670.2022.18.028
2022-06-02
国家重点研发计划项目(2018YFC1704904);湖南省科学技术厅省重点研发计划项目(2022SK2016);湖南中医药大学中西医结合一流学科重点项目(2021ZXYJH01)
王香元,硕士,研究方向为中西医结合防治心脑血管疾病。E-mail: 1742380492@qq.com
葛金文,教授,博士。E-mail: 001267@hnucm.edu.cn
梅志刚,教授,博士。E-mail: meizhigang@hnucm.edu.cn
[责任编辑 崔艳丽]
