海洋曲霉Aspergillus ruber TX-M4-1的次级代谢产物研究
2022-09-20王玉妃王诗怡蓝坤燕杜为胜孔凡栋周丽曼
王 聪,王玉妃,孙 建,王诗怡,蓝坤燕,杜为胜,孔凡栋,周丽曼
海洋曲霉TX-M4-1的次级代谢产物研究
王 聪,王玉妃,孙 建,王诗怡,蓝坤燕,杜为胜,孔凡栋,周丽曼*
广西民族大学化学化工学院,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室,广西林产化学与工程协同创新中心,广西 南宁 530006
对来自涠洲岛火山口的海洋曲霉TX-M4-1的次级代谢产物进行研究。利用硅胶、凝胶和高效液相等柱色谱方法进行分离纯化,运用紫外、红外、质谱和核磁共振波谱等分析方法对化合物进行结构鉴定,分别采用96孔板微量法、CCK-8法和DPPH法对化合物的抗菌活性、肿瘤细胞毒活性及抗氧化活性进行测试。从海洋曲霉TX-M4-1的发酵产物中分离鉴定了1个新的苯甲醛类化合物及10个已知结构的化合物,分别鉴定为5′-顺式-四氢金色灰绿曲霉素(1)、2-(1′,5′-庚二烯基)-3,6-二羟基-5-(3-甲基-2-丁烯基)苯甲醛(2)、异二氢金色灰绿曲霉素(3)、二氢金色灰绿曲霉素(4)、四氢金色灰绿曲霉素(5)、灰绿曲霉黄色素(6)、谷甾醇(7)、胆固醇(8)、链蠕孢素(9)、脱氢海胆灵(10)和新海胆灵A(11)。化合物1、5和6具有清除自由基活性,20 μmol/L浓度下其DPPH自由基清除率分别为61.9%、88.0%和91.9%。化合物1为新的苯甲醛类化合物。化合物1、5和6具有强的抗氧化活性。
海洋曲霉TX-M4-1;苯甲醛类化合物;抗氧化活性;5′-顺式-四氢金色灰绿曲霉素;灰绿曲霉黄色素
海洋环境相较于陆地环境有高压、高盐、高渗、低温、营养少等特点。海洋微生物在长期适应这种特殊生存环境的过程中进化出了有别于陆生生物的新陈代谢途径和适应机制,进而产生了大量结构新颖、活性显著的次级代谢产物,是发现药物先导化合物的主要途径[1]。海洋曲霉来源新化合物的研究始于1992年,截至2014年8月,已报道了512个海洋曲霉来源的新化合物,36%海洋曲霉来源的新化合物具有生物活性,海洋曲霉已成为海洋药物研究的热点来源[2-3]。
涠洲岛地处北部湾海域,是我国最大、最年轻的火山喷发堆积形成的岛屿,其具有独特的火山兼海洋地貌,生态环境特殊。特殊环境中的微生物为适应外部特殊环境演变出独特的次生代谢途径,产生结构新颖的活性化合物。因此对特境微生物次级代谢产物的研究及天然产物的扩充及药源分子的发现具有十分重要的意义[4-5]。
本研究通过梯度稀释法,从采自涠洲岛火山口的苔藓样品中分离得到了一株海洋真菌TX-M4-1,对其进行固态培养后从发酵提取物中分离得到了1个新的苯甲醛类化合物5′-顺式-四氢金色灰绿曲霉素(5′--isotetrahydro- auroglaucin,1)和10个已知化合物2-(1′,5′-庚二烯基)-3,6-二羟基-5-(3-甲基-2-丁烯基)苯甲醛[2-(1′,5′-heptadienyl)-3,6-dihydroxy-5-(3-methyl-2-butenyl)benzaldehyde,2]、异二氢金色灰绿曲霉素(isodihydroauroglaucin,3)、二氢金色灰绿曲霉素(dihydroauroglaucin,4)、四氢金色灰绿曲霉素(tetrahydroauroglaucin,5)、灰绿曲霉黄色素(flavoglaucin,6)、β-谷甾醇(β-sitosterol,7)、胆固醇(cholesterol,8)、链蠕孢素(catenarin,9)、脱氢海胆灵(dehydroechinulin,10)和新海胆灵A(neoechinulin A,11)。结构见图1。对以上分离得到的化合物进行了抗菌、肿瘤细胞毒活性以及自由基清除能力活性测试,结果显示化合物1、5和6具有清除自由基活性,20 μmol/L浓度下的DPPH自由基清除率分别为61.9%、88.0%和91.9%。
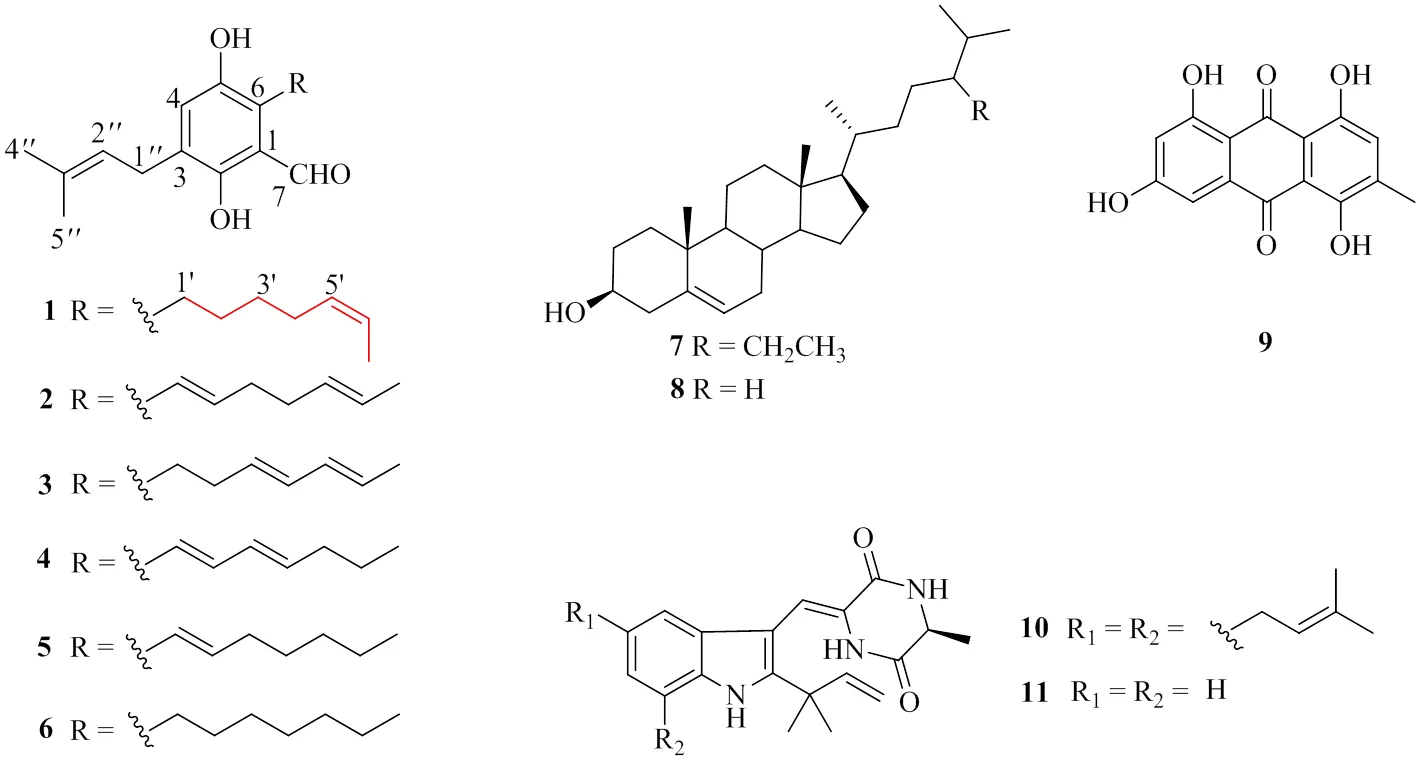
图1 化合物1~11的结构
1 仪器与材料
HCB-1300V型洁净工作台(青岛海尔特种电器有限公司)、LRH-500A型生化培养箱(广东泰宏君科学仪器股份有限公司)、核磁共振波谱仪(布鲁克400 MHz)、CR-080R型春霖超声波清洗机(深圳市春霖清洗设备有限公司)、YXQ-LS-75SII型高压灭菌锅(上海博迅实业有限公司医疗设备厂)、TD4N离心机(长沙英泰仪器有限公司)、Mariner API-TOF型质谱仪(美国应用生物系统公司)、K3 TOUCH酶标仪(飞世尔实验器材有限公司)、Agilent 1260高效液相色谱仪(美国Agilent公司)、SCI-VS混匀仪(美国塞洛捷克公司)、AL104型分析天平(瑞士梅特勒公司)、200~300目正相硅胶(青岛海洋化工集团公司)、YMC*GEL ODS-A-HG反相硅胶(日本YMC Group)。提取分离用醋酸乙酯、甲醇、二氯甲烷等均为工业用化学纯产品。
一株海洋真菌分离于广西涠洲岛来源的苔藓(N21°1′42.97′′,E109°7′46.29′′)。综合菌株的生长形态与序列比对(GenBank accession No. OL989330),此菌株鉴定为TX-M4-1。
2 方法
2.1 菌株发酵
将菌株TX-M4-1接种于PDA平板培养基中,在28 ℃培养3 d,将此菌株接种于大米培养基(大米80 g、海水120 mL)的锥形瓶(1000 mL)中,室温静置培养32 d,发酵规模为100瓶。
2.2 菌株分子鉴定
海洋真菌基因组DNA的提取、扩增以及测序纯化3部分是由上海生工生物工程股份有限公司测试[6]。
2.3 产物的提取分离
2.3.1 菌株提取物制备 采用醋酸乙酯对菌株TX-M4-1发酵物萃取3次,滤过和减压浓缩后得到83.47 g粗提物。
2.3.2 产物的提取 采用石油醚、90%甲醇-水各2 L萃取上述粗提物,得到石油醚萃取物25.1 g,甲醇-水萃取物90.16 g(未完全蒸干水分)。
2.3.3 化合物的分离 对石油醚萃取物进行减压硅胶柱色谱,采用石油醚-醋酸乙酯(1∶0、10∶1、9∶1、8∶1、6∶1、4∶1、2∶1、1∶1、0∶1)梯度洗脱,共9个梯度(Fr. 1~9),每个梯度分4次收集。以Fr. 2为例,编号依次为Fr. 2.1~2.4。Fr. 2.1(100mg)通过HPLC制备(C18半制备柱,甲醇-水85∶15,体积流量4 mL/min),得到化合物1(R=17.1 min,16.6 mg)、2(R=16.3 min,31.3 mg)、3(R=13.6 min,2.5 mg)、4(R=18.1 min,12 mg)、5(R=20.2 min,13 mg)和6(R=22.2 min,18 mg)。Fr. 2.4(640 mg)通过凝胶柱色谱,以二氯甲烷-甲醇(1∶1)洗脱,TLC检测合并、浓缩后得到5个流分Fr. 2.4.1~2.4.5。Fr. 2.4.1(350 mg)通过硅胶柱色谱(石油醚-醋酸乙酯50∶1洗脱),TLC检测、合并得到化合物7(R=7.1 min,7.1 mg)和8(R=10.4 min,65.1 mg)。Fr. 3.2(100 mg)通过凝胶柱色谱,以二氯甲烷-甲醇(1∶1)洗脱,TLC检测浓缩后得到6个流分Fr. 3.2.1~3.2.6。Fr. 3.2.5(63 mg)通过HPLC制备(C18半制备柱,乙腈-水80∶20,流量4 mL/min),得到化合物9(R=6.8 min,25 mg)。Fr.7.2(164 mg)通过凝胶柱色谱,以二氯甲烷-甲醇(1:1)洗脱,TLC检测合并浓缩后得到3个流分Fr. 7.2.1~7.2.3。Fr. 7.2.2(127 mg)通过HPLC制备(C18半制备柱,乙腈-水80∶20,流量4 mL/min),得到化合物10(R=17.2 min,62.7 mg)。Fr. 7.2.2(127 mg)通过HPLC制备(5PFP半制备柱,乙腈-水70∶30,体积流量4 mL/min),得到化合物11(R=10.4 min,4.8 mg)。
3 结果与分析
3.1 菌株鉴定结果
菌株TX-M4-1的PCR扩增序列的长度为502 bp,与NCBI数据库中的菌株[(OL989330)]的ITS序列同源性为100%,亲缘关系在系统发育树上处于同一分支。初步鉴定该海洋真菌TX-M4-1(GenBank OL989330)为曲霉属sp.(图2)。菌株生长一段时间后进一步观察其形态特征,菌落呈黄绿色、绒状,与赤曲霉的形态特征一致,故鉴定菌株TX-M4-1为赤曲霉[7]。

图2 TX-M4-1菌株的系统发育树状关系图
3.2 化合物结构鉴定

化合物2:无色粉末,ESI-MS/301.2 [M+H]+,分子式C19H24O3;1H-NMR (400 MHz, CDCl3):11.70 (1H, s, 6-OH), 10.08 (1H, s, H-7), 7.02 (1H, s, H-4), 6.44 (1H, d,= 16.3 Hz, H-1′), 5.90 (1H, dt,= 16.2, 6.9 Hz, H-2′), 5.50 (1H, m, H-6′), 5.43 (1H, m, H-5′), 5.29 (1H, m, H-2′′), 3.31 (2H, d,= 7.6 Hz, H-1′′), 2.40 (2H, q,= 6.8 Hz, H-3′), 2.22 (2H, q,= 6.8 Hz, H-4′), 1.76 (3H, s, H-4′′), 1.70 (3H, m, H-5′′), 1.69 (3H, m, H-7′);13C-NMR (100 MHz, CDCl3): 196.5 (CH, C-7), 154.7 (C,C-6), 145.0 (C, C-3), 142.1(CH, C-2′), 134.1 (C, C-3′′), 130.6 (C, C-5), 130.4 (CH, C-5′), 126.9 (CH, C-6′), 125.2 (CH, C-4), 123.9 (C, C-2), 121.1 (CH, C-2′′), 121.0 (CH, C-1′), 117.2 (C, C-1), 33.3 (CH2, C-3′), 32.1 (CH2, C-4′), 27.3 (CH2, C-1′′), 25.9 (CH3, C-4′′), 18.0 (CH3, C-5′′), 17.9 (CH3, C-7′)。以上数据与文献报道一致[9],故鉴定化合物2为2-(1′,5′-庚二烯基)-3,6-二羟基-5-(3-甲基- 2-丁烯基)苯甲醛。

图3 化合物1的重要1H-1H COSY、HMBC和NOESY相关
表1 化合物1的1H- (400 MHz, CDCl3) 和13C- (100 MHz, CDCl3) NMR数据
Table 1 1H- (400 MHz, CDCl3) and 13C- (100 MHz, CDCl3) NMR data of compound 1
碳位δHδC 1 117.4, C 2 156.0, C 3 128.8, C 46.89 (1H, s)125.8, C 5 145.1, C 6 128.5, C 710.24 (1H, s)195.7, CH 1′2.88 (2H, t, J = 7.7 Hz)23.8, CH2 2′1.60 (2H, m)31.4, CH2 3′1.46 (2H, m)29.4, CH2 4′2.03 (2H, m)32.4, CH2 5′5.40 (1H, overlapped)131.1, CH 6′5.41 (1H, overlapped)125.5, CH 7′1.64 (3H, d, J = 7.2 Hz)18.1, CH3 1′′3.29 (2H, d, J = 7.4 Hz)27.1, CH2 2′′5.28 (1H, m)121.3, CH 3′′ 134.0, C 4′′1.69 (3H, s)17.9, CH3 5′′1.76 (3H, s)26.0, CH3 2-OH11.92 (1H, s)
化合物3:橙红色固体,ESI-MS/301.2 [M+H]+,分子式C19H24O3;1H-NMR (400 MHz, CDCl3):11.93 (1H, s, 2-OH), 10.23 (1H, s, 1-CHO), 6.90 (1H, s, H-4), 6.02 (1H, m, H-3′), 5.99 (1H, m, H-4′), 5.59 (1H, m, H-5′), 5.58 (1H, m, H-6′), 5.28 (1H, m, H-2′′), 4.51 (1H, brs, 5-OH), 3.29 (2H, d,= 7.4 Hz, H-1′′), 2.98 (2H, t,= 7.6 Hz, H-1′), 2.34 (2H, q,= 7.7 Hz, H-2′), 1.76 (3H, d,= 1.3 Hz, H-5′′), 1.73 (3H, d,= 6.9 Hz, H-7′), 1.69 (3H, s, H-4′′);13C-NMR (100 MHz, CDCl3):195.5 (C, 1-CHO), 156.0 (C, C-2), 145.2 (C, C-5), 134.1 (C, C-3′′), 132.2 (CH, C-3′), 131.3 (CH, C-4′), 129.5 (CH, C-6′), 129.1 (C, C-3), 128.5 (CH, C-5′), 127.5 (C, C-6), 126.0 (CH, C-4), 121.3 (CH, C-2′′), 117.4 (C, C-1), 34.4 (CH2, C-2′), 27.2 (CH2, C-1′′), 26.0 (CH3, C-5′′), 24.3 (CH2, C-1′), 18.2 (CH3, C-7′), 17.9 (CH3, C-4′′)。以上数据与文献报道一致[10],故鉴定化合物3为异二氢金色灰绿曲霉素。
化合物4:棕色油状物;ESI-MS/301.2 [M+H]+,分子式C19H24O3;1H-NMR (400 MHz, CDCl3):11.78 (1H, s, 2-OH), 10.09 (1H, s, 1-CHO), 7.00 (1H, s, H-4), 6.56 (1H, dd,= 15.9 Hz, H-1′), 6.43 (1H, dd,= 15.6, 10.3 Hz, H-2′), 6.27 (1H, dd,= 10.3, 15.1 Hz, H-3′) , 5.89 (1H, dt,= 15.1, 7.2 Hz, H-4′) , 5.30 (1H, m, H-2′′), 3.32 (2H, d,= 7.2 Hz, H-1′′), 2.15 (2H, q,= 7.3 Hz, H-5′), 1.76 (3H, s, H-5′′), 1.70 (3H, s, H-4′′), 1.47 (2H, sextex,= 7.4 Hz, H-6′), 0.94 (3H, t,= 7.3 Hz, H-7′);13C-NMR (100 MHz, CDCl3):196.4 (C, 1-CHO), 155.4 (C, C-2), 145.2 (C, C-5), 140.1 (CH, C-2′′), 139.1 (CH, C-4′), 134.2 (C, C-3′′), 130.7 (C, C-3), 129.7 (CH, C-3′), 125.3 (CH, C-4), 124.2 (C, C-6), 121.1 (CH, C-2′′), 119.5 (CH2, C-1′′), 117.2 (C, C-1), 35.0 (CH2, C-5′), 27.4 (CH2, C-1′′), 26.0 (CH3, C-5′′), 22.4 (CH2, C-6′), 17.9 (CH3, C-4), 13.9 (CH3, C-7′)。以上数据与文献报道一致[10],故鉴定化合物4为二氢金色灰绿曲霉素。
化合物5:红色固体;ESI-MS/341.3 [M+K]+,分子式C19H26O3;1H-NMR (400 MHz, CDCl3):11.72 (1H, s, 2-OH), 10.09 (1H, s, 1-CHO), 7.01 (1H, s, H-4), 6.48 (1H, d,= 16.1 Hz, H-1′), 5.98 (1H, dt,= 16.2, 6.8 Hz, H-2′), 5.29 (1H, m, H-2′′), 4.98 (1H, s, 5-OH), 3.31 (2H, d,= 7.2 Hz, H-1), 2.32 (2H, q,= 7.3 Hz, H-3′), 1.75 (3H, s, H-5), 1.69 (3H, s, H-4), 1.51 (2H, quintet,= 7.2 Hz, H-4′), 1.35 (4H, m, H-5′, 6′), 0.91 (3H, t,= 6.6 Hz, H-7′);13C-NMR (100 MHz, CDCl3):196.5 (C, 1-CHO), 155.2 (C, C-2), 145.0 (C, C-5), 142.8 (CH, C-2′), 134.0 (C, C-3′′), 130.4 (C, C-3), 125.2 (CH, C-4), 124.2 (C, C-6), 121.1 (CH, C-2′′), 120.2 (CH, C-1′), 117.3(C, C-1), 33.6 (CH2, C-3′), 31.6 (CH2, C-5′), 28.9 (CH2, C-4′), 27.4 (CH2, C-1′′), 25.9 (CH3, C-5′′), 22.6 (CH2, C-6′), 17.9 (CH3, C-4′′), 14.1 (CH3, C-7′)。以上数据与文献报道一致[10],故鉴定化合物5为四氢金色灰绿曲霉素。
化合物6:棕黄色固体;ESI-MS/327.3 [M+Na]+,分子式C19H28O3;1H-NMR (400 MHz, CDCl3): 11.92 (1H, s, 2-OH), 10.25 (1H, s, 1-CHO), 6.89 (1H, s, H-4), 5.28 (1H, m, H-2), 4.44 (1H, m, 5-OH), 3.29 (2H, d,= 7.4 Hz, H-1′′), 2.88 (2H, t,= 7.7 Hz, H-1′), 1.76 (3H, s, H-5), 1.70 (3H, s, H-4′′), 1.57 (2H, m, H-2′), 1.39 (2H, m, H-3′), 1.30 (2H, m, H-4′), 1.28 (4H, m, H-5′, 6′), 0.88 (3H, t,= 6.8 Hz, H-7′);13C-NMR (100 MHz, CDCl3):196.5 (C, 1-CHO), 155.2 (C, C-2), 145.0 (C, C-5), 134.0 (CH, C-3′′), 130.4 (C, C-3, 6), 125.2 (CH, C-4), 121.1 (CH, C-2′′), 117.3 (C, C-1), 33.6 (CH2, C-2′), 31.6 (CH2, C-5′), 29.8 (CH2, C-3′), 28.9(CH2, C-4′), 27.4 (CH2, C-1′′), 25.9 (CH3, C-5′′), 24.1 (CH2, C-1′), 22.6 (CH2, C-6′), 17.9 (CH2, C-4′′), 14.1 (CH3, C-7′)。以上数据与文献报道一致[10],故鉴定化合物6为灰绿曲霉黄色素。
化合物7:白色粉末;ESI-MS414.3 [M+H]+,分子式C29H50O;1H-NMR (400 MHz, CDCl3):5.35 (1H, brd,= 5.5 Hz, H-6), 3.52 (1H, m, H-3) , 1.01 (3H, s, H-19), 0.92 (3H, m, H-21), 0.86 (3H, m, H-29), 0.84 (3H, m, H-26), 0.82 (3H, m, H-27), 0.68 (3H, s, H-18);13C-NMR (100 MHz, CDCl3):140.9 (C, C-5), 121.9 (CH, C-6), 72.0 (CH, C-3), 56.9 (CH, C-14), 56.2 (CH, C-17), 50.3 (CH, C-9), 46.0 (CH, C-24), 42.5 (CH2, C-4), 42.5 (C, C-13), 39.9 (CH2, C-12), 37.4 (CH2, C-1), 36.7 (C, C-10), 36.3 (CH, C-20), 34.1 (CH2, C-22), 32.1 (CH2, C-7), 31.8 (CH, C-8), 31.8 (CH2, C-2), 29.3 (CH, C-25), 28.4 (CH2, C-23), 26.2 (CH2, C-16), 24.5 (CH2, C-15), 22.8 (CH2, C-28), 21.2 (CH2, C-11), 20.0 (CH3, C-19), 19.5 (CH3, C-27), 19.2 (CH3, C-26), 18.9 (CH3, C-21), 12.1 (CH3, C-29), 12.0 (CH3, C-18)。以上数据与文献报道一致[11],故鉴定化合物7为β-谷甾醇。
化合物8:白色粉末;ESI-MS/409.3[M+Na]+,分子式C27H46O;1H-NMR (400 MHz, CDCl3):5.35 (1H, m, H-6), 3.52 (1H, m, H-3), 1.01 (3H, s, H-19), 0.92 (3H, m, H-21), 0.86 (3H, m, H-29), 0.84 (3H, m, H-26), 0.82 (3H, m, H-27), 0.68 (3H, s, H-18);13C-NMR (100 MHz, CDCl3):140.8 (C, C-5), 121.8 (CH, C-6), 71.9 (CH, C-3), 56.9 (CH, C-14), 56.2 (CH, C-17), 50.3 (CH, C-9), 46.0 (C, C-13), 42.3 (CH2, C-4), 39.9 (CH2, C-12), 39.8 (CH2, C-24), 37.4 (CH2, C-1), 36.6 (C, C-10), 36.3 (CH2, C-22), 35.9 (CH, C-20), 34.1 (CH, C-8), 32.0 (CH2, C-2), 31.6 (CH2, C-7), 29.3 (CH, C-25), 28.4 (CH2, C-16), 24.4 (CH2, C-15), 23.2 (CH2, C-23), 22.8 (CH3, C-27), 22.7 (CH3, C-26), 21.2 (CH2, C-11), 19.2 (CH3, C-21), 18.9 (CH3, C-19), 12.0 (CH3, C-18)。以上数据与文献报道一致[12-14],故鉴定化合物8为胆固醇。
化合物9:橙红色粉末;ESI-MS/309.2 [M+Na]+,分子式C15H10O6;1H-NMR (400 MHz, DMSO-6):13.13 (1H, s, 4-OH), 12.15 (2H, s, 1, 8-OH), 11.41 (1H, s, 6-OH), 7.11 (1H, brs, H-2), 7.00 (1H, d,= 2.24 Hz, H-5), 6.41 (1H, d,= 2.18 Hz, H-7);13C-NMR (100 MHz, DMSO-6):186.7 (C, C-9), 186.3 (C, C-10), 167.7 (C, C-6), 164.7 (C, C-8), 156.6 (C, C-1), 155.9 (CH, C-4), 153.6 (C, C-3), 134.4 (C, C-11), 129.0 (C, C-14), 111.5 (CH, C-2), 110.2 (C, C-13), 109.7 (C, C-12), 108.2 (C, C-5), 107.9 (CH, C-7), 15.8 (CH3, C-11)。以上数据与文献报道一致[15],故鉴定化合物9为链蠕孢素。
化合物10:白色固体;ESI-MS/492.3 [M+Na]+,分子式C29H37N3O2,1H-NMR (400 MHz, CDCl3):8.38 (1H, brs, NH-1), 7.53 (1H, brs, NH-14), 7.19 (1H, m, H-8), 6.98 (1H, brs, H-4), 6.90 (1H, brs, H-6), 6.05 (1H, dd,= 17.4, 10.6 Hz, H-16), 5.50 (1H, t,= 7.4 Hz, H-26), 5.41 (1H, t,= 7.2 Hz, H-21), 5.28 (1H, d,= 10.6 Hz, H-17a), 5.25 (1H, d,= 17.4 Hz, H-17b), 4.37 (1H, dq,= 7.1, 1.9 Hz, H-12), 3.62 (2H, d,= 7.4 Hz, H-25), 3.46 (2H, d,= 7.3 Hz, H-20), 1.94 (3H, s, H-29), 1.87 (3H, s, H-28), 1.80 (3H, s, H-23), 1.79 (3H, s, H-24), 1.68 (3H, d,= 7.0 Hz, H-30), 1.57 (6H, s, H-18, 19);13C-NMR (100 MHz, CDCl3):165.8 (C, C-13), 160.4 (C, C-10), 144.6 (CH, C-16), 143.4 (C, C-2), 135.0 (C, C-5), 133.3 (C, C-27), 132.3 (C, C-7a), 132.0 (C, C-22), 126.6 (C, C-3a), 124.4 (C, C-9), 124.3 (CH, C-21), 123.9 (C, C-7), 123.3 (CH, C-6), 122.9 (CH, C-26), 116.0 (CH, C-4), 113.2 (CH2, C-17), 112.3 (CH, C-8), 103.0 (C, C-3), 51.8 (CH, C-12), 39.3 (C, C-15), 34.6 (CH2, C-20), 31.4 (CH2, C-25), 27.5 (CH3, C-18), 27.4 (CH3, C-19), 25.9 (CH3, C-23), 25.8 (CH3, C-28), 21.0 (CH3, C-30), 18.1 (CH3, C-29), 17.9 (CH3, C-24)。以上数据与文献报道一致[16],故鉴定化合物10为脱氢海胆灵。
化合物11:淡黄色粉末;ESI-MS346.2 [M+Na]+,分子式C19H21N3O2;1H-NMR (400 MHz, CD3OD):7.42 (1H, d,= 7.9 Hz, H-7),7.24 (1H, d,= 7.8 Hz, H-4), 7.21 (1H, s, H-8), 7.12 (1H, m, H-6), 7.06 (1H, m, H-5), 6.11 (1H, dd,= 17.3, 10.8 Hz, H-17), 5.11 (1H, d,= 10.7 Hz, H-18a ), 5.09 (1H, d,= 17.4 Hz, H-18b), 4.22 (1H, q,= 7.1 Hz, H-12), 1.55 (3H, s, H-19 ), 1.54 (3H, s, H-20 ), 1.53 (3H, d,= 7.0 Hz, H-15);13C-NMR (100 MHz, CD3OD):168.7 (C, C-13), 162.2 (C, C-10), 146.2 (CH, C-17), 146.0 (C, C-2), 136.8 (C, C-3a), 127.3 (C, C-7a), 124.7 (C, C-3), 122.6 (CH, C-6), 121.2 (CH, C-5), 119.8 (CH, C-7), 114.4 (CH2, C-18), 112.7 (CH, C-8), 112.6 (CH, C-4), 104.3 (C, C-9), 52.6 (CH, C-12), 40.4 (C, C-16), 28.2 (CH3, C-20), 28.1 (CH3, C-19), 20.7 (CH3, C-15)。以上数据与文献报道一致[17-18],故鉴定化合物11为新海胆灵A。
3.3 抗氧化活性测试
对化合物进行抗氧化活性测试[19],样品浓度为20 μmol/L下化合物1、5和6显示出较强的抗氧化活性;DPPH自由基清除率分别为61.9%、88.0%和91.9%。阳性对照维生素C的DPPH自由基清除率为76.1%。
3.4 抑菌和肿瘤细胞毒活性测试
对化合物进行抗菌活性测试[20],结果显示化合物对金黄色葡萄球菌、MRSA、白色念珠菌和香蕉枯萎病菌没有活性。对化合物进行肿瘤细胞株HepG2和A549细胞毒活性测试,结果未显示细胞毒活性。
4 讨论
本实验对海洋真菌TX-M4-1的次级代谢产物进行了研究,该菌在大米培养基条件下代谢产生11个化合物(1~11),其中化合物1为新化合物。化合物1、5和6的DPPH自由基清除率分别为61.9%、88.0%和91.9%,具有一定生物活性。
利益冲突 所有作者均声明不存在利益冲突
[1] 朱伟明, 王俊锋. 海洋真菌生物活性物质研究之管见 [J]. 菌物学报, 2011, 30(2): 218-228.
[2] 赵成英, 刘海珊, 朱伟明. 海洋曲霉来源的新天然产物[J]. 微生物学报, 2016, 56(3): 331-362.
[3] 马丽丽, 田新朋, 李桂菊, 等. 海洋天然产物的高效发现与成药性研究 [J]. 热带海洋学报, 2021, 40(5): 134-146.
[4] 周荣丽, 穆军, 张翼, 等. 海洋真菌活性代谢产物最新研究进展 [J]. 天然产物研究与开发, 2008, 20(4): 741-747.
[5] 程思佳, 李顺祥. 生物转化技术在中药和天然药物开发中的应用进展[J]. 世界中医药, 2021, 16(13): 2051-2057.
[6] 王聪, 刘春娟, 雷福厚, 等. 海洋真菌sp. H1中1个新的二萜糖苷类化合物 [J]. 中草药, 2018, 49(24): 5746-5750.
[7] Nies J, Li S M. Prenylation and dehydrogenation of a C2-reversely prenylated diketopiperazine as a branching point in the biosynthesis of echinulin family alkaloids in[J]., 2021, 16(1): 185-192.
[8] Kim K S, Cui X, Lee D S,. Inhibitory effects of benzaldehyde derivatives from the marine fungussp. SF-5989 on inflammatory mediators via the induction of heme oxygenase-1 in lipopolysaccharide- stimulated RAW264.7 macrophages [J]., 2014, 15(12): 23749-23765.
[9] Li D L, Li X M, Li T G,. Benzaldehyde derivatives fromrubrum, an endophytic fungus derived from the mangrove plant[J].(), 2008, 56(9): 1282-1285.
[10] Miyake Y, Ito C, Itoigawa M,. Antioxidants produced byof filamentous fungi used for the manufacture of karebushi, dried bonito (Katsuobushi) [J]., 2009, 73(6): 1323-1327.
[11] 陈嘉颖, 马钢华, 钱菲, 等. 广藿香中非挥发性化学成分研究 [J]. 中草药, 2021, 52(5): 1240-1251.
[12] Fristiohady A, Yodha A W M, Sadarun B,. Isolation and identification of secondary metabolite from marine spongesp. and its antibacterial potency [J]., 2020, 11(3): 10082-10088.
[13] 陈显强, 高程海, 邢楠楠, 等. 侧扁软柳珊瑚中倍半萜和甾烷类化学成分研究 [J]. 中草药, 2019, 50(23): 5683-5689.
[14] 刘瑞, 张弘弛, 安志鹏, 等. 一株黄芪内生真菌甾醇类代谢产物的分离和鉴定 [J]. 食品工业科技, 2019, 40(8): 120-124, 130.
[15] 吴希, 夏厚林, 黄立华, 等. 香附化学成分研究 [J]. 中药材, 2008, 31(7): 990-992.
[16] 于洪佳, 薛雅馨, 洪葵, 等. 一株红树林曲霉菌sp. WHUF0343的次级代谢产物研究 [J]. 微生物学报, 2022, 62(7): 2658-2670.
[17] 王巍, 陈超, 杨君, 等. 植物内生真菌代谢物吲哚生物碱Neoechinulin A [J]. 天然产物研究与开发, 2007, 19(1): 48-50.
[18] 范翠梅, 侴桂新, 朱恩圆. 野百合的化学成分研究 [J]. 药学学报, 2016, 51(5): 775-779.
[19] Liu P P, Wang C, Lu Z Y,. New isochromane derivatives from the mangrove fungus094102 [J]., 2015, 10(12): 2123-2126.
[20] 陈默, 王志伟, 胡长鹰, 等. 酶标仪法快速评价香兰素的抑菌活性 [J]. 食品与发酵工业, 2009, 35(5): 63-66.
Secondary metabolites from marine-derivedTX-M4-1
WANG Cong, WANG Yu-fei, SUN Jian, WANG Shi-yi, LAN Kun-yan, DU Wei-sheng, KONG Fan-dong, ZHOU Li-man
Key Laboratory of Chemistry and Engineering of Forest Products, State Ethnic Affairs Commission, Guangxi Key Laboratory of Chemistry and Engineering of Forest Products, Guangxi Collaborative Innovation Center for Chemistry and Engineering of Forest Products, Guangxi Minzu University, Nanning 530006, China
To study the secondary metabolites of marine-derivedTX-M4-1.The secondary metabolites were isolated and purified by silica gel column chromatography, gel column chromatography and HPLC methods. The structures of the compounds were identified by UV, IR, MS and NMR. The antimicrobial, antitumor and antioxidant activities of compounds were evaluated by 96-well microtiter plate method, CCK-8 method and DPPH method, respectively.One new benzaldehyde compound and 10 compounds with known structures were isolated from the fermentation products of marine-derivedTX-M4-1. 5′--isotetrahydroauroglaucin (1), 2-(1′,5′-heptadienyl)-3,6-dihydroxy-5-(3-methyl-2-butenyl) benzaldehyde (2), isodihydroauroglaucin (3), dihydroauroglaucin (4), tetrahydroauroglaucin (5), flavoglaucin (6), β-sitosterol (7), cholesterol (8), catenarin (9), dehydroechinulin (10) and neoechinulin A (11), respectively. Compounds 1, 5 and 6 exhibited radical scavenging activity against DPPH with inhibition rates of 61.9%, 88.0% and 91.9% at a DPPH concentration of 20 μmol/L, respectively.Compound 1 is a new benzaldehyde. Compounds 1, 5 and 6 exhibited strong antioxidant activity.
marine-derivedTX-M4-1; benzaldehyde; antioxidant activity; 5′--isotetrahydroauroglaucin; flavoglaucin
R284.1
A
0253 - 2670(2022)18 - 5600 - 07
10.7501/j.issn.0253-2670.2022.18.002
2022-07-17
广西科技基地和人才专项(桂科AD20297036);广西自然科学基金项目(2021GXNSFBA220040,2021GXNSFBA075036);国家自然科学基金青年项目(82104034);广西民族大学校级引进人才科研启动项目(2020KJQD09,2021KJQD09);广西民族大学相思湖青年创新团队项目(2021RSCXSHQN01)
王 聪,副教授,研究方向为海洋药物化学。E-mail: wangcong123206@163.com
周丽曼,博士,讲师,研究方向为天然产物化学。Tel: 15621369181 E-mail: zhouliman88@126.com
[责任编辑 王文倩]
