包载姜黄素的白及多糖载药胶束的活性氧响应性、抗炎作用及肝靶向性研究
2022-09-20党婷婷赵慧雯
王 济,党婷婷,赵慧雯,冯 斌
包载姜黄素的白及多糖载药胶束的活性氧响应性、抗炎作用及肝靶向性研究
王 济,党婷婷,赵慧雯*,冯 斌*
军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔生物工程技术研究中心,第四军医大学口腔医院 药剂科,陕西 西安 710032
考察包载模型药物姜黄素(curcumin,Cur)的白及多糖(polysaccharide,BSP)载药胶束的活性氧(reactive oxygen species,ROS)响应性、抗炎作用以及肝靶向性。采用透析袋法考察Cur载药胶束在H2O2存在下的体外释放特性;利用荧光显微镜观察Cur载药胶束在富含ROS的巨噬细胞内的响应性释放效果;采用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)法考察Cur载药胶束的抗炎作用;研究Cur载药胶束在肝纤维化大鼠模型体内的药动学和组织分布情况。Cur载药胶束在H2O2存在的情况下释药速度加快,在12 h内累积释放量达到53%,48 h累积释放量达76%;Cur载药胶束可被富含ROS的巨噬细胞特异性识别并响应性释放药物;Cur与BSP有协同抗炎作用,可协同降低致炎因子的水平;药动学和组织分布研究表明,Cur载药胶束在大鼠体内滞留时间延长,平均滞留时间(mean residence time,MRT0~∞)达(12.109±3.528)h,且在肝脏中分布最多。包载Cur的BSP载药胶束具有ROS响应性、抗炎作用以及肝脏靶向性。
白及多糖;姜黄素;活性氧响应;抗炎作用;肝脏靶向
肝纤维化是各种慢性肝脏疾病的共同病理特征之一,主要表现为肝组织中细胞外基质合成和降解失调,进而导致肝内纤维结缔组织过度沉积[1]。库否细胞(Kupffer cell,KC)是肝脏的巨噬细胞,其参与纤维化的整个进程,是纤维化的关键调控者[2-3]。在炎症反应前阶段,KC受各种致病因素作用后可产生大量活性氧(reactive oxygen species,ROS),在ROS触发下继而产生炎症因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素- 1β(interleukin-1β,IL-1β)等,并诱导其他炎症细胞的渗透,最终导致肝损伤[4-5]。
研究发现白及多糖(polysaccharide,BSP)能与巨噬细胞特异性结合[6-9],且具有抗炎、抗氧化、抗纤维化、抗肿瘤等生物学活性[10-14],因此本课题组前期以BSP为骨架材料,利用ROS响应基团4-羟基苯硼酸频那醇酯(4-hydroxymethyl phenyl-boronic acid pinacol ester,PBAP)对BSP进行修饰,包封具有抗炎、抗氧化作用的姜黄素(curcumin,Cur),制备得到包载Cur的ROS敏感BSP胶束(Cur-Oxi-BSP)[15]。
本研究对Cur-Oxi-BSP能否特异性靶向至肝脏KC及其在ROS刺激下响应性释放药物的抗炎作用进行考察。首先,以H2O2模拟体内高浓度ROS水平,考察ROS对Cur-Oxi-BSP胶束体外释药行为的影响,评价其在体外是否具有ROS响应性。然后,采用脂多糖(lipopolysaccharide,LPS)刺激巨噬细胞产生ROS,用荧光染料香豆素-6(coumarin-6,C6)代替Cur制备荧光标记载体(C6-Oxi-BSP),考察载体在富含ROS巨噬细胞内的响应性释药情况。将载体与RAW264.7巨噬细胞和LPS孵育后,分别采用ELISA试剂盒测定致炎因子TNF-α、IL-1β和IL-6的蛋白表达水平,考察载体的抗炎活性。最后,构建肝纤维化大鼠模型,研究Cur-Oxi-BSP胶束的药动学和组织分布情况,验证其是否具有肝脏靶向性。
1 仪器与材料
1.1 仪器
R205B型旋转蒸发仪(上海申生科技有限公司);78HW-1型数显恒温磁力搅拌器(杭州仪表电机有限公司);BT125D型电子天平(德国赛多利斯公司);X1R台式低温离心机(赛默飞世尔公司);G560E型涡旋混合器(Scientific Industries);370系列CO2培养箱(赛默飞世尔科技有限公司);HHWS-II-200型恒温箱(上海跃进恒温设备厂);SW-CJ-1C超净工作台(苏州安泰空气技术有限公司)。
1.2 药物与试剂
Cur-Oxi-BSP胶束[实验室自制,平均粒径为(225.33±2.97)nm,包封率为(85.75±0.87)%,载药量为(20.21±0.44)%];BSP(批号20171126,西安朗泽生物科技有限公司,质量分数90%);Cur原料药(批号C1523070,阿拉丁试剂上海有限公司,质量分数98%);大黄素内标物(质量分数98.7%,批号110756-201512,中国食品药品检定研究院);泊洛沙姆Pluronic F127(批号SLBL1780V,Sigma-Aldrich公司);二甲基亚砜(dimethylsulfoxide,DMSO,批号C1807128,Aladdin试剂公司);CCK-8试剂盒(cell counting Kit-8,批号C0042,上海碧云天生物技术有限公司);TNF-α ELISA试剂盒(批号180909,武汉菲恩生物科技有限公司);IL-1β ELISA试剂盒(批号180912,武汉菲恩生物科技有限公司);IL-6 ELISA试剂盒(批号180920,武汉菲恩生物科技有限公司);DCFH-DA荧光染料(质量分数>99.9%,Sigma公司);C6(批号MKBV4602V,上海源叶生物科技公司,质量分数>98.0%);DMEM高糖培养基(批号20180925,索莱宝公司);胎牛血清(批号181018,杭州四季青生物公司);纯化水(实验室自制)。
1.3 细胞与动物
RAW264.7巨噬细胞株(西安飞扬生物科技有限公司);SPF级雄性SD大鼠168只,体质量(220±20)g,6~7周龄,第四军医大学实验动物中心提供,动物许可证号SCXK(军)2016-0007。动物实验经第四军医大学口腔医院实验动物管理伦理委员会批准(批准号2018伦审字076号)。
2 方法与结果
2.1 不同Cur制剂的制备
2.1.1 姜黄素溶液(curcumin solution,Cur-S)的制备 称取Cur原料药以DMSO溶解,质量浓度为1 mg/mL。
2.1.2 非ROS响应性载药胶束(curcumin-loaded Pluronic micelles,Cur-P)的制备 载体Pluronic 50 mg和Cur原料药15 mg溶解于10 mL甲醇溶液中,水浴加热至60 ℃,减压旋蒸30 min去除有机溶剂,向混合薄膜骨架中加入12 mL同温度的去离子水(pH 6.6的PBS缓冲溶液),于相同温度下水化一定时间,用0.45 μm微孔滤膜滤过,即得Cur质量浓度为1 mg/mL的Cur-P。
2.1.3 Cur-Oxi-BSP的制备 参考课题组前期报道方法[15]。
2.2 Cur-Oxi-BSP胶束的细胞安全性评价
参照“2.1.3”方法制备Cur-Oxi-BSP胶束和空白载体,其中空白载体不加入Cur。用DMEM培养基稀释分别得到含Cur浓度为5、10、20、30、50 μmol/L的Cur-Oxi-BSP胶束溶液及质量浓度为5、20、50、100、200 μg/mL的空白载体溶液,备用。取处于对数生长期的RAW264.7巨噬细胞接种于96孔板中,每孔约5×104个细胞,加入200 μL含10%胎牛血清的DMEM培养基,于37 ℃下在CO2培养箱中培养过夜,洗去培养液,加入200 μL上述空白载体溶液或Cur-Oxi-BSP载药胶束溶液,继续培养24 h后,向每个孔中加入20 μL CCK-8储备液,继续孵育4 h。取出,用酶标仪于450 nm测定各孔吸光度。以无细胞的空白培养基作为空白对照;以含10%胎牛血清的培养液孵育细胞作为阴性对照。每个样品3复孔,根据所测得吸光度计算细胞存活率。
实验结果如图1所示,空白载体的细胞安全性考察结果显示,空白载体在5~50 μg/mL未表现出明显的细胞毒性,在质量浓度为100 μg/mL及以上时表现出了一定的细胞生长抑制现象,同时Cur-Oxi-BSP胶束在大于30 μmol/L时,抑制细胞生长,这可能是由于载体材料积聚在细胞内浓度较高造成的。因此,本研究中后续实验所涉及的载体质量浓度均在20~25 μg/mL,Cur-Oxi-BSP胶束浓度在20 μmol/L,在此浓度范围内载体未表现出明显的细胞毒性。
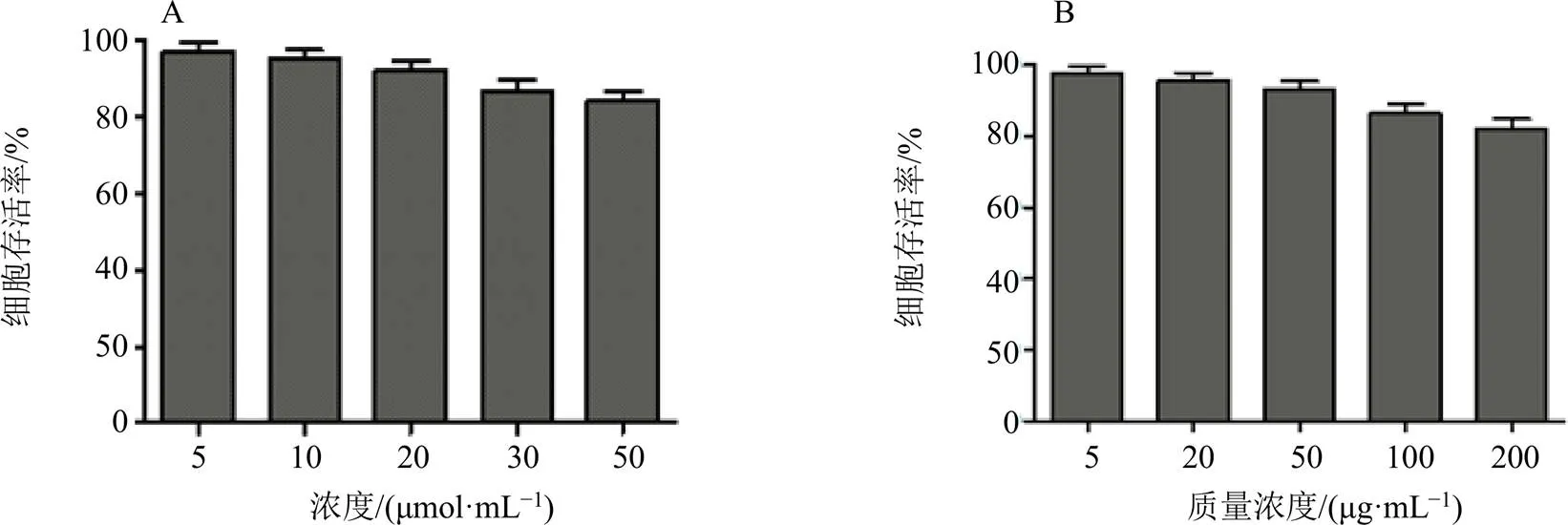
图1 Cur-Oxi-BSP胶束(A)和空白载体(B) 的细胞毒性()
2.3 Cur-Oxi-BSP胶束的体外ROS响应性考察
2.3.1 Cur-Oxi-BSP胶束在H2O2存在下的体外释药考察 分别精密吸取不同制剂溶液(Cur-S、Cur-P、Cur-Oxi-BSP)各3 mL,转移至透析袋中,两端夹紧,置于含或不含10 mmol/L H2O2的200 mL透析介质(含5% SDS的等渗葡萄糖溶液)中,水浴恒温振荡,频率为100 r/min,温度(37.0±0.5)℃[16]。分别在不同时间点取出透析袋,透析袋内溶液4000 r/min离心10 min,以透析袋内的药物沉淀加透析液为药物释放部分,透析袋内的离心上清液为未释放部分。采用HPLC法[17]进行分析,所有的样品平行测定3次。按以下公式计算各取样点各样品的累积释放率。
累积释放率=释放/总
释放表示药物释放部分量;总表示药物总量
结果(图2)表明,Cur-Oxi-BSP在H2O2存在的条件下Cur释放速率较快,且在12 h内累积释放量达到53%,48 h累积释放量达76%。而在无H2O2条件下Cur 48 h累积释放量仅为50%,表明BSP具有良好的氧化响应性。H2O2对Cur-S的释放几乎没有影响。Cur-P则在单纯的释放介质和H2O2条件下,药物释放相对缓慢,且没有显著差异,证明Cur-P无ROS响应性。
2.3.2 Cur-Oxi-BSP在富含ROS的巨噬细胞内的摄取及响应性释药考察 首先用荧光染料C6代替Cur,按照“2.1”项方法制备C6-S、C6-P及C6-Oxi-BSP。
取无菌处理的圆形盖玻片置于24孔板内,将RAW264.7巨噬细胞以1×105接种于24孔细胞板,在含有10%胎牛血清的DMEM培养基(含有100 U/mL青霉素和100 μg/mL链霉素)中标准条件培养24 h,弃去上层培养基,用PBS润洗。将细胞分为C6-S、C6-P及C6-Oxi-BSP组,分别与400 ng/mL LPS孵育3 h,弃去旧培养液,加入经无血清培养基稀释的各荧光制剂(C6终质量浓度为100 ng/mL)。同时以不含胶束的空白培养液作为阴性对照。37 ℃培养3 h后,吸除上层培养液,PBS洗细胞3次,加1 mL 4%多聚甲醛固定细胞(室温20 min),PBS洗3次,加入细胞核染色剂DAPI(200 μL/孔),避光室温孵育10 min。弃去DAPI,PBS洗2 min,重复5次;取出细胞爬片置于洁净载玻片上,采用50%甘油封片,避光保存于4 ℃,荧光显微镜观察细胞对各组制剂的摄取情况。
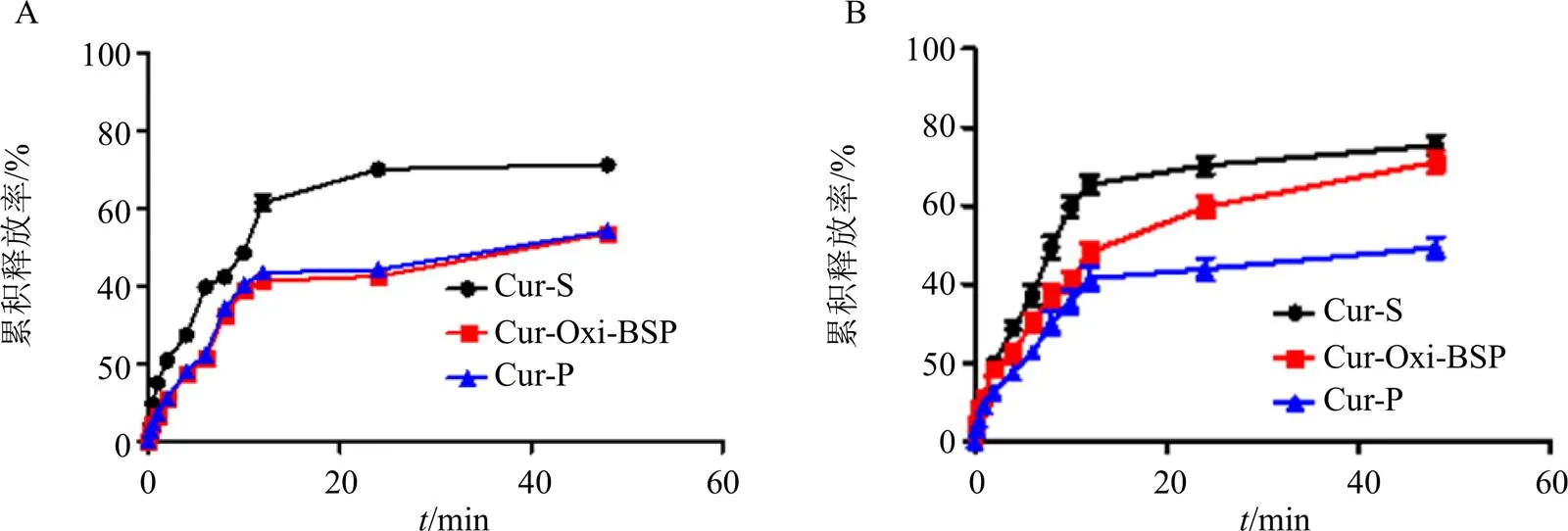
图2 Cur-S、Cur-P、Cur-Oxi-BSP在无H2O2条件(A)及10 mmol·L−1H2O2条件(B) 下的体外释放曲线()
由图3可知,巨噬细胞与不同的荧光标记载体孵育后呈现出不同的荧光强度,且绿色荧光均分布于细胞浆内;荧光强度的强弱反映出细胞对不同载体的摄取程度以及载体在胞内的释药情况。C6-S组细胞内C6的荧光最强,原因在于溶液中的C6为小分子,可自由扩散进入细胞,无需细胞摄取和胞内释放过程;C6-Oxi-BSP次之,C6-P荧光最弱,证实相比于无ROS响应的载体,ROS响应载体可更多地被巨噬细胞表面受体特异性识别摄取,且载体在胞内高浓度ROS刺激下可实现响应性释药。
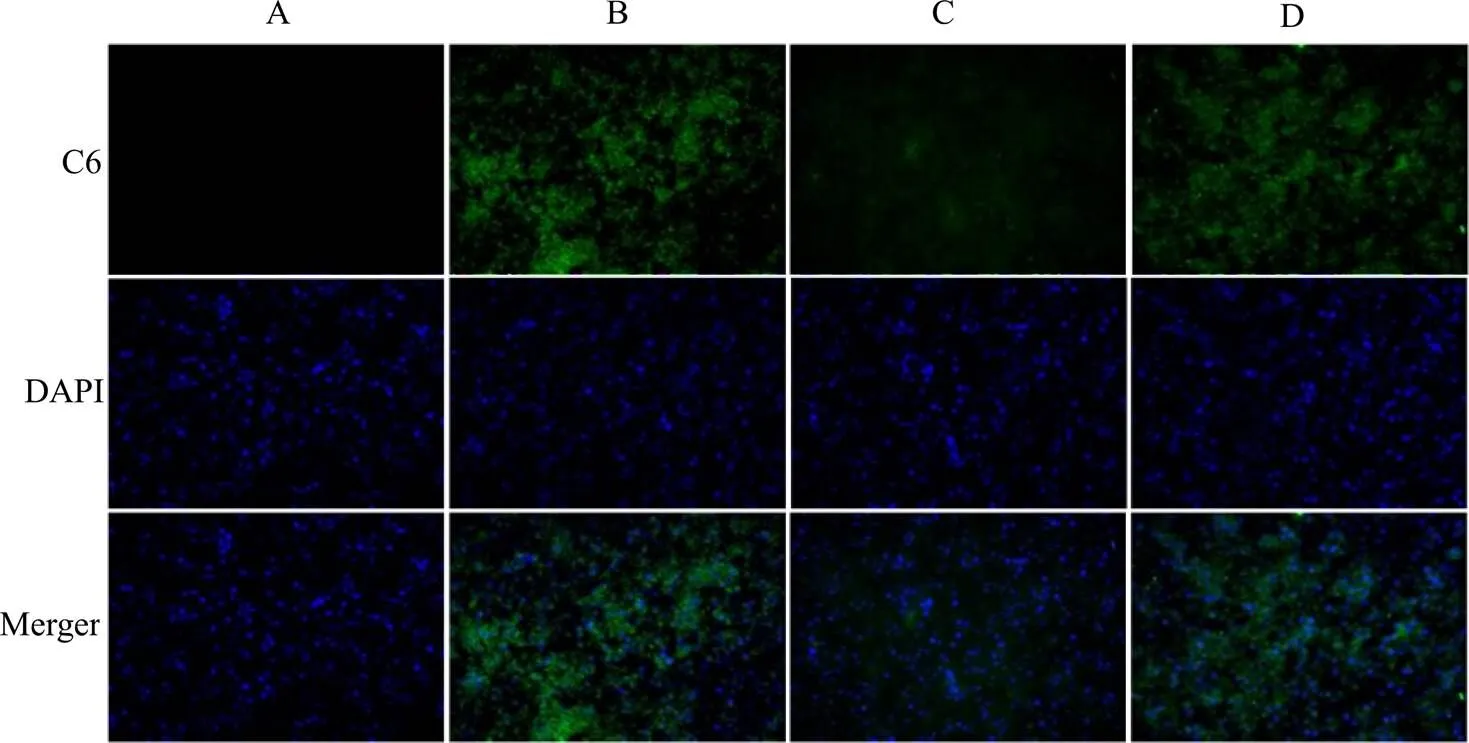
A-阴性对照组 B-C6-S C-C6-P D-C6-Oxi-BSP
2.4 Cur-Oxi-BSP的抗炎活性研究
按“2.2”项方法培养细胞后,分为4组:Cur-S组(Cur浓度20 μmol/L)、空白载体组(B-Oxi-BSP,与Cur-Oxi-BSP组加入相同的溶液体积)、Cur-Oxi-BSP组(Cur浓度20 μmol/L)、Cur-P组(Cur浓度20 μmol/L)。分别将细胞与无血清DMEM(含400 ng/mL LPS)及不同制剂孵育,继续培养24 h,每组设置6个复孔。同时设置阳性对照(只加入LPS,不加任何制剂)组和阴性对照(不加LPS和任何制剂)组。培养结束后,收集细胞培养液,4 ℃、12 000 r/min离心10 min,分别采用ELISA试剂盒测定致炎因子TNF-α、IL-1β、IL-6的表达水平,结果见图4。
各组细胞中致炎因子(TNF-α、IL-1β、IL-6)的表达水平趋势大致相同,Cur-Oxi-BSP组最低,Cur-P组次之,Cur-S组和B-Oxi-BSP组也均明显低于阳性对照组(<0.05)。可见游离的Cur和空白载体均能抑制致炎因子的表达,而含Cur载体的作用最强,且Cur-Oxi-BSP组强于Cur-P组(<0.05),证实Cur与载体BSP有协同抗炎作用。
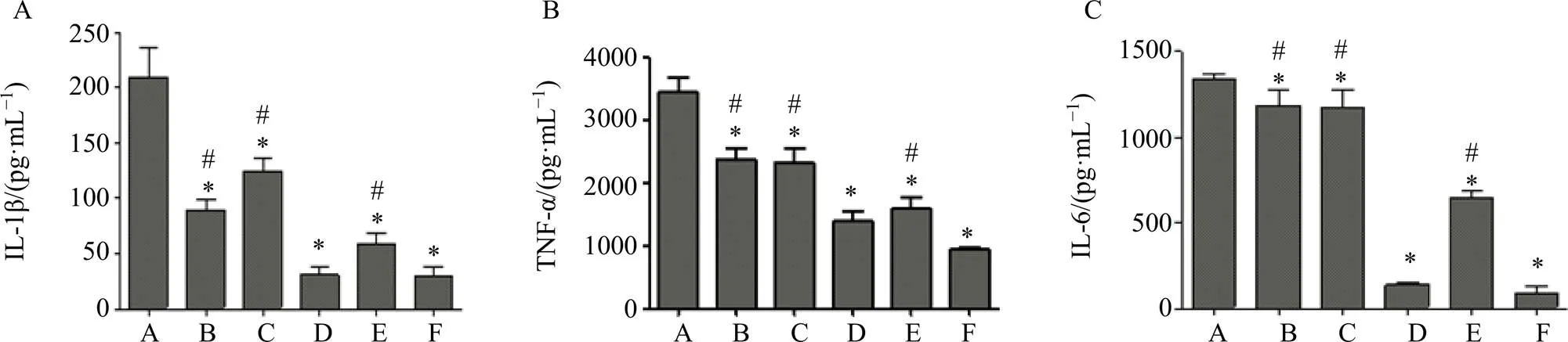
A-阳性对照组 B-Cur-S组 C-B-Oxi-BSP组 D-Cur-Oxi-BSP组 E-Cur-P组 F-阴性对照组 与阳性对照组比较:*P<0.05;与Cur-Oxi-BSP比较:#P<0.05
2.5 Cur-Oxi-BSP在模型大鼠体内的肝靶向性研究
2.5.1 肝纤维化大鼠模型的构建 取SD大鼠168只,雄性,体质量(220±20)g,适应性饲养7 d后,留取3只作为正常组继续饲养,其余ip CCl4-橄榄油(1∶1)的混合溶液,剂量为2 mL/kg。第1周每天连续注射诱导大鼠肝脏急性损伤,第2周开始2 d注射1次,诱导大鼠肝纤维化;第4周末造模结束后,随机选取3只大鼠解剖,取心、肝、脾、肺、肾、脑等组织,备用,观察肝脏组织形态,并进行HE染色。
4周后正常组和模型组大鼠肝脏的病理切片HE染色结果如图5所示。从图中可以看出正常组大鼠肝索排列整齐,肝小叶结构完整,无坏死、变性现象;模型组大鼠肝索排列紊乱,肝小叶结构破坏,肝汇管区纤维结缔组织增生[18]。模型大鼠肝脏切片表现出明显的肝纤维化特征,由此可推断肝纤维化大鼠模型构建成功。
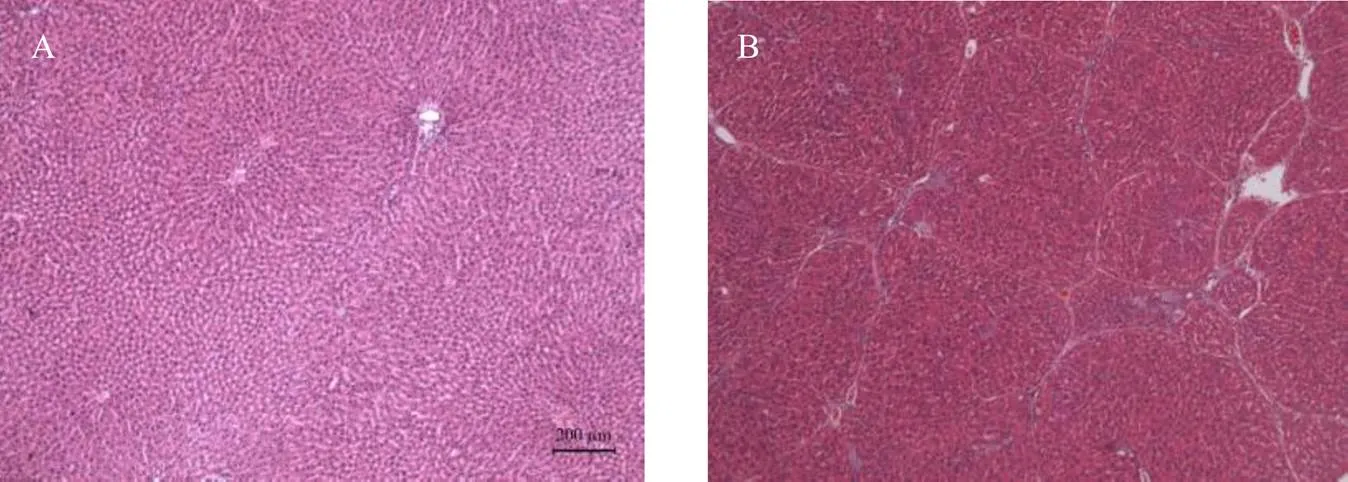
图5 正常组(A) 和模型组(B) 大鼠肝脏的病理变化 (HEstaining, 200 μm)
2.5.2 药动学研究 将肝纤维化模型大鼠随机分为3组(=54),给药前12 h禁食不禁水,各组大鼠分别ip给予Cur-S、Cur-P和Cur-Oxi-BSP。各组给药剂量按Cur质量分数10 mg/kg计算。
肝纤维化模型大鼠ip给药后,分别在不同时间点(5、15、30 min及1、2、4、8、12、24 h)大鼠眼底静脉丛取血,置于预先用EDTA饱和的离心管中,13 000 r/min离心10 min,分离上清液,于−20 ℃保存备用。
精密吸取大鼠血浆200 μL至1.5 mL EP管中,并加入色谱甲醇200 μL,大黄素内标液10 μL,涡旋混合1 min,沉淀蛋白,13 000 r/min离心10 min,分离上清液,N2吹干后,再用200 μL甲醇复溶,涡旋3 min使充分溶解,离心取上清液,参照课题组前期报道的UHPLC-MS/MS法测定各血浆中Cur含量[18]。
以不同时间点血浆中的Cur浓度为纵坐标,对应的时间为横坐标,绘制血药浓度-时间曲线。采用药动学软件DAS 2.1.1,计算相关药动学参数,见图6。药动学参数结果见表1。
由图6和表1可见,与Cur-S组相比,Cur-P和Cur-Oxi-BSP组大鼠血浆Cur的峰浓度(max)均降低(<0.05),且Cur-Oxi-BSP组降低更明显(<0.05);Cur-P组和Cur-Oxi-BSP组大鼠体内Cur的滞留时间(MRT0~∞)明显延长(<0.05),且Cur-Oxi-BSP组MRT0~∞比Cur-P组更长。原因可能为Cur-P组和Cur-Oxi-BSP组中的胶束载体进入腹腔后,仅有少量会在腹腔液中释放出游离Cur,大部分会优先被肝、脾等富含巨噬细胞的脏器摄取[18],在脏器中载体会缓慢释放出游离的Cur。只有游离的Cur才能扩散进入血液循环,导致胶束组的血药峰浓度比较低,达峰时间(max)较长,体内MRT0~∞延长(<0.05)。而Cur-S中的游离Cur则可快速进入血液循环,快速达到血浆max,又被快速的清除。此外,与Cur-P相比,Cur-Oxi-BSP在腹腔液内几乎不会释放出游离Cur,只有在ROS浓度较高的肝脏部位才会响应性释药,因此Cur-Oxi-BSP组中进入血液循环的Cur含量更少,药-时曲线下面积(area under the concentration-time curve,AUC0~∞)更低(<0.05)。
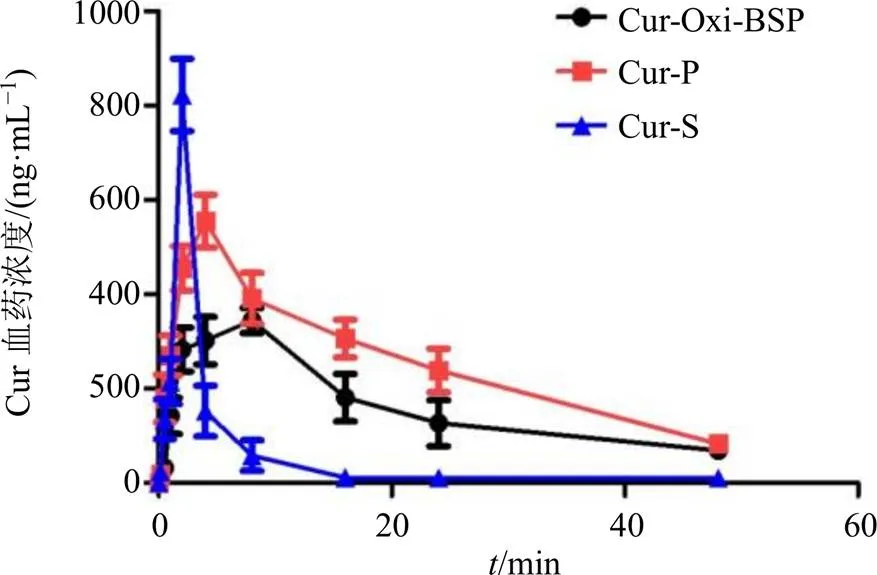
图6 肝纤维化大鼠ip不同Cur制剂体内血药浓度-时间曲线()
表1 各组大鼠的主要药动学参数()
Table 1 Main pharmacokinetic parameters of rats in each group ()
药动学参数单位Cur-Oxi-BSPCur-PCur-S t1/2h7.688±2.896#7.693±1.466#2.759±0.422 tmaxh3.167±1.329*#2.000±0.001#1.000±0.001 CLz/FL·h−1·kg−12.277±0.529*#1.443±0.139#7.692±0.995 MRT0~∞h12.109±3.528#11.681±1.79#3.619±0.214 Cmaxμg·L−1347.478±28.484*#555.193±56.244#823.011±76.592 AUC0~tμg·h·L−13 922.411±582.394*#6 119.546±375.98#1 323.601±207.139 AUC0~∞μg·h·L−14 589.109±1 054.300*#6 982.105±644.498#1 325.712±206.365
与Cur-P组比较:*<0.05;与Cur-S组比较:#<0.05
*< 0.05Cur-P group;#< 0.05Cur-S group
2.5.3 Cur-Oxi-BSP在模型大鼠体内的药物组织分布 按“2.5.2”项方法分组及样品处理,各组大鼠眼底静脉丛取血后,脱臼处死并解剖大鼠,分离心、肝、脾、肺、肾、脑等组织,生理盐水冲洗组织表面,滤纸吸干,组织称质量,按组织质量的2倍加入生理盐水,匀浆仪匀浆,备用。参照课题组前期报道的UHPLC-MS/MS法测定各组织中Cur含量[18]。根据各时间点血浆、心、肝、脾、肺、肾、脑样品中Cur的浓度绘制柱状图,比较各时间点样品中的Cur浓度来考察其分布特征。
组织分布(图7)结果显示,Cur-Oxi-BSP组在前2 h内肝脏中的Cur浓度均比较高,证明载体可优先进入肝脏组织。Cur-Oxi-BSP组肝脏Cur浓度于4 h开始下降,明显低于Cur-P组(<0.05),可能是由于Cur-Oxi-BSP在肝脏高浓度ROS刺激下已完成响应性释药,Cur已经在肝脏部位发挥作用后被代谢,从胆汁中快速清除[19]。而Cur-P无ROS响应性,进入肝脏后仍维持缓慢释药,肝脏中的Cur可在较长时间内维持较高浓度。Cur-S组中的游离Cur则会快速进入血浆中,快速达峰,很快又被清除;其在各个组织均有分布,在不同部位的分布差异是由其血流灌注量导致的[18]。
2.6 统计分析
通过ANOVA单因素方差分析对实验数据进行统计学分析,数据以表示,<0.05认为差异有统计学意义。
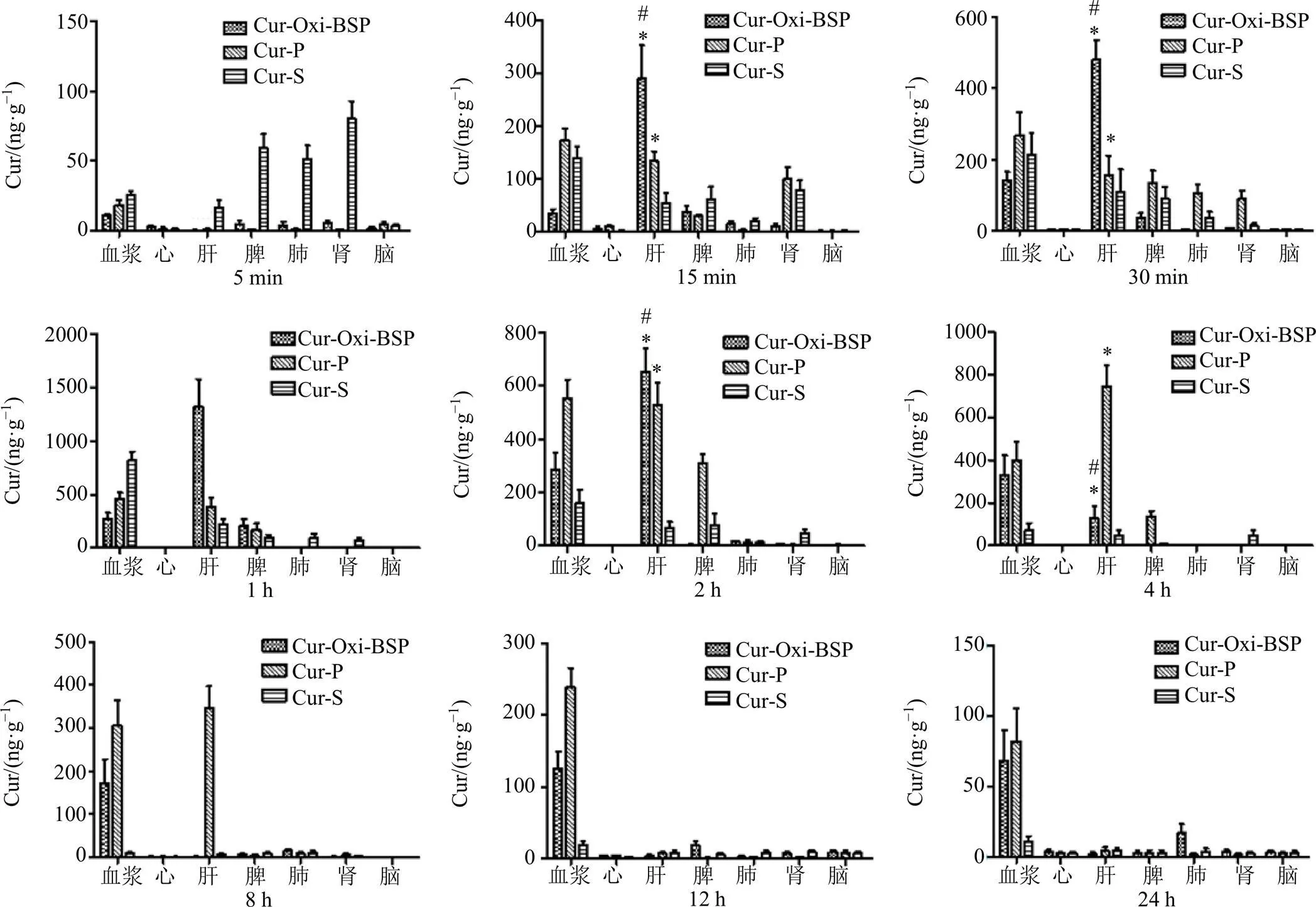
与Cur-S组比较:*P<0.05;与Cur-P组比较:#P<0.05
3 讨论
BSP是从白及药材中提取的由葡萄糖和甘露糖(1∶2.4)以β-糖苷键聚合而成的多糖化合物[6-8]。BSP是中药白及的有效成分,具有抗炎、抗氧化、抗纤维化等生物学活性,无毒、无刺激性,还可特异性靶向至巨噬细胞表面的β-葡聚糖受体和甘露糖受体[9-11]。但BSP作为药物递送载体具有自身缺陷,其亲水性较强、缺少疏水域,使其应用受到限制。
目前已有许多研究者对其进行疏水改性。成念等[20]制备了胆甾醇琥珀酰基BSP两亲性嵌段共聚物,该材料可自发形成胶束,包载紫杉醇后,与游离药物相比,其对肿瘤细胞的杀伤力增强。Guan等[21]制备了包载多西他赛的硬脂酸-BSP两亲性聚合物胶束,该胶束对HepG2等4种癌细胞呈现良好的抗癌活性。此外,还有用乙二胺[22]、伯胺基[23]等修饰的阳离子化BSP作为基因和RNA药物载体。本课题组前期采用疏水材料PBAP对BSP进行修饰,二者以ROS敏感的苯硼酸酯键联接,包载抗肝纤维化药物Cur,制备得到KC靶向且具有ROS敏感响应的药物载体Cur-Oxi-BSP,用于肝纤维化治疗。该载体能够在细胞外维持胶束结构的稳定性,一旦其被KC表面的特异性受体识别进入细胞后,载体中的苯硼酸酯键即可在细胞内高浓度ROS刺激下断裂,胶束结构被破坏,释放出游离药物[15,24],同时BSP还可与药物发挥协同抗炎作用。该载体集特异性靶向、ROS响应性释药和协同抗炎等优点于一体,将有利于肝纤维化的治疗。
前期已对载体的制备工艺及其理化性质表征进行报道,本研究继续对载体的生物学活性进行验证。为证实Cur-Oxi-BSP胶束具有ROS响应性,首先采用H2O2(ROS最主要的一种形式)模拟体内ROS环境,考察Cur-Oxi-BSP胶束在H2O2条件下的体外释放情况。前期研究发现当H2O2浓度为10 mmol/L时,胶束已呈现中空状,分布散乱,边界模糊。此外胶束的粒径、分散指数和Zeta电位开始发生较大变化,且与H2O2浓度呈正比,提示当H2O2浓度大于10 mmol/L时,BSP可产生ROS响应,因此确定10 mmol/L H2O2为体外释药实验所使用的浓度[15]。结果显示Cur-Oxi-BSP胶束在H2O2存在下释药速度加快,具有ROS响应性。
采用细胞实验验证Cur-Oxi-BSP胶束在富含ROS的巨噬细胞内也具有ROS响应性。查阅文献得知RAW264.7巨噬细胞细胞表面有与KC相同的受体,可与白及多糖结合[17,25-26],因此本实验以可传代的RAW264.7细胞替代成本较高不可传代的KC进行实验。细胞毒性实验证实各载体具有较好的安全性。采用LPS刺激巨噬细胞来构建富含ROS的巨噬细胞模型,并使用DCFH-DA荧光染料试剂盒测定细胞内ROS表达水平[27],最终结合细胞内ROS水平和细胞存活率2个指标筛选最佳LPS浓度。结果显示各组巨噬细胞在LPS刺激下均可呈现不同的荧光强度,且随着LPS浓度的增加,细胞荧光强度有所增加,表明细胞内产生的ROS增加[28]。但质量浓度大于400 ng/mL时,LPS抑制细胞生长,细胞存活率下降较为明显。综合考虑,选择LPS质量浓度为400 ng/mL进行后续实验。接着将荧光标记载体、LPS与巨噬细胞孵育,荧光显微镜观察后发现相比于非ROS响应载体,BSP载体可被巨噬细胞特异性识别,并在细胞内高浓度ROS刺激下响应性释药。此外,ELISA结果显示载体BSP和Cur具有协同抗炎作用,可协同降低致炎因子TNF-α、IL-1β、IL-6的蛋白表达水平。
最后进一步考察Cur-Oxi-BSP在肝脏组织的靶向性。构建肝纤维化大鼠模型,研究载体在模型大鼠体内的药动学和组织分布特征。结果表明,Cur-Oxi-BSP中的Cur在大鼠体内MRT0~∞延长,在肝脏中的Cur浓度最高,提示其可更多地靶向至肝脏,在肝纤维化病灶部位发挥作用。
综上所述,该载体具有ROS响应性、抗炎活性及肝脏靶向性等特点,将BSP与Cur相结合,可充分发挥药物和载体的双重作用,为探索抗肝纤维化治疗提供了新思路。但本研究仅考察了Cur-Oxi-BSP的体外ROS响应性,还需要对其体内ROS响应性进行深入研究;另外其在动物体内的抗肝纤维化药效也有待进一步考察。
利益冲突 所有作者均声明不存在利益冲突
[1] Ezhilarasan D. Oxidative stress is bane in chronic liver diseases: Clinical and experimental perspective [J]., 2018, 19(2): 56-64.
[2] Wang J H, Leclercq I, Brymora J M,. Kupffer cells mediate leptin-induced liver fibrosis [J]., 2009, 137(2): 713-723.
[3] Nakashima H, Kinoshita M, Nakashima M,. Superoxide produced by Kupffer cells is an essential effector in concanavalin A-induced hepatitis in mice [J]., 2008, 48(6): 1979-1988.
[4] Muriel P. Role of free radicals in liver diseases [J]., 2009, 3(4): 526-536.
[5] Saravanakumar G, Kim J, Kim W J. Reactive-oxygen-species-responsive drug delivery systems: Promises and challenges [J].(), 2016, 4(1): 1600124.
[6] 王启斌, 王迎朝, 董永成, 等. 白及相关制剂与医用材料的研究进展 [J]. 中成药, 2018, 40(8): 1808-1811.
[7] 陈正坤, 王嘉兴, 林平, 等. 白芨多糖在药剂领域的应用 [J]. 中南药学, 2019, 17(1): 74-77.
[8] Diao H J, Li X, Chen J N,.polysaccharide stimulates inducible nitric oxide synthase and proinflammatory cytokine expression in macrophages [J]., 2008, 105(2): 85-89.
[9] Dong L, Xia S H, Luo Y,. Targeting delivery oligonucleotide into macrophages by cationic polysaccharide fromsuccessfully inhibited the expression of TNF-alpha [J]., 2009, 134(3): 214-220.
[10] Li Y, Ma Z H, Yang X,. Investigation into the physical properties, antioxidant and antibacterial activity ofpolysaccharide/chitosan membranes [J]., 2021, 182: 311-320.
[11] Chen Z Y, Cheng L Z, He Y C,. Extraction, characterization, utilization as wound dressing and drug delivery ofpolysaccharide: A review [J]., 2018, 120(Pt B): 2076-2085.
[12] Huang Y B, Shi F L, Wang L M,. Preparation and evaluation ofpolysaccharide/ carboxymethyl chitosan/Carbomer 940 hydrogel for wound healing [J]., 2019, 132: 729-737.
[13] 陈思思, 吴蓓, 谭婷, 等. 白及多糖BSP-1的分离纯化、结构表征及抗肿瘤活性研究 [J]. 中草药, 2019, 50(8): 1921-1926.
[14] 朱峻霄, 林亚蒙, 杨野, 等. 白及多糖在生物医药材料领域中的应用研究进展 [J]. 中药材, 2018, 41(4): 1011-1014.
[15] 党婷婷, 王济, 唐鹏, 等. 活性氧响应的白及多糖载药胶束制备及其表征 [J]. 中草药, 2018, 49(23): 5548-5553.
[16] Yu L Y, Su G M, Chen C K,. Specific cancer cytosolic drug delivery triggered by reactive oxygen species-responsive micelles [J]., 2016, 17(9): 3040-3047.
[17] Wang J, Kang Y X, Pan W,. Enhancement of anti-inflammatory activity of curcumin using phosphatidylserine-containing nanoparticles in cultured macrophages [J]., 2016, 17(5): E969.
[18] Wang J, Pan W, Wang Y,. Enhanced efficacy of curcumin with phosphatidylserine-decorated nanoparticles in the treatment of hepatic fibrosis [J]., 2018, 25(1): 1-11.
[19] 李皓玥, 王晨林, 王玉欣, 等. 姜黄素药代动力学及其抗乳腺癌作用的研究进展 [J]. 中药新药与临床药理, 2021, 32(5): 744-750.
[20] 成念, 赵文萃, 张琦, 等. 用疏水改性的白及多糖制备载紫杉醇纳米粒并对其表征 [J]. 药学实践杂志, 2017, 35(1): 48-53.
[21] Guan Q X, Sun D D, Zhang G Y,. Docetaxel-loaded self-assembly stearic acid-modifiedpolysaccharide micelles and their anticancer effect: Preparation, characterization, cellular uptake andevaluation [J]., 2016, 21(12): E1641.
[22] Huang Z, Gan J J, Long Z Y,. Targeted delivery of let-7b to reprogramme tumor-associated macrophages and tumor infiltrating dendritic cells for tumor rejection [J]., 2016, 90: 72-84.
[23] 夏向文, 李欣, 冯敢生, 等. 中药白芨提取物作为基因载体的制备与表征 [J]. 中国药学杂志, 2008, 43(18): 1369-1373.
[24] 卢光照, 侯成, 钟延强, 等. 活性氧自由基响应给药系统研究进展 [J]. 药学学报, 2017, 52(2): 206-213.
[25] Minayoshi Y, Maeda H, Yanagisawa H,. Development of Kupffer cell targeting type-I interferon for the treatment of hepatitis via inducing anti-inflammatory and immunomodulatory actions [J]., 2018, 25(1): 1067-1077.
[26] Bartneck M, Ritz T, Keul H A,. Peptide-functionalized gold nanorods increase liver injury in hepatitis [J]., 2012, 6(10): 8767-8777.
[27] Liang X Y, Li X L, Duan J W,. Nanoparticles with CD44 targeting and ROS triggering properties as effectiveantigen delivery system [J]., 2018, 15(2): 508-518.
[28] Hosomura N, Kono H, Tsuchiya M,. HCV-related proteins activate Kupffer cells isolated from human liver tissues [J]., 2011, 56: 1057-1064.
Reactive oxygen species-responsiveness and anti-inflammatory activity of curcumin-loadedpolysaccharide micelles and its liver-targeting
WANG Ji, DANG Ting-ting, ZHAO Hui-wen, FENG Bin
State Key Laboratory of Military Stomatology & National Clinical Research Center for Oral Diseases & Shaanxi Engineering Research Center for Dental Materials and Advanced Manufacture, Department of Pharmacy, Hospital of Stomatology, The Fourth Military Medical University, Xi’an 710032, China
To investigate the reactive oxygen species (ROS)-responsiveness, anti-inflammatory activity and liver-targeting properties ofpolysaccharide (BSP) micelles loaded with curcumin (Cur).Therelease characteristics of drug-loaded micelles in the presence of H2O2was investigated by dialysis bag method; The responsive release effect of Cur-loaded micelles in ROS-rich RAW264.7 macrophages was observed by fluorescence microscopy; Theanti-inflammatory activities of Cur-loaded micelles were investigated by enzyme-linked immunosorbent assay (ELISA); The pharmacokinetics and tissue distribution of Cur-loaded micelles in rats with liver fibrosis were also evaluated.In the presence of H2O2, the release rate of Cur-loaded micelles was accelerated, and the cumulative release amount reached 53% within 12 h and 76% within 48 h. The Cur-loaded micelles could be specifically recognized by ROS-rich macrophages and release drugs in response. Cur and BSP had synergistic anti-inflammatory effects and could synergistically reduce the levels of inflammatory factors. Pharmacokinetic and tissue distribution studies showed that the retention time of Cur-loaded micelles in rats was prolonged, and the mean residence time (MRT0-∞) was (12.109 ± 3.528) h, and the distribution of Cur-loaded micelles was the most in liver.The BSP micelles loaded with Cur have ROS- responsiveness, anti-inflammatory activity and liver-targeting.
polysaccharide; curcumin; reactive oxygen species-responsiveness; anti-inflammatory activity; liver-targeting
R283;R285
A
0253 - 2670(2022)18 - 5759 - 09
10.7501/j.issn.0253-2670.2022.18.019
2022-05-13
陕西省中医药管理局科研项目(2021-ZZ-ZY001)
王 济(1988—),女,主管药师,研究方向为药物新制剂和新剂型。Tel: (029)84773998 E-mail: wjsydkq145@163.com
冯 斌(1986—),主管药师,研究方向为口腔制剂研究和神经药理学研究。Tel: (029)84773998 E-mail: binfeng@fmmu.edu.cn
赵慧雯(1990—),主管药师,研究方向为药物分析和药物质量控制。Tel:(029)84773998 E-mail: zhaohw928@163.com
[责任编辑 潘明佳]
