怀菊花提取物对皮质酮诱导的抑郁模型的保护作用及机制研究
2022-09-20卢仁睿徐瑞豪王慧慧冯卫生郑晓珂
卢仁睿,张 莉, 2,徐瑞豪,王慧慧,冯卫生, 2,郑晓珂, 2
怀菊花提取物对皮质酮诱导的抑郁模型的保护作用及机制研究
卢仁睿1,张 莉1, 2,徐瑞豪1,王慧慧1,冯卫生1, 2*,郑晓珂1, 2*
1. 河南中医药大学药学院,河南 郑州 450046 2. 河南省中药开发工程技术研究中心,河南 郑州 450046
通过皮质酮诱导的小鼠抑郁症模型和肾上腺嗜铬细胞瘤PC-12细胞损伤模型,研究怀菊花提取物的抗抑郁作用。将雄性C57BL/6小鼠随机分为对照组、模型组、氟西汀(5 mg/kg)组和怀菊花提取物低、中、高剂量(1.67、3.33、6.67 g/kg)组,模型组和各给药组连续21 d sc皮质酮(20 mg/kg),造模同时ig相应药物,给药结束后进行糖水偏好实验、悬尾实验和旷场实验;采用ELISA法检测小鼠血清中皮质酮及神经递质水平;采用Western blotting检测海马组织中环磷腺苷效应元件结合蛋白(cyclic adenosine monophosphate-response element binding protein,CREB)通路关键蛋白表达。皮质酮诱导PC-12细胞建立细胞损伤模型,采用流式细胞术检测怀菊花提取物对细胞凋亡及活性氧(reactive oxygen species,ROS)水平的影响;采用In-Cell Western法检测凋亡相关蛋白及CREB通路关键蛋白表达。怀菊花提取物能够显著改善小鼠的糖水偏好率(<0.05、0.01),增加小鼠的站立次数(<0.05、0.01),减少小鼠悬尾实验的不动时间(<0.01),显著降低血清中皮质酮水平(<0.01),升高血清中5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)、多巴胺(dopamine,DA)、乙酰胆碱(acetylcholine,Ach)水平(<0.05、0.01),上调海马组织中CREB、磷酸化CREB(phosphorylated CREB,p-CREB)、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)蛋白表达水平(<0.05、0.01)。怀菊花提取物显著抑制皮质酮诱导的PC-12细胞凋亡率及细胞内ROS水平(<0.01),抑制凋亡相关蛋白表达(<0.01),上调CREB通路关键蛋白表达(<0.01)。怀菊花提取物可能通过调节CREB通路、抑制神经细胞凋亡,从而改善抑郁。
怀菊花;皮质酮;抑郁;环磷腺苷效应元件结合蛋白;凋亡
抑郁症临床表现为显著而持久的心情低落、思维迟钝、认知功能损害、意志活动减弱等[1]。在世界范围内,抑郁症已成为患者负担最严重的疾病之一[2]。目前临床抗抑郁药物以化学药为主,其优势在于起效较快、疗效确切,不足在于不良反应较大,患者对药物存在依赖性,复发率较高,而中药的药效稳定且不良反应少,安全性高[3-4]。因此从中药中发掘潜在的抗抑郁药物具有重要意义。菊花是药食同源的典型植物,具有较好的医疗保健功效,在我国的文字记载中已经有4000年的历史[5]。Wu等[6]研究发现,菊花提取物能够减轻慢性不可预知的温和应激(chronic unpredictable mild stress,CUMS)诱导的小鼠模型中的抑郁样行为,同时对下丘脑-垂体-肾上腺(hypothalamic pituitary adrenal,HPA)轴的过度活跃和促炎细胞因子的表达有抑制作用。现代药理学研究证明,怀菊花有较好的抗菌、降压、抗氧化等作用[7]。本课题组在对河南产中药进行抗抑郁活性筛选时发现怀菊花具有较好的抗抑郁作用,因此本研究采用体内外抑郁模型,研究怀菊花的抗抑郁作用以及其可能的作用机制。
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠,体质量18~22 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。动物饲养于18~22 ℃清洁级动物实验室内,空气流通,12 h光照,昼夜循环,自由进食饮水。动物实验经河南中医药大学实验动物伦理委员会批准(批准号DWLL2018080003)。
1.2 细胞
大鼠肾上腺嗜铬细胞瘤PC-12细胞购自中国科学院上海细胞库。
1.3 药材
怀菊花采购于焦作武陟,经河南中医药大学陈随清教授鉴定为菊科植物菊Ramat.的干燥头状花序。
1.4 药品与试剂
皮质酮(批号16063)购自Cayman Chemical;盐酸氟西汀分散片(批号7298A)购自法国Patheon France;二甲基亚砜(dimethyl sulfoxide,DMSO,批号1213C0215)、活性氧(reactive oxygen species,ROS)检测试剂盒(批号20210915)购自北京索莱宝科技有限公司;小鼠皮质酮、5-羟色胺(5-hydroxytryptamine,5-HT)、多巴胺(dopamine,DA)、去甲肾上腺素(norepinephrine,NE)、乙酰胆碱(acetylcholine,Ach)试剂盒(批号E20181001A)购自江苏卡尔文生物技术有限公司;半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体、Caspase-9抗体、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)抗体、环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)抗体、磷酸化CREB(phosphorylated CREB,p-CREB)抗体、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)抗体、β-actin抗体购自英国Abcam公司,批号分别为ab13847、ab202068、ab32503、ab59348、ab48394、ab56416、ab31387、ab32096、ab26322;羊抗兔二抗(批号C80911-11)、羊抗鼠二抗(批号C80816-10)购自美国LI-COR公司;AnnexinV-FITC/碘化丙啶(PI)凋亡检测试剂盒(批号0020694)购自美国BD公司;对照品金合欢素(批号C12O8Q45551)、绿原酸(批号Y24J7K16726)、柚皮素(批号X21M7C11378)、芹菜素(批号Y27A6C1)、香叶木素(批号T22F7X9844)、木犀草苷(批号Y05D8H49919)、木犀草素(批号YA0408YA13)购自上海源叶生物制品有限公司,质量分数均≥98%;咖啡酸对照品(批号MUST-12042403,质量分数≥98%)购自成都曼斯特生物科技有限公司;其他试剂均为进口或国产分析纯。
1.5 仪器
BioMate 3S型分光光度计、Forma 3111型细胞培养箱(美国Thermo Fisher Scientific公司);HVA-85型全自动高压灭菌锅(上海申安医疗器械厂);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);AB204-N型万分之一精密分析天平(瑞士Mettler Toledo公司);Arium 611VF型超纯水仪(德国Sartorius公司);SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司);ECLIPSE TS100型倒置显微镜(日本Nikon公司);微量加样器(德国Eppendorf公司);iMark酶标仪(美国Bio-Rad公司);BD FACSAria III流式细胞仪(美国BD公司);Odyssey CLx双色红外激光成像系统(美国LI-COR公司);TMV-100S型行为学实验站(成都泰盟软件有限公司)。
2 方法
2.1 怀菊花提取物的制备及成分分析
2.1.1 怀菊花提取物的制备 称取怀菊花1 kg,加入10倍量水,煎煮3次,每次1 h,纱布滤过,合并滤液,减压浓缩干燥,称定质量,计算提取率为28.0 %。取怀菊花水提物4.5 mg于锥形瓶中,加入10 mL蒸馏水,超声提取30 min,1200 r/min离心10 min,取上清液于进样小瓶中,进行UPLC-Q/TOF-MS分析。
2.1.2 对照品溶液的制备 精密称取芹菜素、柚皮素、香叶木素、金合欢素、木犀草苷、咖啡酸、绿原酸、木犀草素对照品适量,至10 mL量瓶中,加蒸馏水定容,得到质量浓度为0.1 mg/mL的对照品溶液。精密吸取上述各对照品溶液1 mL,加蒸馏水定容至10 mL,得到混合对照品溶液。
2.1.3 色谱条件 RSLC 120 C18色谱柱(100 mm×2.1 mm,2.2 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~3 min,5%~12% B;3~7 min,12%~15% B;7~12 min,15%~20% B;12~20 min,20% B;20~30 min,20%~95% B。柱温40 ℃;体积流量0.3 mL/min;进样量2 μL。
2.1.4 质谱条件 采用电喷雾离子源(ESI),在正离子模式下进行检测,扫描范围/50~1000;离子源能量为3.0 eV;碰撞能量为5.0 eV;毛细管电压为3.5 kV;去溶剂气为N2;去溶剂气体积流量为8.0 L/min;脱溶剂气温度为230 ℃。
2.2 体内实验
2.2.1 动物模型的建立、分组及给药 C57BL/6小鼠适应性喂养3 d后,根据体质量均衡原则随机分为对照组、模型组、氟西汀(5 mg/kg)组和怀菊花提取物低、中、高剂量(1.67、3.33、6.67 g/kg)组,每组8只。模型组和各给药组sc皮质酮(20 mg/kg),对照组sc等体积生理盐水,1次/d,连续21 d[8]。造模同时,各给药组ig相应药物(20 mL/kg),1次/d,连续21 d。
2.2.2 行为学实验
(1)糖水偏好实验:末次给药结束后,小鼠单笼饲养,并放入2瓶含1%蔗糖的水溶液,24 h后将其中1瓶换成纯水,12 h后调换2个水瓶位置,再饲养12 h,适应期结束后,将小鼠禁食禁水24 h,之后进行基线测试。在鼠笼上放置已称定质量的2个瓶子,分别为含1%蔗糖的水溶液与纯水,小鼠禁食12 h后,取下瓶子,记录2个瓶子的液体消耗量,计算糖水偏好率[9]。
糖水偏好率=糖水消耗量/(糖水消耗量+纯水消耗量)
(2)悬尾实验:在小鼠尾部三分之一处固定,悬挂于支架上,使小鼠头部距离台面15 cm,适应1 min后记录小鼠5 min内的不动时间[9]。
(3)自主活动测定:将小鼠放到自主活动箱中,盖上闭光板,适应2 min后,记录5 min内小鼠的站立次数和活动次数[9]。
2.2.3 血清CORT、5-HT、DA、Ach和NE水平的测定 行为学测试完毕后,小鼠摘眼球取血,离心后取血清,按试剂盒说明书测定CORT、5-HT、DA、Ach和NE水平。
2.2.4 Western blotting检测海马组织CREB通路相关蛋白表达 取各组小鼠海马组织,加入裂解液提取蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于封闭液中封闭2 h,分别加入CREB、p-CREB、cAMP、BDNF和β-actin抗体(1∶1000),4 ℃孵育过夜;TBST洗涤5次,每次6 min,加入荧光二抗(1∶10 000),避光孵育1 h;TBST洗涤5次,使用双色红外激光成像系统700 nm和800 nm双通道进行检测和分析[9]。
2.3 体外实验
2.3.1 MTT检测细胞活力 PC-12细胞用含10%胎牛血清的RMPI 1640培养基培养,以4×104/mL接种于96孔板,每孔200 μL,待细胞完全贴壁后培养24 h。设置对照组、模型组和怀菊花提取物(1、10、50、100、500 μg/mL)组,对照组加入含1%胎牛血清的RMPI 1640培养基,模型组和各给药组加入皮质酮(500 μmol/L),各给药组再加入相应药物,培养24 h后,每孔加入20 μL MTT溶液(5 mg/mL),于37 ℃、5% CO2的培养箱中培养4 h后,弃去上清液,每孔加入150 μL DMSO,振荡10 min后,采用酶标仪测定490 nm处的吸光度()值[10]。
2.3.2 流式细胞术检测细胞凋亡情况 PC-12细胞以8×104/mL接种于6孔板,每孔3 mL,待细胞完全贴壁后培养24 h。设置对照组、模型组、氟西汀(0.3 μmol/L)组和怀菊花提取物(100 μg/mL)组,对照组加入含1%胎牛血清的RMPI 1640培养基,模型组和各给药组加入皮质酮(500 μmol/L),各给药组再加入相应药物,培养24 h后,收集细胞,1000 r/min离心5 min,加入1×Loading Buffer重悬细胞,再用PI和FITC进行染色,避光15 min后,上机检测[10]。
2.3.3 流式细胞术检测细胞ROS水平 按“2.3.2”项下方法进行分组和给药,处理24 h后,弃去上清液,用PBS清洗后,装载探针,用培养液洗去多余探针,胰酶消化后,收集细胞,重悬,上机检测[11]。
2.3.4 In-Cell Western法检测凋亡通路和CREB通路相关蛋白表达 按“2.3.2”项下方法进行分组和给药,处理24 h后,收集细胞,依次进行固定、透化,于5%脱脂牛奶中封闭1.5 h,分别加入一抗(1∶100),4 ℃孵育过夜;PBST洗涤5次,5 min/次,加入二抗,孵育1 h;PBST洗涤4次,PBS洗涤1次后显影,使用双色红外激光成像系统进行检测和分析。
2.4 统计分析
3 结果
3.1 怀菊花提取物的成分分析
如图1所示,怀菊花提取物中含有芹菜素、柚皮素、香叶木素、金合欢素、木犀草苷、咖啡酸、绿原酸和木犀草素。
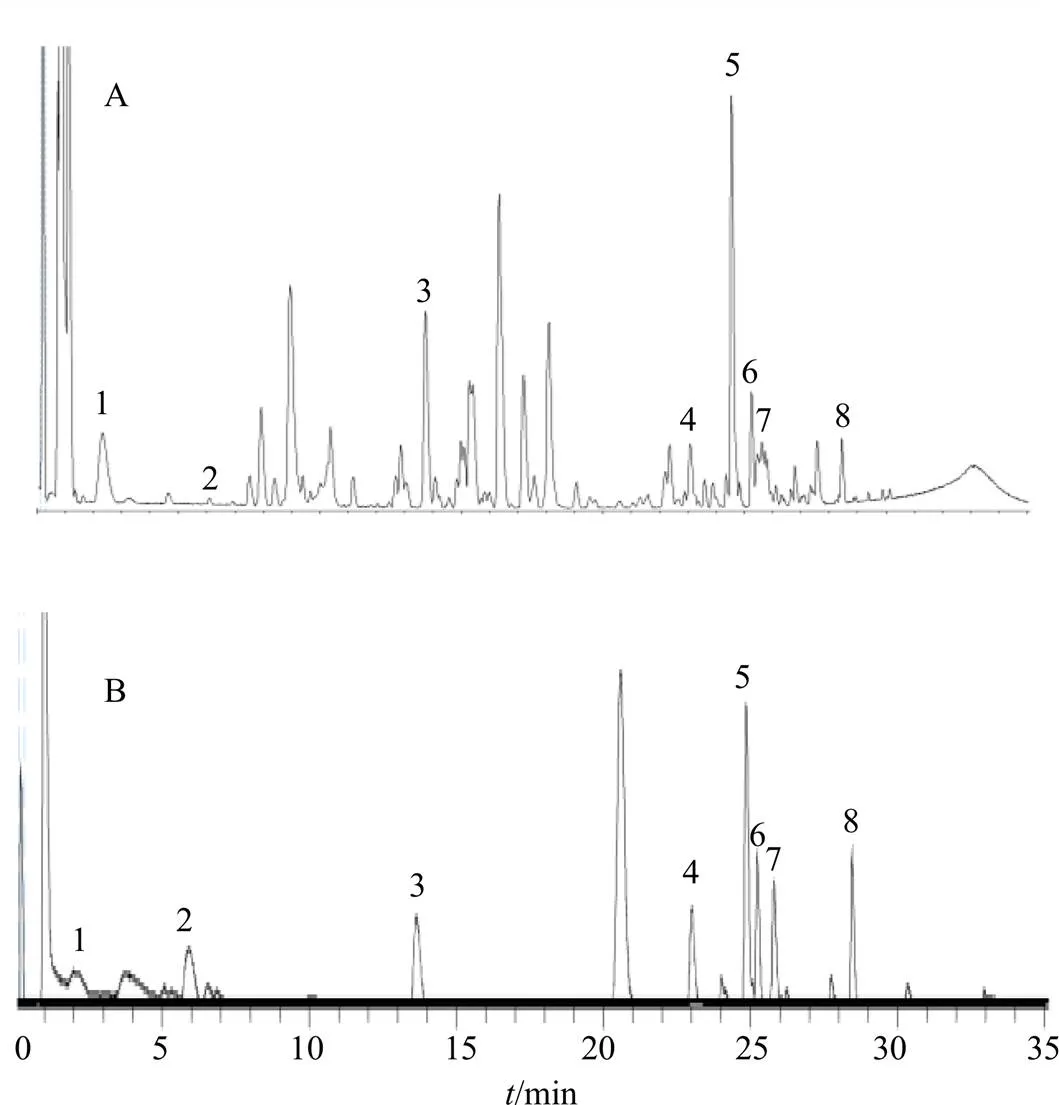
1-绿原酸 2-咖啡酸 3-木犀草苷 4-木犀草素 5-柚皮素 6-芹菜素 7-香叶木素 8-金合欢素
3.2 怀菊花提取物对皮质酮诱导的抑郁小鼠行为学的影响
如图2所示,与对照组比较,模型组小鼠糖水偏好率显著降低(<0.01),悬尾实验不动时间显著增加(<0.01),自主活动数和站立次数显著减少(<0.05、0.01);与模型组比较,各给药组小鼠悬尾实验不动时间显著减少(<0.01),站立次数显著增加(<0.05、0.01);氟西汀组和怀菊花提取物低、中剂量组小鼠糖水偏好率显著升高(<0.05、0.01);怀菊花提取物低剂量组小鼠自主活动数显著增加(<0.05)。
3.3 怀菊花提取物对皮质酮诱导的抑郁小鼠血清中皮质酮水平的影响
如图3所示,与对照组比较,模型组小鼠血清中皮质酮水平显著升高(<0.01);与模型组比较,氟西汀组和怀菊花提取物低、中剂量组小鼠血清中皮质酮水平均显著降低(<0.01)。
3.4 怀菊花提取物对皮质酮诱导的抑郁小鼠血清中神经递质水平的影响
如图4所示,与对照组比较,模型组小鼠血清中5-HT、DA、Ach和NE水平均显著下降(<0.01);与模型组比较,各给药组小鼠血清中5-HT水平显著升高(<0.05、0.01),氟西汀组和怀菊花提取物低剂量组DA水平显著升高(<0.05、0.01),氟西汀组和怀菊花提取物低、中剂量组Ach水平显著升高(<0.05、0.01),怀菊花提取物中剂量组NE水平显著升高(<0.05)。

C-对照组 M-模型组 F-氟西汀组 JH-怀菊花提取物 与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同

图3 怀菊花提取物对皮质酮诱导的抑郁小鼠血清中皮质酮水平的影响(, n = 8)
3.5 怀菊花提取物对皮质酮诱导的抑郁小鼠脏器指数的影响
如图5所示,与对照组比较,模型组小鼠胸腺指数显著下降(<0.05),其他脏器指数无明显变化;与模型组比较,各给药组小鼠脏器指数均没有明显变化。

图4 怀菊花提取物对皮质酮诱导的抑郁小鼠血清中神经递质水平的影响(, n = 8)

图5 怀菊花提取物对皮质酮诱导的抑郁小鼠脏器指数的影响(, n = 8)
3.6 怀菊花提取物对皮质酮诱导的抑郁小鼠海马组织CREB通路关键蛋白表达的影响
如图6所示,与对照组比较,模型组小鼠海马组织中CREB、p-CREB、cAMP和BDNF蛋白表达水平均显著降低(<0.05、0.01);与模型组比较,怀菊花提取物低、中剂量组小鼠海马组织中CREB和cAMP蛋白表达水平显著升高(<0.05、0.01),怀菊花提取物低剂量组小鼠海马组织中p-CREB蛋白表达水平显著升高(<0.01),氟西汀组小鼠海马组织中上述蛋白表达均无明显变化。

图6 怀菊花提取物对皮质酮诱导的抑郁小鼠海马组织CREB通路关键蛋白表达的影响(, n = 3)
3.7 怀菊花提取物对皮质酮诱导的PC-12细胞存活率的影响
如图7所示,与对照组比较,模型组细胞存活率明显降低(<0.01);与模型组比较,各给药组细胞存活率均显著升高(<0.01),怀菊花提取物质量浓度为100 μg/mL时效果最佳。

图7 怀菊花提取物对皮质酮诱导的PC-12细胞存活率的影响(, n = 6)
3.8 怀菊花提取物对皮质酮诱导的PC-12细胞凋亡的影响
如图8所示,与对照组比较,模型组活细胞数显著降低(<0.01),凋亡和坏死细胞数显著升高(<0.01);与模型组比较,各给药组活细胞数显著升高(<0.01),凋亡和坏死细胞数显著降低(<0.05、0.01)。
3.9 怀菊花对皮质酮诱导的PC-12细胞内ROS水平的影响
如图9所示,与对照组比较,模型组细胞内ROS水平显著升高(<0.01);与模型组比较,各给药组细胞内ROS水平显著降低(<0.01)。
3.10 怀菊花提取物对皮质酮诱导的PC-12细胞凋亡蛋白表达的影响
如图10所示,与对照组比较,模型组Caspase-3、Caspase-9蛋白表达水平显著升高(<0.01),Bax/Bcl-2值显著升高(<0.01);与模型组比较,各给药组Caspase-3蛋白表达水平显著降低(<0.01),Bax/Bcl-2值显著降低(<0.01),怀菊花提取物组Caspase-9蛋白表达水平显著降低(<0.01)。

图8 怀菊花提取物对皮质酮诱导的PC-12细胞凋亡的影响(, n = 3)

图9 怀菊花提取物对皮质酮诱导的PC-12细胞内ROS水平的影响(, n = 3)

图10 怀菊花提取物对皮质酮诱导的PC-12细胞凋亡蛋白表达的影响(, n = 3)
3.11 怀菊花提取物对皮质酮诱导的PC-12细胞CREB通路关键蛋白表达的影响
如图11所示,与对照组比较,模型组细胞CREB、p-CREB、cAMP和BDNF蛋白表达水平均显著降低(<0.01);与模型组比较,各给药组CREB、p-CREB、cAMP和BDNF蛋白表达水平均显著升高(<0.05、0.01)。
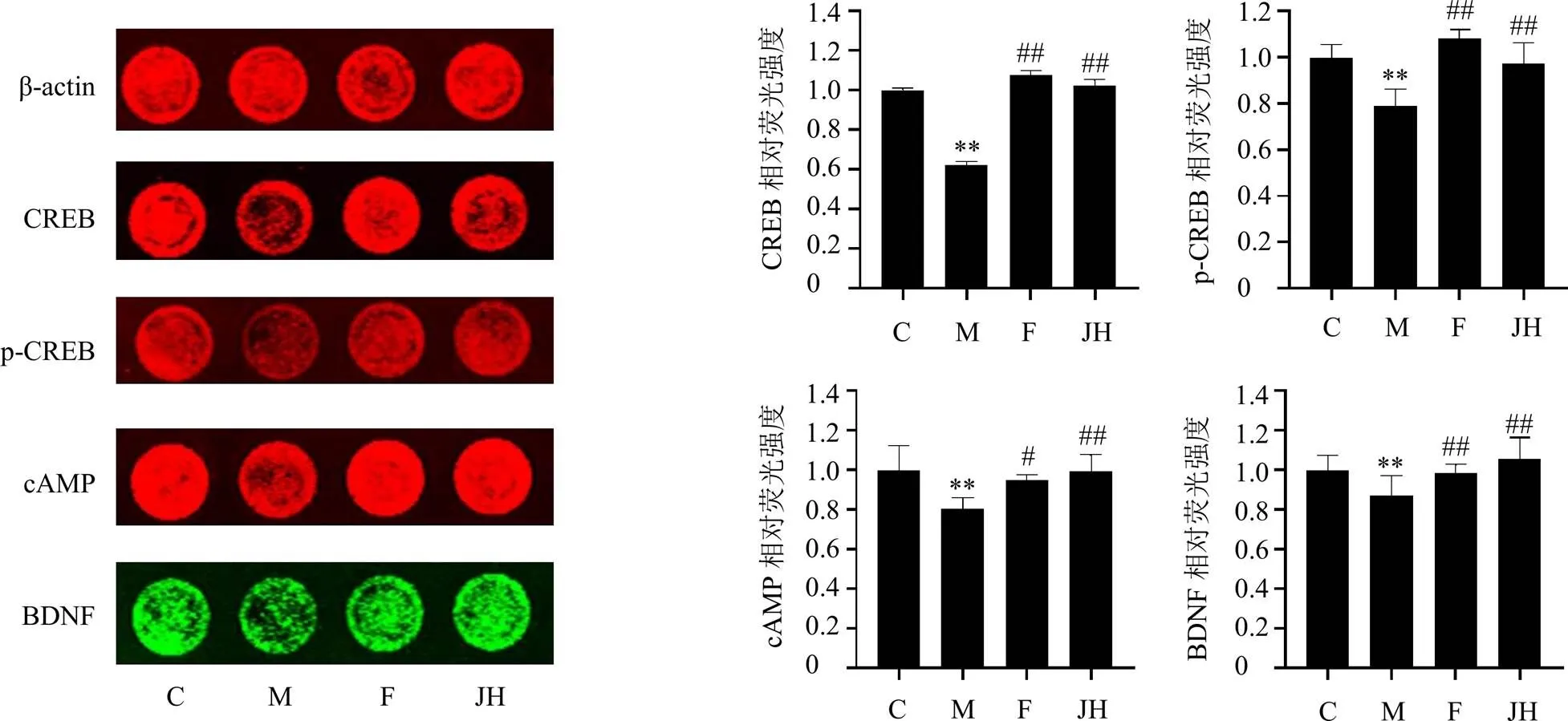
图11 怀菊花提取物对皮质酮诱导的PC-12细胞CREB通路关键蛋白表达的影响(, n = 3)
4 讨论
随着社会的不断发展,人们的精神压力越来越大,抑郁症患者数量逐年上升。据世界卫生组织报告,2017年全世界有超过3.22亿抑郁症患者,而且这个数字一直在增加[12]。中医虽无抑郁症病名,但根据抑郁症临床表现在古籍中找到脏躁、梅核气、奔豚气、郁证、百合病等相关病名[13]。目前对抑郁症发病机制的研究主要集中在神经递质及其受体假说、神经营养假说、神经免疫假说、神经可塑性假说、信号转导通路系统异常假说和神经-内分泌假说。研究发现,抑郁症的发生与糖皮质激素有密切关系,当机体处于长期应激状态,HPA系统持续亢奋,会产生大量的糖皮质激素,通过血脑屏障入脑,易与海马组织中神经元的糖皮质激素受体结合产生神经毒性,造成海马萎缩[9],而海马参与情绪的控制和反应,对情绪反应起非特异性抑制作用。当皮质酮升高时可诱使抑郁的发生,因此本研究采用糖皮质激素——皮质酮诱导抑郁症模型,行为学结果显示,模型组小鼠糖水消耗量减少,悬尾不动时间延长,自主活动数减少,表明小鼠快感缺乏,即造模成功;怀菊花提取物能够不同程度地改善小鼠的抑郁行为。
单胺类神经递质假说是目前公认的抑郁症发病机制之一,5-HT、NE和DA在情绪、认知、学习、运动活动、警觉、奖励、睡眠和食欲等方面发挥着重要作用[14],它们在脑内分泌的减少将会影响神经信号的传导,进而产生抑郁情绪。因此,增加脑内突触间隙的神经递质水平是缓解抑郁症的途径之一[15]。研究发现,抑郁症患者脑内和血清中5-HT、NE和DA水平均降低[16]。本研究结果显示,模型组血清中神经递质水平均降低,怀菊花提取物可以通过调节神经递质水平来缓解抑郁症。
cAMP/CREB/BDNF信号通路在抑郁症中起着关键作用,且与增强认知有关[17]。cAMP作为第二信使与其下游CREB结合,CREB是细胞内重要的转录因子,能够调节多巴胺能神经元及BDNF表达[17]。神经营养假说认为抑郁的发生与BDNF表达减少有关。研究发现,海马组织BDNF信号受损可致抑郁,给予抗抑郁药物治疗后,海马组织BDNF表达升高[18]。本研究发现,模型组海马组织中CREB、p-CREB、cAMP、BDNF蛋白表达水平均显著降低,怀菊花提取物组以上蛋白的表达均显著升高,表明怀菊花能够通过调节cAMP/CREB/BDNF信号通路发挥抗抑郁作用。此外,持续地激活HPA轴,会造成机体稳态失衡,由此改变神经生化物质,导致大脑发生器质性的变化[9]。抑郁症、ROS与神经细胞凋亡之间联系密切[19]。因此,采用流式细胞术和In-Cell Western技术分别检测细胞凋亡和凋亡蛋白表达情况,结果显示,怀菊花提取物能够抑制皮质酮诱导的细胞凋亡。此外,本研究发现,皮质酮能够影响小鼠胸腺组织,表明抑郁的发生与免疫系统有一定的联系,推测怀菊花能够在一定程度上调节机体的免疫系统。
综合,怀菊花在体内外均能够有效缓解抑郁模型的相关指标,提示其可能是抗抑郁的潜在药物,怀菊花提取物可能通过调节CREB通路、抑制神经细胞凋亡,从而改善抑郁。
利益冲突 所有作者均声明不存在利益冲突
[1] 王瑾, 周小江, 胡园, 等. 开心散药效物质基础和药理作用机制的研究进展 [J]. 中草药, 2020, 51(18): 4780-4788.
[2] Smith K. Mental health: A world of depression [J]., 2014, 515(7526): 181.
[3] 王力文, 黄德华, 田俊生, 等. 基于外周血单个核细胞转录组学的柴归颗粒抗抑郁作用机制研究 [J]. 中草药, 2022, 53(7): 2031-2043.
[4] 刘晓节, 刘欢乐, 卫拂晓, 等. 逍遥类方联合帕罗西汀治疗抑郁症的Meta分析[J]. 药物评价研究, 2022, 45(1): 132-143.
[5] 张会敏, 陈睿, 鲜小林. 中国功能菊花的研究进展 [J]. 中国农学通报, 2022, 38(14): 38-46.
[6] Wu X L, Tang B Q, Liao X,. Suppressive effects of the supercritical-carbon dioxide fluid extract ofon chronic unpredictable mild stress-induced depressive-like behavior in mice [J]., 2019, 10(2): 1212-1224.
[7] 张钦钦, 曾梦楠, 张贝贝, 等. 猫眼草酚D抑制小鼠急性肺损伤的作用及其机制研究 [J]. 中国新药杂志, 2022, 31(4): 362-368.
[8] Zhao Y N, Ma R, Shen J,. A mouse model of depression induced by repeated corticosterone injections [J]., 2008, 581(1/2): 113-120.
[9] 张莉, 王慧慧, 徐瑞豪, 等. 皂角刺水提物对皮质酮诱导小鼠抑郁症模型的研究 [J]. 中药药理与临床, 2020, 36(5): 100-104.
[10] 王慧慧, 卢仁睿, 张莉, 等. 地黄中松果菊苷对皮质酮诱导PC-12细胞凋亡的抑制作用及机制研究 [J]. 中国临床药理学杂志, 2021, 37(18): 2447-2450.
[11] 卢仁睿, 王慧慧, 张莉, 等. 地黄中松果菊苷对谷氨酸诱导的PC-12细胞神经损伤模型的氧化应激和NMDAR1表达的影响 [J]. 中药药理与临床, 2021, 37(5): 45-48.
[12] Yang P, Zhang Q Y, Shen H Y,. Research progress on the protective effects of aucubin in neurological diseases [J]., 2022, 60(1): 1088-1094.
[13] 唐显群, 雷亚玲, 韩祖成. 从肝论治郁病作用机制 [J]. 中西医结合心脑血管病杂志, 2020, 18(12): 2001-2003.
[14] Peng Y Z, Su Y, Jiang Y. Effect of the warming and tonifying kidney-yang recipe on monoamine neurotransmitters and pathological morphology of hippocampus tissue in depression model rats [J]., 2020, 28(S1): 237-244.
[15] 李方园, 盛婵娟, 袁方玉, 等. 栀子提取物GJ-4对利血平致抑郁症小鼠的作用及机制研究 [J]. 中药新药与临床药理, 2021, 32(6): 751-757.
[16] Zhao H, Jiang M Q, Miao M S. Pharmacological study on total glycosides of Xiebai protecting against depression model [J]., 2022, 2022: 5498130.
[17] Li Y H, Liu Q X, Wang J S,. Ghrelin improves cognition via activation of the cAMP-CREB signalling pathway in depressed male C57BL/6J mice [J]., 2021, doi: 10.1080/00207454.2021.1928114.
[18] Chen C, Dong Y Y, Liu F,. A study of antidepressant effect and mechanism on intranasal delivery of BDNF-HA2TAT/AAV to rats with post-stroke depression [J]., 2020, 16: 637-649.
[19] 张莉, 卢仁睿, 王慧慧, 等. 地黄苷D对皮质酮诱导的PC-12细胞损伤的保护作用及机制研究 [J]. 中草药, 2022, 53(11): 3385-3393.
Protective effect and mechanism of Huaiextract on corticosterone-induced depression model
LU Ren-rui1, ZHANG Li1, 2, XU Rui-hao1, WANG Hui-hui1, FENG Wei-sheng1, 2, ZHENG Xiao-ke1, 2
1. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Henan Engineering Technology Research Center for Chinese Medicine Development, Zhengzhou 450046, China
To study antidepressant effect of Huai Juhua () extract on corticosterone-induced mouse depression model and adrenal pheochromocytoma PC-12 cell injury model.Male C57BL/6 mice were randomly divided into control group, model group, fluoxetine (5 mg/kg) group and Huaiextract low-, medium-and high-dose (1.67, 3.33, 6.67 g/kg) groups. Model group and each administration group were sc corticosterone (20 mg/kg) for 21 consecutive days, and corresponding drugs were given at the same time during modeling. After administration, sugar water preference experiment, tail suspension experiment and open field experiment were performed; Corticosterone and neurotransmitter levels in serum of mice were detected by kits; Western blotting was used to detect the expression of key proteins in cyclic adenosine monophosphate-response element binding protein (CREB) pathway in hippocampus. Corticosterone induced PC-12 cells was used to establish a cell injury model, flow cytometry was used to detect the effect of Huaiextract on cell apoptosis and reactive oxygen species (ROS) levels; In-Cell Western method was used to detect apoptosis-related protein and CREB pathway key protein expressions.Huaiextract significantly improved the sugar water preference rate of mice (< 0.05, 0.01), increased the number of standing times (< 0.05, 0.01), reduced the immobility time of mice in tail suspension test (< 0.01), significantly decreased corticosterone level in serum (< 0.01), increased levels of 5-hydroxytryptamine (5-HT), norepinephrine (NE), dopamine (DA) and acetylcholine (Ach) in serum (< 0.05, 0.01), up-regulated the protein expression levels of CREB, phosphorylated CREB (p-CREB) and cyclic adenosine monophosphate (cAMP) in hippocampus (< 0.05, 0.01). Huaiextract significantly inhibited corticosterone-induced PC-12 cells apoptosis and intracellular ROS level (< 0.01), inhibited the expression of apoptosis-related proteins (< 0.01), and up-regulated the expression of key proteins in CREB pathway (< 0.01).Huaiextract may improve depression by regulating CREB pathway and inhibiting neuronal apoptosis.
Huai; corticosterone; depression; cyclic adenosine monophosphate-response element binding protein; apoptosis
R285.5
A
0253 - 2670(2022)18 - 5750 - 09
10.7501/j.issn.0253-2670.2022.18.018
2022-07-08
国家重点研发计划项目(2017YFC1702800);河南省中医药科学研究专项课题(20-21ZY2148);河南省重大科技专项(171100310500);河南省高层次人才特殊支持“中原千人计划”项目(ZYQR201810080);河南省教育厅河南省科技攻关项目(212102311106);河南中医药大学2018年度博士科研基金资助项目(BSJJ2018-04)
卢仁睿(1998—),女,在读硕士研究生,从事中药药效物质基础及作用机制研究。E-mail: 13203703171@163.com
冯卫生,男,教授,从事中药药效物质基础及作用机制研究。E-mail: fwsh@hactcm.edu.cn
郑晓珂,女,教授,从事中药活性及其作用机制研究。Tel: (0371)60190296 E-mail: zhengxk.2006@163.com
[责任编辑 李亚楠]
