结合非靶向代谢组学和指纹图谱对通体结香技术产沉香与野生沉香化学成分的比较分析
2022-09-20侯文成刘洋洋魏建和
郁 萌,侯文成,冯 剑,陈 兰,杨 云,刘洋洋*,魏建和*
结合非靶向代谢组学和指纹图谱对通体结香技术产沉香与野生沉香化学成分的比较分析
郁 萌1, 2,侯文成1,冯 剑1,陈 兰1,杨 云1,刘洋洋1, 2*,魏建和1, 2*
1. 中国医学科学院 北京协和医学院 药用植物研究所海南分所,海南省南药资源保护与开发重点实验室,国家中医药管理局沉香可持续利用重点研究室,海南 海口 570311 2. 中国医学科学院 北京协和医学院 药用植物研究所,中草药物质基础与资源利用教育部重点实验室,濒危药材繁育国家工程实验室,北京 100193
系统全面分析比较通体结香技术产沉香(简称通体香)与野生沉香化学成分,为通体结香技术进一步的应用和推广提供科学可靠的依据。采用超高效液相色谱串联四级杆飞行时间质谱(UPLC-Q/TOF-MS)和气相色谱-质谱(GC-MS)结合非靶向代谢组学和指纹图谱,对通体香与野生沉香的乙醇提取物和挥发性成分进行分析。16批通体香与16批野生沉香的共有成分相同,但通体香指纹图谱相似度较高,且4个倍半萜、3个小分子芳香物质和8个2-(2-苯乙基)色酮等共17个共有成分在通体香中含量较高。通体香和野生沉香主要化学成分组成相同,但不同批次间通体香的质量更稳定。
沉香;通体结香技术;2-(2-苯乙基)色酮;非靶向代谢组学;指纹图谱;2,4-二叔丁基苯酚;6,7-二甲基-1,2,3,5,8,8a-六氢萘;去氢蜂斗菜酮
沉香为名贵香药,《中国药典》2020年版规定其为瑞香科植物白木香(Lour.) Gilg含有树脂的木材[1]。自然情况下,白木香树须受到外界伤害后,在其生长过程中缓慢形成沉香[2]。为了减少对野生沉香资源的依赖,我国从20世纪90年代就开始大力发展白木香种植,并探索人工结香方法。其中,魏建和等[3]发明的通体结香技术已成为目前我国乃至全世界范围内主要沉香产区应用最广泛的沉香结香技术。李浩洋等[4]对10批通体结香技术所产沉香(简称通体香)的质量进行评价,认为通体香的质量符合《中国药典》的规定,可代替野生沉香入药。相关研究证明通体香对实验动物的止呕[5]、保肝[6]、抗心肌缺血[7]、抗胃溃疡[8]和抗结肠炎[9]等作用与野生沉香相当或优于野生沉香。Li等[10]采用UPLC-Q/TOF-MS结合多元变量统计分析初步发现通体香和野生沉香中6,7-二甲氧基- 2-(2-苯乙基)色酮等14个2-(2-苯乙基)色酮类成分在含量上存在一定差异。而刘洋洋[11]研究发现通体香乙醇提取物中主要成分为2-(2-苯乙基)色酮类化合物(图1),其挥发性成分主要为倍半萜类化合物和小分子芳香物质。已有研究尚未从全化学组成角度分析比较通体香与野生沉香化学成分的差异。
为了系统全面地分析和评价通体香药材质量,本研究收集我国沉香2大主要产区海南和广东的具有代表性的通体香和野生沉香样品,采用超高效液相色谱串联四级杆飞行时间质谱(UPLC-Q/TOF- MS)和气相色谱质谱(GC-MS)分析沉香化学成分,基于中药指纹图谱相似度评价方法和非靶向代谢组学方法对通体香与野生沉香的化学成分进行比较分析,从而评价通体香与野生沉香化学成分的组成差异,以期为通体结香技术的推广以及通体香在医药和大健康产业中的应用提供依据。
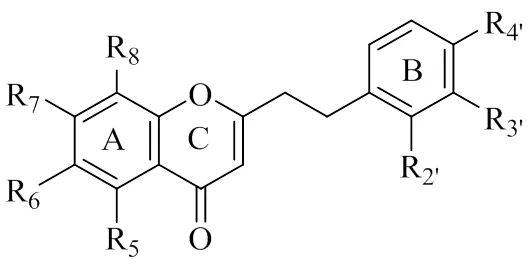
图1 2-(2-苯乙基)色酮类化合物结构
1 材料、仪器与试剂
1.1 材料
32批沉香样品详细信息见表1。其中16批为通体香样品,16批为野生沉香样品,所有样品经中国医学科学院药用植物研究所海南分所刘洋洋研究员鉴定为瑞香科植物白木香(Lour.) Gilg含有树脂的木材。
表1 样品信息
Table 1 Information of samples
序号来源分类序号来源分类 tt1广东茂名通体香ys1海南五指山野生沉香 tt2广东化州通体香ys2海南定安野生沉香 tt3广东茂名通体香ys3海南定安野生沉香 tt4广东湛江通体香ys4市售(购买地广东江门)野生沉香 tt5广东湛江通体香ys5市售(购买地广东江门)野生沉香 tt6广东化州通体香ys6市售(购买地广东江门)野生沉香 tt7广东化州通体香ys7广东化州野生沉香 tt8广东电白通体香ys8广东化州野生沉香 tt9广东化州通体香ys9海南定安野生沉香 tt10海南琼中通体香ys10海南定安野生沉香 tt11海南海口通体香ys11海南定安野生沉香 tt12海南海口通体香ys12海南定安野生沉香 tt13海南定安通体香ys13市售(购买地广东江门)野生沉香 tt14海南琼中通体香ys14海南定安野生沉香 tt15海南儋州通体香ys15海南定安野生沉香 tt16海南儋州通体香ys16市售(购买地广东江门)野生沉香
1.2 仪器
ASE 350型加速溶剂萃取仪(赛默飞世尔科技有限公司);7890A-5975C气相色谱质谱联用仪(GC-MS,安捷伦科技有限公司);Xevo G2-XS型超高效液相色谱串联四极杆飞行时间质谱仪(美国沃特世科技有限公司)。
1.3 试剂
硅藻土(赛默飞世尔科技有限公司,粒径大于三号筛),乙腈(赛默飞世尔科技有限公司,质谱纯),屈臣氏蒸馏水,其余试剂均为国产分析纯。
2 方法
2.1 UPLC-Q/TOF-MS分析方法
2.1.1 样品溶液制备 精密称取沉香样品粉末0.1 g,加50%乙醇10 mL,称定质量,超声(40 kHz,600 W)提取30 min,静置、冷却,称定质量,用50%乙醇补足质量,取上清液作为UPLC分析用样品溶液,待用。从以上32个样品溶液中各取200 μL混合,制成质控样品[12]。
2.1.2 分析条件 采用UPLC-Q/TOF-MS分析32个样品溶液,每6个样品间插入1个质控样品。
(1)UPLC色谱条件:Waters ACQUITY UPLC BEH C18色谱柱(100 mm×3 mm,1.7 μm),流动相乙腈(A)-水(B)梯度洗脱(0~20 min,20%~50%A;20~30 min,50%~100%A),体积流量0.25 mL/min,柱温30 ℃,检测波长254 nm,进样量2 μL。
(2)质谱条件:Q/TOF-MS采用电喷雾电离源(ESI)在正离子模式下以MSE模式采集,扫描范围/100~1500,采用亮氨酸-脑啡肽(/556.277 1 [M+H]+)实时校正。毛细管电离电压3.0 kV;锥孔电压40 V;离子源温度100 ℃;脱溶剂气温度350 ℃;脱溶剂N2体积流量600 L/h;锥孔反吹N2体积流量50 L/h。低能量扫描无碰撞能,高能量MSE模式扫描碰撞能35~45 eV,碰撞气为氩气。
2.2 GC-MS分析方法
2.2.1 样品溶液制备 精密称取0.1 g沉香样品粉末,与适量的硅藻土研磨混匀,装入34 mL不锈钢萃取池中,以硅藻土填满萃取池,置于加速溶剂萃取仪中。加速溶剂萃取仪以水为提取剂,加热温度120 ℃,静态时间5 min,冲洗体积为萃取池体积的30%,循环2次。所得提取液用5 mL正己烷萃取,制得GC-MS分析用样品溶液,待用。从32个样品溶液中各取200 μL混合,制成质控样品[12]。
2.2.2 分析条件 采用GC-MS以液体进样方式分析32个样品溶液,记录TIC图。每6个样品间插入1个质控样品。
(1)色谱条件:色谱柱为HP-5MS石英毛细管柱(30 m×250 μm),进样口温度240 ℃;柱温50 ℃保持1 min,以15 ℃/min至140 ℃并保持8 min;以1 ℃/min至155 ℃并保持8 min;以10 ℃/min至175 ℃并保持7.5 min;以5 ℃/min至200 ℃并保持9.5 min;最后以20 ℃/min至260 ℃并保持5 min。进样量1 μL。
(2)质谱条件:EI离子源,离子阱温度230 ℃,四级杆温度150 ℃,接口温度260 ℃,质量范围/50~300。
2.3 共有峰分析
将16批通体香和16批野生沉香样品的GC-MS总离子流和UPLC-Q/TOF-MS基峰图(BPC,base peak chromatogram)分别导入《中药色谱指纹图谱相似度评价系统软件》(2012版),以质控样品QC指纹图谱为参照图谱,时间窗宽度为0.5 s,经多点校正、自动匹配后,分别生成通体香的GC-MS、UPLC-Q/TOF-MS指纹图谱和野生沉香GC-MS、UPLC-Q/TOF-MS指纹图谱,并依次提取共有峰。
2.4 多元变量统计分析
采用MS-DIAL软件[13]对GC-MS原始数据进行峰提取、识别、对齐、归一化、尺度化和缺失值填充等数据预处理,采用Waters Progenesis QI软件[14]对UPLC-Q/TOF-MS原始数据进行峰提取、识别、对齐、归一化、尺度化和缺失值填充等数据预处理,并分别输出每个样品标准化后得到的保留时间、精确质荷比和峰面积组成的三维数据矩阵,导入至SIMCA 14.0软件分别对GC-MS和UPLC-Q/TOF- MS数据进行多元变量统计分析。
3 结果与分析
3.1 指纹图谱方法学考察
3.1.1 精密度试验 精密称取质控样品,分别按“2.1.1”和“2.2.1”项下方法制得样品溶液,并分别按“2.1.2”和“2.2.2”项下色谱条件连续进样测定6 次。UPLC-Q/TOF-MS以2号峰为参照峰、GC-MS以3号峰为参照峰,计算各共有峰相对保留时间和相对峰面积RSD值分别小于0.59%和3.30%、0.079%和2.49%,表明仪器精密度良好。
3.1.2 重复性试验 精密称取质控样品6份,分别按“2.1.1”和“2.2.1”项下方法制备样品溶液,并分别按“2.1.2”和“2.2.2”项下色谱条件进样,UPLC-Q/TOF-MS以2号峰为参照峰、GC-MS以3号峰为参照峰计算各共有峰相对保留时间和相对峰面积RSD值分别小于0.93%和3.51%、0.084%和2.54%,表明该方法重复性良好。
3.1.3 稳定性试验 精密称质控样品,分别按“2.1.1”和“2.2.1”项下方法制得样品溶液,并分别按“2.1.1”和“2.2.1”项下色谱条件分别于0、2、4、6、12、24 h进样,UPLC-Q/TOF-MS以2号峰为参照峰、GC-MS以3号峰为参照峰计算各共有峰相对保留时间和相对峰面积RSD值分别小于0.76%和3.74%、0.05%和2.33%,表明24 h内样品溶液在室温下的稳定性良好。
3.2 指纹图谱的建立及共有峰分析
采用UPLC-Q/TOF-MS对16批通体香和16批野生沉香50%乙醇提取物的化学成分指纹图谱进行分析,见图2。结果表明16批通体香样品之间相似度为0.598~0.869,而16批野生沉香样品间的相似度仅为0.092~0.815,可见16批通体香醇提物化学成分的相似度较16批野生沉香醇提物化学成分相似度大。同时,基于MSE质谱采集模式高能量场得到的碎片离子信息,并参考已有文献数据[10, 15-16]确认了2-(2-苯乙基)色酮类化合物色酮部分(A环)和苯乙基部分(B环)取代基的类型和数目,进而指认了32个2-(2-苯乙基)色酮类化合物,见表2。
根据指纹图谱共有峰分析结果可知,通体香的UPLC-Q/TOF-MS指纹图谱共有峰(RLC-tt,图3-A)和野生沉香的UPLC-Q/TOF-MS指纹图谱共有峰(RLC-ys,图3-B)均为24个。可见,通体香和野生沉香50%乙醇提取物的主要化学成分一致,均为2-(2-苯乙基)色酮类成分,且根据分子离子峰的相对丰度比较,各成分在通体香中的含量均高于野生沉香。
采用GC-MS分析16批通体香和16批野生沉香的挥发性成分,结果发现16批通体香样品之间相似度为0.846~0.995,16批野生沉香样品间的相似度仅为0.393~0.974,可见16批通体香挥发性成分的相似度较16批野生沉香挥发性成分相似度大。

图2 通体香(I) 和野生沉香(II) 的GC-MS (A) 和UPLC-Q/TOF-MS (B) 指纹图谱
表2 通体香和野生沉香UPLC-Q/TOF-MS共有成分及差异化合物信息
Table 2 Overview of common compounds and potential markers from agarwood induced by Agar-Wit and natural agarwood analyzed in UPLC-Q/TOF-MS total ion chromatograms common models fingerprint
序号tR/min[M+H]+误差(×10−6)MSE碎片离子峰取代基分子式类型名称差异成分A环B环 1*5.06340.259 0 未鉴定 2*5.37319.118 20301.108 0, 283.096 8, 255.102 04×OH C17H18O6THPEC2-(2-phenylethyl)-5,6,7,8-tetrahydroxy-5,6,7,8-tetrahydrochromone(isomer) 3*5.55407.790 8 未鉴定 4*6.04319.118 0−0.6301.108 9, 283.096 8, 255.105 44×OH C17H18O6THPEC2-(2-phenylethyl)-5,6,7,8-tetrahydroxy-5,6,7,8-tetrahydrochromone(isomer) 5*6.30319.118 0−0.6301.108 4, 283.096 5, 255.101 94×OH C17H18O6THPEC2-(2-phenylethyl)-5,6,7,8-tetrahydroxy-5,6,7,8-tetrahydrochromone(isomer) 6*8.58329.102 3−0.6301.107 8, 301.107 8, 137.059 82×-O-OH; OCH3C18H16O6DEPECoxidoagarochromone C(isomer) 7*11.81331.117 2−3.0313.107 3, 285.112 0, 121.064 92×OH; -O-OCH3C18H18O6EPEC2-[2-(4'-methoxyphenyl)ethyl]-6,7-epoxy-5,8-dihydroxy-5,6,7,8-tetrahydrochromone(isomer) 8*12.04301.109 04.6283.097 8, 255.103 8, 227.109 12×OH; -O- C17H16O5EPEC2-(2-phenylethyl)-6,7-epoxy-5,8-dihydroxy-5,6,7,8-tetrahydrochromone(isomer) 9*14.33313.107 60283.112 5, 257.120 1, 121.068 52×-O-OCH3C18H16O5DEPECoxidoagarochromone B(isomer)L1 10*14.69283.097 10.3255.102 0, 227.107 1, 192.042 02×-O- C17H14O4DEPECoxidoagarochromone A(isomer)L2 11*17.47297.113 83.7137.060 0 OH; OCH3C18H16O4FTPEC2-[2-(2′-hydroxy-4′-methoxyphenyl)ethyl]chromone(isomer) 12*17.47327.123 20191.071 0, 137.059 9OCH3OH; OCH3C19H18O5FTPEC6-methoxy-2-[2-(3′-hydroxy-4′-methoxyphenyl)ethyl]chromone(isomer) 13*17.72327.123 40.6191.070 6, 137.060 2OCH3OH; OCH3C19H18O5FTPEC6-methoxy-2-[2-(3′-hydroxy-4′-methoxyphenyl)ethyl]chromone(isomer) 14*18.08297.113 83.7137.060 0 OH; OCH3C18H16O4FTPEC2-[2-(2′-hydroxy-4′-methoxyphenyl)ethyl]chromone(isomer) 15*19.06297.112 70137.060 6 OH; OCH3C18H16O4FTPEC2-[2-(2′-hydroxy-4′-methoxyphenyl)ethyl]chromone(isomer) 16*19.71267.102 72.2137.023 9, 176.047 4OH C17H14O3FTPEC2-[2-(4′-methoxyphenyl)ethyl]chromone(isomer)L3 17*20.94341.139 10.6121.069 12×OCH3OCH3C20H20O5FTPEC6,7-dimethoxy-2-[2-(4′-methoxyphenyl)ethyl]chromone(isomer)L4 18*21.61311.128 50.6121.067 8OCH3OCH3C19H18O4FTPEC6-methoxy-2-[2-(4′-methoxyphenyl)ethyl]chromone(isomer)L5 19*24.16251.107 61.6173.060 1, 121.029 3 C17H14O2FTPEC2-(2-phenylethyl)chromoneL6 20*24.47311.128 10.6121.065 0OCH3OCH3C19H18O4FTPEC6-methoxy-2-[2-(4′-methoxyphenyl)ethyl]chromone(isomer)L7 21*24.88281.117 90.3121.069 2 OCH3C18H16O3FTPEC2-[2-(4'-methoxyphenyl)ethyl]chromone(isomer)L8 22*25.14233.154 5 未鉴定 23*25.40255.154 6 未鉴定 L9 24*26.55549.191 1−0.3531.183 4, 458.136 8, 440.126 0; 283.097 5 C34H28O7PEC dimers 259.26301.107 60283.097 4, 255.102 52×OH; -O- C18H16O5DEPEC2-(2-phenylethyl)-6,7-epoxy-5,8-dihydroxy-5,6,7,8-tetrahydrochromone(isomer) 2610.93367.094 5−0.8349.084 2, 331.118 2, 313.107 63×OH; ClOCH3C18H20ClO6THPEC8-chloro-5,6,7-trihydroxy-5,6,7,8-tetrahydro-2-[2-(4′-methoxyphenyl)ethyl]chromone(isomer)
续表2

序号tR/min[M+H]+误差(×10−6)MSE碎片离子峰取代基分子式类型名称差异成分 A环B环 279.82361.129 72.8137.060 7-O-; OH; OCH3OH; OCH3C19H21O7EPEC2-[2-(3′-hydroxy-4′-methoxyphenyl)ethyl]-7,8-epoxy-5-methoxy-6-hydroxy-5,6,7,8- tetrahydrochromone(isomer) 2811.24337.084 1−0.6319.073 7, 301.062 6, 283.096 73×OH; Cl C17H18ClO5THPEC8-chloro-5,6,7-trihydroxy-5,6,7,8-tetrahydro-2-(2-phenylethyl)chromone(isomer) 2912.42313.107 70.3285.112 8 OCH3C18H16O5DEPECoxidoagarochromone B(isomer) 3016.75267.102 51.5189.073 3, 176.047 5OH C17H14O3FTPEC2-[2-hydroxy-2-(2-phenylethyl)]chromone(isomer) 3116.05267.102 10173.056 2, 161.059 9 OHC17H14O3FTPEC2-[2-(3′-hydroxyphenyl)ethyl]chromone(isomer) 3216.69297.113 01.0137.060 5 OH; OCH3C18H16O4FTPEC2-[2-(2′-hydroxy-4′-methoxyphenyl)ethyl]chromone(isomer) 3317.11297.112 90.7137.059 6 OH; OCH3C18H16O4FTPEC2-[2-(2′-hydroxy-4′-methoxyphenyl)ethyl]chromone(isomer) 3418.34327.125 77.6137.059 3OCH3OH; OCH3C19H18O5FTPEC6-methoxy-2-[2-(3′-hydroxy-4′-methoxyphenyl) ethyl]chromone(isomer) 3523.57281.117 4−1.4151.039 3OCH3 C18H16O3FTPEC6-methoxy-2-(2-phenylethyl)chromone(isomer) 3625.88297.112 90.7206.057 5, 191.034 5, 167.034 6OH; OCH3 C18H16O4FTPEC6-hydroxy-7-methoxy-2-(2-phenylethyl)chromone(isomer)
DEPEC-双氧环四氢色酮 EPEC-单氧环四氢色酮 THPEC-四羟基四氢2-(2-苯乙基)色酮 FTPEC-简单2-(2-苯乙基)色酮 PEC dimers-2-(2-苯乙基)色酮二聚体;“*”为指纹图谱共有成分;L1~L9代表显著差异性成分
DEPEC-diepoxy-2-(2-phenylethyl)chromones EPEC-epoxy-2-(2-phenylethyl)chromones THPEC-5,6,7,8-tetrahydro-2-(2-phenylethyl)chromones FTPEC-flindersia type 2-(2-phenylethyl)chromones PEC dimers 2-(2-phenylethyl)chromone dimers;“*”the common components in the fingerprint;L1—L9 represent significantly different components
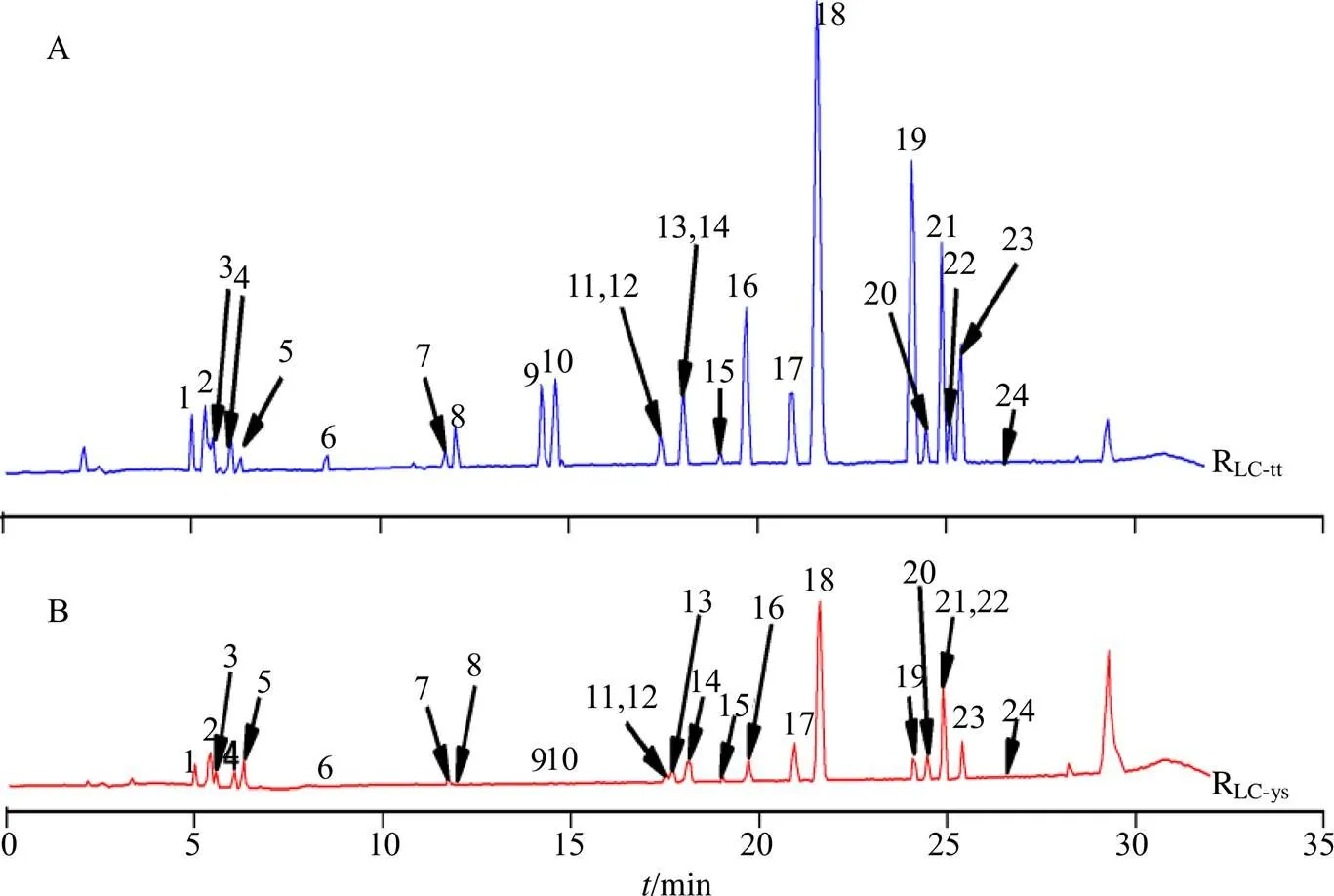
图中编号与表2对应
根据指纹图谱共有峰分析结果可知,通体香的GC-MS指纹图谱共有峰(RGC-tt,图4-A)和野生沉香的GC-MS指纹图谱共有峰(RGC-ys,图4-B)均为32个。通过检索NIST17谱库并结合已有文献对共有峰进行解析,指认了其中20个共有成分,见表3。包括9个倍半萜类化合物、8个小分子芳香化合物、2个2-(2-苯乙基)色酮类化合物以及1个酚酸类化合物。由此可见,通体香和野生沉香含有的主要挥发性成分一致。
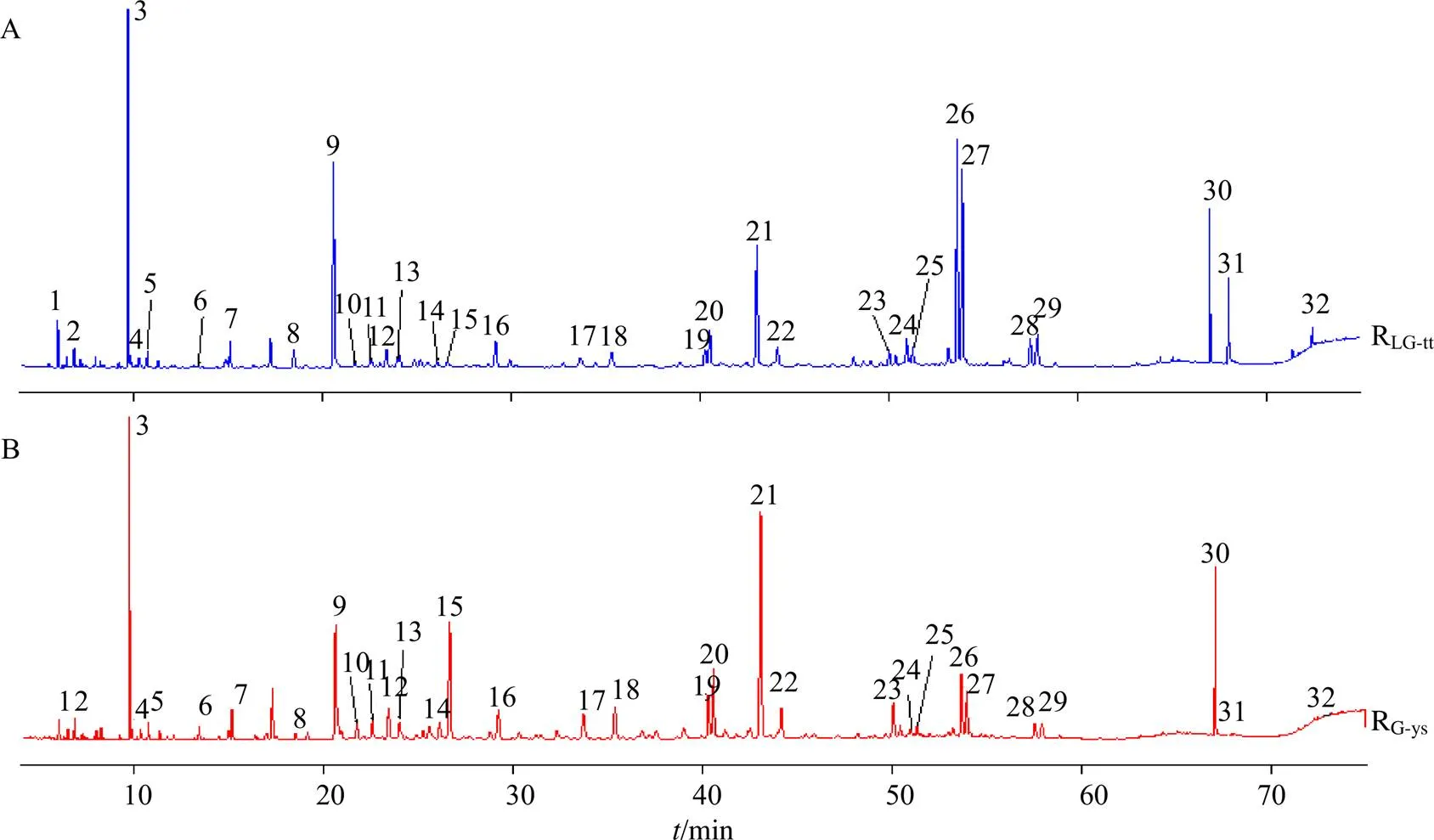
图中编号与表3对应
3.3 差异性分析
为了进一步探究通体香和野生沉香化学组成的差异,采用有监督的正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)模型分析数据。结合OPLS-DA模型与独立样本检验,根据VIP值、S-Plot(即PC1方差贡献率(p[1])和变量相关系数(p(corr)[1])以及值(阈值0.05)筛选差异变量。
根据32批沉香样品的UPLC-Q/TOF-MS分析结果,以VIP值>8、分布在S-plot左下角(p[1]<−0.1且p(corr)[1]<−0.5)以及<0.05为筛选条件(图5-A),得到9个显著差异性成分L1~L9,其中,L1和L2属于三元氧环四氢色酮(DEPECs),L3、L4、L5、L6、L7以及L8属于2-(2-苯乙基)色酮(FTPECs)。但是由表2可知,该9个成分均为通体香和野生沉香UPLC-Q/TOF-MS指纹图谱中的共有成分,且从S-plot图(图5)可发现,L1~L9等9个差异成分均位于X轴负半轴,表明其在通体香中的含量均显著高于野生沉香。根据32批沉香样品的GC-MS分析结果,以VIP值>1且分布在S-plot左下角(p[1]<−0.07且p(corr)[1]<−0.15)和右上角(p[1]>0.045且p(corr)[1]>0.5)以及<0.05为筛选条件(图5-B),得到12个显著差异性成分G1~G12,包括3个小分子芳香化合物(G1、G2、G5)、5个倍半萜类化合物(G4、G7~G10)、2个2-(2-苯乙基)色酮类化合物(G11、G12)、1个烯烃类(G6)以及1个酚酸类化合物(G3),其中显著差异性成分2-(2-苯乙基)色酮(G15)与UPLC-Q/TOF-MS分析所得显著差异性成分2-(2-苯乙基)色酮(L6)相同。但是由表3可知,该12个成分均为通体香和野生沉香GC指纹图谱中的共有成分,且从S-plot图(图5)可发现,2,4-二叔丁基苯酚(G3)、6,7-二甲基- 1,2,3,5,8,8a-六氢萘(G6)、以及去氢蜂斗菜酮(G7)等3个成分在野生沉香中的含量显著高于通体香,其余9个成分在通体香中的含量均显著高于野生沉香。
表3 通体香和野生沉香GC-MS指纹图谱已鉴定共有成分及差异化合物信息
Table 3 Overview of identified common compounds and potential markers from agarwood induced by Agar-Wit and natural agarwood analyzed in GC-MS total ion chromatograms common models’ fingerprint
峰号tR/min化合物名称碎片离子 (m/z)匹配度分子式差异成分 16.02苯甲醛105.1, 77.1, 51.198.3C7H6OG1 39.75苄基丙酮148.1, 105.1, 91.1, 43.199.3C10H12OG2 510.744-甲氧基苯甲醛135.0, 77.0, 63.096.0C8H8O2 715.152,4-二叔丁基苯酚206.0, 191.0, 57.095.5C14H22OG3 818.51α-檀香醇206.0, 191.0, 57.080.1C15H24OG4 920.624-(4-甲氧基苯基)-2-丁酮178.0, 121.0, 43.093.8C11H14O2G5 1021.75沉香螺旋醇204.2, 161.1, 119.1, 59.193.1C15H26O 1122.57(–)-马兜铃烯161.1, 105.191.190.1C15H24 1223.422-((2R,8R,8aS)-8,8a-二甲基-1,2,3,4,6,7,8,8a-八氢萘-2-甲基)异丙基-2-醇204.2, 161.1, 59.190.7C15H26O 1323.96(4aS,8R)-4a,8-二甲氧基-4,4a,5,6,7,8-六氢萘-2(3H)-酮136.1, 121.0, 107.185.5C12H18O 1426.121,3-二(1-甲基乙基)苯162.0, 147.0, 105.0, 59.080.9C12H18 1526.656,7-二甲基-1,2,3,5,8,8a-六氢萘162.2, 147.1, 59.196.4C12H14O4G6 1940.32(4aR-cis)-4,4a,5,6,7,8-六氢-4a,5-二甲基-3-(1-甲基亚乙基)-2(3H)-萘175.0, 161.0, 147.089.0C15H22O 2143.08[3S-(3α,4aα,5α)]-3,4,4a,5,6,7-六氢-4a,5-二甲基-3-(1-甲基乙烯基)-1(2H)-萘177.1, 147.0, 91.179.9C15H22OG7 2653.68(4aR,5S)-1-羟基-4a,5-二甲基-3-亚丙基-4,4a,5,6-四氢萘-2(3H)-酮232.2, 217.0, 91.1, 77.183.1C15H20O2G8 2753.945,8-二羟基-4a-甲基-4,4a,4b,5,6,7,8,8a,9,10-十氢-2(3H)-菲酮185.2, 105.1, 91.182.0C15H22O3G9 2957.88(2aS,3aR,5aS,9bR)-2a,5a,9-三甲基-2a,4,5,5a,6,7,8,9b-八氢-2H-萘并 [1,2-b]环氧基[2,3-c]呋喃261.0, 105.0, 91.067.9C15H22O2G10 3067.022,2′-亚甲基双[6-(1,1-二甲基乙基)-4-甲基苯酚340.0, 177.0, 161.097.0C23H32O2 3168.022-(2-苯乙基)色酮250.1, 91.194.7C17H14O2G11 3272.436-甲氧基-2-(2-苯乙基)色酮280.0, 91.083.4C18H16O3G12
G1~G12代表显著差异性成分
G1-G12 represent significantly different components
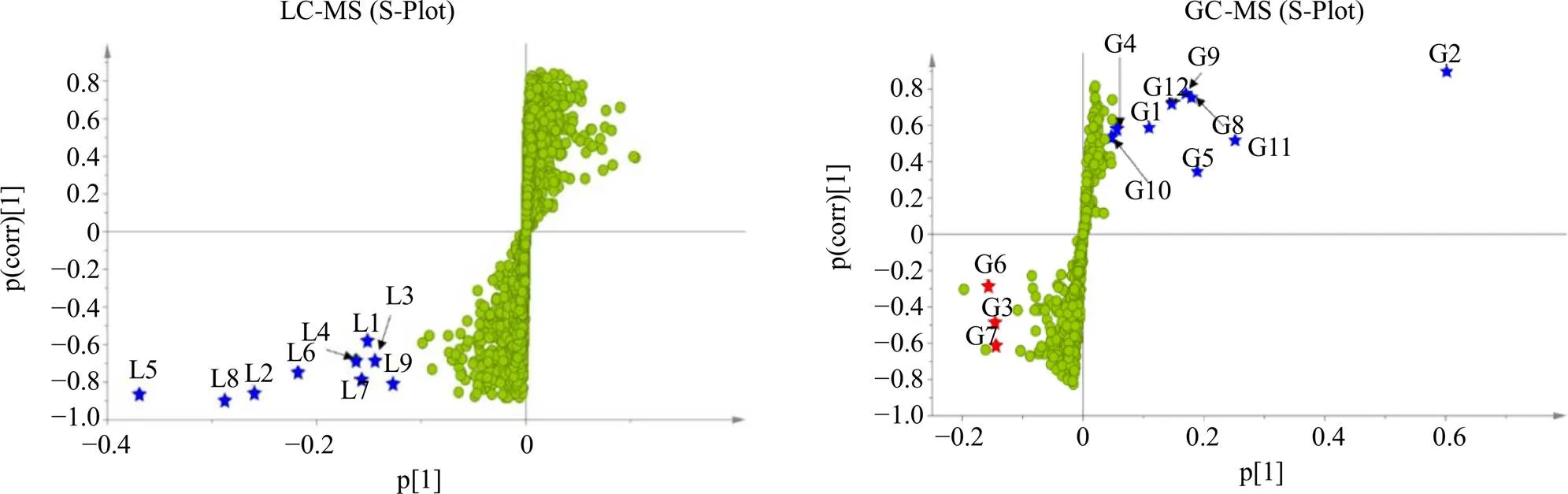
图5 通体香和野生沉香UPLC-Q/TOF-MS和GC-MS的S-Plot图
将以上20个差异成分导入到Metaboanalyst软件中绘制热图,距离度量方法为皮尔森积矩相关系数,聚类方法为平均连接法,结果见图6,通体香和野生沉香各聚为一类。可见,20个差异成分可以区分通体香和野生沉香,即通体香和野生沉香组间化学成分的差异远大于其组内差异。通过热图的颜色变化发现,除了挥发性成分中G3、G6和G7在野生沉香中的含量显著高于通体香,其余17个成分在通体香中的含量均显著高于野生沉香,且具有显著差异的2-(2-苯乙基)色酮类化合物均在通体香中具有较高的含量。
4 讨论
4.1 样品前处理方法的选择
本研究在UPLC-Q/TOF-MS的样品前处理过程中对不同浓度甲醇溶液和乙醇溶液的热回流提取效果进行了比较。结果发现,50%乙醇溶液和无水甲醇的提取效果较好,但采用无水甲醇溶解待测样品时对其极性较大成分有溶剂效应,导致在UPLC上分离度较差。因此,本研究选择50%乙醇溶液进行热回流作为UPLC-Q/TOF-MS的样品前处理方式。此外,本研究GC-MS的样品前处理采用了加速溶剂萃取法代替水蒸气蒸馏法,以水作为提取溶剂,通过提高温度与压力,在120 ℃提取沉香挥发性成分,可实现名贵药材沉香的微量取样,及其挥发性成分的高效、标准化提取。
4.2 通体香与野生沉香的主要化学成分相同
中药指纹图谱是采用一定分析手段得到的反应该中药主要化学成分的共有峰图谱,作为一种半定量鉴别手段,常用于中药质量控制[17]。本研究发现,通体香和野生沉香UPLC-Q/TOF-MS指纹图谱共有峰均为24个,主要为2-(2-苯乙基)色酮类化合物;而二者GC-MS指纹图谱共有峰均为32个,主要为小分子芳香化合物和倍半萜。由于倍半萜和2-(2-苯乙基)色酮类等成分均是因白木香树受到外界伤害产生防御反应后产生的防御性物质[2]。可见,通体香和野生沉香在形成过程中产生的主要化学成分相同,这可能也是通体香乙醇提取物抗胃溃疡[8]、抗结肠炎[9]等作用与野生沉香作用相当的原因。
中药指纹图谱可全面反映中药所含的物质群,其相似度系数反映了不同批次样品间化学组成的整体波动程度,即中药材质量的稳定性[17-18]。沉香化学成分与其结香时间、生长环境和结香原因等因素有关[19]。Gao等[20]基于GC-MS指纹图谱分析发现野生沉香和不同人工结香方法所产沉香的主要挥发性成分一致,但是不同人工结香方法所产沉香的指纹图谱相似度较低,仅为0.180~0.811。而本研究发现16批采用通体结香技术诱导白木香树所产沉香UPLC-Q/TOF-MS指纹图谱和GC-MS指纹图谱相似度较高,分别为0.598~0.869和0.846~0.995,且相似度高于野生沉香。可见,不同批次通体香的化学组成相对于野生沉香更稳定,可能与通体结香技术所采用的标准化结香、种植方式有关[21]。而16批野生沉香化学成分的相似度较16批通体香化学成分相似度小,可能与野生沉香生长环境、结香原因和产地加工等复杂因素有关,且其结香时间通常为数年至数十年不等[22-23]。
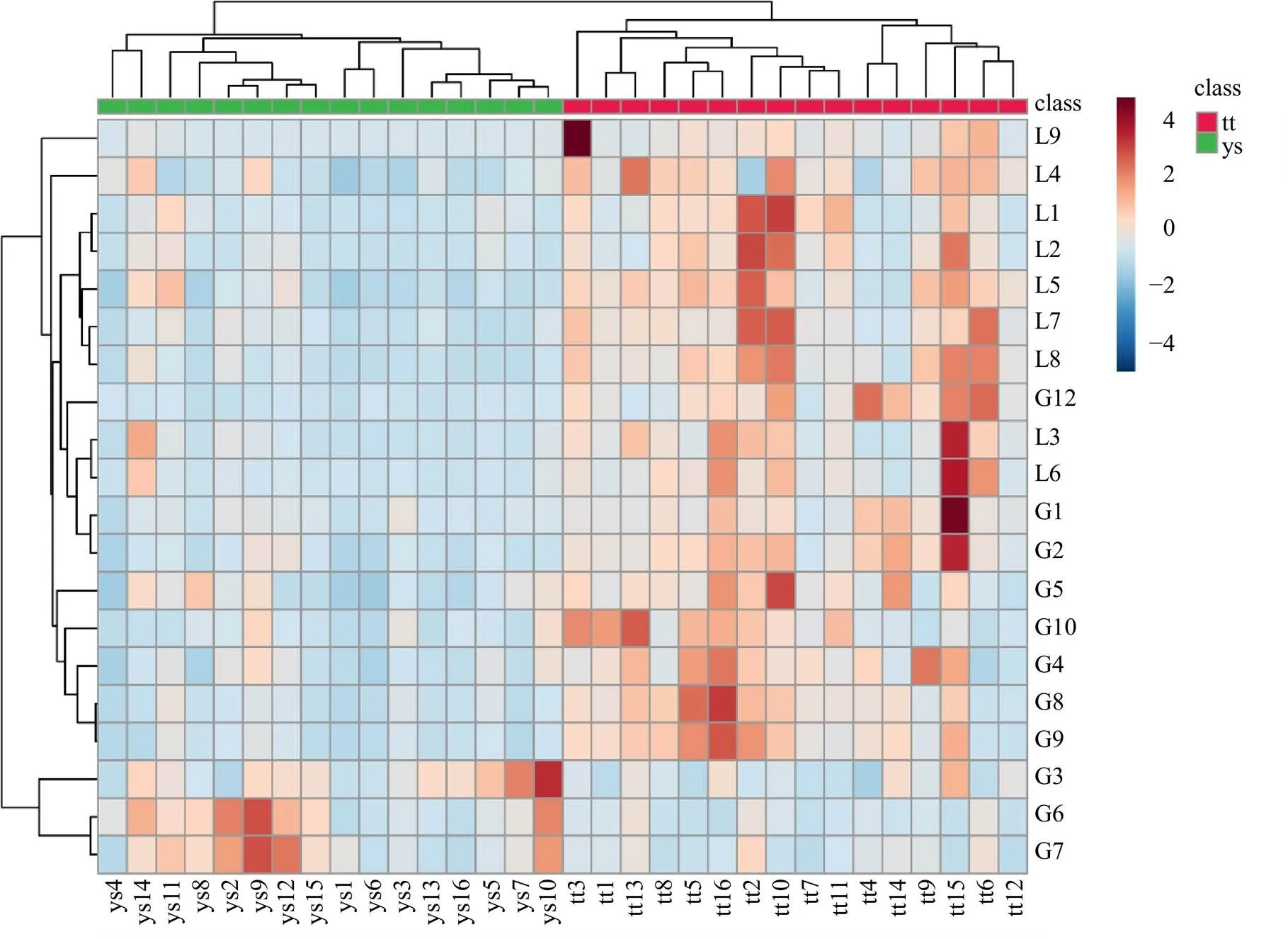
图6 通体香和野生沉香差异成分热图分析
4.3 通体香中部分主要化学成分的含量高于野生沉香
中药材化学成分是其质量优劣和药理活性的物质基础[24-25]。本研究基于UPLC-Q/TOF-MS和GC-MS并采用多元变量统计分析方法,从通体香和野生沉香中找出20个差异成分,但该20个成分均为二者的共有成分,在通体香和野生沉香中的含量存在差异。其中α-santalol等5个倍半萜和5个小分子芳香物质以及8个2-(2-苯乙基)色酮类成分在通体香中的含量均显著高于野生沉香。这可能是通体香乙醇提取物对家鸽的止呕作用[5]、对四氯化碳致小鼠急性肝损伤的保护作用[26]和改善异丙肾上腺素诱导的小鼠心肌缺血作用[7]优于野生沉香的主要原因。其中,沉香乙醇提取物可通过降低多巴胺D2和5-羟色胺2A发挥止呕作用[5]。α-santalol是多巴胺D2和5-羟色胺2A受体拮抗剂[27],而本研究发现通体香中的α-santalol比野生沉香高,可进一步解释通体香止呕作用优于野生沉香。但是通体香中其他含量较高的化学成分及其药理作用与机制还有待开展深入研究。
此外,以本研究筛选出的20个差异成分通过聚类分析可将通体香和野生沉香各自聚为一类,可见20个主要成分在通体香和野生沉香组间的差异远大于其组内差异,因此可作为通体香和野生沉香的鉴定依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部2020: 192-193.
[2] 张争, 杨云, 魏建和, 等. 白木香结香机制研究进展及其防御反应诱导结香假说 [J]. 中草药, 2010, 41(1): 156-159.
[3] Liu Y Y, Chen H Q, Yang Y,. Whole-tree agarwood-inducing technique: An efficient novel technique for producing high-quality agarwood in cultivatedtrees [J]., 2013, 18(3): 3086-3106.
[4] 李浩洋, 张宪臣, 张小花, 等. “通体结香技术”所结人工沉香的质量评价 [J]. 理化检验: 化学分册, 2017, 53(4): 470-473.
[5] 王灿红, 彭德乾, 刘洋洋, 等. 沉香醇提物对顺铂诱导家鸽呕吐的止呕作用研究 [J]. 中国现代中药, 2020, 22(10): 1611-1617.
[6] 王灿红, 王帅, 彭德乾, 等. 通体沉香醇提物对氟尿嘧啶致小鼠肝损伤的保护作用 [J]. 国际药学研究杂志, 2018, 45(3): 187-197.
[7] 王灿红, 彭德乾, 刘洋洋, 等. 沉香醇提物对大鼠气滞血瘀心肌缺血的保护作用 [J]. 药物评价研究, 2019, 42(7): 1279-1285.
[8] 刘洋洋, 王帅, 周岳, 等. “通体结香技术”所产沉香提取物对胃肠动力及胃溃疡的作用 [J]. 国际药学研究杂志, 2016, 43(6): 1076-1081.
[9] Wang C H, Wang S, Peng D Q,. Agarwood extract mitigates intestinal injury in fluorouracil-induced mice [J]., 2019, 42(7): 1112-1119.
[10] Li Y B, Sheng N, Wang L L,. Analysis of 2-(2-phenylethyl)chromones by UPLC-ESI-QTOF-MS and multivariate statistical methods in wild and cultivated agarwood [J]., 2016, 17(5): 771.
[11] 刘洋洋. 通体结香技术产沉香的质量特征研究 [D]. 北京: 北京协和医学院, 2018.
[12] Want E J, Masson P, Michopoulos F,. Global metabolic profiling of animal and human tissues via UPLC-MS [J]., 2013, 8(1): 17-32.
[13] Tsugawa H, Cajka T, Kind T,. MS-DIAL: Data-independent MS/MS deconvolution for comprehensive metabolome analysis [J]., 2015, 12(6): 523-526.
[14] Zhang J, Yang W, Li S,. An intelligentized strategy for endogenous small molecules characterization and quality evaluation of earthworm from two geographic origins by ultra-high performance HILIC/QTOF MS(E) and Progenesis QI [J]., 2016, 408(14): 3881-3890.
[15] 张倩, 霍会霞, 孙慧, 等. LC-IT-TOF-MSn快速鉴别沉香中2-(2-苯乙基)色酮类成分 [J]. 中国现代中药, 2019, 21(7): 869-877.
[16] Yang J L, Dong W H, Kong F D,. Characterization and analysis of 2-(2-phenylethyl)-chromone derivatives from agarwood () by artificial holing for different times [J]., 2016, 21(7): E911.
[17] 任德权. 中药指纹图谱质控技术的意义与作用 [J]. 中药新药与临床药理, 2001, 12(3): 135-140.
[18] 于燕乔, 史大卓, 曲华, 等. 定性研究方法在中医药领域的应用与思考[J]. 世界中医药, 2021, 16(13): 2058-2060.
[19] Naziz P S, Das R, Sen S. The scent of stress: Evidence from the unique fragrance of agarwood [J]., 2019, 10: 840.
[20] Gao X X, Xie M R, Liu S F,. Chromatographic fingerprint analysis of metabolites in natural and artificial agarwood using gas chromatography-mass spectrometry combined with chemometric methods [J]., 2014, 967: 264-273.
[21] 周亚非, 魏建和, 孙佩文, 等. 中国沉香科技创新与产业发展的现状及思考 [J]. 中国现代中药, 2017, 19(8): 1051-1056.
[22] Tan C S, Isa N M, Ismail I,. Agarwood induction: Current developments and future perspectives [J]., 2019, 10: 122.
[23] 黄俊卿, 魏建和, 张争, 等. 沉香结香方法的历史记载、现代研究及通体结香技术 [J]. 中国中药杂志, 2013, 38(3): 302-306.
[24] 张铁军, 许浚, 申秀萍, 等. 基于中药质量标志物(Q-Marker)的元胡止痛滴丸的“性-效-物”三元关系和作用机制研究 [J]. 中草药, 2016, 47(13): 2199-2211.
[25] 张萌, 封亮, 贾晓斌. 基于生物活性与效应基准的中药质量评价技术发展现状与展望[J]. 世界中医药, 2020, 15(15): 2234-2239.
[26] 王灿红, 王帅, 彭德乾, 等. 沉香醇提物对四氯化碳致小鼠急性肝损伤的保护作用 [J]. 中国现代中药, 2017, 19(8): 1091-1096.
[27] Okugawa H, Ueda R, Matsumoto K,. Effects of sesquiterpenoids from “Oriental incenses” on acetic acid-induced writhing and D2 and 5-HT2A receptors in rat brain [J]., 2000, 7(5): 417-422.
Comparative analysis of chemical constituents between the agarwood produced by Whole-tree agarwood-inducing technique and natural agarwood based on the combination of non-targeted metabolomics and fingerprint
YU Meng1, 2, HOU Wen-cheng1, FENG Jian1, CHEN Lan1, YANG Yun1, LIU Yang-yang1, 2, WEI Jian-he1, 2
1. Hainan Provincial Key Laboratory of Resources Conservation and Development of Southern Medicine & Key Laboratory of State Administration of Traditional Chinese Medicine for Agarwood Sustainable Utilization, Hainan Branch of the Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Haikou 570311, China 2. Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education & National Engineering Laboratory for Breeding of Endangered Medicinal Materials, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
To provide scientific basis for the advanced application and popularization of agarwood produced by Whole-tree agarwood-inducing technique (Agar-Wit), the compositional differences between agarwood induced by Agar-Wit and natural agarwood were analyzed and compared in the study.The ethanol extracts and volatile components of samples were analyzed by ultra-performance liquid chromatography tandem quadrupole time-of-flight mass spectrometry (UPLC-Q/TOF-MS) and gas chromatography-mass spectrometry (GC-MS) combined with non-targeted metabolomics and fingerprint in this study.The common components of agarwood induced by Agar-Wit were consistent with natural agarwood. The similarity coefficients among Agar-Wit agarwood were higher than that in natural agarwood. In addition, the content of three low-molecular-weight aromatic compounds, four kinds of sesquiterpenes and eight 2-(2-phenylethyl)chromones were richer in agarwood induced by Agar-Wit.The main chemical composition of agarwood induced by Agar-Wit, which is more stable, is proved to be in accordance with wild agarwood.
agarwood; whole-tree agarwood-inducing technique (Agar-Wit); wild agarwood; non-targeted metabolomics; fingerprint
R284.1
A
0253 - 2670(2022)18 - 5625 - 11
10.7501/j.issn.0253-2670.2022.18.005
2022-02-20
国家重点研发计划项目(2018YFC1706403);海南省自然科学基金高层次人才项目(2019RC340);现代农业产业技术体系建设专项(CARS-21);中国医学科学院医学与健康科技创新工程项目(2016-I2M-2-003);2021年国家药品标准提高课题(2021Z14)
郁 萌,硕士研究生,研究方向为沉香质量分析。E-mail: jokeryml@163.com
刘洋洋,研究员,硕士生导师,研究方向为中药质量控制技术及其应用。Tel/Fax: (0898)31589000 E-mail: eadchris@163.com
魏建和,研究员,博士生导师,研究方向为药用植物基因资源、分子育种及次生代谢产物调控研究。Tel: (010)57833016 E-mail: wjianh@263.net
[责任编辑 王文倩]
