一株γ-聚谷氨酸高产菌株的筛选鉴定及发酵培养基优化
2022-09-19张必松陈宇航薛慧欣张翊姿朱益波
张必松,陈宇航,张 璐,薛慧欣,张翊姿,朱益波
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
0 引言
γ-聚谷氨酸(γ-PGA)是一种通过微生物将D型和L型谷氨酸单体缩合形成的生物兼容高分子聚合物[1].其分子量在10~10 000 KDa,最早发现于炭疽杆菌的荚膜组成成分[2].因为γ-PGA分子量不同会呈现不同的特点,从而展现优异的吸水性、保湿性、生物相容性及可降解性等性质,被广泛应用于化妆品、食品、药物载体、环境保护、农业菌肥等行业[3-5].因微生物发酵法相较于其他方法具有生产周期短、反应条件温和、环境污染小及产量高等优点[6-7],工业上广泛应用其生产γ-PGA.迄今为止多数生产γ-PGA的菌株均属于芽孢杆菌,依照是否利用谷氨酸作为前体,分为谷氨酸非依赖型和依赖型[8].谷氨酸依赖型菌株(例如Bacillus lichensATCC 9945a,Bacillus subtilisN-2)需要向培养基中添加L-谷氨酸或其前体来提高γ-PGA产量[9-10].非谷氨酸依赖型菌株如Bacillus methylis nutritionSK19.001和Bacillus licheniformisPGA-N可以利用无谷氨酸的培养基生产γ-PGA[11-12].虽然该类菌株可以缩减原料成本,但因其产量低且提升空间小的缺点,而较少被应用于大规模生产.除了生产菌株,培养基成本也是制约γ-PGA工业化生产的重要影响因素.目前工业生产γ-PGA高成本的主要原因是原材料和产物回收过程的成本居高不下,而原材料成本甚至达到了生产成本的60%[13].综上所述,要实现γ-PGA的大规模工业生产,必须要有优良的生产菌株以及搭配合理的低成本培养基.本研究旨在从发酵大豆产品中筛选获得γ-PGA高产菌株,并利用响应面法预测最佳发酵培养基以提高γ-PGA的产量.
1 材料与方法
1.1 材料
1.1.1 样品来源
(1)12种不同品名或产商的发酵豆制品均从常熟理工学院东湖校区超市及电商平台购买.
(2)γ-PGA标品(分子量700 KDa)由上海蓝嫣化妆品有限公司提供.
1.1.2 培养基
LB ( Luria-Bertani ) 培养基:酵母提取物5 g/L、胰蛋白胨10 g/L、氯化钠10 g/L,pH 7.4.
种子培养基:丙三醇20 g/L、氯化铵 10 g/L、七水硫酸镁5 g/L、L-谷氨酸10 g/L、酵母提取物10 g/L、磷酸氢二钾 2 g/L,pH 7.4.
初始发酵培养基:柠檬酸12 g/L、L-谷氨酸20 g/L、丙三醇80 g/L、氯化铵7 g/L、磷酸二氢钾 0.5 g/L、一水合硫酸锰 0.1 g/L、七水硫酸镁 0.5 g/L、氯化钙 0.15 g/L、六水三氯化铁0.04 g/L,pH 7.4.
以上培养基成分误差均控制在±0.01 g以内且培养基以121 ℃灭菌20 min后待用.
1.1.3 材料与试剂
腐乳、磷酸氢二钾、谷氨酸钠、酵母提取物、柠檬酸、氯化铵、氯化钠、磷酸二氢钾、七水硫酸镁、L-谷氨酸、MnSO4·H2O、酵母提取物、琼脂粉、氯化钙、氢氧化钠、丙三醇、六水三氯化铁、胰蛋白胨、浓硫酸、盐酸、十六烷基三甲基溴化铵、薄层色谱板、DNA抽提试剂盒(上海生工生物工程有限公司)、8 000~14 000 Da透析袋(美国联合碳化物公司)、KOD预混酶(爱必梦生物科技有限公司)、Gyra及16S rRNA引物(苏州金唯智生物科技有限公司).
1.1.4 仪器与设备
恒温水浴锅、冷冻干燥机、电子天平、离心机、pH计、恒温培养箱、往复式摇床、立式灭菌锅、722分光光度计.
1.2 方法
1.2.1 菌种筛选
参考Sui and Engineering[14]的方法,称取2 g发酵豆制品于100 mL无菌蒸馏水中煮沸5 min,杀灭细胞营养体.静置沉淀后取1 mL上清液于50 mL LB培养基中,220 r/min,30 ℃,培养24 h,10-4倍梯度稀释后在LB固体培养基上均匀涂布100 μL培养液,30 ℃培养24 h.将具有湿润光滑表面且挑起拉丝的单个菌落接种到种子培养基中,220 r/min,30 ℃培养20 h.然后在发酵培养基中接种6%(v/v)的种子液,220 r/min,30 ℃培养48 h.测定发酵液中γ-PGA产量并斜面保存产量最大的菌株.
1.2.2 分析方法
1.2.2.1 产物分离纯化
取一定量的发酵液并用6 mol/L HCl将pH调至4.0,离心机程序为12 000 r/min条件下离心5 min除去菌体沉淀;使用6 mol/L NaOH将上清液pH调至7.0后加入3倍体积预冷乙醇,混匀后于4 ℃醇沉过夜(10 h);在相同条件下离心,保留产物沉淀并静置直至残留乙醇完全挥发;再将沉淀溶解于适量蒸馏水后,使用8 000~14 000 Da的透析袋于蒸馏水中过夜透析[15-16],并将透析液在 -42 ℃条件下冷冻干燥24 h后得到高纯度γ-PGA.
1.2.2.2 产量测定方法
利用十六烷基三甲基溴化铵(CTAB)比色法快速检测γ-PGA的产量[17-18].
1.2.2.3 产物鉴定
参照Song[19]的方法对产物进行鉴定.使用蒸馏水溶解纯化后的γ-PGA,加入等体积浓硫酸,密封后于高压灭菌锅中121 ℃加热2.5 h水解γ-PGA.待冷却至室温后加入6 mol/L NaOH调pH至7.4.将γ-PGA标品进行相同处理,用薄层层析法分析其成分,以L-谷氨酸为对照,将正丁醇、蒸馏水、乙酸作为展开剂,体积比依次为3∶1∶1.
1.2.3 菌种鉴定
(1)菌落形态和革兰氏染色鉴定
按照微生物生物学实验教程的方法[20],将菌种划线接种于LB固体培养基后倒置于37 ℃培养箱中培养并记录其菌落形态,使用革兰氏经典染色法对目的菌株菌种染色并用油镜观察.
(2)系统发育分析
参照高阳[21]及Vet[22]的方法,取5 mL新鲜培养液,于10 000 r/min 离心2 min后收集细胞沉淀物,用细菌基因组提取试剂盒对Bacillus amyloliquefaciensYB-9菌株提取基因组DNA,然后对该菌株16S rRNA和gyrA基因进行扩增、测序和比对.扩增引物为通用引物,对27F和1492R及GyrAF(5'-GAGGGATAGCGGTTAGATGAGC-3')和GyrAR(5'-CCGTTCACCAGCAGGTTAGG-3')分别扩增细菌的16S rRNA及gyrA基因.
16S rRNA 反应体系:50 µL,包括 KOD 预混酶 20 µL、上下游引物各 2 µL、模板 DNA 2 µL、H2O 24 µL.PCR 扩增程序为:94 ℃ 3 min;94 ℃ 30 s;58 ℃ 30 s;72 ℃ 1 min 30 s;循环 35 次;72 ℃ 5 min.
gyrA 扩增反应体系:50 µL, Phanta Max Master预混酶 20 µL、模板 DNA 2 µL、上下游引物各 2 µL、H2O 24 µL.PCR 扩增程序为:94 ℃ 3 min;94 ℃ 30 s;58 ℃ 30 s;72 ℃ 1 min;35 个循环;72 ℃ 5 min.
用1%(m/v)的琼脂糖凝胶电泳检测扩增产物.将PCR产物切胶回收后,委托苏州金唯智生物科技有限公司完成 16S rRNA和gyrA基因测序.结果用DNA star进行拼接,并上传到NCBI数据库中执行核苷酸序列Blast,再使用MEGA 7软件NJ(Neighbour Joining)方法构建系统发育树.
1.3 发酵培养基优化
1.3.1 单因素试验
以γ-PGA产量为指标优化碳源、氮源、底物和无机盐.分别选择可溶性淀粉、蔗糖、葡萄糖、麦芽糖、丙三醇、甘蔗和糖蜜代替初始培养基中的丙三醇作为碳源,在获得最优碳源后优化碳源浓度.选取5种有机氮源:黄豆粉、豆粕粉、胰蛋白胨、酵母提取物、牛肉膏和4种无机氮源:氯化铵、硫酸铵、柠檬酸铵、尿素代替初始培养基中的氯化铵作为氮源,得到最优氮源后对其质量浓度进行优化.对底物 L- 谷氨酸和谷氨酸钠进行优化,梯度依次为:5,10,15,20,25,30,35 g/L.对柠檬酸的浓度进行优化,选取梯度依次为0,3,6,9,12,15 g/L.通过比较磷酸二氢钾、七水硫酸镁、一水合硫酸锰、氯化钙、六水三氯化铁、氯化锌、七水硫酸亚铁对γ-PGA产量的影响,选出影响最显著的金属离子.
1.3.2 PB实验设计
在单因素优化试验的基础上,通过选择尿素、甘油、柠檬酸、谷氨酸、酵母提取物、七水硫酸镁、磷酸二氢钾、氯化钙、FeCl3这9个参数进行了N为12的PB实验设计,各个参数应用高(+)低(-)两个水平(表1).
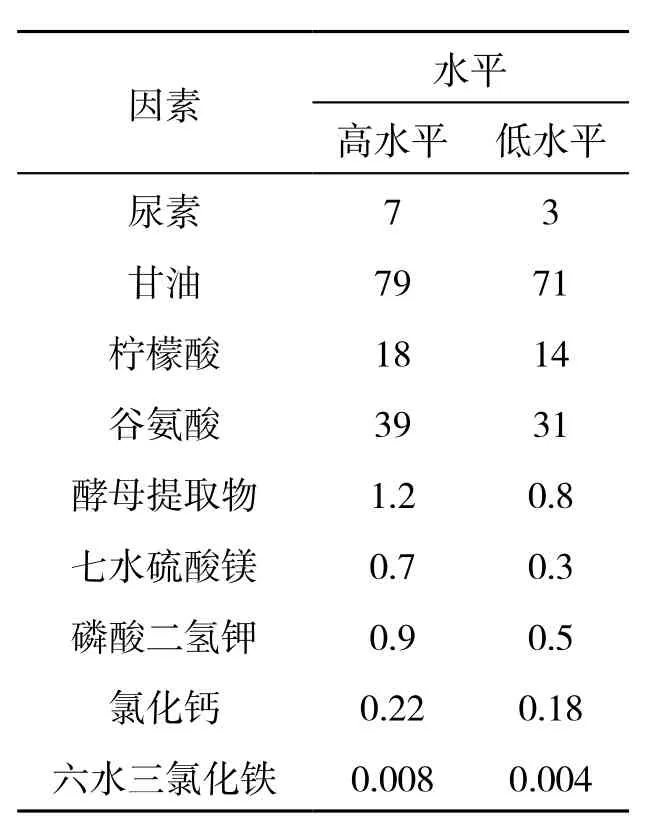
表1 PB实验设计表 单位:(g·L-1)
1.3.3 最陡爬坡试验
按照PB试验结果获得对γ-PGA产量影响最为明显的3个因素,并依照其正效应和负效应来设计步长长短及变动方向,迅速达到最佳响应区域.根据PB实验中估计值对产量的正或负影响选取高低水平.
1.3.4 BBK(Box-Behnken)设计
根据PB试验和最陡爬坡试验的分析结果确定的3个因素,设置γ-PGA的产量为响应值且每个因子的3个水平用(-1, 0, +1)编码,每个测试点平行3次,其他因素按照PB试验的分析结果确定.表现出积极影响的因素采用高水平,表现出消极影响的因素采用低水平.BBK试验设计的因素及水平见表2.
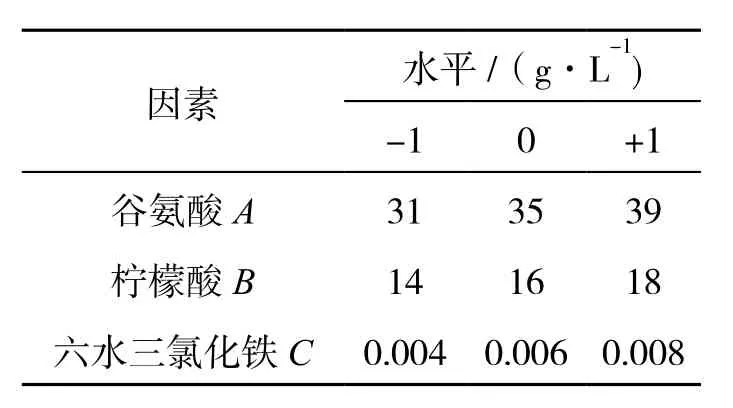
表2 Box-Behnken 试验因素水平
2 结果与分析
2.1 菌株的鉴定
2.1.1 菌落及细胞形态
经过筛选和分离,由不同的发酵豆制品中分离出10株γ-PGA生产菌株,表现最优的为编号YB-9的菌株.其在种子培养基上生长旺盛,并且菌落随培养时间表现出不同的形状:培养9 h时,菌落开始形成,形态类似水滴,表层光滑透明,呈圆形或椭圆形,挑起拉丝,见图1(a).培养24 h时,菌落表面变成白色,中间突起形成包含黏液的囊泡,周围褶皱,在培养过程中少量菌落囊泡破裂,囊泡中的无色黏液滴落,见图1(b).
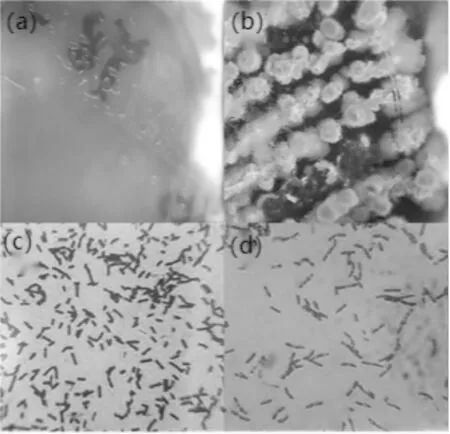
图1 (a)9 h时菌落形态;(b)24 h时菌落形态;(c)9 h时革兰氏染色;(d)24 h时革兰氏染色
对培养9 h和24 h的细菌用革兰氏染色法进行染色和观察,通过油镜可以观察到:培养9 h的细菌单体为杆状,呈紫色,见图1(c).可以初步判定 YB-9 为革兰氏阳性杆菌;培养24 h的细菌出现前芽孢,见图1(d),可以判定 YB-9 为芽孢杆菌.
2.1.2 YB-9的系统发生树分析
将YB-9的16S rRNA和gyrA基因序列上传至NCBI进行BLAST序列比对和分析,使用MEGA7.0软件构建系统发生树,如图2所示.从YB-9的16S rRNA和gyrA基因的系统发生树可知,YB-9与解淀粉芽孢杆菌相似度最高,并且和菌株Bacillus amyloliquefaciensstrain MPA 1034的相似性达到了100%.结合YB-9的形态特征可以确定其为解淀粉芽孢杆菌.

图2 YB-9的系统发生树
2.2 发酵产物分析
按照1.2.2.3的方法对纯化产物的水解液进行薄层色谱分析,以γ-PGA标品和L-谷氨酸为对照.结果表明,纯化产物水解液中主要是L-谷氨酸,与γ-PGA标品水解产物层析图谱一致,并且与L-谷氨酸的相对迁移率相同(图3).考虑到γ-PGA为L-谷氨酸均聚物,基于以上结果,可初步判断YB-9发酵液纯化产物为γ-PGA.
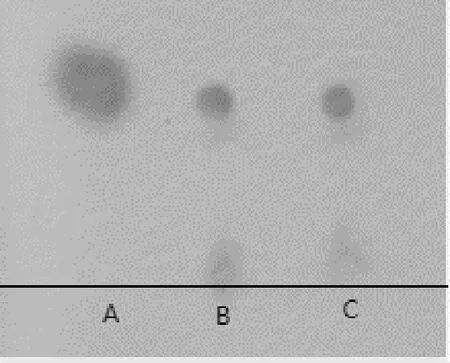
图3 水解产物薄层色谱图
2.3 培养基成分优化
2.3.1 单因素优化
在单因素试验中,经过比较6种碳源对菌株产γ-PGA的作用大小,得到最优碳源为甘油,最适浓度是75 g/L(图4).
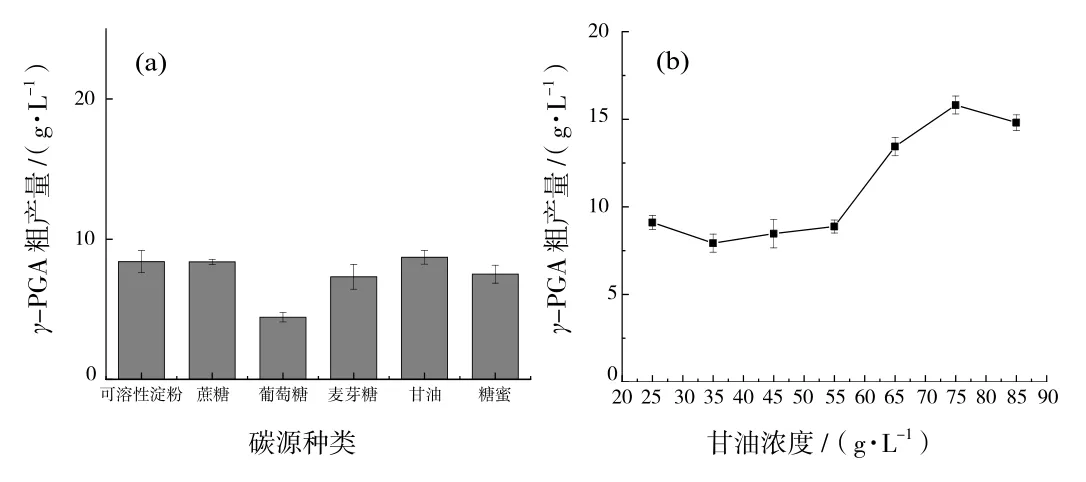
图4 碳源对γ-PGA产量的影响
选择了5种有机氮源和4种无机氮源进行实验,最佳的有机氮源为酵母提取物,无机氮源为尿素,尿素和酵母提取物的最适浓度分别为5 g/L和1 g/L(图5).由图5(c)还可以看出YB-9的生物量随着酵母提取物浓度的增加而增大,且γ-PGA的产量达到最大前的变化趋势与YB-9的生物量变化趋势一致.可以推测酵母提取物应该是通过促进YB-9的生长进而影响γ-PGA生产的.由图6(a)可见,对γ-PGA产量促进作用较大的底物是谷氨酸,其最佳浓度为35 g/L.由图6(b)可以看出,当发酵培养基不含柠檬酸时,γ-PGA产量处于一个很低的水平,并且随着柠檬酸含量的增多,γ-PGA产量呈抛物线变化的趋势,在浓度为12 g/L时上升到峰值.
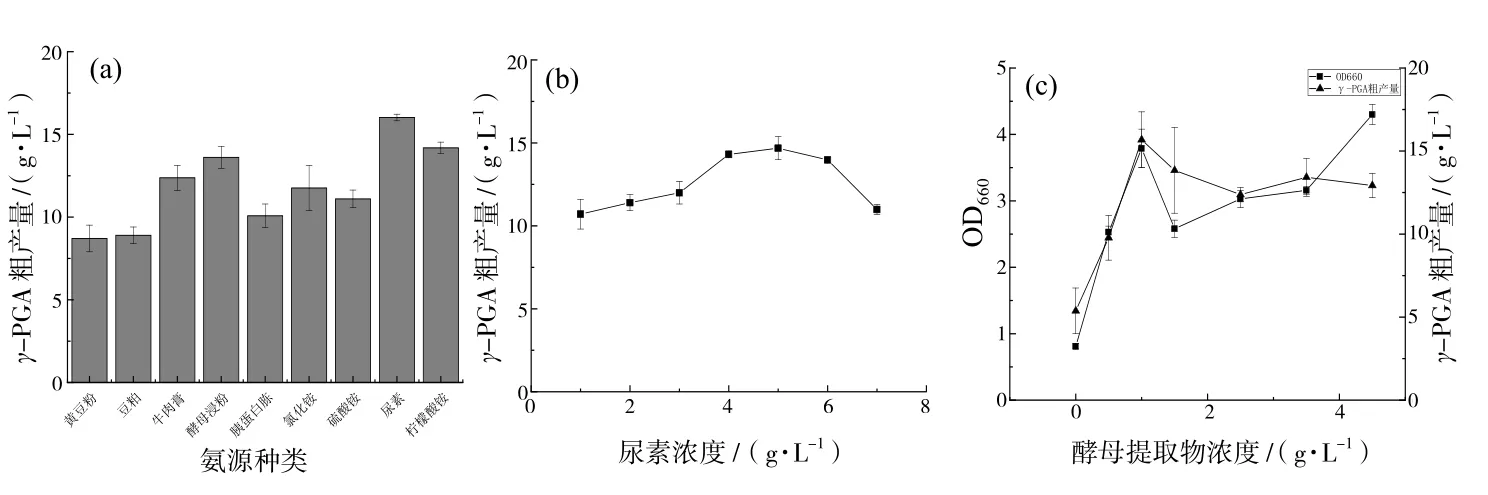
图5 氮源对γ-PGA产量的影响
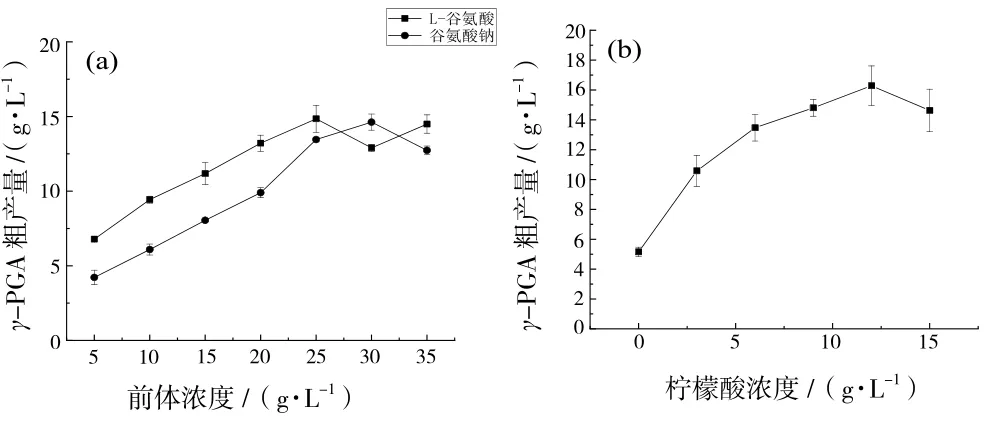
图6 前体及柠檬酸对γ-PGA产量的影响
2.3.2 Plackett-Burman试验结果
在单因素优化试验的基础上,通过Design Expert 10.0.4软件对尿素、甘油、柠檬酸、谷氨酸、酵母提取物、七水硫酸镁、磷酸二氢钾、氯化钙、FeCl3这9个参数进行了N为12的PB实验设计,结果如表3所示.对表3的数据进行方差分析结果表明模型的P值远小于0.01(表4),说明该模型影响十分显著.谷氨酸浓度、柠檬酸浓度和六水三氯化铁浓度3个因素通过F检验后P值均小于0.01,说明该3个因素对YB-9产生γ-PGA的影响最为显著,其影响大小顺序为:谷氨酸>柠檬酸>六水三氯化铁,因此选取这3个因素作为显著影响因素.此外,由表3还能看出谷氨酸和柠檬酸呈现正效应,六水三氯化铁呈现负效应.
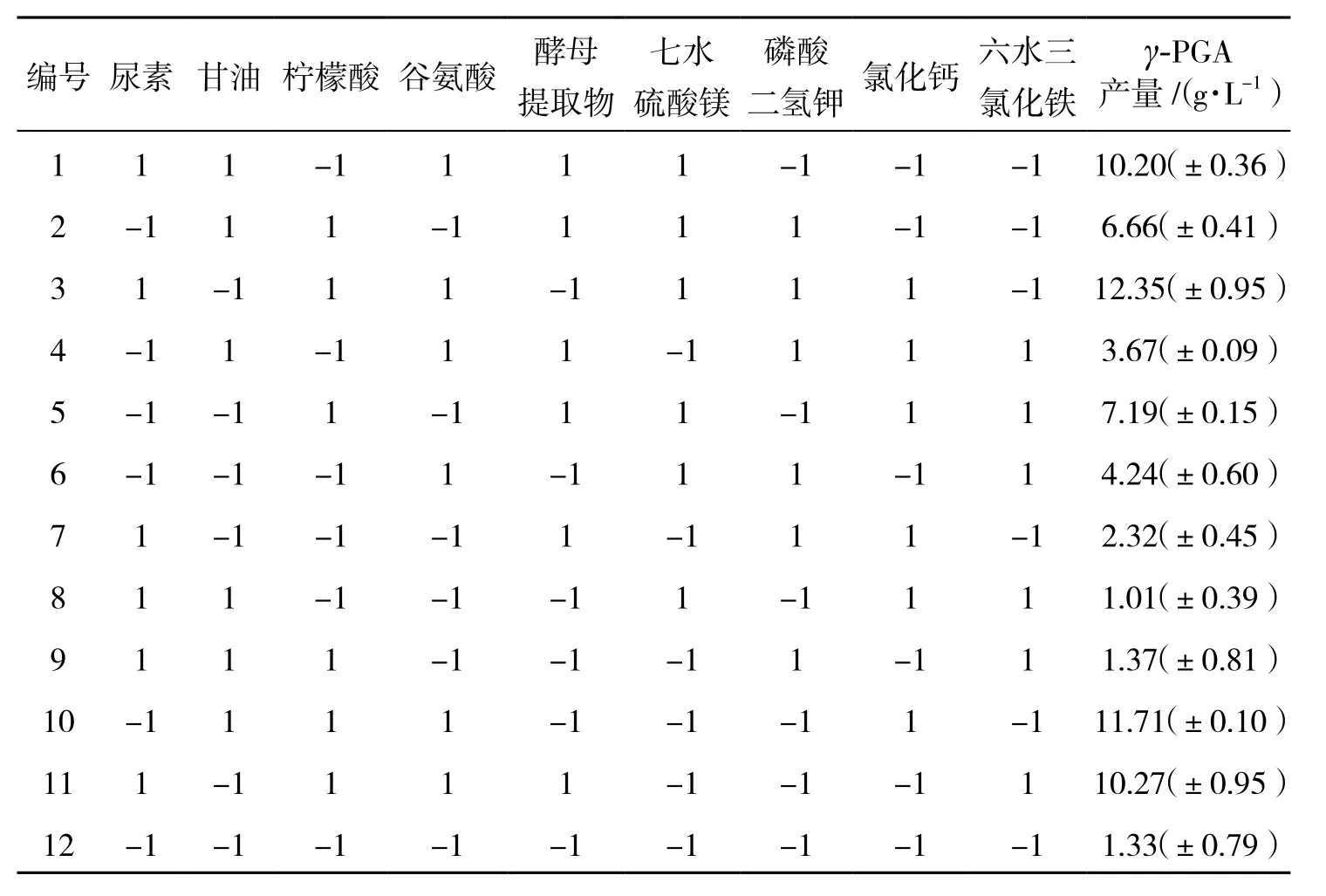
表3 Plackett-Burman 试验设计及结果
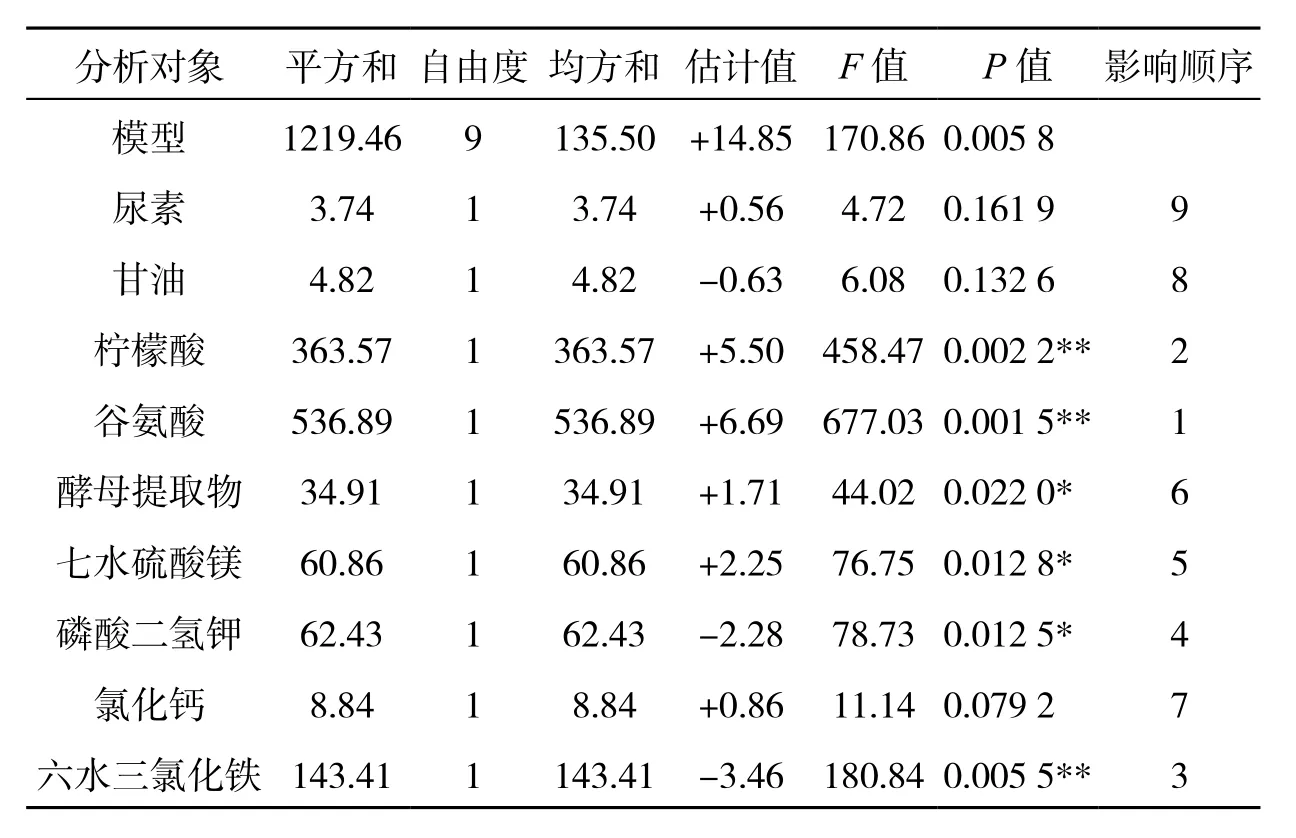
表4 Plackett-Burman 试验的方差回归模型分析
2.3.3 最陡爬坡试验结果
基于 PB 试验的结果,选择谷氨酸、柠檬酸、六水三氯化铁作为最陡爬坡试验的3个因素.依据谷氨酸、柠檬酸、六水三氯化铁三因素估计值中的正负符号来确定各因素的步长以及方向,然后通过最陡爬坡试验确定中心点.具体试验设计和结果见表5.γ-PGA的产量随着3个显著因子谷氨酸、柠檬酸、六水三氯化铁的变化出现类抛物线趋势,在第3组试验时出现峰值,因此选取谷氨酸、柠檬酸、六水三氯化铁的浓度分别为 35,16,0.006 g/L 作为 BBK 试验设计的中心点.
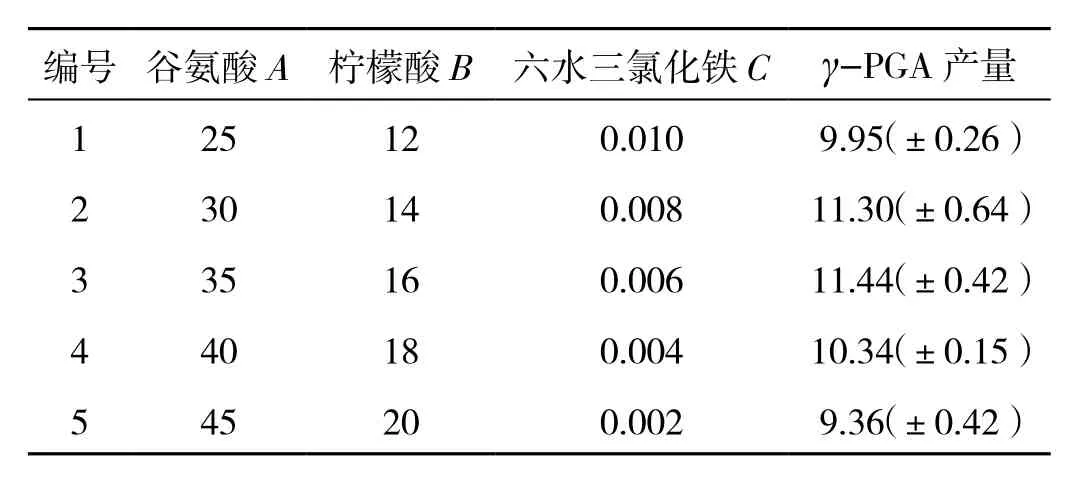
表5 最陡爬坡试验设计结果 单位:(g·L-1)
2.3.4 BBK Design 试验结果
试验结果见表6、表7.根据表7可知,模型F值为 255.37(P>0.000 1),试验误差很小,失拟项的F值为5.22(P=0.720>0.01),说明回归模型显著.综上,该实验模型可用于预测γ-PGA最大产量.通过Design Expert 10.0.4对表6中的测试数据执行二次多项式回归拟合后获得以下方程式:Y=18.69+1.3A-0.36B-0.2C-3.15AB-1.52AC+1.27BC-6.5A2-7.02B2-6.02C2.式中:Y为γ-PGA 产量(g/L);A为L-谷氨酸浓度(g/L);B为柠檬酸浓度(g/L);C为六水三氯化铁浓度(g/L).
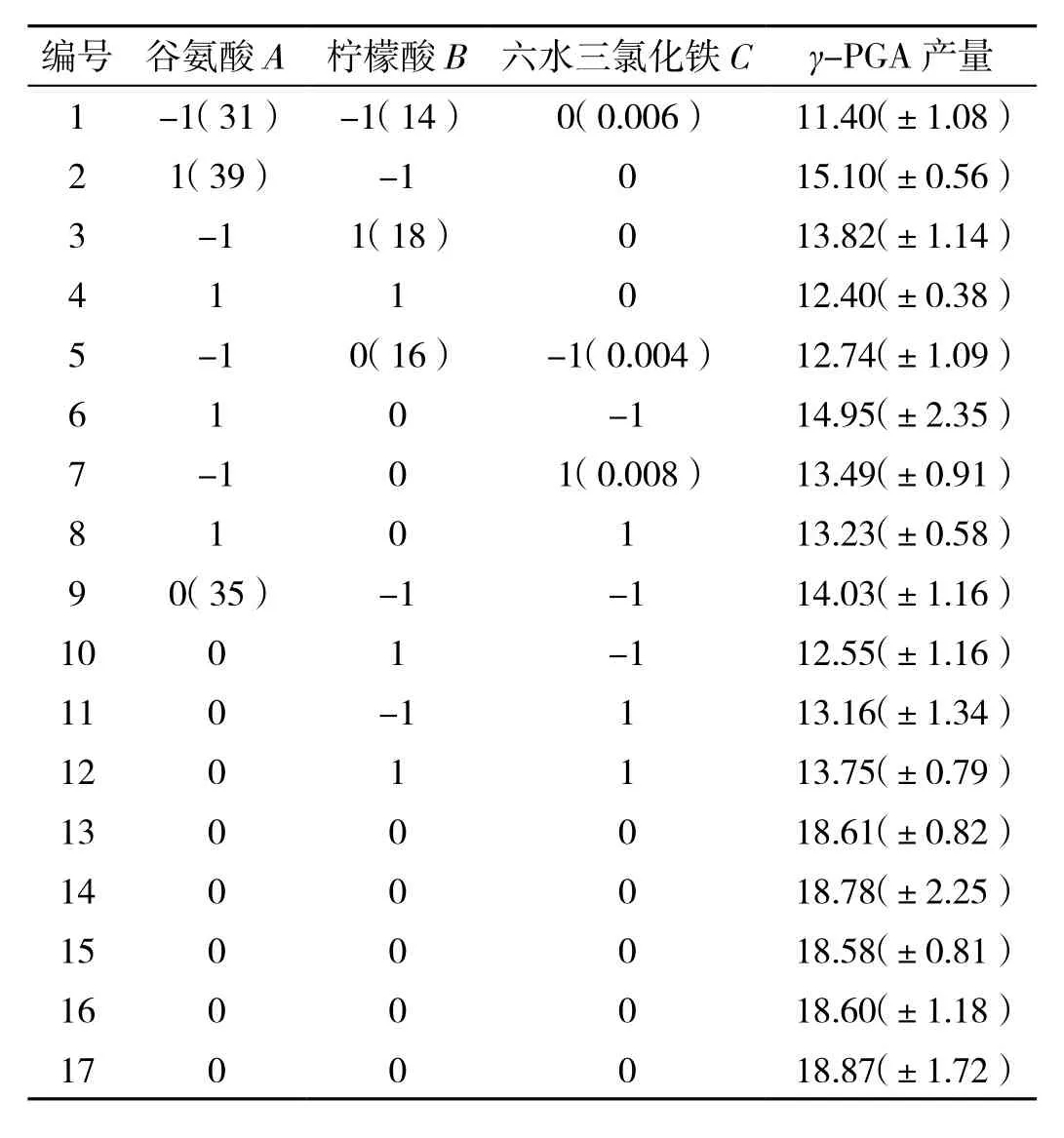
表6 Box-Behnken Design 试验设计与结果 单位:(g·L-1)
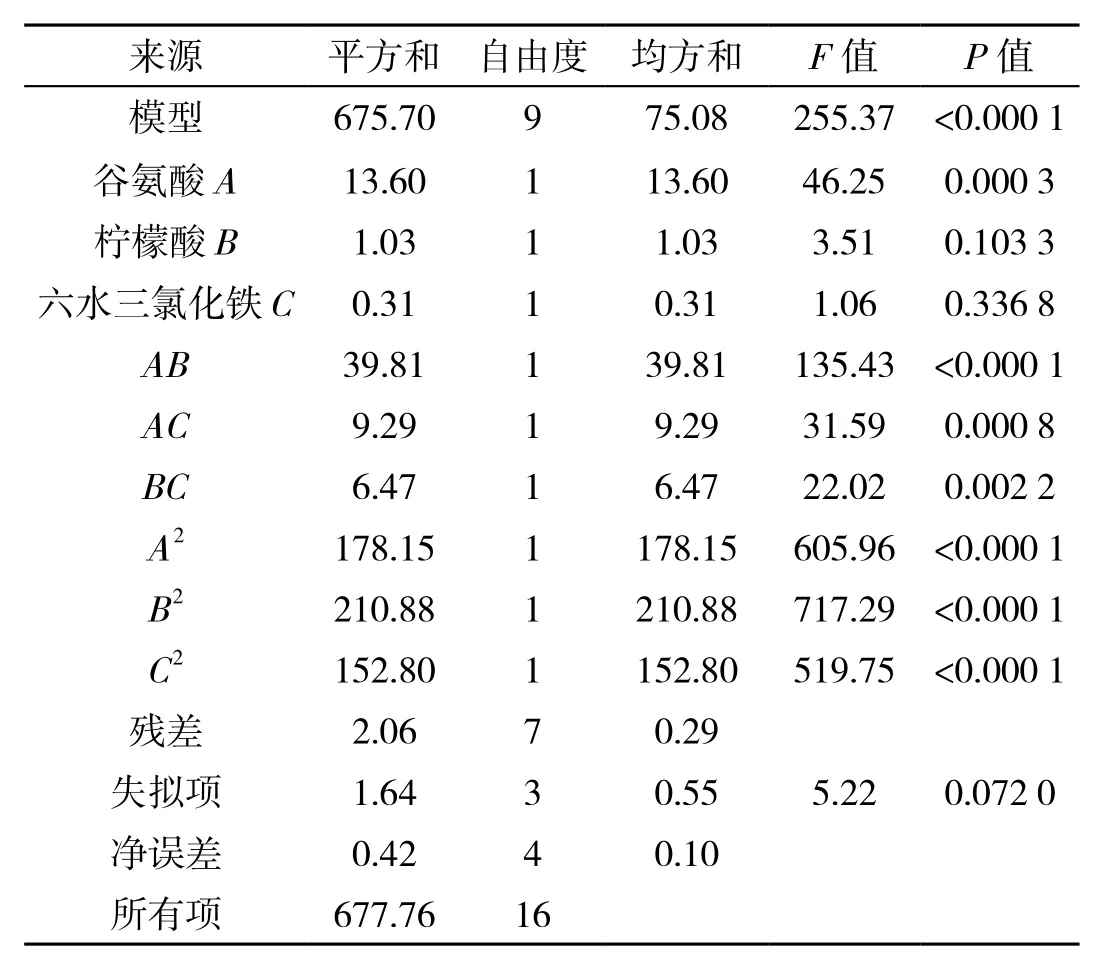
表7 方差回归模型分析
2.4 最优条件的预测及验证
使用Design-Expert 10.0.4 根据回归方程得出相对应的等高线、响应面图.若等高线的形状越类似于椭圆形,那么相应的两个因素的相互作用就越显著,反之越不显著;响应表面的三维图坡度越陡,影响越大,反之越小.
由图7~图9知:柠檬酸浓度和谷氨酸浓度之间的相互作用对 YB-9产生γ-PGA 的影响最为显著;谷氨酸和六水三氯化铁浓度的交互作用、柠檬酸浓度和六水三氯化铁浓度的交互作用依次降低.在一定范围内,γ-PGA的产量随着各因素浓度的增大呈抛物线趋势.由响应面模型能够观察到,3个因素之间彼此相互影响,表明它们之间对γ-PGA的产率是多因素共同影响而非简单的线性关系.根据二次多项回归方程运算结果得出:谷氨酸、柠檬酸和六水三氯化铁的最佳浓度分别为35.00,16.00,0.006 g/L.在上述条件下,γ-PGA 的最大预测产量为18.87 g/L.使用响应面确定的最佳培养基进行了3个平行实验,获得的γ-PGA平均产量为19.39±0.75 g/L,与预测值接近,表明该模型能较好地反映培养基成分对解淀粉芽孢杆菌YB-9产生γ-PGA的实际情况.
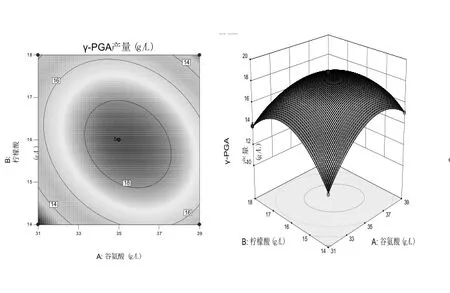
图7 谷氨酸和柠檬酸浓度对γ-PGA产量交互影响的响应面及等高线图
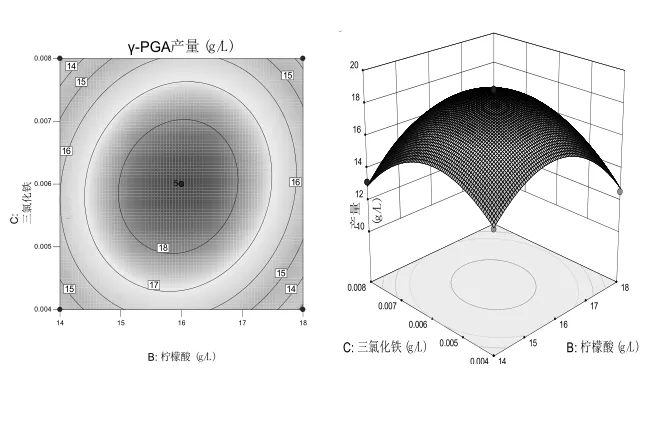
图8 六水三氯化铁和柠檬酸浓度对γ-PGA产量交互影响的响应面及等高线图
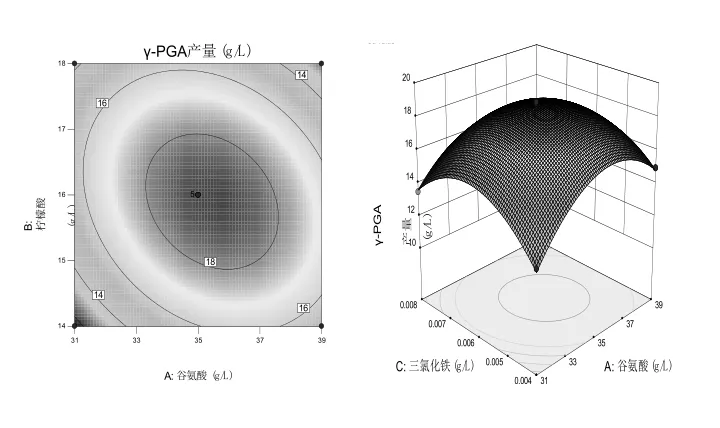
图9 六水三氯化铁和谷氨酸浓度对γ-PGA产量交互影响的响应面及等高线图
3 结语
本实验的主要目的是研究解淀粉芽孢杆菌YB-9发酵生产γ-PGA的培养基的优化.通过PB实验设计,筛选出谷氨酸、柠檬酸和六水三氯化铁的浓度对γ-PGA产量的影响最显著.然后通过最陡爬坡试验确定其浓度范围.最后经过BBK试验完成了响应面设计,得到了发酵培养基的最优配比:柠檬酸16 g/L、L-谷氨酸35 g/L、丙三醇80 g/L、尿素5 g/L、酵母提取物1 g/L、七水硫酸镁0.5 g/L、磷酸二氢钾0.5 g/L、氯化钙0.15 g/L、一水合硫酸锰 0.1 g/L、六水三氯化铁0.006 g/L,pH7.4,发酵条件220 r/min,30 ℃培养48 h,γ-PGA的产量最终为19.39±0.75 g/L,与优化前相比提高了132.25%.
