二维Ce-MOFs纳米片的合成及可见光介导脱羧氧化性能
2022-09-19李思骏邵兰兴庄金亮
李思骏,邵兰兴,冯 丽,程 琥,庄金亮
(贵州师范大学 化学与材料科学学院 贵州省功能材料化学重点实验室,贵阳 550001)
有机羧酸及其衍生物广泛存在于自然界,具有易得、价格低廉以及易于功能化等特点,是有机合成中最重要的砌块分子之一。通常,有机羧酸类化合物可以通过脱羧功能化构筑C—C键、C—卤键、C—O键、C—N键、C—S键,合成高附加值化合物[1]。对于β-含氧酸、二芳基乙酸等活泼羧酸,在无催化剂条件即可发生脱羧反应[2]。然而对于大多数非活化烷基羧酸,常规的脱羧反应需要化学计量的氧化剂、贵金属(Ag,Hg,Au,Pd,Rh等)或者过渡金属作为催化剂,限制了其大规模合成以及存在重金属离子污染等问题[3-6]。
可见光催化具有绿色、反应条件温和、选择性高、官能团兼容性强以及底物适用范围广等特点,被广泛应用于各种有机合成反应[7-10]。Ir,Ru等贵金属及其配合物是目前最常见的可见光催化剂。例如,a,b-不饱和烷基羧酸,以Ir(Ⅲ)为催化剂在可见光照射下可以发生脱羧偶联反应[11]。Tian等[12]利用Ir(Ⅲ)作为光催化剂,将烷基羧酸脱羧后与杂原子芳烃偶联,实现了杂原子芳烃一步烷基化。最近,Mashima课题组[13]报道了以Ce(Ⅵ)为光催化剂的脱羧反应,形成的自由基中间体可以在氧气作用下,发生氧化加成反应生成醛和醇。该工作不仅利用廉价易得的Ce(Ⅵ)替代Ir(Ⅲ)作为光催化剂,还利用氧气作为氧化剂将来源广泛的羧酸类化合物通过脱羧氧化成相应的醛类化合物。鉴于大多数醛类化合物通常利用相应醇类化合物的选择性催化氧化获得[14-16],该工作为制备醛类化合物开辟了新的合成路径。值得注意的是,上述反应为均相催化反应,且以四叔丁氧基铈(Ce(OtBu)4)为催化剂,存在产物需通过硅胶柱分离提纯以及催化剂难以分离重复利用等问题。如能将四叔丁氧基铈替换成更常见的铈盐(如硝酸铈铵),且将均相催化转化成异相催化,有望进一步拓展其在合成醛类化合物的应用前景。
金属-有机框架(MOFs)具有高比表面积、高孔隙率以及易于功能化等特点,是目前研究最深入、应用最广泛的异相催化剂之一[17-18]。相比于三维体相MOFs材料,二维MOFs纳米片独特的片层结构、高度暴露的催化活性位点、更短的底物/产物扩散路径,极大拓展了MOFs在异相催化领域的应用范围[19-21]。例如,林文斌和汪骋课题组[22]以1,3,5-三(4-羧基苯基)苯(H3BTB)为有机配体,以铪[Hf(Ⅵ)]为金属离子节点,合成出Hf-BTB二维纳米片。通过混合配体策略,在Hf-BTB骨架引入配位的Fe(Ⅱ),实现了烯烃硅氢加成反应,且对反马氏规则产物具有优异的选择性。此外,林文斌课题组[23]合成了一种超薄二维铈基纳米片,通过后修饰法将光催化活性物种Ru联吡啶嫁接于Ce团簇,实现了可见光催化产氢。上述MOFs二维纳米片催化剂通常作为催化活性位点的锚定基底,需利用后修饰等策略引入催化基团,从而实现MOFs二维纳米片的催化功能。由于MOFs的金属离子节点是潜在的催化活性位点,因此,选择合适的金属离子构筑MOFs纳米片即可实现MOFs的催化活性。
Mashima课题组[13]报道了Ce6-Oxo团簇具有光催化脱羧性能,受此启发,本研究分别以硝酸铈铵和H3BTB为金属盐和有机配体,利用醋酸作为调节剂,构筑二维Ce-MOFs纳米片,本工作研究了二维Ce-MOFs纳米片对各种取代基的苯乙酸光催化脱酸反应的催化性能。该方法有望为设计、合成具有高催化活性的二维MOFs纳米片提供重要参考。
1 实验材料与方法
1.1 主要原料
4′-甲基苯乙酮,氯化亚砜,分析纯,均购于上海阿拉丁生化科技股份有限公司;无水乙醇,浓硝酸,分析纯,均购于国药集团化学试剂有限公司;硝酸铈铵(Ce(NH4)2(NO3)6),N,N′-二甲基甲酰胺(DMF),冰乙酸(醋酸),对氟苯乙酸,3-氟苯乙酸,4-氯苯乙酸,3-氯苯乙酸,4-溴苯乙酸,4-三氟甲基苯乙酸,甲苯,分析纯,均购于北京伊诺凯科技有限公司;3-溴苯乙酸,4-碘苯乙酸,对甲基苯乙酸,分析纯,均购于上海普迈生物科技有限公司;二甲基亚砜(DMSO),二氯甲烷(DCM),无水甲醇,均购于成都科隆化学品有限公司;硝基苯,购于梯希爱化成工业发展有限公司;去离子水。
1.2 H3BTB有机配体的合成
H3BTB根据文献[24-25]的方法合成:产物为橙黄色粉末(6.42 g,产率62.4%)。1HNMR (400 MHz,DMSO-d6),δ: 13.16 (s, 3H),8.10~8.09 (d, 6H),8.08(s, 3H), 8.05 (d, 6H)。
1.3 Ce-BTB纳米片的合成
Ce-BTB纳米片的合成示意图,如图1所示,根据文献[23]合成:称取硝酸铈铵(117 mg, 0.21 mmol)于10 mL玻璃瓶A中,加入0.4 mL去离子水,超声溶解,置于80 ℃油浴;称取H3BTB(31.3 mg, 0.07 mmol)于10 mL玻璃瓶B中,加入1.2 mL DMF超声溶解,加入醋酸(245 mL,n[醋酸]∶n[H3BTB]=60∶1)。在搅拌条件下将B溶液滴入A溶液,并搅拌15 min。之后将溶液缓慢冷却至室温,然后重新升温至80 ℃后继续反应15 min。反应结束后,将反应液冷却至室温,离心分离(10000 r/min)Ce-BTB沉淀,DMF洗涤3次,60 ℃烘箱干燥,获得黄色粉末Ce-BTB-H60(56 mg)。反应中不添加冰醋酸获得的粉末标记为Ce-BTB-H0(50 mg)。
1.4 Ce-BTB纳米片的表征
利用X射线粉末衍射分析仪(CuKα射线源,RigakuUltimaⅣ XRD)表征所合成样品的结晶度;利用扫描电子显微镜(HITACHI S-4800)和透射电子显微镜(JEM-4800F)分析样品的形貌和晶粒尺寸;利用傅里叶变换红外光谱仪(IS5型)分析确定所合成样品的官能团结构;利用紫外光谱仪(Shimadzu UV-2450)测定样品的可见光吸收范围;利用比表面积测定仪(ASAP2460)测定样品的BET比表面积;利用气相色谱仪(GC-9160)分析不同取代基苯甲醛和苯甲醇催化氧化转化率和选择性。
1.5 Ce-BTB纳米片光催化氧化脱羧性能测试
分别依次称取Ce6-BTB(28.2 mg,5%,摩尔分数)、对氟苯乙酸(46.3 mg, 0.3 mmol)和甲苯(3 mL)于鸡心瓶中,超声分散,充入氧气密封并保持在氧气氛围中,以蓝色LED灯带(425 nm, 45 W)照射反应瓶,在室温和搅拌条件下反应至指定时间。反应结束后,离心分离催化剂,上清液加入内标(硝基苯),利用气相色谱仪(gaschromatographys,GC)检测反应液,通过计算各峰的峰面积得到对氟苯甲醛和对氟苯甲醇的转化率及选择性。
2 结果与讨论
2.1 Ce-BTB纳米片的合成及表征
以H3BTB为有机配体,以Ce(NH4)2(NO3)6为金属盐,以醋酸为调节剂,通过溶剂热法合成Ce-BTB纳米片(图1)。醋酸作为调节剂,对Ce-MOFs的形貌具有重要影响。图2(a-1),(a-2)分别为不添加醋酸调节剂合成的Ce-MOFs形貌SEM图与TEM图(标记为Ce-BTB-H0)。从图2(a-1)可以看出,无醋酸调节的Ce-BTB-H0尽管具有纳米片结构,但纳米片二维尺寸较小,且纳米片间交错团聚成5~20 μm的微米球。透射电子显微镜照片(图2(a-2))进一步表明Ce-BTB-H0深度团聚,其团聚结构的厚度使得电子束无法穿透整个微米球,导致微米球内部形貌较模糊。当合成体系中加入醋酸(用量为H3BTB有机配体物质的量的60倍),相同反应条件下,获得的Ce-MOFs(标记为Ce-BTB-H60)形貌SEM图与TEM图分别如图2(b-1),(b-2)所示。从图2(b-1)可以看出,相比高度团聚的Ce-BTB-H0,Ce-BTB-H60具有更好的分散性,且纳米的二维尺寸较大,尺寸在400~500 nm之间,且交错卷曲的纳米片之间具有较大空隙。透射电子显微镜照片(图2(b-2))清晰显示Ce-BTB-H60具有超薄的结构,其厚度大约为10 nm。将Ce-BTB-H60纳米片超声分散于乙醇溶液,可以观察到明显的丁达尔现象(图2(b-1)插图),进一步表明Ce-BTB-H60纳米片具有优异的分散性。
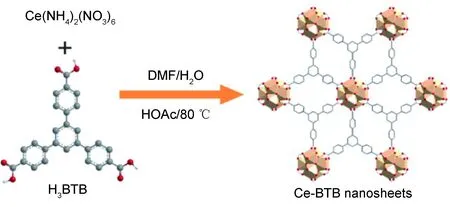
图1 醋酸辅助溶剂热合成Ce-BTB纳米片的示意图Fig.1 Scheme of acetic acid assisted solvothermal synthesis of Ce-BTB nanosheets

图2 Ce-BTB纳米片的形貌表征(a)Ce-BTB-H0纳米片;(b)Ce-BTB-H60纳米片;(1)SEM图;(2)TEM图Fig.2 Morphology characterization of Ce-BTB nanosheets(a)Ce-BTB-H0 nanosheets;(b)Ce-BTB-H60 nanosheets;(1)SEM images;(2)TEM images

图3 Ce-BTB纳米片的结构表征(a)粉末XRD图谱和单晶模拟XRD图;(b)Ce-BTB纳米片和H3BTB配体的FTIR谱图;(c)N2吸附/解吸等温线;(d)DFT法计算的孔径分布Fig.3 Structural characterization of Ce-BTB nanosheets(a)powder XRD patterns and single crystal simulated XRD pattern;(b)FTIR spectra of Ce-BTB nanosheets and H3BTB ligands;(c)N2 adsorption/desorption isotherms;(d)pore size distribution calculated by DFT method
紫外可见漫反射光谱(UV-Vis DRS,图4(a))表明Ce-BTB-H0和Ce-BTB-H60纳米片在400~500 nm可见光区均具有一定的吸光性能。由Tauc方程[27]可以计算相应的禁带宽度:
(αhν)0.5=k(hν-Eg)
(1)
式中:α为光吸收系数,cm-1;h为普朗克常数,eV·s;k为常数;ν为光频率,Hz;Eg为带隙宽度,eV。计算结果表明Ce-BTB-H0和Ce-BTB-H60的禁带宽度分别为2.89 eV和2.93 eV(图4(b))。
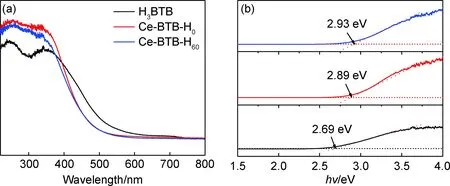
图4 H3BTB配体和Ce-BTB纳米片的结构表征 (a)紫外-可见漫反射光谱;(b)(αhν)2-hν光谱Fig.4 Structural characterization of H3BTB ligands and Ce-BTB nanosheets(a)UV-Vis diffuse reflectance spectroscopy;(b)(αhν)2-hν spectra
2.2 Ce-BTB纳米片的可见光介导脱羧氧化性能
为了测试Ce-BTB纳米片可见光催化性能,以对氟苯乙酸(标记为A)脱羧氧化生成对氟苯甲醛(标记为B)和对氟苯甲醇(标记为C)为模型反应[13],催化结果如表1所示,当底物对氟苯乙酸为0.3 mmol,甲苯为溶剂(3 mL), Ce-BTB-H60纳米片用量为28.2 mg(以[Ce6(μ3-O)4(μ3-OH)4(μ-OH)6(μ-H2O)6(BTB)2]分子式计算,相对于底物物质的量的5%,摩尔分数),在氧气氛围室温条件下,以45 W蓝光灯照射3 h,发现底物完全转化,生成的对氟苯甲醛和对氟苯甲醇的选择性分别为88%和12%(Entry 1)。对照实验表明,当反应体系不含有Ce-BTB-H60纳米片(Entry 2)或者无光照时(Entry 3),对氟苯乙酸均不发生反应,证明Ce-BTB-H60纳米片是光活性催化物种。将氧气替换为氮气(Entry 4),对氟苯乙酸也未发生反应,表明氧气是对氟苯乙酸氧化脱羧生成醛和醇的必要条件。当反应在敞口瓶中进行(以空气为氧化剂),反应3 h后对氟苯乙酸转化率高达92%(Entry 5),且对产物的选择性几乎与氧气氛围时一致,表明该反应具有较高的实际应用价值。将Ce-BTB-H60纳米片替换成Ce(NH4)2(NO3)6金属盐(相对于底物物质的量的5%)或者H3BTB有机配体(相对于底物物质的量的5%),相同条件下,对氟苯乙酸未发生反应(Entry 6,7),表明单独的Ce(Ⅳ)或者H3BTB均无法催化该反应,进一步证明Ce-BTB二维MOFs纳米片是该反应的光催化活性物质。此外,还发现Ce-BTB-H0纳米片在相同反应条件下,对氟苯乙酸的转化率仅为80%(Entry 8)。从Mashima等[13]的工作可知,Ce6-O团簇是羧酸脱羧氧化的催化活性物种。从XRD(图3(a))和BET(图3(c))分析结果可知,相比于Ce-BTB-H0纳米片,Ce-BTB-H60具有更高的结晶度和比表面积,表明Ce-BTB-H60孔道更加有序以及易于暴露的Ce6-O团簇有利于底物对氟苯乙酸扩散至催化活性位点。此外,从SEM和TEM图可以发现,Ce-BTB-H60具有高度分散的纳米片,相比于团聚的Ce-BTB-H0微米球,底物以及反应产物在Ce-BTB-H60纳米片具有较短的扩散路径。综上因素,在相同反应条件下,Ce-BTB-H60纳米片比Ce-BTB-H0纳米片具有更高的催化活性。

表1 在不同条件下Ce-BTB纳米片光催化对氟苯乙酸脱羧氧化性能Table 1 Photocatalytic activity of Ce-BTB nanosheets for decarboxylation oxidation of p-fluorophenylacetic acid under various conditions
为了考察Ce-BTB-H60纳米片催化对氟苯乙酸脱羧氧化反应动力学,在最优反应条件下(表1,Entry 1),检测不同时间段对氟苯乙酸的转化率(图5(a))。实验结果表明,对氟苯乙酸的脱羧氧化的转化率在3 h内随反应时间呈现线性增长。反应进行1 h时,对氟苯乙酸的转化率为38%;当反应至2 h和3 h时,对氟苯乙酸的转化率达到72%和100%。值得注意的是,在该时间段检测出的对氟苯甲醛和对氟苯甲醇的选择性基本保持不变,分别为88%和12%左右[13],表明两者是对氟苯乙酸均裂的产物。反应进行1 h后,将Ce-BTB-H60纳米片催化剂滤除,滤液在相同条件下继续反应至7 h,对氟苯乙酸的转化率并未明显增加,表明Ce-BTB-H60纳米片是异相催化剂。为了考察催化剂的循环性能,将反应后的Ce-BTB-H60离心分离,二氯甲烷洗涤烘干后用于下一轮催化反应。循环性能测试结果(图5(b))表明Ce-BTB-H60纳米片在第二次使用时,相同反应条件下,对氟苯乙酸的转化率降至86%;第三次使用时,对氟苯乙酸的转化率仅为60%。XRD结果表明使用后的Ce-BTB-H60纳米片的晶体结构未发生明显变化(图5(c))。因此,Ce-BTB-H60纳米片循环使用性能降低的可能原因是部分Ce6-O团簇与底物或者反应产物发生配位作用,简单的洗涤过程未能完全活化Ce6-O团簇。后续将重点研究Ce-BTB-H60纳米片的活化工艺(如采用极性溶剂回流),提高Ce-BTB-H60纳米循环使用性能。

图5 Ce-BTB-H60纳米片可见光催化脱羧氧化性能(a)对氟苯乙酸转化率随时间变化关系;(b)循环利用性能;(c)循环使用前后Ce-BTB-H60纳米片的XRD图Fig.5 Visible-light mediated decarboxylation oxygenation properties of Ce-BTB-H60(a)conversion curves of p-fluorophenylacetic acid versus time;(b)recycling performance;(c)XRD patterns of Ce-BTB-H60 nanosheets before and after use
为了验证Ce-BTB-H60纳米片光催化剂对脱羧底物的普适性,研究了一系列不同取代基的苯乙酸脱羧氧化反应,结果如表2所示,苯乙酸对位为—Cl,—Br,—I等卤素或者—CH3时,上述取代苯乙酸经过3 h反应均能完全转化,且相应的苯甲醛类产物的选择性在80%左右。当对位为—CF3或间位取代的苯乙酸,完全转化所需的反应时间增加到10 h或者16 h。
2.3 Ce-BTB纳米片氧化脱羧反应的催化机理
基于Ce-BTB纳米片的结构特点,结合Mashima等提出的光催化脱羧氧化机理[13],推测苯乙酸的可见光脱羧氧化的催化活性位点在Ce-BTB纳米片的[Ce6(OH)6COO6]团簇上,可能的催化机理如图6所示。首先,Ce-BTB-H60纳米片的CeⅣ-Oxo团簇(黄色)吸收光后攫取底物苯乙酸的H,自身被还原成CeⅢ-Oxo团簇(青色),苯乙酸形成羧基自由基1;1脱去一分子CO2后形成苄基自由基2,并被氧气捕获形成过氧自由基中间产物3;此后3将CeⅢ-Oxo团簇氧化成CeⅣ-Oxo团簇,而自身得到H生成过4(氢化氧甲基)苯中间体。最终,4(氢化氧甲基)苯失去一分子水,生成主要产物苯甲醛。
3 结论
(1)以硝酸铈铵和H3BTB为金属盐和有机配体,利用醋酸作为调节剂,构筑二维Ce-MOFs纳米片。醋酸对Ce-MOFs的形貌和结晶度具有显著的调节作用。无醋酸调节的Ce-BTB-H0纳米片较小且高度团聚成微米球,结晶度和比表面积(103.5 m2·g-1)均较低;醋酸调节的Ce-BTB-H60为分散的纳米片,纳米片二维尺寸较大,具有更高的结晶度和更大的比表面积(197.2 m2·g-1)。

表2 Ce-BTB-H60纳米片可见光催化不同取代基苯乙酸脱羧氧化性能Table 2 Visible-light mediated decarboxylation oxygenation of various substituted phenylacetic acids catalyzed by Ce-BTB-H60 nanosheets

图6 Ce-BTB纳米片可见光催化苯乙酸脱羧氧化机理Fig.6 Mechanism of visible light catalytic oxidation decarboxylation of Ce-BTB nanosheets
(2)经过3 h反应,Ce-BTB-H60催化对氟苯乙酸的转化率达到100%;而相同反应条件下,Ce-BTB-H0催化对氟苯乙酸的转化率仅为80%。Ce-BTB-H60更高的催化效率主要来源于其分散的纳米片结构、更高的比表面积和结晶度。
(3)Ce-BTB-H60纳米片可将各种对位和间位取代基苯乙酸高效、高选择氧化成相应的醛,但催化剂经过3次使用后,催化性降至60%,循环使用性能有待进一步提高。
(4)Ce-BTB-H60纳米片可见光催化脱羧氧化反应的机理说明CeⅣ/Ⅲ-Oxo团簇的氧化还原对是该反应的催化活性中心。
