构建高效载体OPEI 沉默TRAF6 促进骨关节炎软骨再生的研究
2022-09-19刘宏强陆艳青高宇轩王一云王传东张晓玲
刘宏强,陆艳青,高宇轩,王一云,王传东,张晓玲
1.山西大学体育学院,太原 030006;2.上海交通大学医学院附属新华医院骨科,上海 200092;3.山西医科大学第二医院骨科,太原 030001
骨关节炎(osteoarthritis,OA) 以滑膜炎症、进行性关节退变和功能丧失为特征[1-2],是导致老年人关节疼痛、生活质量恶化的主要原因。OA 关节软骨的不可逆变性仍然是尚未解决的问题。近年来,尽管干细胞修复软骨的研究取得了很大进展,但OA 病理环境仍然是软骨再生的重要障碍[3-4]。既往研究表明, 炎症细胞因子如白介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达异常是影响关节病理发展的关键因素[3,5-6],可通过上调基质金属蛋白酶(matrix metalloproteinase,MMPs),触发核因子κB(nuclear factor-κB,NF-κB)信号通路,导致细胞外基质降解[7]。因此,特异性抑制NF-κB 通路,减轻IL-1β 和TNF-α 介导的炎症反应,从而调节OA 炎症微环境,是延缓OA 治疗过程中关节软骨退化和促进软骨修复的潜在手段[8-9]。前期研究[10]表明,抑制IL-1β/NF-κB 表达可挽救间充质干细胞(软骨干细胞)的软骨再生功能。肿瘤坏死因子受体 相 关 因 子 6 (tumor necrosis factor receptorassociated factor 6,TRAF6)是连接天然免疫、促炎细胞因子和抗原受体与典型的NF-κB 途径和IL-1 信号通路的接头/支架蛋白,其重要功能是泛素化和修饰中间信号分子[11-15]。与健康人体相比,OA 患者软骨细胞中TRAF6 的mRNA 和蛋白表达增高[16]。然而,目前为止,TRAF6 在OA 中的作用以及抑制TRAF6 对间充质干细胞成软骨分化能力和凋亡的影响尚不清楚。
siRNA 由21~25 个核苷酸组成,以高度序列特异性的方式降解靶mRNA,可以特异性地抑制靶基因的表达[17]。2019 年美国食品药品监督管理局(FDA)批准了首个siRNA 衍生疗法,RNA 干扰(RNAi)介导的基因疗法逐渐从研究领域向临床应用过渡。递送siRNA材料类型有脂质、聚合物、金属、介孔二氧化硅和多孔硅;然而siRNA 在临床的应用仍然受到限制,主要是因为缺乏有效的给药系统[18]。在阳离子聚合物领域,聚乙烯亚胺(polyethylenimine,PEI)已得到广泛应用[19]。商业化的PEI25kDa作为一种经典的基因传递载体,因缺乏可生物降解的化学键(C-C 或C-N 键),细胞毒性大,不适合临床使用[20-22]。本研究在无水厌氧环境中合成了带有氨基甲酸酯键的小分子PEI 衍生物[23],使邻苯二甲醛的醛基与PEI(相对分子质量1 800)的氨基反应,形成可降解的亚胺键(-N=C-),命名为OPEI。本研究观察OPEI 的细胞毒性及其在关节滑膜中的siRNA 转染效率,探讨利用OPEI 转染TRAF6siRNA 抑制滑膜细胞中的IL-1β 信号对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成 软 骨 分化能力的影响,以期为临床OA 软骨修复提供新的治疗策略。
1 材料与方法
1.1 内侧半月板切除模型的建立
实验选用8周龄SD雄性大鼠,体质量270~300 g,购于上海斯莱克实验动物有限责任公司。动物生产许可证号为SCXK(沪)2017-0005,使用许可证号为SYXK (沪) 2017-0008。将动物随机分为OA 组(n=20) 和假手术组(n=10)。OA 组大鼠术前用100 mg/kg氯胺酮和10 mg/kg赛拉嗪麻醉,剃毛消毒,切断膝关节内侧副韧带,全层切开内侧半月板,切除半月板[24]。假手术组除半月板保持完好外,均接受相同的操作。
1.2 细胞培养和处理
1.2.1 细胞采集 原代滑膜细胞和BMSCs 取自相同来源的4周龄SD大鼠,体质量65~75 g。大鼠BMSCs取自胫骨和股骨后段的骨髓。细胞采集方法参考相关文献[25-27]。细胞培养于培养基DMEM (HyClone,美国),加入10%热灭活胎牛血清(Gibco,美国)和1%青霉素-链霉素溶液(HyClone,美国)。所有细胞均在37 ℃、含5%CO2的潮湿空气中生长,每隔3~4 d传代1次。第4代细胞用于后续分析。
1.2.2 IL-1β 刺激的原代滑膜细胞模型检测 原代滑膜细胞用IL-1β (20 ng/μL)刺激48 h 后,分别转染Lipo2000/siNC(对照组)和Lipo2000/siTRAF6(实验组)48 h,Western blotting 检测MMP13、TRAF6、t-p65、p-p65的表达并进行定量分析。
1.2.3 大鼠BMSCs 向软骨分化诱导 将大鼠的BMSCs 接种于12 孔板中,每孔接种1.5×107个细胞,37 ℃培养2 h后,在含有地塞米松(100 nmol/L)、丙酮酸钠(100µg/mL)、亚油酸(4.7µg/mL)、牛血清白蛋白(0.5 mg/mL)、抗坏血酸2-磷酸(37.5 µg/mL)、转化生长因子-β1(10 ng/mL)的培养基中培养。
1.3 OPEI及OPEI/siRNA复合物的制备
1.3.1 OPEI 的制备 反应在无水厌氧环境中进行(用高纯氮气保护)。将0.5 mmol 的邻苯二甲醛(Aladdin,中国)溶解在10 mL 无水甲醇(Sigma-Aldrich,美国)中,滴加到0.25 mmol 的PEI 1.8K(Aladdin,中国)中,溶解在10 mL 无水甲醇中。溶液室温搅拌24 h后,用减压旋转式蒸发器除去有机溶剂,残渣溶于少量离子水中,转入截留相对分子质量10 000 的透析袋中注射48 h,透析后溶液在-20 ℃下冷冻干燥48 h,得到最终的OPEI 产品,-40 ℃下存储。
1.3.2 OPEI/siRNA 复合物的制备及表征观察 将OPEI溶液以不同的质量比(m/m分别为2、3、4、5、6、7、8、9 和10),加入siRNA 溶液中以制备OPEI/siRNA 复合物,然后在室温下孵育30 min。用90Plus粒度分析仪(Brookaven Instruments,美国)测量形成的复合物的粒径和Zeta电位。使用原子力显微镜系统(多模纳米显微镜Ⅲa,DI 公司,美国)观察复合物的形态。复合物的稳定性通过琼脂糖凝胶电泳检测,以裸siRNA为对照。
1.4 细胞毒性及细胞增殖的检测
1.4.1 MTT 法检测复合物的细胞毒性 将原代大鼠滑膜细胞以1×104个/孔的密度接种于96 孔板,将2、5、10、15、20、30、50、75、100 μg/mL 的OPEI 载体或不同质量比值(2∶1~10∶1)的OPEI/siRNA 复合物加入孵育,每个浓度或质量比设置3 个复孔。孵育4 h 后,加入5 mg/mL PBS 溶解的MTT 溶液(20 μL/孔),37 ℃孵育4 h,弃去溶液,每孔加入150 μL 的DMSO,37 ℃摇动震荡10 min。酶标仪(InfinitM200 PRO,TECAN,瑞士)检测光密度[D(490 nm)],计算细胞存活率。
1.4.2 荧光法检测细胞增殖 将大鼠原代滑膜细胞以1×104个/孔接种于96孔微孔板中24 h,用不同质量比值的复合物,包括OPEI/siRNA(最佳质量比值为3∶1)和PEI25kDa/siRNA(最佳质量比值为2∶1)处理4、24、40 和48 h;裸siRNA 作为对照。在微孔板中加入PrestoBlue 试剂(Invitrogen,美国),37 ℃下孵育1 h,荧光法检测细胞增殖的变化,在激发波长570 nm和发射波长610 nm处记录荧光。
1.5 流式细胞术检测细胞凋亡及siRNA转染效率
1.5.1 检测细胞凋亡 大鼠原代滑膜细胞以1×105个/mL 的密度接种于12 孔板上,在含10%胎牛血清的DMEM 中培养24 h,用含有不同质量比值的复合物 的Opti-MEM (31985062,Life Technologies,美国)代替培养液,分别为OPEI/siRNA(最佳质量比值为3∶1)和PEI 25 kDa/siRNA(最佳质量比值为2∶1);裸siRNA 作为对照。细胞孵育4 h,收获后用1×PBS 洗涤。使用凋亡分析试剂盒(V13241,Life Technologies,美国)对细胞进行染色。采用FlowJo流式细胞仪分析软件(Tree Star,美国)进行流式细胞术分析。
1.5.2 检测siRNA 转染效率 OPEI(质量比值为3∶1) 或PEI25kDa(质量比值为2∶1) 转染siRNA(FITC标记)至大鼠原代滑膜细胞后,采用FlowJo流式细胞仪分析软件(Tree Star,美国)进行流式细胞术分析,比较2组的转染效率。
1.6 激光共聚焦及荧光显微镜观察体内外滑膜细胞的siRNA转染效率
用Cy3 荧光素标记的siRNA (GenePharma,中国)制备不同的复合物。将大鼠原代滑膜细胞以1×105个/mL 的密度种于12 孔板,培养24 h 后用不同复合物(OPEI/siRNA-Cy3 和PEI25kDa/siRNA-Cy3)以及裸siRNA-Cy3 转染细胞4 h,用Hoechst 33342 和LysotrackerTMDND-99(Invitgen,美国) 分别标记细胞核和溶酶体,用激光共聚焦显微镜(Cell Watch,ZEISS,德国)体外观察细胞转染效率。在2 月龄大鼠关节腔内分别注射OPEI/siRNA-Cy3 和PEI25kDa/siRNA-Cy3,3 d 和7 d 后处死大鼠,收集滑膜,用荧光显微镜(Nikon,日本)观察复合物体内转染效率。
1.7 实时定量PCR、免疫组织化学法及Western blotting检测
1.7.1 实时定量PCR 检测TRAF6基因 用PBS 洗涤细胞后,用TriPure 分离剂(93956520,罗氏公司,瑞士)从细胞中提取总RNA。使用Prime Script RT Master Mix cDNA 合成试剂盒(RR036A-1,Takara,日本)反转录RNA样品(1µg),获得第一链cDNA。使用SYBR PreMix Ex TaqTM(RR420a,Takara,日本)进行实时PCR,使用LightCycler 480系统(罗氏公司,瑞士)测量TRAF6基因的表达。以GAPDH为内参。所用基因引物的序列如下。TRAF6-F:5′-AGAGGAATCACTTGCACG-3′;TRAF6-R: 5′-TCTGCGTTTCCATTTTTGGCG-3′。GAPDH-F: 5′-CTCAACTACATGGTCTACATGTTCCA-3′;GAPDH-R:5′-CTTCCCATTTCTCAGCCG-3′。
1.7.2 免疫组织化学法检测TRAF6 表达 于内侧半月板切除后3 个月采集软骨和滑膜标本,固定脱钙、石蜡包埋、切片,免疫组织化学法检测TRAF6表达。
1.7.3 Western blotting 检测 细胞在裂解缓冲液(50 mmol/L Tris-HCl,pH 值7.4,150 mmol/L NaCl,0.1%SDS,1%Nonidet P-40,1 mmol/L PMSF,蛋白酶抑制剂) 中冰冻30 min。蛋白质组分在4 ℃下15 000×g离心10 min,经过10%的SDS-PAGE 电泳,转移至硝酸纤维素膜上。转移膜用5%牛血清白蛋白封闭,加入特异性抗体,在4 ℃冰箱中孵育过夜。使用增强型化学发光试剂盒(Pierce,美国),在添加辣根过氧化物酶标记的二级抗体后对蛋白质条带进行可视 化。 抗TRAF6(ab40675)、 MMP13(ab39012,Abcam)由Abcam 公 司(英 国) 提 供, 抗p65(8242S)、p-p65(3033S)、cleaved caspase 3(9664s)、caspase 3(9665S)和GAPDH(2118)由Cell Signaling Technology公司(美国)提供。
1.8 BMSCs 成软骨分化的阿尔新蓝染色及细胞凋亡检测
原代大鼠滑膜细胞与IL-1β 孵育24 h 后,分别用OPEI/siNC 和OPEI/siTRAF6 处理4 h,取上清液与BMSCs 软骨细胞分化诱导培养液混合,诱导分化10 d。细胞用4%多聚甲醛固定1 h,PBS 洗涤3 次,乙醇脱水,二甲苯洗涤,石蜡包埋、切片(5 μm)、载片。将切片脱蜡处理,并在室温下用0.1%的阿尔新蓝(Sigma-Aldrich,美国)原液孵育30 min。去除染料溶液,用蒸馏水轻轻清洗载玻片,用倒置显微镜(Eclipse TS100,尼康,日本) 观察软骨阿尔新蓝染色结果。同时采用Western blotting 检测IL-1β 刺激条件下,BMSCs 的cleaved caspase 3 表达水平,以及分别转染OPEI/siNC 和OPEI/siTRAF6 后,IL-1β 刺激下BMSCs的cleaved caspase 3表达水平。
1.9 统计学分析
采用SPSS13.0 软件进行统计学分析,数据用±s表示,组间比较采用t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 大鼠OA 模型及原代滑膜细胞中TRAF6 的表达
术后3个月,免疫组织化学检测结果显示OA组关节软骨和滑膜中TRAF6的表达明显高于假手术组(图1A)。Western blotting结果显示,在IL-1β刺激下,原代滑膜细胞中TRAF6、MMP13、TRAF6、p-p65的表达水平显著升高;与对照组(Lipo2000/siNC)相比,实验组(Lipo2000/siTRAF6)上述蛋白的表达水平随着TRAF6的沉默而显著降低(图1B~F)。
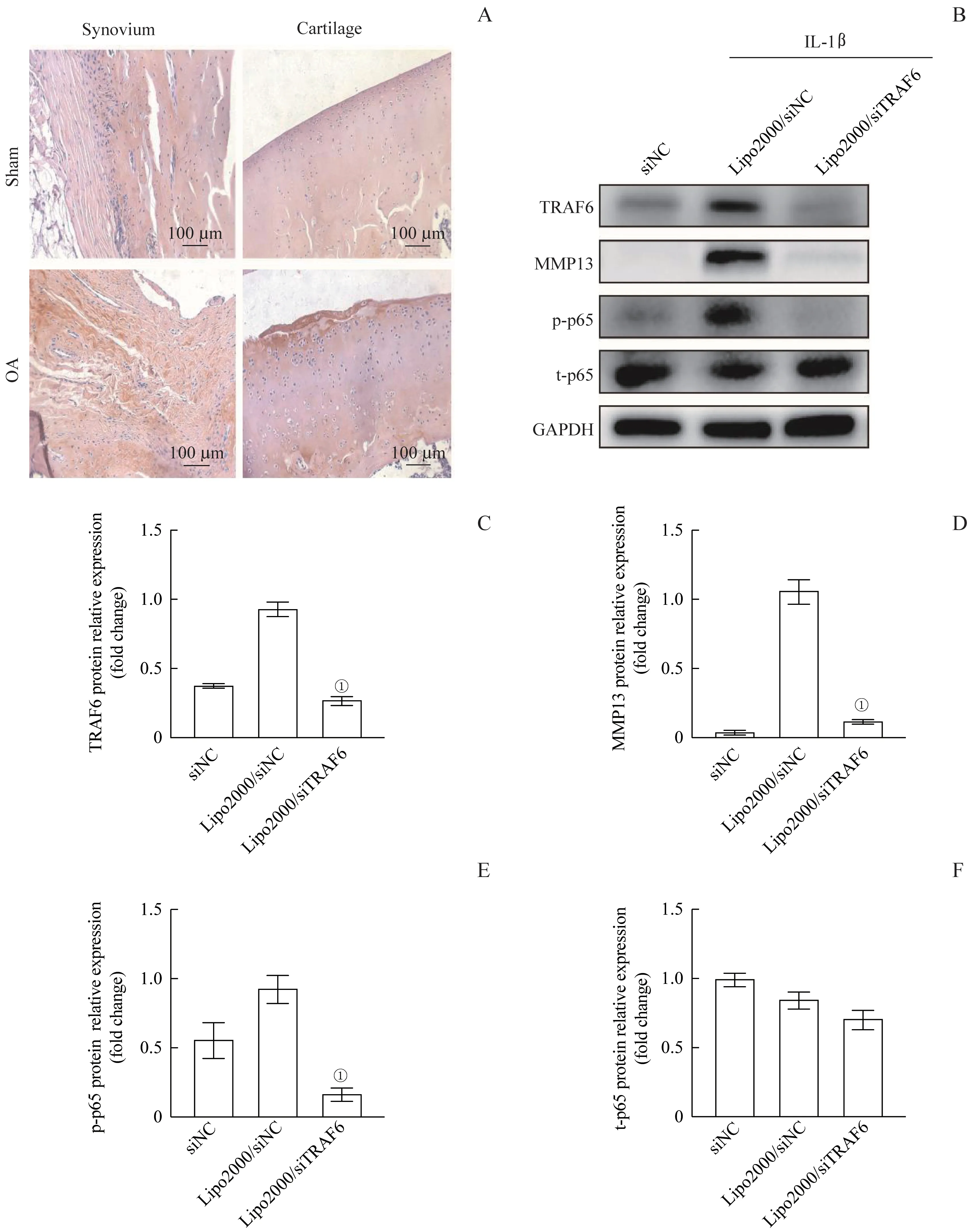
图1 大鼠OA模型及IL-1β刺激下原代滑膜细胞中TRAF6的表达Fig 1 Expression of TRAF6 in OA models and IL-1β-stimulated primary synovial cells
2.2 OPEI/siRNA复合物的表征
琼脂糖凝胶电泳结果证实质量比值≥2,OPEI 完全包裹siRNA(图2A)。用动态光散射测量形成的纳米颗粒的尺寸,当质量比值从2 增大至10 时,OPEI表现出从23 mV 到43 mV 的可变Zeta 电位(图2B)。不同质量比值的OPEI/siRNA 复合物的粒径见图2C,与OPEI/siRNA 复合物形态的透射电子显微镜分析结果一致(图2D~E)。
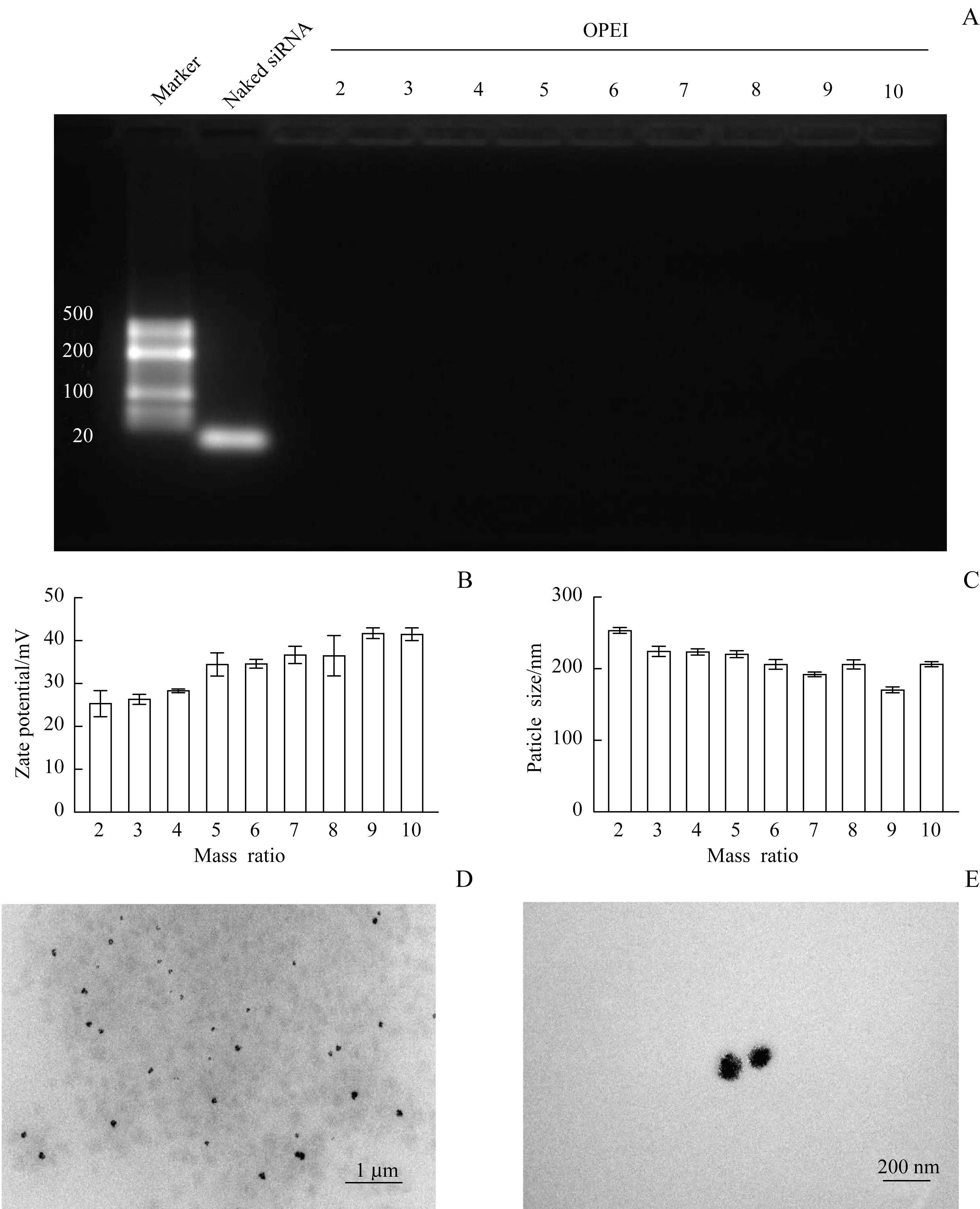
图2 OPEI/siRNA复合物的表征Fig 2 Characterization of OPEI/siRNA polyplex
2.3 OPEI/siRNA复合物的细胞毒性
在2~50 μg/mL 浓度范围内,与大鼠原代滑膜细胞孵育4 h 后,OPEI 聚合物的细胞存活率高于PEI25kDa(图3A)。在质量比值为2∶1~7∶1 时,OPEI/siRNA 复合物的细胞存活率为83.54%~93.07%,而对照组PEI25kDa/siRNA 复合物的细胞存活率为42.52%~87.26%(图3B)。细胞转染后4、24、40、48 h 检测细胞增殖情况,结果显示siRNA 对照组、OPEI 组、PEI25kDa 组细胞数均呈时间依赖性增加,但PEI25kDa组细胞增殖低于OPEI组和siRNA 对照组(P<0.05),见图3C。大鼠原代滑膜细胞与复合物孵育4 h 后的细胞凋亡分析结果显示,与PEI25kDa/siRNA 组(活细胞百分率为88.54%)相比,OPEI/siRNA 组(活细胞百分率93.5%)细胞凋亡减少(图3D),复合物诱导的细胞凋亡主要发生在转染后4 h的早期阶段(图3E~H)。
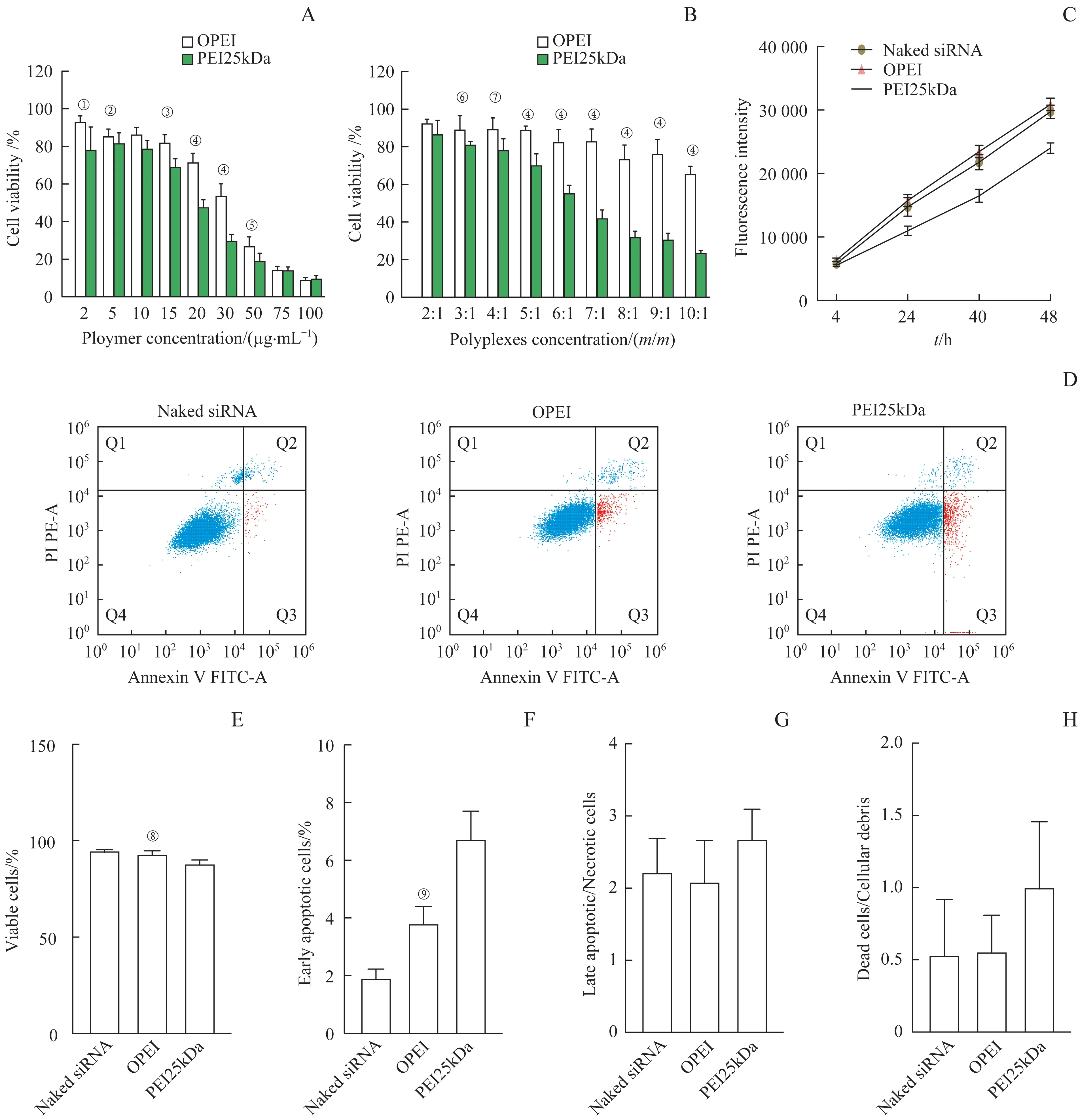
图3 OPEI和OPEI/siRNA复合物对大鼠原代滑膜细胞的生物相容性和细胞毒性Fig 3 Biocompatibility and cytotoxicity of OPEI and OPEI/siRNA polyplexes on rat primary synoviocytes
2.4 体外和体内OPEI/siRNA 复合物的细胞转染效率
OPEI(质量比值为3∶1)或PEI(质量比值为2∶1)转染siRNA到大鼠原代滑膜细胞后,比较2组的转染效率(图4A)。在OPEI/FITC-siRNA 组的最佳质量比值为3∶1 和PEI25kDa/FITC-siRNA 组的最佳质量比值为2∶1 时,转染效率分别为99.33%和97.17%。OPEI/siRNA (最佳质量比值为3∶1) 和PEI25kDa/siRNA(最佳质量比值为2∶1)与大鼠原代滑膜细胞孵育1 h 后,用共聚焦显微镜检测细胞转染状况(图4B)。溶酶体用LysotrackerTM DND-99(红色)标记,siRNA用FAM(绿色)标记,细胞核用蓝色标记。结果表明,体外OPEI/FAM-siRNA 和PEI25 kDa/FAMsiRNA 均显示大量细胞摄取siRNA。体内研究结果显示,OPEI/Cy3-siRNA和PEI25 kDa/Cy3-siRNA转染的大鼠滑膜在第3 日、第7 日均显示出高水平的siRNA转染效率(红色,图4C),而阴性对照(裸siRNA)组滑膜组织中未观察到siRNA(数据未显示)。
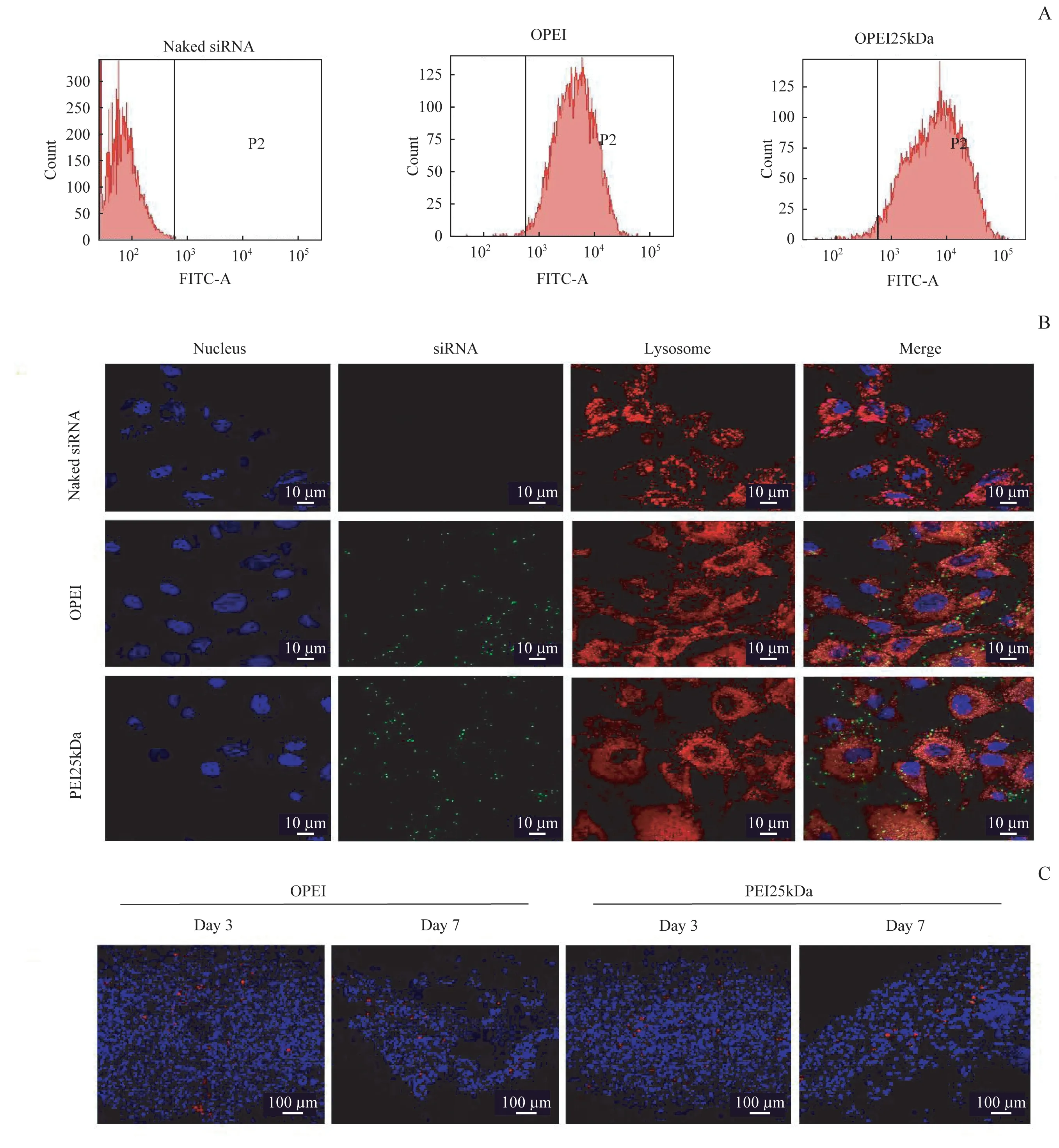
图4 OPEI/siRNA复合物在体外和体内的细胞转染效率Fig 4 Cell transfection efficiency of OPEI/siRNA polyplexs in vitro and in vivo
2.5 OPEI/siTRAF6 复合物对大鼠原代滑膜细胞TRAF6基因敲除效率
不同的质量比值的OPEI/siTRAF6 或PEI25kDa/siRNA 复合物转染大鼠原代滑膜细胞2 d 后,荧光定量PCR结果显示:与裸siTRAF6对照组(NC)相比,OPEI/siTRAF6 组在质量比值为3∶1、4∶1 和5∶1 时,TRAF6沉默的比例分别为58.1%、41.62%和60%;PEI25kDa/siTRAF6 组在质量比值为2∶1 时,TRAF6沉默的比例为61.38%(图5A)。实时荧光定量PCR结果显示,OPEI/siRNA 复合物(最佳质量比值为3∶1) 在 转 染 细 胞 后5、7 和10 d 稳 定 沉 默TRAF6,PEI25kDa/siRNA 复合物(最佳质量比值为2∶1)在转染细胞后5、7 d 沉默TRAF6(图5B)。Western blotting 检测不同质量比值的复合物转染细胞2 d 后TRAF6 蛋白表达,结果显示OPEI/siTRAF6 组在质量比值为3∶1、4∶1 和5∶1 时,TRAF6基因敲除效率分别为49.05%、74.61%和83.18%(图5C~D)。
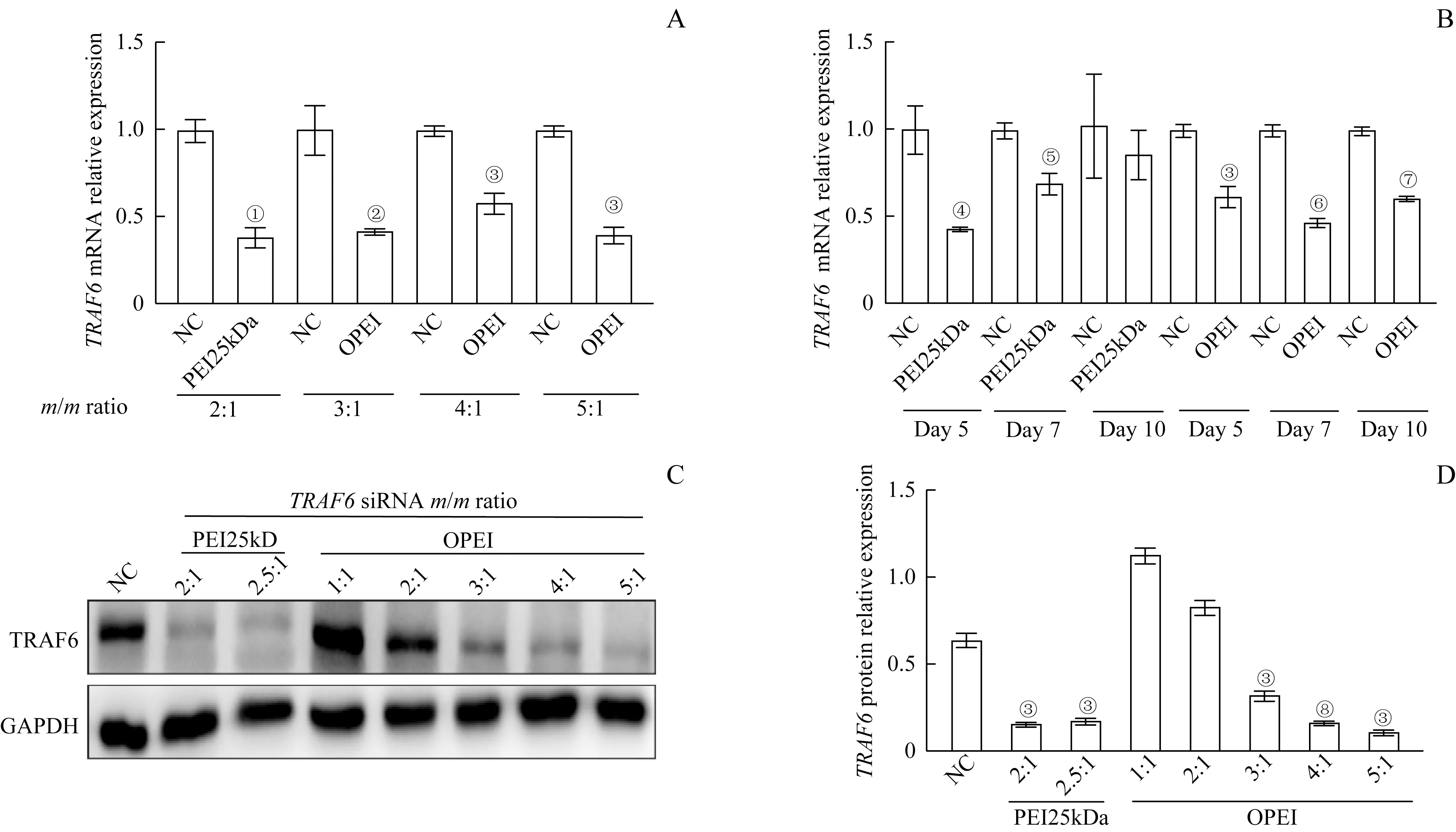
图5 OPEI/siTRAF6复合物转染大鼠原代滑膜细胞的TRAF6基因敲除效率Fig 5 TRAF6 knockdown efficiency of OPEI/siTRAF6 polyplexes in rat primary synoviocytes
2.6 OPEI/siTRAF6 沉 默TRAF6 基 因 对IL-1β 诱导的大鼠原代滑膜细胞炎症的抑制作用
将大鼠原代滑膜细胞与IL-1β 共孵育48 h,并以不同质量比值的复合物转染4 h 后,Western blotting分析结果显示:与裸siTRAF6 对照组相比,OPEI/siTRAF6 组(质量比值为3∶1 和4∶1)和PEI25kDa/siTRAF6组(质量比值为2∶1和2.5∶1)均可明显抑制TRAF6表达(图6A、B)。OPEI/siTRAF6组(质量比值为2∶1、3∶1 和4∶1)比PEI25kDa/siTRAF6 组(质量比值为2∶1、2.5∶1)能更有效地降低p-p65 的表达(图6C、D)。
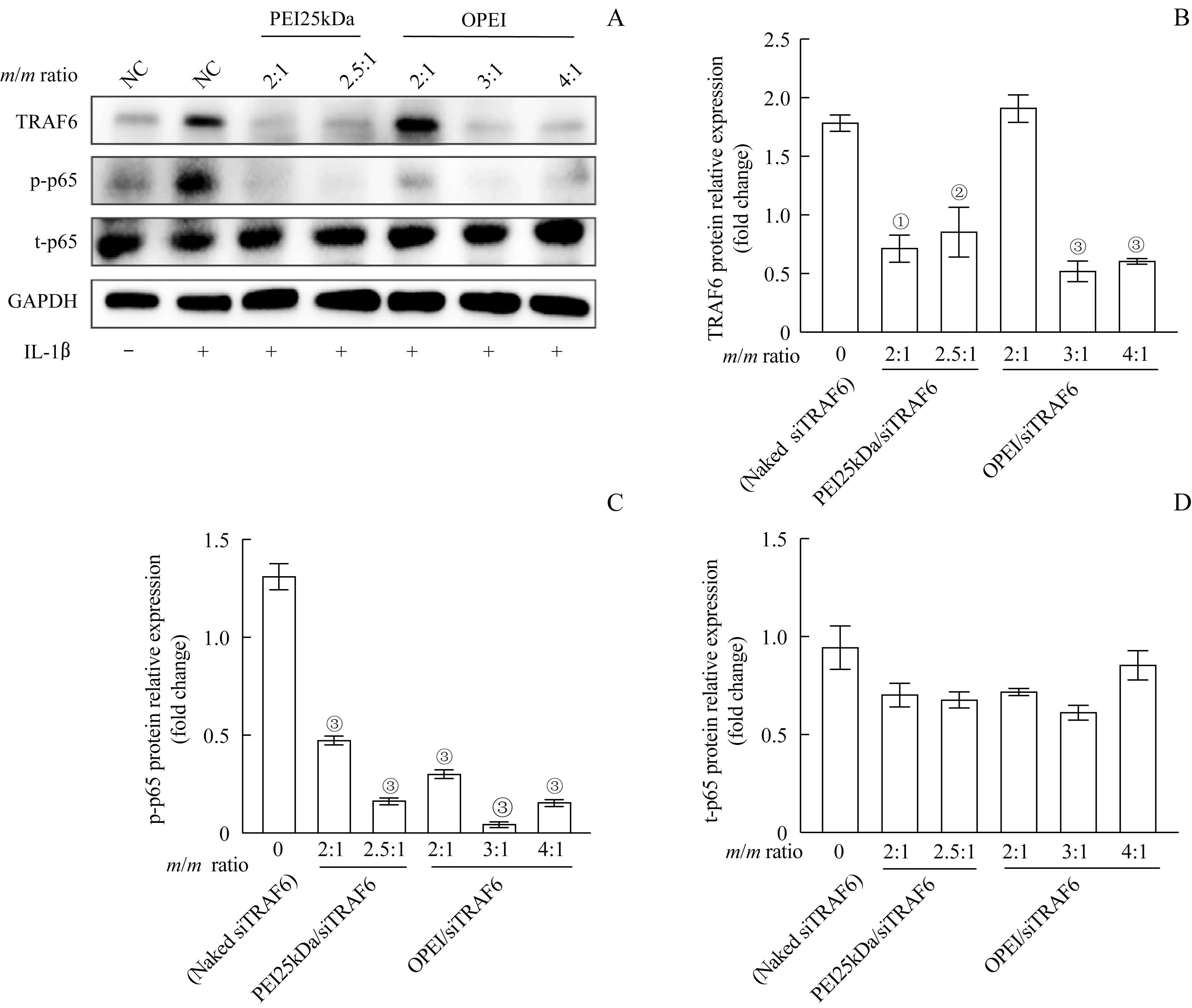
图6 TRAF6基因敲除对IL-1β诱导的大鼠滑膜细胞炎症的影响Fig 6 Effect of TRAF6 knockdown on IL-1β-induced inflammation in rat primary synoviocytes
2.7 TRAF6 基因敲除对BMSCs 软骨形成能力的恢复作用
与未刺激组相比,IL-1β刺激条件下BMSCs的软骨形成能力明显下降;但经OPEI/siTRAF6 处理后,与OPEI/siNC 对照相比,阿尔新兰染色显示BMSCs的软骨形成能力明显恢复(图7A)。Western blotting结果显示:与对照组(Naked siNC)相比,IL-1β 刺激条件下,BMSCs 的cleaved caspase 3 表达明显升高(图7B)。定量分析结果显示,IL-1β+OPEI/siTRAF6组cleaved caspase 3 的表达低于IL-1β+OPEI/siNC 组(图7C)。caspase 3 在各组中的表达水平无明显差异(图7D)。该结果提示TRAF6基因敲除可挽救IL-1β诱导的炎症条件下BMSCs 的成软骨分化及抑制BMSCs凋亡。
3 讨论
OA 的发病机制极其复杂。与趋化因子和促炎细胞因子表达相关的炎症是关节炎发病的原因之一。在多种致炎细胞因子中,TNF-α、IL-6 和IL-1β 在关节炎发病机制中起重要作用。IL-1、IL-6、IL-17 和TNF-α的异常水平刺激NF-κB激活,从而导致关节炎症和软骨破坏[28-30]。研究表明,泛素连接酶TRAF6在天然免疫、促炎细胞因子和抗原受体与典型的NF-κB 途径之间起着关键的调节作用[31]。本研究通过免疫组织化学方法检测到TRAF6在大鼠OA模型滑膜和软骨中均有过表达,提示TRAF6可能在OA的病理过程中起重要作用。进一步用siRNA 敲除TRAF6,发现可明显降低IL-1β 诱导的大鼠原代滑膜细胞炎症模型中MMP13 和p-p65 的表达,提示抑制TRAF6 活性是治疗OA的一种很有前景的新策略。
临床siRNA的治疗面临的主要挑战之一是缺乏有效和安全的优化递送载体[32-33]。商业上可获得的PEI25kDa 是一种经典的基因递送载体,但缺乏可生物降解的化学键(C-C 或C-N 键),且毒性太高,不适合临床使用。为了优化siRNA向关节的转移,我们合成了一种小分子交联聚乙烯亚胺(OPEI)。利用邻苯二甲醛的醛基与PEI1.8K 的氨基反应生成可降解的亚胺键(-N=C-)。结果表明,OPEI/siRNA 在大鼠原代滑膜细胞中具有与PEI25kDa/siRNA 相似的转染效率,但细胞毒性明显低于PEI25kDa/siRNA,OPEI 组的细胞凋亡率低于PEI25kDa 组。细胞存活率的提高可能是OPEI/siRNA组与PEI25kDa/siRNA组相比可更稳定地抑制TRAF6 的原因[34]。体内观察结果显示OPEI/Cy3-siRNA 转染后3、7 d,滑膜细胞Cy3-siRNA 高表达。这些结果表明,OPEI 可作为一种高效、低毒siRNA体内外输送载体。
炎症因子的级联作用可导致关节软骨的破坏,因此,抑制炎症因子的表达已成为治疗OA的重要策略。然而,目前的研究表明,生物制剂可以延缓恶化的进程,但不能促进组织修复[4]。与迄今大多数直接抑制IL-1β 和TNF-α 的研究不同[8-9,35],我们的研究表明,通过siRNA靶向IL-1β的下游可能会产生更好的结果。大多数关节炎病例与创伤无关,有多种潜在的主要原因,包括遗传倾向、衰老、生物力学改变、肥胖或全身炎症状况[36]。目前关节炎的发病机制尚不清楚,但慢性细胞因子暴露、信号异常和体细胞突变等可能参与了病理过程[37]。本研究中,将TRAF6siRNA 转染大鼠原代滑膜细胞来抑制TRAF6 表达,一方面抑制IL-1/MMP13/p65 信号转导,另一方面减少BMSCs 凋亡,并显著激发由IL-1β诱导的炎症抑制的BMSCs的软骨形成能力。与现有的治疗方法相比,这代表着生理和功能上的结果都有所改善。
综上所述,本研究发现TRAF6在大鼠OA模型滑膜和软骨中过表达。我们进一步合成了一种低毒、可生物降解的小分子PEI(OPEI),将siTRAF6 转染到TRAF6基因上。结果显示,抑制TRAF6 不仅可以对抗IL-1/MMP13/p65 信号转导途径,还可以减少BMSCs的凋亡,并显著增强IL-1β诱导的炎症抑制的BMSCs 的软骨形成能力,提示TRAF6 可能是OA 治疗的新靶点。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有动物实验均已通过上海交通大学医学院伦理委员会的审核批准(审批号:XHEC-F-NSFC-2018-275)。所有实验过程均遵照上海交通大学动物保护委员会批准的程序和原则进行。
All experimental animal protocols in this study were reviewed and approved by Ethics Committee of Shanghai Jiao Tong University School of Medicine (Approval Letter No.XHEC-F-NSFC-2018-275,dated 01/03/2018),and all experimental animal protocols were carried out by following the guidelines and principles approved by the Animal Protection Committee of Shanghai Jiao Tong University.
作者贡献/Authors'Contributions
刘宏强、张晓玲参与了实验设计;刘宏强、陆艳青、高宇轩参与了论文的写作和修改;王一云、王传东参与了数据分析。所有作者均阅读并同意了最终稿件的提交。
The study was designed by LIU Hongqiang and ZHANG Xiaoling.The manuscript was drafted and revised by LIU Hongqiang, LU Yanqing and GAO Yuxuan. The data was analyzed by WANG Yiyun and WANG Chuandong. All the authors have read the last version of paper and consented for submission.
·Received:2022-01-06
·Accepted:2022-06-18
·Published online:2022-07-28
