SUMO化修饰在精子发生过程中的作用
2022-09-19栾家妍韩邦旻
栾家妍,李 朋,韩邦旻
上海交通大学医学院附属第一人民医院泌尿外科临床医学中心,上海 200080
精子发生是一个连续而复杂的过程,其从原始生殖细胞分化为精原干细胞开始,经历精原细胞自我更新、增殖和分化,精母细胞减数分裂和精子变形,最终形成精子。其中,任一环节出现问题都可能导致精子发生异常,表现为少弱畸精子症,严重时则会导致无精子症。精子发生异常可由遗传因素和表观遗传因素引起,前者包括染色体异常、Y 染色体微缺失、致病基因突变等,后者包括非编码RNA 对染色质的重塑[1-4]、DNA 甲基化修饰、组蛋白翻译后修饰[5]等。SUMO 化修饰(SUMOylation)作为一种蛋白质翻译后修饰方式,通过在一系列特定酶的作用下,使底物蛋白与小分子泛素相关修饰物 蛋 白 (small ubiquitin-related modifier protein,SUMO)相结合,从而调节细胞功能。由于底物蛋白不尽相同,SUMO 化修饰也发挥了不同作用。在精子发生过程中,SUMO 在精母细胞、延长形精子细胞和成熟精子中均有表达且表达水平各异,提示SUMO 化修饰可能参与了精子发生中的多个重要事件。基于此,本文针对SUMO 化修饰在精子发生的不同阶段中的作用进行介绍。
1 SUMO化修饰
SUMO化修饰是底物蛋白的赖氨酸残基与SUMO形成异肽键的过程[6],能够调控一系列生物学事件,包括DNA 损伤修复、免疫应答、肿瘤免疫、细胞周期和凋亡等。在细胞中,SUMO 化修饰过程是可逆的,由SUMO 家族、SUMO 修饰酶系、SENP 家族共同参与完成。SUMO化修饰需经历成熟、激活、结合和连接4 个步骤(图1)。最初,SUMO 是无活性的SUMO 前体,经SUMO 特异性蛋白酶(sentrin/SUMO-specific protease,SENP)切割后,与SUMO E1 激活酶连接从而被激活;随后,在E2 结合酶的作用下,其可通过异肽键连接到目标蛋白赖氨酸残基上,形成底物、E2 结合酶、SUMO 的三者复合物;最后,E3 连接酶与该复合物结合,促进复合物中E2结合酶的解离,从而使SUMO 与底物连接得更为直接且紧密。同时, SENP 家族成员可切断底物与SUMO的异肽键,完成去SUMO化。
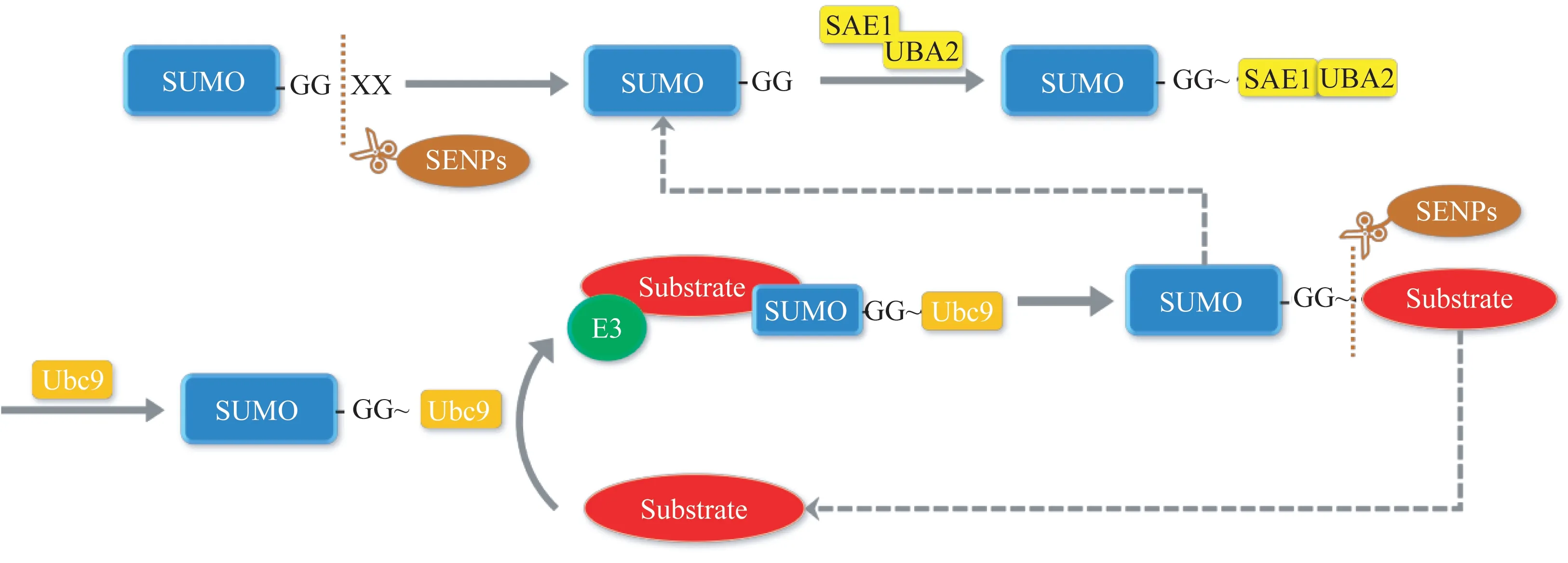
图1 SUMO化修饰与去SUMO化修饰的基本过程Fig 1 Basic process of SUMOylation and deSUMOylation
2 SUMO家族在精子发生中的作用
1996 年SUMO 被首次发现,且相关报道[7]显示其三维结构与泛素相似,仅在氨基酸序列和表面结构分布上存在差异。在哺乳动物中,参与SUMO 化修饰的SUMO 家族主要包括4 个成员,即SUMO1、SUMO2、SUMO3 和SUMO4;其 中,SUMO2 和SUMO3 具有高度同源性(约97%),常被统称为SUMO2/3;而SUMO4 仅表达于肾脏、肝脏和淋巴结中[8]。
2.1 SUMO1在精子发生中的作用
SUMO1 主要作用于精母细胞的第一次减数分裂过程,影响染色体联会[9]。在第一次减数分裂前期,SUMO1 表达始于偶线期,随后在粗线期表达增多,直至双线期停止。同时,SUMO1 定位于粗线期的染色质轴上;在粗线期的早期,主要呈线性模式表达,与联会复合体共定位于所有染色体上;而在粗线期的后期,可孤立表达于9 号、1 号染色体着丝粒区域的异染色质上[10]。9 号染色体着丝粒区域是最后发生联会的区域,如联会出现异常则将导致精子发生过程停滞[11],且多数不育男性的9 号、1 号染色体均存在异常[12],因此推测SUMO1 在9 号染色体的表达可能会影响精子发育过程。此外,在不育症患者的样本中发现,即使异染色质联会不连续甚至受阻,SUMO 化修饰依然存在,精母细胞仍可发育至粗线期[13],因此SUMO (特别是SUMO1) 可能是一个保护性蛋白。同时,有研究[14]在双链DNA 断裂位点发现了SUMO1 的表达,进一步证明SUMO1 在染色体重组中发挥了一定的作用。另有研究[15-16]发现,SUMO 可能与泛素共同影响精母细胞的第一次减数分裂,并参与调节染色体轴的组装和联会;由于泛素可促使蛋白发生降解,继而提示在此阶段SUMO 化修饰可能发挥了保证精母细胞发育的作用。
在精子变形过程中,SUMO1可影响线粒体功能。在延长形精子细胞中,SUMO1 主要定位于精子的头部、颈部和中段[17],特别是中段的线粒体之中。考虑到外膜线粒体锚定蛋白连接酶作为SUMO E3连接酶,可通过SUMO 化修饰的动力相关蛋白1促进线粒体分裂[18],而在无精子、弱精子受试者参与的研究[19]中证实,精子表达的SUMO1越多,精子运动能力越差,继而推测SUMO1 可能通过裂解线粒体而影响精子活力,但还需进一步的研究验证。
此外,Sertoli 细胞也可受到SUMO1 的影响。在Sertoli 细胞的细胞核中,雄激素受体(androgen receptor,AR)经SUMO 化修饰后,其转录活性受到抑制;而在体外抑制了SUMO 化修饰作用后,小鼠和人类的Sertoli 细胞均会发生凋亡[20]。这提示SUMO1和AR均可影响Sertoli细胞,特别是Sertoli细胞中的雄激素依赖性转录活动。在梗阻性无精子症患者中,Sertoli细胞核仁内的SUMO1表达缺乏、AR表达大量存在;而在生精阻滞的非梗阻性无精子症患者中,二者的表达均极低[21];由此可以推断,SUMO1和AR 的表达异常可能直接影响Sertoli 细胞的功能,从而导致男性不育,但具体机制尚不明确。
2.2 SUMO2/3在精子发生中的作用
在精子发生过程中SUMO2/3 先于SUMO1 表达,即在细线期和偶线期均可检测到[22]。研究[10]发现,SUMO2/3主要集中表达于9号染色体着丝粒处,少量呈灶性或弥散分布于其余常染色体着丝粒处。且在Sumo1敲除小鼠中,其睾丸生精功能正常[8]。因此,我们推测SUMO2/3 可能代偿SUMO1 的功能或独立发挥作用,但具体机制尚不清楚。
YANG等[23]发现,非洲绿猴肾成纤维细胞COS7内含有丰富的、未结合的SUMO2/3,当细胞受到损伤刺激后,SUMO化修饰的蛋白质将明显增加,参与细胞应激反应。SHRIVASTAVA 等[24]发现,吸烟产生的氧化反应可损伤精子细胞,而此时精子细胞中SUMO2/3的表达也会增加。且当精子细胞发生形态或功能的异常时,SUMO常在精子颈部过度表达[25]。因此,SUMO2/3 的表达或与精子细胞损伤程度呈正相关,这可能是导致不育的潜在因素之一。
3 SUMO 化修饰酶系在精子发生中的作用
3.1 SUMO E1激活酶在精子发生中的作用
SUMO E1 激活酶 是由SAE1 和UBA2 共2 个亚基组成的异二聚体,其活性位点位于亚基UBA2上,可与SUMO 结合。SUMO 前体被SENP 切割后,与UBA2 上的活性位点发生结合,从而激活SUMO。在细胞的SUMO 化修饰过程中,SUMO E1 激活酶发挥作用是第一步,而该步骤一旦被抑制,SUMO将无法被活化,继而使得SUMO1 和SUMO2/3 无法与底物连接,导致SUMO 化修饰无法进行。目前,有关SUMO E1激活酶在精子发生中的相关研究较少。
3.2 SUMO E2结合酶在精子发生中的作用
Ubc9 是目前发现的、唯一的SUMO E2 结合酶[26]。在 精 子 发 生 中,Ubc9 的 定 位 与SUMO1、SUMO2/3 相似,主要表达于粗线期和双线期的联会复合体和XY 小体内[27-28]。在Ubc9敲除小鼠的囊胚细胞中染色质高度浓缩,染色体在后期分离时出现错误,导致非整倍体产生从而影响细胞的有丝分裂,最终导致细胞凋亡;同时,Ubc9 的缺失还会阻碍囊胚内细胞SUMO 化修饰的进行,导致细胞核结构和物质运输能力受损,进而影响胚胎存活[29]。
3.3 SUMO E3连接酶的作用
研究[7]显示,SUMO E3 连接酶可提高SUMO E2 结合酶促进SUMO 与底物分子相结合的能力,以及SUMO 化修饰的效率。近年来,SUMO E3 连接酶在精子发生中的作用备受关注。
在哺乳动物中,活化STAT 的蛋白抑制剂(protein inhibitor of activated STAT,PIAS)是最早被发现且研究最为广泛的SUMO E3 连接酶家族成员。PIAS 家族由至少5 个成员组成,分别是PIAS1、PIAS3、PIASy 和PIASx,其中PIASx 又分为PIASxα和PIASxβ共2个亚类[30-32]。
(1)码头拆除分区清挖顺序:4区不受地基处理影响,开工后先施工4区,5区在地基满足强度要求后立即进行开挖。施工顺序为4区→其他→5区,由下游往上游施工。
在新生大鼠睾丸中,PIASx 和PIAS1 的表达较低,仅见于少量的精原细胞内;随着大鼠睾丸的发育,PIASx 主要表达于精母细胞中,而PIAS1 表达晚于PIASx,主要在晚期精母细胞和圆形精子细胞中,之后二者表达量逐渐递增[33-34];当大鼠睾丸发育成熟后,二者仅局限表达于Sertoli 细胞和精母细胞中。有研究[35]发现,Piasx被敲除后小鼠能够存活且仍具有一定的生育能力,但睾丸重量明显减少,精子细胞凋亡异常增加。此外,PIASx 和PIAS1 还可介导信号转导蛋白和转录激活物1 (signal transducer and activator of transcription 1,STAT1) 的SUMO 化 修饰[36],调节Sertoli 细胞中的AR 的转录活性;同时,PIAS1 也被证实为男性前列腺癌的影响因素之一[37],这可能也与其对AR 的影响有关。在精子发生过程中,PIAS1 和PIASx 可通过多种方式发挥重要作用,主要表现为调控精母细胞减数分裂和AR的功能。
SUMO 化修饰的RET 指蛋白(RET finger protein,RFP)高表达于人类的多种肿瘤细胞系和雄性生殖细胞中,并与精子发生有关[38-39]。且有研究[40]证实,RFP、PIASy和SUMO1定位于小鼠睾丸的精母细胞的XY 小体中。由于在粗线期性染色体形成XY 小体可抑制X 和Y 染色体编码的基因表达,因此推测SUMO 化修饰可能增强RFP 的转录抑制作用,从而有助于基因沉默,促进XY小体的形成。
4 SENP家族在精子发生中的作用
SENP 家族可通过切割SUMO 和底物之间的异肽键使底物去SUMO化修饰,以维持目标蛋白的SUMO化和去SUMO化的动态平衡。在哺乳动物中,目前已知的SENP家族成员有SENP 1~3、SENP 5~7,可分为3 个亚家族;其中,亚家族1 包括SENP1 和SENP2,可解离SUMO1 和SUMO2/3;亚家族2 包括SENP3 和SENP5,可解离SUMO2/3 与底物的共价结合[41];亚家族3 包括SENP6 和SENP7,可分解SUMO2/3 聚合链[42]。此外,SENP 家族(主要是SENP1 和SENP2)还可切割SUMO 前体,从而在SUMO E1 激活酶的作用下使SUMO发生活化[43]。SENP家族对SUMO化修饰的调节还会影响细胞的功能,研究[44]发现SUMO化修饰可抑制基因的表达,而SENP 家族的去SUMO化修饰能够再次激活被抑制的基因。
目前,相关研究对SENP 家族在精子发生过程中的定位及作用底物已有了初步认识。SENP1、SENP2和SENP6 的表达模式与SUMO2/3、SAE1/UBA2 和Ubc9 相同,即在精母细胞第一次减数分裂前期的细线期、偶线期、粗线期表达持续增加,而在圆形精子细胞中表达较低。SENP5 在该细胞第一次减数分裂前期的细线期、偶线期的表达低于粗线期,但粗线期前后其表达量没有变化,这和SUMO1 的表达模式相类似[45]。SENP3 和SENP7 在该细胞第一次减数分裂前期的细线期和偶线期表达最为丰富,之后随着精子细胞的成熟而表达下降[27],这与PIAS1、PIASx 和PIASy 的表达模式相反[45]。上述这些表达差异再次提示,SUMO 化修饰在精子发生过程中呈动态变化,虽然其详细的作用机制尚不明确,但可以推测SENP1、SENP 2 从精子发生早期即开始表达,解离SUMO1 和SUMO2/3,以促进二者各自发挥作用;在发育过程中,SENP5 解离SUMO2/3 与底物,使SUMO2/3 恢复未结合状态以应对细胞应激,同时避免过量SUMO2/3 损伤精子细胞,或促进SUMO2/3 参与染色体联会;在精子形成后期,SENP3、SENP7的表达较少,与SUMO2/3 此时表达稳定相符。此外,SENP3 的作用也不局限于去SUMO 化修饰。研究[46]发现,在成年小鼠的Sertoli细胞中,SENP3可通过调节STAT3 的转录活性,影响血睾屏障(blood-testis barrier,BTB)的基因表达;且在Senp3敲除小鼠的睾丸内肌动蛋白会发生解聚[47],而肌动蛋白是BTB的超微结构。因此,SENP3 的缺失会影响BTB 的紧密连接,从而影响BTB对精子细胞的保护作用。
5 总结与展望
SUMO化修饰参与了精子发生过程中的多个重要事件。首先,SUMO化修饰可作用于精母细胞的第一次减数分裂,SUMO1、SUMO2/3 和Ubc9 参与染色体联会,且PIASx、PIAS1 的表达有助于调控该减数分裂过程。其次,SUMO 化修饰可影响生精微环境,SUMO1、PIASx 和PIAS1 均 参 与 调 节Sertoli 细 胞 和AR 之间的关系,SENP3 有利于保证BTB 的紧密连接。同时,SUMO化修饰的过度或缺失均会导致精子发生过程的异常,但具体的分子机制尚未被明确,亟待进一步的相关研究加以证实。
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献/Authors'Contributions
韩邦旻负责文章设计及论文修改;栾家妍、李朋负责论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was designed and the manuscript was revised by HAN Bangmin. The manuscript was drafted and revised by LUAN Jiayan and LI Peng. All authors have read the last version of paper and consented for submission.
·Received:2022-02-11
·Accepted:2022-07-01
·Published online:2022-07-28
