鸟分枝杆菌MAV_2927基因编码蛋白质的生物信息学分析
2022-09-18李祥芳丁寿鹏高婧华吴利先
李祥芳,丁寿鹏,高婧华,吴利先
(大理大学基础医学院,云南大理 671000)
非结核分枝杆菌(nontuberculous mycobacteria,NTM)是除麻风分枝杆菌、结核分枝杆菌(mycobacterium tuberculosis,Mtb)复合群以外的分枝杆菌,而鸟分枝杆菌复合群(Mycobacterium aviumcomplex,MAC)是NTM中生长缓慢的一类菌群。目前已知有200多种NTM,其中MAC是革兰氏阳性、抗酸、需氧杆菌,广泛存在于土壤、水、灰尘等自然环境中〔1〕,绝大多数为腐物寄生菌。近年来随着HIV病毒的传播,NTM(特别是MAC)的感染人数逐年增多,而且MAC对治疗Mtb的药物大部分都耐药,导致MAC病防治非常困难,因此MAC感染致病机制的研究对临床治疗显得尤为重要。
鸟分枝杆菌(Mycobacterium avium,MAV)基因组具有相似的PPE(Pro-Pro-Glu)和PE(Pro-Glu)基因家族,其在分枝杆菌致病机制中起着重要作用。有研究发现MAV_2927基因属于PE家族,紧邻PPE25_MAV(MAV_2928),其 中MAV_2928、MAV_2927和MAV_2926是在一个多顺反子转录本上产生的,它们形成了一个异二聚体〔2〕。研究表明PPE基因MAV_2928可以促进MAC在细胞内的存活,可预测MAV_2927蛋白质,也可以影响MAC在细胞内的存活并致病。本研究利用生物信息学对MAV_2927基因编码蛋白质进行结构功能预测,为研究MAC的致病机制和防治提供基础。
1 材料与方法
1.1 材料来源 使用NCBI(https://www.ncbi.nlm.nih.gov/gene)数据库和Uniprot(https://www.uniprot.org/)蛋白数据库对鸟分枝杆菌104菌株MAV_2927进行序列分析,获取MAV_2927蛋白质的基因序列和氨基酸序列。
1.2 生物信息学分析
1.2.1 MAV_2927蛋白质的理化性质 使用在线软件Expasy(https://web.expasy.org/contact)的Prot-Param toll对MAV_2927蛋白质的理化性质(分子式、不稳定指数、氨基酸数量、分子量、氨基酸组成、等电点和正、负电荷的残基总数等)进行预测分析。
1.2.2 MAV_2927蛋白质结构分析 使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线软件 和SWISSMODEL(https://swissmodel.expasy.org/interactive)蛋白分析软件在线分析MAV_2927蛋白质二级结构和三级结构。
1.2.3 MAV_2927蛋白质的跨膜区和信号肽预测运用TMHMM Server V 2.0(https://www.cbs.dtu.dk/services/TMHMM/)和SignalP 4.0 server(https://www.cbs.dtu.dk/services/SignalP-4.0)在线软件对MAV_2927蛋白质进行跨膜区和信号肽预测。
1.2.4 MAV_2927蛋白质磷酸化位点及亲疏水性分析 使用NetPhos 3.1 servera(https://www.cb s.dtu.dk/services/NetPhos/)和ExPASy ProtScale(https://web.expasy.org/protscale/)在线软件预测MAV_2927蛋白质的磷酸化位点及亲疏水性。
1.2.5 MAV_2927蛋白质T细胞、B细胞抗原表位预测 采用BepiPred 1.0 server(https://www.iedb.org/home_v3.php)和NCBI-Conserved domains在线软件预测MAV_2927蛋白质的B细胞抗原表位,采用SYFPEITHI(https://www.syfpeithi.de/bin/MHCServer.dll/EpitopePrediction.htm)软件在线预测MAV_2927蛋白质的T细胞抗原表位。
2 结果
2.1 基因及编码蛋白质基本信息 使用蛋白数据库Uniprot分析鸟分枝杆菌MAV_2927基因编码蛋白质的氨基酸数为43个,蛋白质名称为PE domain-containing protein,登录号为ABK69185。
2.2 MAV-2927蛋白质序列及其理化性质MAV_2927蛋白质分子量为4.213 kDa,等电点4.72,分子式:C183H284N48O62S2,总原子数579个。负电荷残基总数(Asp+Glu)3个,正电荷残基总数为0,消光系数ε280=1 490 m-1。半衰期t1/2=30 h(哺乳动物网织红细胞,体外),t1/2>20 h(酵母,体内),t1/2>10 h(大肠埃希菌,体内)。不稳定指数(instability index,II)38.57,当II<40时为稳定蛋白质,II≥40则为不稳定蛋白质,该蛋白质为稳定蛋白质。脂肪指数75.35,亲水性总平均值(grand average of hydropathicity,GRAVY)为0.595,说明该蛋白质为疏水性蛋白质。MAV_2927基因编码蛋白质含43个氨基酸,丙氨酸占30.2%,天冬酰胺占2.3%,谷氨酸占7.0%,甘氨酸占4.7%,组氨酸占4.7%,亮氨酸占4.7%,甲硫氨酸占4.7%,苯丙氨酸占4.7%,脯氨酸占2.3%,丝氨酸占11.6%,苏氨酸占11.6%,酪氨酸占2.3%,缬氨酸占9.2%。
2.3 MAV_2927蛋白质结构 采用SOPMA软件预测MAV_2927蛋白质二级结构,其中α-螺旋(Hb)26个(占60.5%),β-折叠(Ee)8个(占18.6%),β-转角(Tt)1个(占2.3%),无规则卷曲(Cc)8个(占18.6%)。见图1。通过SWISS-MODEL软件构建MAV_2927蛋白质三级结构模型。见图2。SWISSMODEL中含有对模型的GMQE和QMEAN评分,该模型GMQE评分为0.30,QMEAN评分为-2.66,一致性较好。
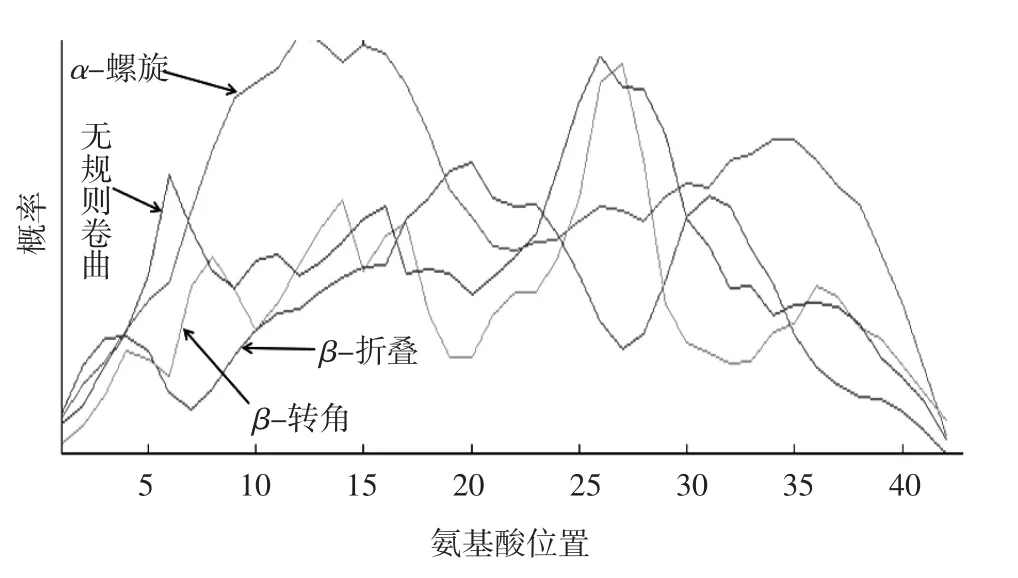
图1 MAV_2927蛋白质二级结构预测

图2 MAV_2927蛋白质三级结构预测
2.4 MAV_2927蛋白质跨膜区和信号肽预测 应用TMHMM Server V 2.0软件预测MAV_2927蛋白质跨膜螺旋数为0。见图3。跨膜氨基酸数为0.789 76(>18表示很可能为跨膜蛋白质),可能在胞质内的概率为0.214 62,表明MAV_2927蛋白质可能无跨膜区,即为非跨膜区蛋白质(膜内蛋白质)。应用SignalP 4.0 server软件预测MAV_2927蛋白质43个氨基酸的信号肽,结果显示MAV_2927蛋白质D值为0.336,阈值0.450,无信号肽。见图4。

图3 MAV_2927蛋白质跨膜区分析

图4 MAV_2927蛋白质信号肽分析
2.5 MAV_2927蛋白质磷酸化位点 采用NetPhos 3.1 servera软件预测MAV_2927蛋白质有7个磷酸化位点,其中磷酸化丝氨酸位点3个(氨基酸位置分别为25、28、30),磷酸化苏氨酸位点3个(氨基酸位置分别为6、26、34),磷酸化酪氨酸位点1个(氨基酸位置为31)。见图5。
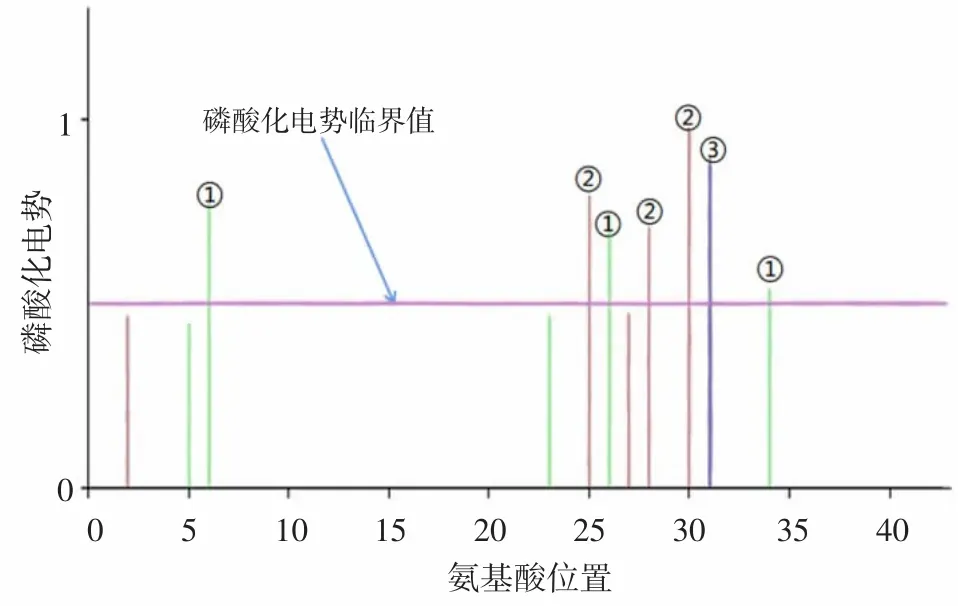
图5 MAV_2927蛋白质磷酸化位点预测
2.6 MAV_2927蛋白质抗原表位 采用BepiPred 1.0 server在线软件分析MAV_2927蛋白质,得到多个可能B细胞抗原表位,其中得分>0.35(临界参考值0.35)的可能B细胞抗原表位有23个,得分>0.80的可能B细胞抗原表位9个。见表1。采用SYFPEITHI软件预测得到多个可能T细胞抗原表位,主要组织相容性抗原类型为RT1.AI。见表2。

表1 MAV_2927蛋白质B细胞抗原表位预测

表2 MAV_2927蛋白质T细胞抗原表位预测
2.7 MAV_2927蛋白质亲水性 采用ExPASY ProtScale软件预测MAV_2927蛋白质为亲水性蛋白质,其氨基酸残基分布见图6。氨基酸亲水性得分最高分为1.6,最低分为-0.5(标度值>0的区域比标度值<0的较为密集),GRAVY为0.595(GRAVY>0为疏水性蛋白质;GRAVY<0为亲水性蛋白质),所以预测该蛋白质可能为疏水性蛋白质。

图6 MAV_2927蛋白质的亲水性分析
3 讨论
MAC是一种生长缓慢的分枝杆菌,是一种机会性细胞内致病菌,能够在巨噬细胞中存活并抵抗宿主的免疫机制,这种机制可能是其细胞壁中存在的糖肽类物质发挥作用〔3〕。除肺部疾病外,MAV还可侵入淋巴结、骨骼、关节、皮肤和软组织,并可在全身扩散。如果不治疗或治疗不当,感染可能导致严重疾病甚至死亡,尤其是在免疫功能低下的人群中。感染的症状是非特异性的,包括不适、咳嗽、发烧、虚弱、呼吸困难和咯血〔4〕。神经纤维素2蛋白(neurofibromin 2,NF2)是一种含有顶端蛋白的结构域,充当核心Hpo/Wts激酶级联的上游调节器。有研究发现MAV可通过阻止细胞凋亡和影响细胞增殖而在巨噬细胞内存活,其机制是干扰这些核心蛋白NF2的正常表达〔5〕。van der Woude等〔6〕观察到巨噬细胞吞噬体分泌的PknG激酶可有效抑制吞噬体-溶酶体融合,从而提高MAV的毒力和在巨噬细胞中的存活率。Mtb基因组测序于1998年完成,发现了2个主要的富含甘氨酸的蛋白质家族PE和PPE,其编码基因约占整个Mtb基因组的10%〔7〕。PE/PPE家族蛋白质是分枝杆菌特有的分子,以其N端保守的PE(Pro-Glu)和PPE(Pro-Pro-Glu)结构域命名,这2个基因在Mtb基因组的染色体上非常接近〔8〕。PPE和PE基因家族编码大量功能未知的蛋白质,MAC基因组中具有相似的PPE和PE基因家族〔9〕。由MAC表达的一种PE蛋白,与Mtb中发现的PE 18和PE 19的氨基酸序列有89.9%的同源性。且基因组搜索表明,MAC可能含有6个PE基因,而Mtb中有38个PE基因〔10〕,无PE_PGRS(PE_polymorphic GC-rich sequences)基因。PE抗原也在感染MAC的抗原呈递细胞中表达,感染或接种含PE蛋白细菌可引起与MAV MaPE蛋白交叉反应的免疫反应〔11〕。PE/PPE蛋白是免疫调节蛋白,可能与通过破坏Th1与Th2之间的平衡来建立或维持感染有关,从而促进Mtb存活〔8〕。
Mtb PE家族基因编码的细胞表面蛋白以前被报道与毒力和宿主的相互作用有关,可能是介导细菌逃避宿主免疫攻击的关键因素〔12〕。而MAV_2927蛋白质全长同源物存在于Mtb Rv1788(PE18)中〔2〕,可预测MAV_2927蛋白质也与MAC的毒力和宿主免疫相关,且PPE25_MAV转录在一个多顺反子转录本上,该转录本包含MAV_2927蛋白质,表明MAV_2927蛋白质的功能可能转移到了PPE25-MAV。经Uniprot分析,Rv1788氨基酸序列长度99,MAV_2927蛋白质(43 aa)比Mtb同系物Rv1788(99 aa)少56个残基,其三级结构比MAV_2927蛋白质的复杂,相对分子量9.552 kDa属于大分子物质,含PE_PGRS基因。MAC可以主动破坏正常的宿主防御反应,抑制巨噬细胞吞噬体的酸化和成熟〔13〕,还可调节宿主细胞凋亡和坏死过程,以促进细菌在巨噬细胞中的逃逸和扩散〔14〕。除此之外,MAV_2927蛋白质中预测的α-螺旋结构已被证明对PE蛋白与其配位及PPE蛋白的接合和相互作用有重要意义〔15〕。
本研究采用生物信息学方法预测的MAV_2927蛋白质可能为非跨膜区蛋白质(膜内蛋白质),可能存在于细胞质基质且该蛋白质是稳定蛋白质,无跨膜结构、无信号肽。对其疏水性进行了预测,它的氨基酸中丙氨酸数量最多,与其是疏水性蛋白质相符。MAV_2927蛋白质具有多个磷酸化位点,表明它可能参与了细胞间的信号转导。众所周知,α-螺旋结构在DNA模板中起着重要的作用,本研究预测MAV_2927蛋白质二级结构中α-螺旋结构占60.5%,推测该蛋白质可能相对保守。除此之外,MAV_2927蛋白质具有多个抗原表位,可推测该蛋白质具有一定的免疫原性,说明它可引起机体产生免疫反应且具有致病性。虽然生物信息学在预测基因含量和蛋白质对菌体毒力方面的影响有局限性,但确定蛋白质致病性的基础是发现该蛋白质与其他相关蛋白质之间的相似点和不同点。目前,鸟-胞内分枝杆菌基因组已经测序完成,这让我们得以重新审视PE和PPE蛋白质家族的亚家族成员和MAC之间的关系和进化史,以进一步确定MAC中PE蛋白的致病特征,这对MAC的致病机制研究及其诊断有重要意义。
