基于TLR4/ NF-κB 信号通路研究右美托咪定对脑卒中后中枢痛大鼠的镇痛机制
2022-09-17黄鼎力邹宛芸
黄鼎力 邹宛芸 张 英 刘 庆
西南医科大学附属中医医院疼痛科,四川泸州 646000
脑卒中后中枢痛(central post-stroke pain,CPSP)是一种由各种脑血管意外导致的相关疼痛,其发生率为8%~11%[1-2]。CPSP 疼痛程度剧烈,常用的镇痛药物效果不佳[3]。小胶质细胞是中枢神经系统中重要的免疫细胞,对组织损伤做出迅速反应,并释放大量炎症因子[4]。TLR4/NF-κB 信号通路能明显增加小胶质细胞的活化和炎症介质的产生[5-6],右美托咪定是一种选择性α2 受体激动剂,对小胶质细胞及神经炎症有强大的调节作用[7-8]。此外,右美托咪定能抑制损伤脑组织中TLR4/NF-κB 信号[9-10]。因此右美托咪定可能通过抑制TLR4/NF-κB 信号活动抑制小胶质细胞活化改善CPSP 大鼠的疼痛。
1 材料与方法
1.1 试剂和仪器
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素(interleukin,IL)-6 和IL-1β 酶联免疫吸附试剂盒(Abcam,货号:ab235662);Iba-1、NeuN 抗体(Abcam,货号:ab178846、ab177487);TLR4、NF-κB、pNFκB 抗体(碧云天生物技术有限公司,货号:AF8171、AF1246、AF5881);右美托咪定(四川国瑞药业有限公司,货号:1909242);Ⅳ型胶原酶(Gibco,货号:17104019)。热板仪(上海玉研科学仪器有限公司;PL-200);微量进样针(Hamilton)。
1.2 实验动物及分组
90 只SD 大鼠(雄性,240~280 g,6~8 周龄)由西南医科大学城北实验动物中心提供[许可证号:SCXK(川)2018-17]。实验通过伦理委员会审批(2016-1A)。随机选取30 只为假手术组,进行丘脑腹后外侧核(ventralis posterolateral,VPL)注射生理盐水进行伤口对照。剩余60 只进行VPL 注射Ⅳ型胶原酶,造模后3 d 测定热缩足反射潜伏期(thermal withdrawal latency,TWL),TWL 较术前降低2 s 即认为出现疼痛[11]。造模成功的标准即为右侧VPL 出现卒中,且疼痛行为学改变[12]。将TWL 异常的大鼠按随机数字表法分为模型组和干预组,每组30 只。造模后第4 天开始干预。干预组连续7 d 腹腔注射右美托咪定50 μg/kg,该剂量为治疗复杂区域疼痛综合征大鼠的最佳剂量[13]。模型组注射等量生理盐水。
1.3 疼痛行为学检测
每组大鼠10 只,于造模前1 天(T0)、造模后第10 天(T1)、17 天(T2)、31 天(T3)检测TWL[13]。
1.4 Western blot 检测各组大鼠VPL 中TLR4、核因子κB(nuclear factor-κB,NF-κB)及pNF-κB 的表达
在T3时,各组取5 只大鼠采用Western blot 检测各组大鼠VPL 中TLR4、NF-κB 及pNF-κB 的表达,心脏灌注去除全身血液,取材。采用BCA 法测定蛋白浓度。电泳,转膜,封闭,孵育抗体,显影;经Image J 软件进行定量分析。
1.5 免疫荧光染色检测大鼠VPL 神经元和Iba-1 的表达情况
在T3时,采用免疫荧光染色检测大鼠VPL 神经元和Iba-1 的表达情况。左心灌注后,固定、脱水、包埋,切片,孵育抗体。采用荧光显微镜观察。经cellSens软件进行细胞计数。
1.6 酶联免疫吸附试验测定TNF-α、IL-6 和IL-1β水平
在T3时,取10 mg 胶原酶注射点周围脑组织,充分研磨匀浆,离心10 min(4 000 r/min),取上清液。按照酶联免疫吸附试验试剂盒提供的标准步骤测定TNF-α、IL-6 和IL-1β 水平。
1.7 统计学方法
应用SPSS 17.0 软件进行统计分析。计量资料采用均数±标准差()表示,两两比较采用t 检验,不同时间点的测量采用重复测量方差分析。以P <0.05为差异有统计学意义。
2 结果
2.1 三组大鼠不同时间点TWL 比较
重复测量方差分析结果显示,假手术组及模型组TWL 组间比较、时间点比较及交互作用差异均有统计学意义(P <0.05) 。进一步两两比较,组内比较模型组、干预组T1~T3时TWL 低于T0时,T2~T3时TWL低于T1时,T3时TWL 低于T2时(P <0.05);组间比较:模型组T1~T3时TWL 低于假手术组,干预组T1~T3时TWL 高于模型组(P <0.05)。见表1~2。
表1 假手术组、模型组大鼠不同时间点TWL 比较(,n=10)

表1 假手术组、模型组大鼠不同时间点TWL 比较(,n=10)
注 与假手术组比较,aP <0.05;与本组T0 比较,cP <0.05;与本组T1比较,dP <0.05;与本组T2 比较,eP <0.05。TWL:热缩足反射潜伏期
表2 假手术组、模型组大鼠不同时间点TWL 比较(,n=10)

表2 假手术组、模型组大鼠不同时间点TWL 比较(,n=10)
注 与模型组比较,aP <0.05;与本组T0 比较,cP <0.05;与本组T1比较,dP <0.05;与本组T2 比较,eP <0.05。TWL:热缩足反射潜伏期
2.2 三组VPL 中TLR4、NF-κB、pNF-κB 表达比较
与假手术组比较,模型组VPL 中TLR4 及pNFκB 的表达升高(P <0.05);与模型组比较,干预组VPL 中TLR4 及pNF-κB 的表达降低(P <0.05);三组VPL 中NF-κB 表达比较,差异无统计学意义(P >0.05)。见图1。
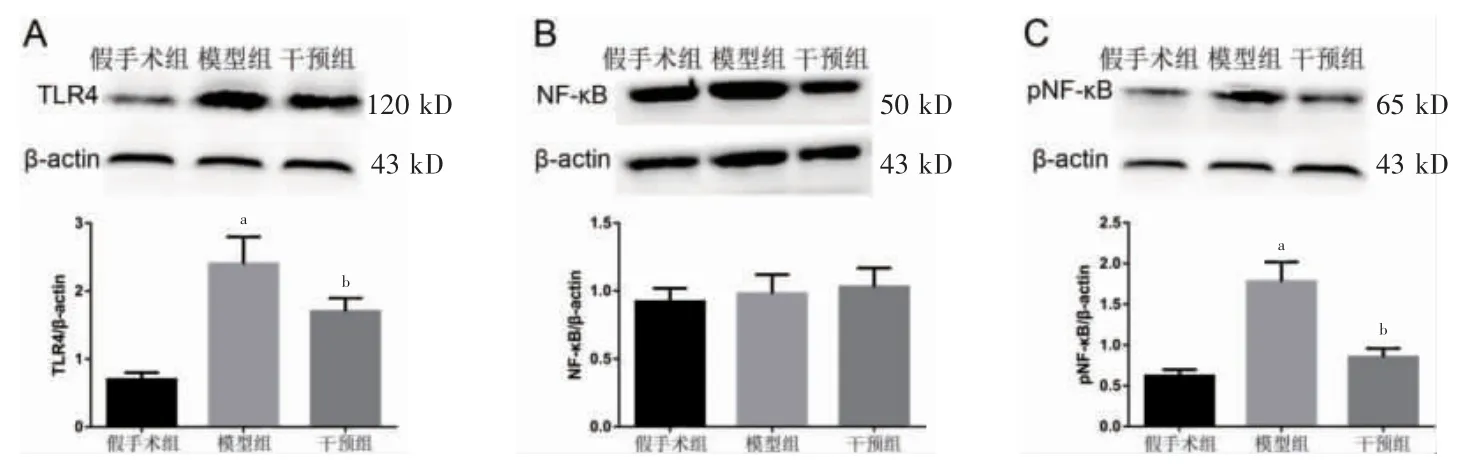
图1 三组大鼠VPL 中TLR4、NF-κB、pNF-κB 表达比较(n=5)
2.3 三组VPL 变化情况
与假手术组比较,模型组VPL 神经元数量减少(P <0.05);与模型组比较,干预组VPL 神经元数量差异无统计学意义(P >0.05)。见图2。
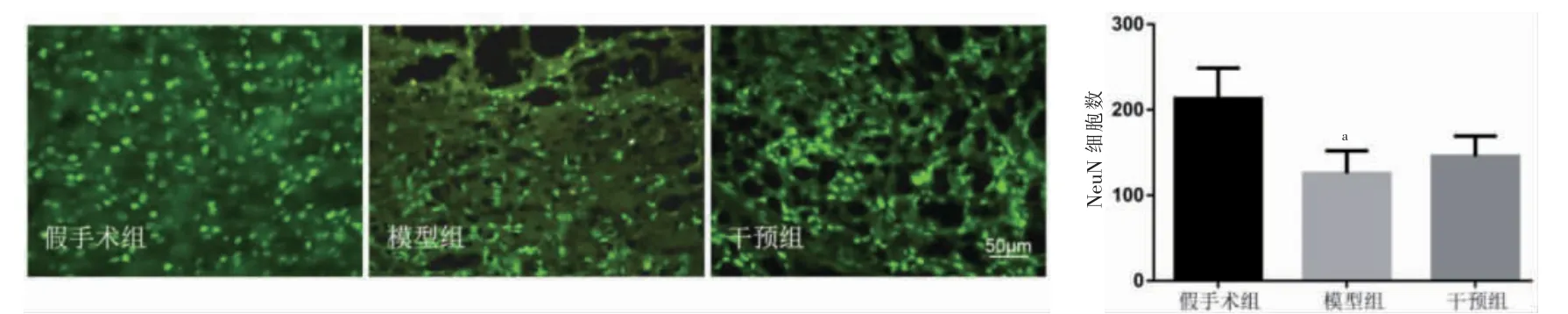
图2 三组大鼠丘脑腹后外侧核中NeuN 蛋白的免疫荧光图像(n=6)
2.4 三组VPL 中炎症因子及Iba-1 比较
模型组VPL 中TNF-α、IL-1β 和IL-6 水平及Iba-1较假手术升高(P <0.05),干预组VPL 中炎症因子TNF-α、IL-1β 和IL-6 水平及Iba-1 较模型组降低(P <0.05)。见表3、图3。
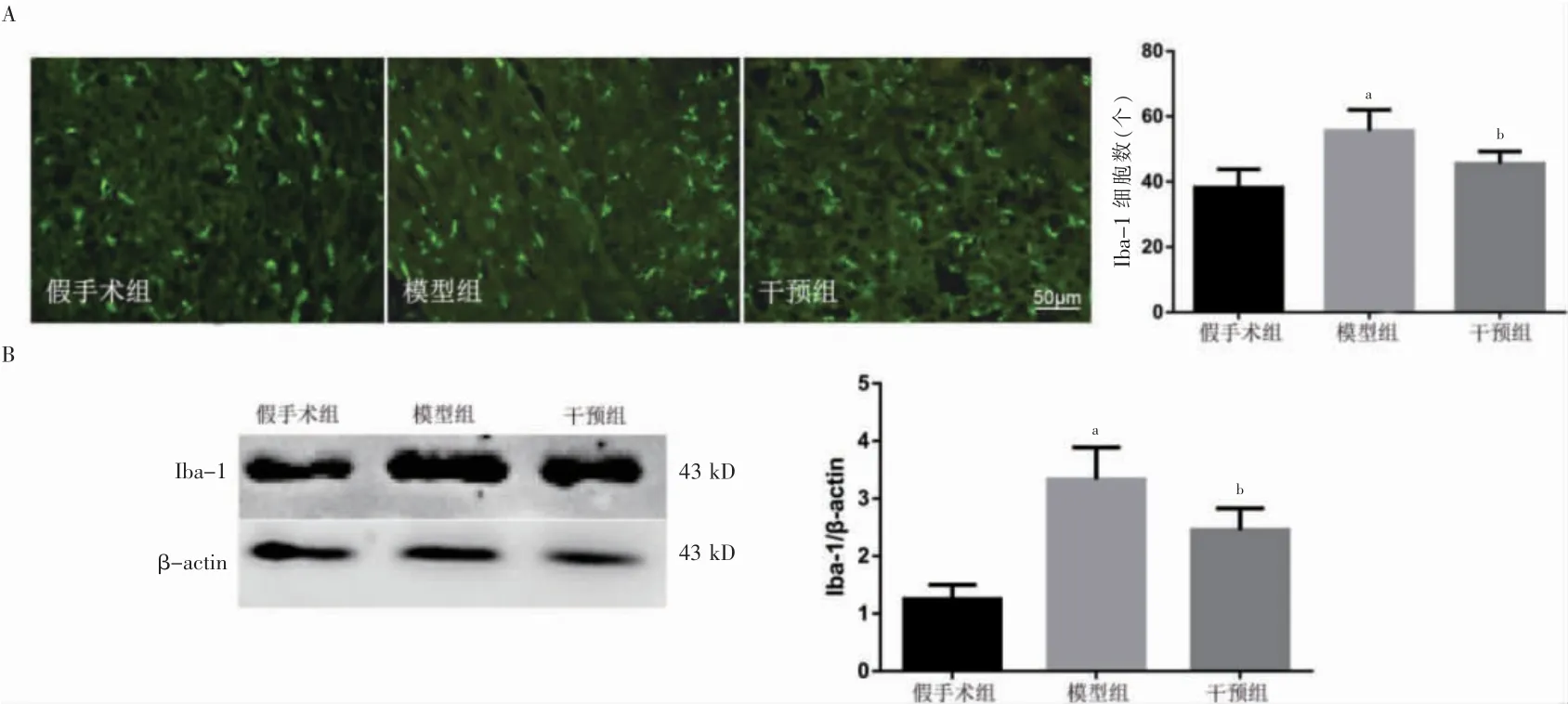
图3 三组大鼠VPL 中Iba-1 比较(n=5)
表3 三组大鼠炎症因子表达情况比较(,n=6)

表3 三组大鼠炎症因子表达情况比较(,n=6)
注 与假手术组比较,aP <0.05;与模型组比较,bP <0.05。TNF-α:肿瘤坏死因子-α;IL:白介素
3 讨论
本研究采用VPL 注射胶原酶的方法建立CPSP模型,VPL 是人类CPSP 的重要病变位置之一[15-16]。在当前研究中,大鼠从造模3 d 开始,TWL 明显降低,并持续至造模后31 d。结合VPL 神经元的数量明显减少,构建CPSP 模型成功。同时,VPL 中的Iba-1 和炎症因子的表达明显上调,提示小胶质细胞介导的神经炎症在CPSP 大鼠的中枢敏化中起着重要作用。
中枢敏化与参与了CPSP 的发生发展[17]。大脑神经损伤后增殖活化的小胶质细胞释放多种促炎性细胞因子使痛觉信号在丘脑的传递被明显放大,导致中枢敏化的发生[18-19]。TLR4 与多种炎症疾病密切相关[10,20]。TLR4能增强NF-κB 的磷酸化并非促进其表达,而NF-κB磷酸化是其活化的标志。pNF-κB 可增强炎症因子的表达及释放[21-22]。TLR4 高表达于小胶质细胞,参与小胶质细胞的增值活化及炎症因子的释放[23]。当前研究发现,T3时CPSP 大鼠的丘脑腹后外侧核中TLR4、pNF-κB 表达上调,结合小胶质细胞标志物Iba-1 的上调,证实TLR4/NF-κB 信号通路参与CPSP大鼠的小胶质细胞引起神经炎症的病理过程。
右美托咪定能够改善器官的缺血再灌注损伤、抑制促炎信号通路和减少细胞死亡[24-25]。在当前研究中,CPSP 大鼠的TWL 及VPL 中Iba-1、TNF-α、IL-1β、IL-6 的表达均被右美托咪定所抑制,提示右美托咪定能显著改善CPSP 大鼠的疼痛,抑制小胶质细胞介导的神经炎症。同时发现TLR4/NF-κB 信号的活动也受到右美托咪定的抑制。因此,当前研究结果提示TLR4/NF-κB 信号通路可能参与右美托咪定抑制VPL 的小胶质细胞活化及神经炎症过程。
综上所述,腹腔注射右美托咪定对CPSP 大鼠产生一定的镇痛作用,其机制可能是通过TLR4/NF-κB信号通路抑制小胶质细胞增殖活化及神经炎症进展。
