自噬调控在大鼠缺血性脑卒中亚急性期神经修复中的机制研究
2022-09-17徐伟杰李友宽武煜明
周 平 徐伟杰 臧 瑞 李友宽 武煜明
1.昆明卫生职业学院解剖教研室,云南昆明 650600;2.云南省昭通市中医医院急诊科,云南昭通 657000
脑卒中是一种高发病率及致残率的急性脑血管疾病,其中约80%为缺血性脑卒中[1-2],脑组织局部血流供应完全中断会导致细胞迅速死亡,使患者出现认知和运动功能障碍[3]。组织型纤溶酶原激活物(tissue plasminogen activator,tPA)是目前治疗缺血性脑卒中的有效方法,但tPA 具有严格的适应证和狭窄的窗口期,仅有5%的患者可以进行tPA 治疗[4]。脑卒中核心区周围的脑缺血半影区内细胞凋亡和自噬并存,自噬将受损细胞器传递至溶酶体进行降解并产生能量[5-6]。本研究选择大鼠左侧大脑中动脉闭塞再灌注模型模拟缺血性脑卒中亚急性期,通过自噬诱导剂及抑制剂干预自噬活性探究神经元自噬的相关机制[7]。
1 材料与方法
1.1 实验动物
选取8 周龄250~280 g 的SPF 级雄性健康SD 大鼠96 只,购自湖南斯莱克景达实验动物有限公司,生产许可证号为:SCXK(湘)2019-0004;合格证号:No.430727210101005026。饲养于昆明卫生职业学院(以下简称“我校”)实验动物中心,并通过我校动物伦理委员会审批(R-062021LH-122)。
1.2 主要药物与试剂
TTC 试剂(G3005)、BCA 蛋白浓度测定试剂盒(P0010)、RIPA 裂解液(P0013B)、电致化学发光试剂购自上海碧云天生物技术有限公司;微管相关蛋白轻链3(light chain 3,LC3)(83506)、Becline-1(3738)、β-actin(3700S)、神经元核心抗原(neuronal nuclei,NeuN)一抗(ab104224)、山羊抗兔二抗(SA00001-2)、DAPI(4038)购自Cell Signaling Technology 公司;水合氯醛(A600288)、Triton X-100(T8200)购自北京索莱宝科技有限公司,配制SDS 溶液、电泳液、转膜液。Alexa Fluor-488-缀合抗小鼠IgG(ab150077)、Alexa Fluor-594-缀合抗兔IgG(ab150080)购自美国abcam 公司。
1.3 动物分组及造模
采用随机数字表法将大鼠分为假手术组、模型组、雷帕霉素组、3-甲基腺嘌呤组,每组24 只。制备大鼠左侧脑中动脉闭塞再灌注模型[8],暴露大鼠左侧颈内、颈外及颈总动脉,经颈外动脉切口插入4-0 尼龙线栓,经颈内动脉进入颅底到达大脑中动脉处(长度1.8~2.0 cm)颈外动脉远端结扎固定并计时,激光多普勒血流仪检测脑动脉血流中断情况,90 min 后再灌注,以造模后Zea-longa 评分1~3 分为造模成功[9]。假手术组除不插入线栓外,其余各步骤均相同。
1.4 干预方法
10%水合氯醛麻醉后将大鼠俯卧固定于脑立体定位仪,于前囟后1.0 mm、中线左侧1.5 mm、深3.8 mm的左侧脑室留置给药管,有脑脊液流出提示定位准确。雷帕霉素组给予雷帕霉素(8 ng 溶解于5 μl 0.1%DMAO 中),3-甲基腺嘌呤组给予3-甲基腺嘌呤(100 μg溶解于5 μl 0.1%DMAO 中),假手术组、模型组给予5 μl 0.1%DMAO 溶液,四组给药均经侧脑室泵入[10]。四组注射后留针5 min,1 次/d,连续7 d。
1.5 行为学评估
每组随机选取6 只,根据改良大鼠神经功能缺损评分(modified neurological severity score,mNSS)[11]分别从反射缺失或异常运动(0~4 分)、运动测试(0~6 分)、感觉实验(0~2 分)、平衡木实验(0~6 分)进行评分,得分越高表示大鼠神经功能缺损越严重。
1.6 脑梗死体积检测
行为学评估后,每组另取6 只完整大脑于-20°C冰箱中冷冻20 min 后沿冠状面切成2 mm 厚的脑片,37°C 下TTC 染色30 min,4%多聚甲醛固定12 h 后拍照,未染色的白色区域为梗死区域。脑梗死体积占比(%)=脑梗死体积/同侧半球体积×100%。
1.7 免疫荧光染色
每组另取6 只大鼠麻醉,取完整大脑于20%蔗糖溶液中脱水24 h。采用冷冻切片机将其切成20 μm厚的冠状切片放于原位杂交保护液中。PBS 洗涤脑片后采用0.2%Triton X-100 透化15 min,10%BSA 封闭45 min 后将脑片分别与LC3(1∶400)和NeuN(1∶400)4℃过夜,与Alexa Fluor-488-缀合抗小鼠IgG(1∶800)和Alexa Fluor-594-缀合抗兔IgG(1∶800)于37℃避光孵育1 h,DAPI 溶液复染细胞核5 min,贴于载玻片并以抗荧光淬灭剂封片,高倍显微镜(400×)下拍照。
1.8 Western blot 检测
每组剩余6 只大鼠取缺血半影区脑组织研磨匀浆后RIPA 缓冲液处理40 min。4℃下12 000 r/min 离心15 min 取上清液,离心半径8 cm。SDS-PAGE 凝胶电泳后转膜至PVDF 膜,10%脱脂牛奶封闭2 h 后PBST 洗涤,再用LC3(LC3-Ⅱ/LC3-Ⅰ)、Beclin-1 和β-actin(1∶1 000)-4℃孵育过夜。洗涤后,将膜与山羊抗兔二抗、辣根过氧化物酶酶标抗体(1∶5 000)室温下孵育1 h,与电致化学发光试剂结合后通过BIO-RAD系统曝光拍照,条带的光密度通过Image J 软件进行定量分析。
1.9 统计学方法
采用GraphPad Prism 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,比较采用t检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 四组神经功能比较
模型组mNSS 高于假手术组,雷帕霉素组低于模型组,3-甲基腺嘌呤组高于模型组,差异有统计学意义(P <0.05 或P <0.01)。见图1。
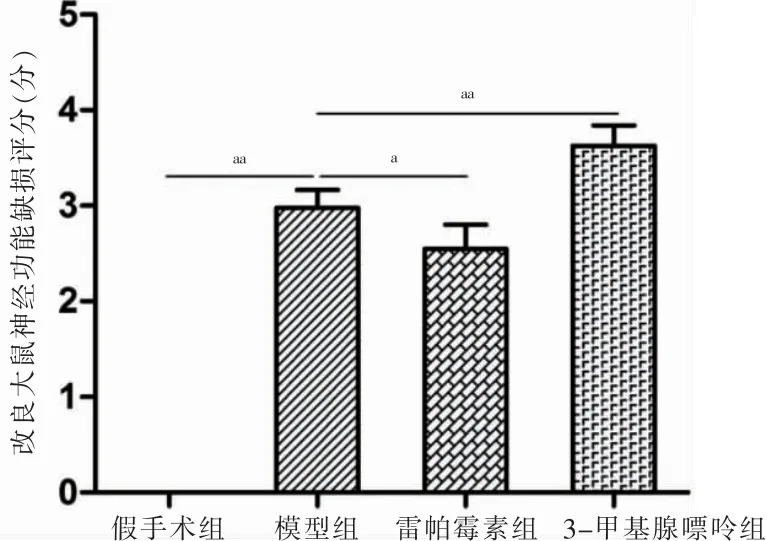
图1 四组神经功能比较(n=6)
2.2 四组脑梗死体积占比比较
模型组脑梗死体积占比高于假手术组,雷帕霉素组低于模型组,3-甲基腺嘌呤组高于模型组,差异有高度统计学意义(P <0.01)。见图2。
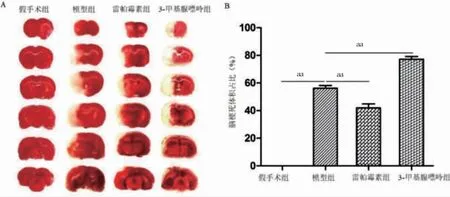
图2 四组脑梗死体积占比比较(n=6)
2.3 四组脑缺血半影区自噬相关指标表达比较
荧光染色及定量分析结果显示,模型组LC3 阳性细胞占比高于假手术组,雷帕霉素组高于模型组,3-甲基腺嘌呤组低于模型组,差异有统计学意义(P <0.05或P <0.01)。Western blot 结果显示,模型组Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白水平高于假手术组,雷帕霉素组高于模型组,3-甲基腺嘌呤组低于模型组,差异有统计学意义(P <0.05 或P <0.01)。见图4。

图4 四组脑缺血半影区自噬相关指标表达比较(n=6)
2.4 四组缺血半影区NeuN 阳性细胞占比比较
免疫荧光检测及定量分析结果显示,模型组缺血半影区NeuN 阳性细胞占比低于假手术组,雷帕霉素组高于模型组,3-甲基腺嘌呤组低于模型组,差异有统计学意义(P <0.05 或P <0.01)。见图5。
3 讨论
脑缺血发生后缺血半影区内神经细胞自噬被显著激活[12],但自噬是神经元存活的一把双刃剑,其神经保护作用仍有争议[13]。诱导适度自噬可增加神经元存活率,改善脑缺血后神经功能损伤,但抑制自噬则加重神经元死亡[14-16]。但抑制缺血性脑卒中后的自噬发生也可减少脑缺血再灌注后的梗死体积,因此认为神经元过度自噬将导致细胞死亡[17]。此结果可能由多种原因引起,包括脑缺血区域、缺血持续时间、干预药物剂量的不同等[18-20],其中药物干预时间的不同可能是自噬活性差异的重要原因[21]。自噬发生后Beclin-1及LC3-Ⅱ/LC3-Ⅰ可用于评估脑卒中后的自噬水平,LC3 前体分子裂解形成LC3-Ⅰ后被激活并偶联,以LC3-Ⅱ的形式附着到自噬体膜,与Beclin-1 一同升高[22-24]。本研究发现,模型组缺血半影区Beclin-1 及LC3 均有较高表达水平,且该区域内神经元数目减少,大鼠大脑大面积梗死并表现出一定程度的神经缺损障碍。自噬诱导剂雷帕霉素干预后该区域自噬水平增加,自噬抑制剂3-甲基腺嘌呤则出现相反结果。本研究结果显示,自噬诱导增加了大鼠脑缺血半影区神经元存活,自噬抑制则表现出相反作用。这些结果提示,自噬诱导剂在左侧大脑中动脉闭塞的亚急性期可提供神经保护作用,但自噬抑制则加重神经损伤。
综上,大鼠缺血性脑卒中亚急性期可能存在自噬不足,适当自噬激活有利于神经修复,及时接受溶栓或手术治疗的患者应该在脑卒中后期可适当诱导自噬[25]。相反,自噬抑制剂造成的自噬不足加重了脑缺血损伤及神经功能障碍[26-27]。自噬激活可增加大鼠脑缺血再灌注亚急性期神经保护,为临床亚急性期缺血性脑卒中患者的治疗提供一定理论基础。
