18F-FDG PET/CT 在预测非小细胞肺癌EGFR 突变状态及PD-L1 表达状态中的应用价值
2022-09-17李雪艳王大维于丽娟林秀艳
李雪艳,王大维,于丽娟,林秀艳,龚 伟,潘 登,陈 璐
(海南省肿瘤医院医学影像部,海南海口 570311)
近年来,恶性肿瘤的分子靶向治疗和免疫治疗发展迅猛,在肺癌治疗中效果尤为显著。表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸酶抑制剂(tyrosine kinase inhibitor,TKI)业已成为EGFR 突变型非小细胞肺癌(non-small cell lung cancer,NSCLC)病人靶向治疗的一线药物,但对于EGFR 野生型的肺癌患者效果甚微。准确的EGFR 的表达状态检测是临床是否应用TKI 重要的参照依据。程序性死亡受体1(programmed cell death-1,PD-1)/程 序 性 死 亡 配 体1(programmed cell death-ligand 1,PD-L1)信号通路目前作为癌症免疫治疗的重要研究靶点,在NSCLC 患者的治疗中表现出了令人惊喜的疗效及巨大的临床潜能[1]。由于活检技术、检测条件等方面的限制,目前临床亟需探索非侵入性方法来评估EGFR 突变及PDL1的表达状态。
正电子发射计算机断层扫描(positron emission tomography/computed tomography,PET/CT)作为分子影像及功能影像的主要代表,在肿瘤各诊疗环节中的作用逐渐被挖掘。大量研究表明18F-FDG PET/CT 在无创性地发现肿瘤特征及疗效预测方面具有很好的价值和应用前景[2-4]。因此,本研究试图探索PET/CT 多模态影像特征和代谢参数与EGFR 基因突变以及PD-L1 表达间的相关性,为临床筛选靶向和免疫治疗受益人群以及准确地评价疗效提供客观依据。
1 资料与方法
1.1 一般资料
筛选本院2017 年7 月~2020 年9 月肿瘤相关治疗前行18F-FDG PET/CT 检查、获得明确病理结果的NSCLC 患者作为研究对象。入组标准为:(1)首诊/首治且病理检查证实为NSCLC;(2)有明确EGFR 基因检测结果和免疫组织化学检测结果;(3)无其他恶性肿瘤病史。收集患者的临床特征资料,包括年龄、性别、吸烟情况、肿瘤体积、肿瘤分期、血清肿瘤标志物等。
1.2 PET/CT 显像方法及图像分析
使用GE Discovery 710 PET/CT 扫描机,显像剂18F-FDG 由GE Qilin 回旋加速器设备和化学合成系统制备,放化纯度超过百分之九十五。被检者在显像前禁食约5 h 左右,并限制血糖浓度不超过7 mmol/L,选择血管状态较好的一侧肘静脉进行显像剂输注,量为5.5~7.4 MBq/kg,嘱被检者休息1 h 后行全身扫描、图像重建、衰减校正及图像融合。
使用GE AW 4.6 工作站的PET VCAR 软件收集肺癌形态学参数及代谢参数,包括原发灶最大径、最大标准化摄取值(maximum standardized uptake value,SUVmax)、肿瘤代谢体积(metabolic tumor volume,MTV),按阈值法定义计算的肿瘤区体积)和病灶总糖酵解量[total lesion glycolysis,TLG;TLG=平均SUV(mean SUV,SUVmean)×MTV]。 在 测 定 或 计 算MTV 和TLG 时 使 用40%SUVmax 为阈值。典型肺腺癌患者PET/CT图像(图1)。
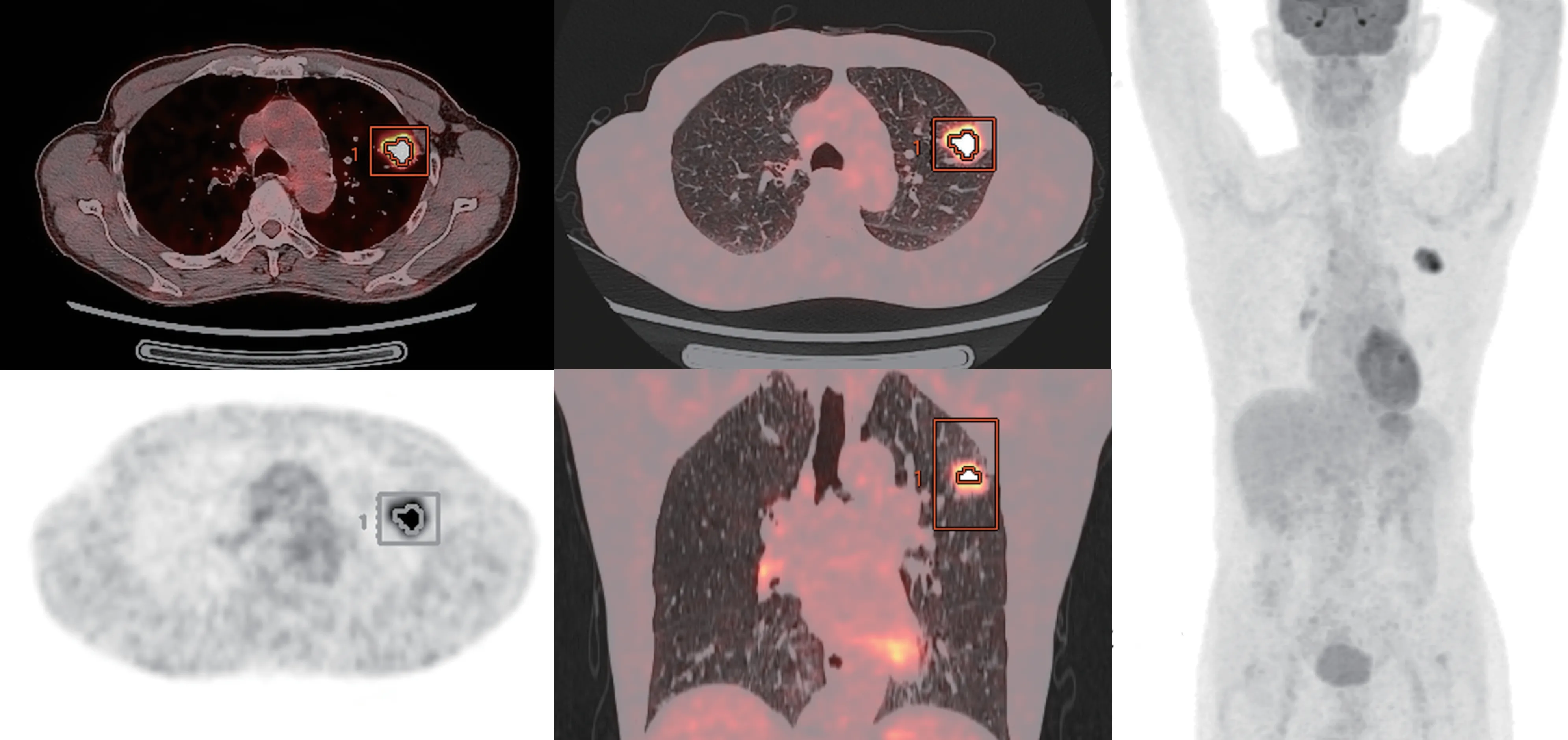
图1 典型肺腺癌患者PET/CT 图像Fig 1 PET/CT images of typical lung adenocarcinoma patient
1.3 EGFR 基因突变检测及免疫组化染色结果判读
基因检测选择手术切除、穿刺或支气管镜活检标本。采用ARMS-PCR 法对EGFR 突变状态进行检 测。EGFR-TKI 敏 感 突 变:19del,21(L858R,L861),18(G719X,G719)。
免疫组化染色切片由二名有经验的病理医生双盲独立分析,判断并评估完全或局部膜染色的肿瘤细胞比例。判读标准为:着色细胞≤5%定义为阴性(-),表达等级为0,着色细胞5%~25%定义为弱阳性(+),表达等级为1,着色细胞25%~50%定义为阳性(++),表达等级为2,着色细胞>50%为强阳性(+++),表达等级为3。
1.4 统计学处理
使用SPSS 21.0 软件进行数据统计分析。分别应用Pearson 卡方检验和Mann-WhitneyU检验进行分类变量和连续变量分析。应用受试者工作 特 性(receiver operating characteristic,ROC)曲线分析连续变量预测EGFR 基因突变状态及PD-L1 蛋白表达状态的曲线下面积(area under curve,AUC)并寻找最佳截断点。单因素及多因素Logistic 回归分析用以检验各参数在预测EGFR 突变状态及PD-L1 蛋白表达状态中的统计学价值。P<0.05 为差异具有统计学意义。
2 结果
2.1 临床病理参数与NSCLC EGFR 突变状态的相关性
PET/CT 多模态参数与EGFR 基因突变状态相关性研究组最终纳入223 例病例,其中男性119例(53.36%),女性104 例(46.64%),EGFR 突变型 126 例(56.50%),EGFR 野 生 型 97 例(43.50%)。入组病例的临床病理特征见表1。通过Logistic 单因素研究评估临床参数与EGFR 突变状态之间的关系。研究结果表明,年龄>55 岁者的EGFR 突变率显著小于年龄≤55 岁者(P=0.01),吸烟者小于非吸烟者(P=0.00),男性小于女性(P=0.00)。而临床分期(P=0.34)、肿瘤直径(P=0.16)、肿瘤位置(P=0.08)均与EGFR 突变状态无明显关系(P>0.05)。

表1 临床病理参数与EGFR 突变状态的关系Tab 1 Relationship between clinicopathological parameters and EGFR mutation status
2.2 PET/CT 代谢参数与NSCLC EGFR 突变状态的相关性
Mann-WhitneyU检验结果显示EGFR 野生型患者MTV 和TLG 均高于突变型患者[(32.46±43.56) cm3vs.(17.28±13.86) cm3,P=0.01] 、[(56.23±33.47)gvs.(25.38±18.76)g,P=0.00]。而SUVmax 在野生组与突变组患者间的差异无统计 学 意 义(13.13±5.02vs.10.87±4.98,P=0.13)(图2)。ROC 曲线分析结果显示SUVmax、MTV和TLG 预测EGFR 突变状态的cut-off 值分别为9.05(AUC =0.54,95%CI:0.46~0.61,P=0.37)、27.54 cm3(AUC=0.60,95%CI:0.52~0.68,P=0.01)、66.90 g(AUC=0.60,95%CI:0.52~0.67,P=0.01)(图3)。

图2 EGFR 突变组和野生组的SUVmax、MTV 和TLG 箱图Fig 2 SUVmax,MTV,and TLG boxes in patients with EGFR mutant and wild-type NSCLC

图3 SUVmax、MTV 及TLG 预测NSCLC EGFR 突变状态的ROC 曲线Fig 3 ROC curves of SUVmax,MTV and TLG to predict NSCLC EGFR mutation status
2.3 NSCLC EGFR突变状态的Logistic多因素分析
将入组病例的临床病理因素和PET/CT 代谢参数均纳入Logistic 单因素分析,结果表明:年龄、性别、吸烟史以和MTV 都与EGFR 基因突变状态具有相关性(P值分别为0.01、0.00、0.00 和0.01),见表1。将这些变量作为协变量进一步纳入Logistic 多因素分析,结果表明MTV、年龄和吸烟史是预测EGFR 基因突变的独立风险因素(P值分别为0.03、0.00 和0.00),见表2。

表2 223 例NSCLC 患者EGFR 突变状态的多因素分析结果Tab 2 Multifactorial analysis of EGFR mutation in 223 NSCLC patients
2.4 临床病理特征、PET/CT 代谢参数与PD-L1蛋白表达状态的关系
PET/CT 与PD-L1 蛋白表达状态相关性研究组最终入组123 例患者,其中男性79 例(64.23%),女性44(35.77%)。PD-L1 阳性者占65.85%,表达等级为0、1、2 和3 的比例分别为37.82%、27.91%、26.25%和8.02%。
ROC 曲 线 分 析 结 果 显 示SUVmax、MTV 和TLG 预测PD-L1 蛋白表达状态的cut-off 值分别为 9.65(AUC=0.47,95%CI:0.36~0.58,P=0.57)、24.15 cm3(AUC=0.56,95%CI:0.45~0.66,P=0.03)、71.25 g(AUC=0.52,95%CI:0.41~0.63,P=0.72)(图4)。Mann-WhitneyU检验结果显示不同PD-L1 蛋白表达状态组间SUVmax、MTV 和TLG 值差异无统计学意义(P>0.05)(图5)。

图4 SUVmax、MTV 及TLG 预测PD-L1 蛋白表达状态的ROC 曲线Fig 4 ROC curves of SUVmax,MTV and TLG to predict PD-L1 protein expression status

图5 PD-L1 表达阳性组和阴性组NSCLC 患者的SUVmax、MTV 和TLG 箱图Fig 5 SUVmax,MTV and TLG boxes of NSCLC patients in the positive and negative groups with PD-L1 expression
采用Logistic 单因素分析评价临床因素与PDL1 蛋白表达状态之间的关系,见表3。研究发现,Ⅲ/Ⅳ期组PD-L1 阳性表达率高于Ⅰ/Ⅱ期 组(P=0.01),而 年 龄(P=0.33)、性 别(P=0.12)、吸 烟 史(P=0.65)、SUVmax(P=0.47)、MTV(P=0.37)、TLG(P=0.12)、LDH(P=0.27)及CEA(P=0.98)均与PD-L1 蛋白状态无明显关系(P>0.05)(表3)。
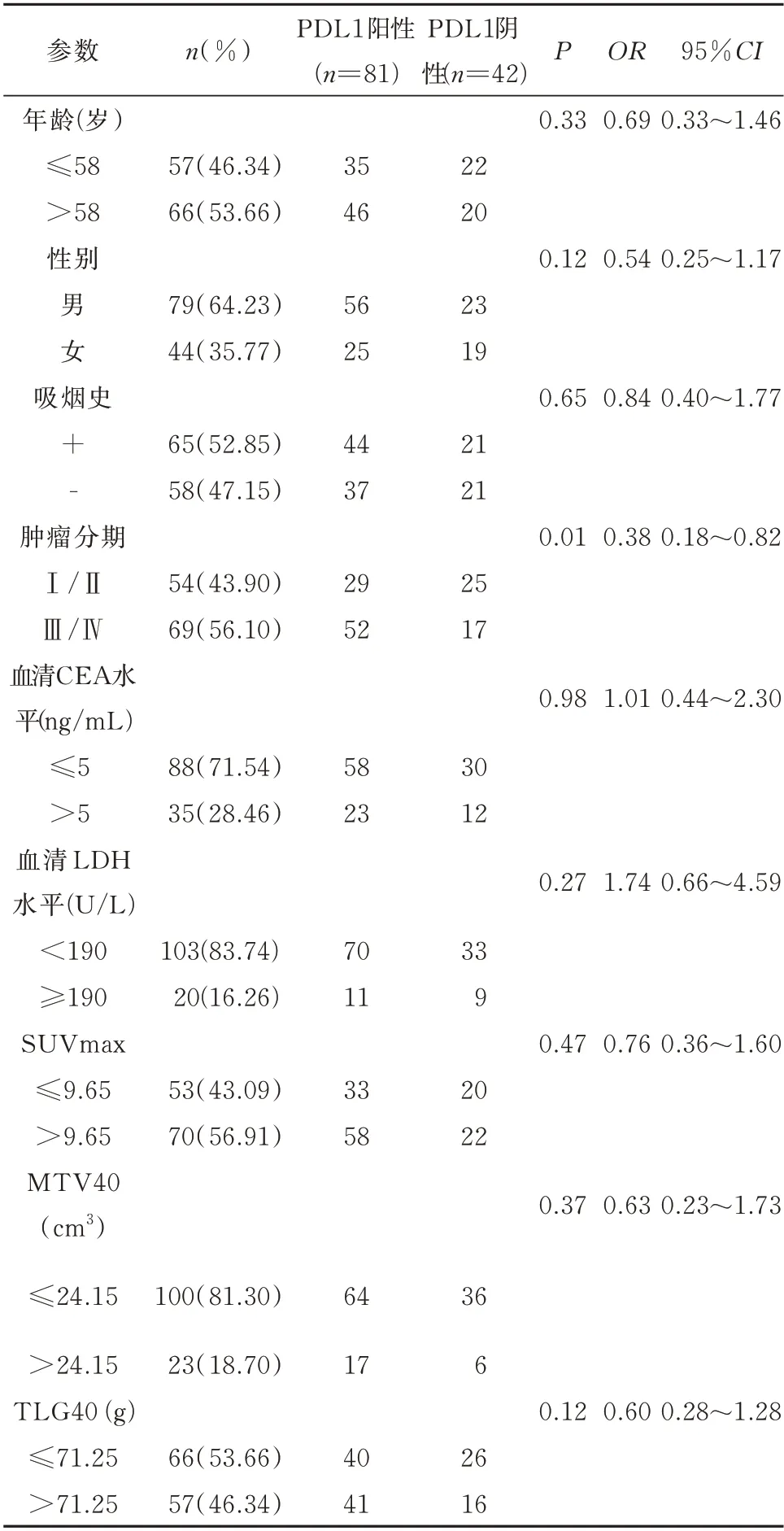
表3 123 例患者临床病理参数与PD-L1 表达状态的关系Tab 3 Relationship between clinicopathological parameters and PD-L1 expression in 123 patients
3 讨论
目前,基于PET/CT 代谢参数预测EGFR 基因突变状态的有关研究重点主要围绕于传统代谢参数,如SUVmax,且研究结论不尽相同。Takamochi等[5]研究表明EGFR 突变型病人的糖代谢相关基因表达水平明显降低,且与SUVmax 存在着明显的正相关性。有研究结果表明,原发肿瘤较低的SUVmax 更可能预测EGFR 突变[5-7],也有研究结果表明较高的SUVmax 更有可能预测EGFR 突变阳性[8]。同时,还有研究表明,SUVmax 与EGFR 突变状态之间无明显关联[7,9],这一结果与本研究结论一致。产生此结论的原因,可能是由于SUVmax 只反映了病灶内FDG 的最高摄取状态,而无法全面反映整个肿瘤的代谢活动,且易受到患者体质及图像采集条件等多种因素的影响。因此本研究补充测量了MTV 和TLG 进行分析,这两项参数融合了肿瘤糖代谢特点及容积参数,可以更好地反映肿瘤负荷,对这两项代谢体积指标的研究也是近期热点。已有研究发现MTV 较低的NSCLC 患者的预后通常优 于MTV 较 高 者[10-12]。本 研 究 亦 发 现 低MTV 与NSCLC EGFR 基因突变存在正相关,且MTV 是预测EGFR 基因突变的独立因素。虽然本研究结果提示TLG 与EGFR 突变状态无关,但由于TLG 和MTV 存在多重共线性关系,不能完全否定TLG 对EGFR 突变状态的预测价值,仍然需要通过多中心、大样本数据进一步分析和验证。
PD-1/PD-L1 抑制剂作为免疫治疗的新星,可阻断肿瘤逃脱自身免疫系统的攻击。其主要作用机理是阻止PD-1 和PD-L1 的结合,上调机体免疫系统T 细胞的增殖生长水平,维持T 细胞的激活状态,从而提高其对恶行肿瘤细胞的识别,并激发其攻击和杀伤活性,进而达到抗肿瘤效果[13,14]。目前临床试验(CheckMate-057)的结果已表明抗PD-1/PD-L1 单克隆抗体是进展期NSCLC 免疫靶向治疗的巨大潜力药物[15],然而并非所有患者都有效,所以,无创地筛选可能从这种治疗中获益的靶向人群有重要的意义。FDG 作为葡萄糖类似物,可被转运入肿瘤组织以及肿瘤相关的活性免疫细胞,因此PET 可提供肿瘤免疫微环境代谢状态相关信息。基于此理论基础,我们假设PET/CT 代谢参数与PD-L1 表达间可能存在某种相关性。 通过Mann-WhitneyU检验及Logistic 单因素分析,发现PD-L1 蛋白表达仅与肿瘤分期(P=0.01)相关,而与其他临床病理因素无关。PET/CT 代谢参数与PD-L1 蛋白表达间亦未发现显著相关性。分析其原因,可能是PD-L1 不仅在肿瘤细胞中表达,也存在于肿瘤微环境中,且在肿瘤间质淋巴细胞中的表达占更大比例[16]。该结果还可能与免疫组化染色阳性阈值的定义有关,目前关于该阈值的定义尚未达成共识[17],判读标准各异,且检测方法不一,使得研究结果存在着较大差异。此外,FDG 并非肿瘤特异性显像剂,炎性细胞、功能异常增强的组织细胞等均会出现FDG 高摄取,这些混杂摄取可能是出现PET/CT 代谢参数与PD-L1 表达无相关性的另一原因。
本研究的主要不足之一为回顾性研究,因为样本量相对较小,所以患者的入组筛选和分析过程中可能存在一定程度的偏倚;其次,本研究未分析其他种类的基因突变,如K-ras等。另外,影像组学和深度学习技术发展迅猛[18,19],其优势之处在于通过计算机技术可深度挖掘到影像的高维信息,在各肿瘤研究领域均表现优异,这也将是笔者今后的重点研究方向。
作者贡献度说明:
李雪艳:试验方案设计、论文撰写与修改;王大维:负责论文审阅及图片处理;于丽娟:负责论文选题及审阅;林秀艳、龚伟:负责入组患者临床数据收集;潘登、陈璐:负责入组患者图像分析。
所有作者声明不存在任何利益冲突。
