山奈酚抑制软骨凋亡延缓小鼠膝骨关节炎的实验研究
2022-09-17米倚林易南星许晓彤杨烙坚李佳宾陈树源邝高艳
米倚林,易南星,许晓彤,杨烙坚,李佳宾,陈树源,邝高艳,卢 敏
(湖南中医药大学第一附属医院,湖南长沙 410007)
膝骨关节炎(knee osteoarthritis,KOA)是常见的关节慢性退行性疾病,主要表现为关节软骨退变、软骨下骨硬化和滑膜炎症[1]。随着人口老龄化和肥胖人口的增加,KOA 的患病率正在上升,已成为中国乃至世界面临的重要社会健康问题[2]。临床主要以非甾体抗炎药(NSAIDs)缓解KOA 症状。目前尚缺乏能够有效治疗KOA 的药物,晚期的关节置换是唯一的治疗方式[3]。因此,亟需研究治疗KOA 的药物。
中药是药物研究的宝库,本研究拟基于网络药理分析结果和实验验证结合的方法探究山奈酚对KOA 的作用。已有研究表明多酚可能有益于骨关节炎,而黄酮类化合物是多酚家族的主要成员[4]。山奈酚是一种生物黄酮类化合物,广泛存在于杜仲、牛膝、独活等中药中。研究证实山奈酚具有抗凋亡、抗炎和抗氧化等多种药理活性[5]。有文献证明山奈酚可通过抑制NF-κB 通路减轻IL-1β 诱导的软骨细胞炎症[6];也能够抑制MAPK 相关的ERK 和p38 信号通路及IL-1β 刺激的基质金属蛋白酶的产生[7]。
网络药理学是基于生物信息学和系统生物学发展起来的新型学科,为揭示中药复杂机理的研究提供了新的方法[8]。本研究通过网络药理学探讨山奈酚治疗KOA 的分子机制,借助分子对接验证山奈酚与其干预KOA 的关键靶基因(BCL-2、BAX和CASP3)的结合情况,并结合体内实验验证山奈酚对膝关节组织形态学的影响以及对软骨凋亡信号通路相关基因表达的影响。
1 材料与方法
1.1 山奈酚相关靶点筛选
借助中药系统药理数据库和分析平台TCMSP(https://tcmspw.com/tcmsp.php)得到山奈酚药物作用靶点,利用蛋白标准化Uniprot 数据库(https://www.uniprot.org/)对山奈酚相关靶点进行统一转化。
1.2 KOA 相关靶点筛选
以“knee osteoarthritis”为检索和筛选KOA 相关靶基因的关键词,通过GeneCards 数据库(https://www. genecards. org/)、OMIM 数 据 库(https://omim.org/)、PharmGKB 数据库(https://www. pharmgkb. org)、TTD 数 据 库(http://db.idrblab.net/ttd/)、Drugbank 数 据 库(https://www.drugbank.ca/)得到KOA 相关靶基因。合并5 个疾病数据库靶点,删除重复基因得到与KOA 相关的靶基因。
1.3 山奈酚-KOA 网络构建
基于筛选出的山奈酚潜在靶点,借助Cytoscape3.8.0 构建山奈酚靶点网络图。利用R 4.0.3 Venn 工具包绘制山奈酚与KOA 相关靶点Venn 图,取其交集,得到共同靶点,再利用Cytoscape3.8.0 构建山奈酚与KOA 的共有靶点网络图。
1.4 共同靶点GO 分析与KEGG 富集分析
为进一步了解得到的交集网络在基因功能和相关信号通路上的具体作用,运用DAVID 6.8(https://david.ncifcrf.gov/)数据库对筛选出的靶点蛋白进行GO 功能富集分析与KEGG 通路富集分析(P值过滤条件及校正后的过滤条件均小于0.05),并借助R 4.0.3 中的clusterProfiler 包结合enrichplot包对富集分析结果及通路进行可视化处理。
1.5 分子对接
为进一步了解山奈酚和所筛选体内受体靶点的结合模式和亲和力,进入PubChem 数据平台(https://pubchem.ncbi.nlm.nih,gov/)下载山奈酚的2D 结构,将其导入Chem3D 14.0.0.117 软件进行结构优化并转换为3D 结构。利用RCSB 数据平台(https://www.rcsb.org/)下载靶点蛋白的3D PDB格式文件;运用PYMOL 2.5.0 对蛋白进行去水分子和小分子配体等处理后导入Auto Dock Tools1.5.6软件对关键靶点进行加氢、计算电荷等处理。并加极性氢,加载电荷,构建活性口袋;利用Vina1.1.2 软件将目标靶点与山奈酚进行分子对接,以结合能作为对接评价指标,导入PYMOL 2.5.0 软件进行可视化处理。
1.6 山奈酚干预KOA 验证性实验
1.6.1 实验动物及分组 SPF 级8 周龄C57BL 雄性小鼠18 只,由湖南中医药大学动物实验中心提供。将小鼠随机分为假手术组、模型组、山奈酚组。各组小鼠在相同条件下自由饮水、摄食,由湖南中医药大学实验动物中心饲养。本实验方案由湖南中医药大学伦理委员会审核(伦理编号:LL2020 121601)。
1.6.2 造模及给药 使用小动物呼吸麻醉机,2%异氟烷麻醉小鼠,右侧膝关节脱毛膏脱毛,碘伏消毒小鼠膝关节部位,半月板内侧失稳手术(destabilization of the medial meniscus,DMM)手术诱导KOA模型[9]。模型组:右膝关节内侧髌韧带与内侧副韧带间切约0.5 cm 切口,显微镜下用显微剪切断内侧半月板胫骨韧带,缝合皮肤切口;假手术组:行假手术造模,在右膝关节内侧髌韧带与内侧副韧带中间开0.5 cm 切口,缝合皮肤切口。伤口处碘伏擦拭,放回笼内,等待小鼠苏醒。山奈酚组每日予以50 mg/kg 山奈酚灌胃[10],假手术组和模型组每日予以同体积生理盐水灌胃;持续8 周。
1.6.3 药物、试剂、仪器 山奈酚(纯度≥98.0%,HPLC 分析,江苏永健医药科技有限公司),脱毛膏(利洁时公司,印度),异氟烷气体麻醉剂(瑞沃德,Batch NO.217140901),多聚甲醛(国药试剂有限公司,80096618),无水乙醇(国药试剂有限公司,10009218),番红O-固绿染液(北京雷根生物技术有限公司,生产批号DB0082),氨水(国药试剂有限公司,10002118),二甲苯(国药试剂有限公司,10023418),氢 氧 化 钠(General-Reagent,G19852 H),世泰组织包埋盒(江苏世泰实验器材有限公司,REF31050102W),世泰黏附载玻片(江苏世泰实验器材有限公司)。全蛋白提取试剂盒(南京建成),BCA 蛋白浓度检测试剂盒(南京建成),兔抗小鼠CASP3 、BAX、BCL-2 抗体(Abcam,1∶500),HRP标记的山羊抗兔二抗IgG(CST,1∶1 000),小动物麻 醉 机(Matrx VMR 美 国),脱 水 机(LEICA,TP1020),包埋机(LEICA,EG1150C)等。
1.6.4 膝关节组织形态学观察 持续灌胃8 周后使用小动物呼吸麻醉机,2%异氟烷深度麻醉小鼠后脱颈处死并取膝关节,4% 多聚甲醛固定;10%EDTA 脱钙4 周,组织脱水,石腊包埋,5 μm 矢状位连续切片,进行番红O-固绿染色,并用国际骨关节炎研究协会(osteoarthritis research society international,OARSI)评分系统分析软骨退变程度[11],利用Image-J v1.50i 软件统计小鼠胫骨软骨面积。
1.6.5 Western blot 检测 采用Western blot 法检测软骨中BCL-2、BAX、CASP3 蛋白水平。将软骨组织与RIPA 裂解液混合,研磨10~15 min,在冰上搅拌30 min 收集上清。BCA 法测定蛋白浓度,经凝胶电泳转膜封闭后,孵育相应一抗和二抗,显影并采集图像。
1.7 统计学处理
实验数据采用GraphPad Prism7.0 软件处理,结果采用均数±标准差(±s)表示。满足正态分布,且方差齐时用单因素方差分析(one-way ANOVA);当方差不齐时,采用Dunnett's T3 检验。不满足正态分布时,则采用非参数检验;两两比较采用LSD 法。P<0.05 表示差异有统计学意义。
2 结果
2.1 山奈酚干预KOA 的潜在靶点网络图
TCMSP 数据库发现山奈酚共有作用靶点63个,包括BAX、PTGS2、MMP1 等,见图1A。检索Gene-Cards、OMIM、PharmGKB、TTD、Drugbank 5个疾病基因相关数据库,共得到与KOA 疾病发生密切相关的1 637 个靶基因。其中,GeneCards 1 579 个、OMIM 6 个、PharmGKB 9 个、TTD 2 个、Drugbank 71 个,将5 个数据库的结果绘制Venn 图,如图1B 所示。将上述筛选得到的山奈酚63 个靶点与KOA 疾病相关的1 637 个靶点取交集,得到35 个共同靶点,其中包括BCL2、BAX、CASP3 等,如图1C 所示。
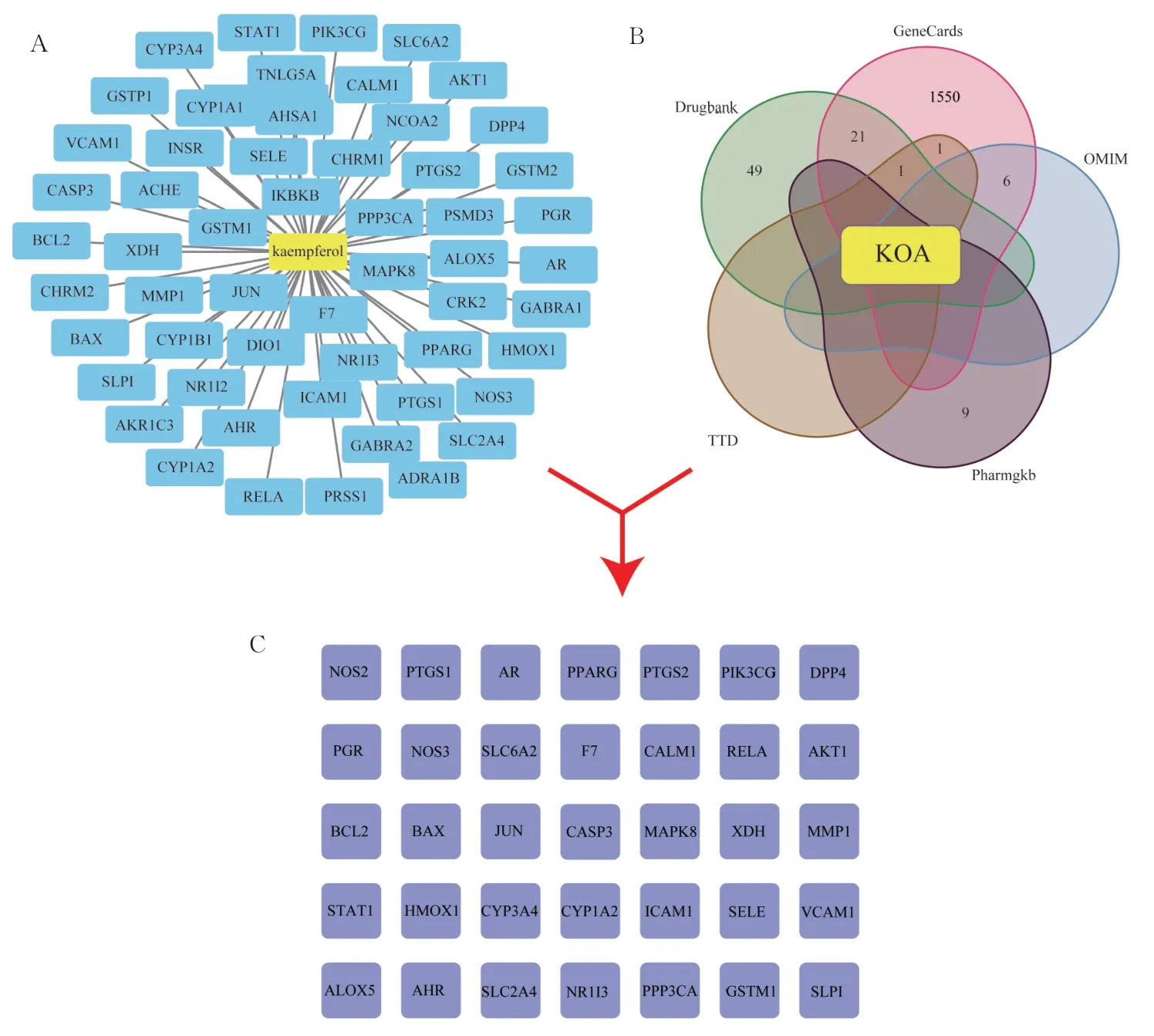
图1 山奈酚治疗KOA 的潜在靶点网路图Fig 1 Network of potential targets for the treatment of KOA with kaempferol
2.2 共同靶点GO 与KEGG 富集分析
借助DAVID 6.8 数据库对山奈酚治疗KOA 相关靶点进行信号通路与生物学过程(biological process,BP)、细胞组分(cell component,CC)和分子功能(molecular functions,MF)富 集 分 析,并 利 用R4.0.3 工具包制作气泡图。结果显示:山奈酚主要参与的生物学过程包括外源性凋亡信号通路(extrinsic apoptotic signaling pathway)、凋亡信号通路的负调控(negative regulation of apoptotic signaling pathway)、氧化应激反应(response to oxidative stress)等,见图2A。参与的通路主要有细胞凋亡(apoptosis)、肿瘤坏死因子信号通路(TNF signaling pathway)等,见图2B。

图2 山奈酚-KOA 靶点与通路的KEGG 与GO 富集分析Fig 2 GO analysis and KEGG pathway enrichment analysis of kaempferol-KOA
2.3 山奈酚与BCL-2、BAX、CASP3 对接良好
通过分子对接来评估蛋白质与配体的结合潜能以进一步了解药物与所筛选作用靶点的相关性。利用Auto Dock1.5.6 对山奈酚治疗KOA 的3 个靶点(BCL-2、BAX、CASP3)进行结合能预测。根据参考文献[12]表明配体与受体的结合能力为-7.0 kcal/mol 具有明显结合活性,-5.0 kcal/mol 具有较好结合活性,-4.0 kcal/mol 有一定结合活性。结果表示,3 个靶点均存在较好结合能力,山奈酚与BCL-2 受 体 结 合 能 力 为-8.3 kcal/mol,与BAX 受体结合能力为-6.6 kcal/mol,与CASP3 受体结合能力为-6.8 kcal/mol,结合活性明显。将山奈酚与BCL-2、BAX、CASP3 的 对 接 结 果 导 入PYMOL 2.5.0,如图3 所示。

图3 山奈酚与BCL-2、BAX、CASP3 的分子对接图Fig 3 Visualization of kaempferol-targets(BCL-2,BAX,CASP3)docking
2.4 山奈酚能够减轻关节软骨损伤
通过番红O-固绿染色发现,假手术组小鼠膝关节关节软骨完整,软骨表面光滑,无粗糙与缺损,半月板完整,无明显病理表现。模型组与山奈酚组胫骨侧关节软骨厚度明显降低,软骨面粗糙、缺损。统计分析发现,与假手术组比较,模型组小鼠膝关节关节软骨OARSI 评分(5.20±0.57)显著升高(P<0.001),胫骨软骨面积[(1 408.00±174.00)mm2]显 著 减 少(P<0.001)。山奈酚干预后,与模型组比较,山奈酚组小鼠关节软骨OARSI 评分(3.00±0.61)明显改善(P<0.001),软骨面积[(2 522.40±439.10)mm2]较 模 型 组 明 显 增 加(P<0.01)。 如 图4所示。

图4 小鼠膝关节番红O-固绿染色(40×,200×)、OARSI 评分和软骨面积Fig 4 Mice knee joints stained with safranin O-fast green and determination of OARSI score and cartilage area
2.5 山奈酚能够调控BCL-2、BAX、CASP3 蛋白表达
Western blot 检测发现,模型组小鼠膝关节软骨中BAX、CASP3 蛋 白 表 达 量[(0.46±0.04),(0.54±0.06)]较假手术组[(0.15±0.02),(0.24±0.08)]显著升高(P<0.01~0.001),而BCL-2 表达则显著降低[(0.05±0.01),(P<0.001)];经山奈酚干预,小鼠软骨BAX、CASP3 蛋白表达量显著降低[(0.31±0.04),(0.37±0.06)(P<0.05~0.01)],而BCL-2 蛋白表 达则显著升高[(0.17±0.02),P<0.05]。表明山奈酚对软骨细胞凋亡具有显著抑制作用,见图5。

图5 小鼠膝关节软骨的BAX、BCL-2、CASP3 表达Fig 5 BAX,BCL-2 and CASP3 protein expression by Western blot assay
3 讨论
KOA 是中老年人常见的关节疾病,不仅可以导致关节疼痛、畸形和功能障碍,还可显著升高心血管事件、下肢深静脉血栓栓塞、髋部骨折以及全因死亡率的风险[13]。中华医学会骨科学分会[13]、国际骨关节炎研究协会(OARSI)[14]等均推荐首选基础治疗。本研究拟寻求治疗KOA 的潜力药物,山奈酚是一种广泛存在于天然药品中的黄酮醇,被证实是重要的天然抗炎化合物之一,在关节炎、癌症、心血管等疾病中均发挥改善病情的作用,这与其降低炎症相关疾病的风险密切相关[15,16]。山奈酚广泛存在于多种中草药和复方制剂中,已有报道说明山奈酚等黄酮醇类化合物是经典名方独活寄生汤的有效化学成分之一,独活寄生汤多年来广泛应用于临床治疗KOA 等骨科疾病,并且取得了较好疗效[17]。本课题组前期已证实加味独活寄生合剂含药血清能通过调控Wnt 信号通路改善IL-1β 诱导的软骨细胞病理表现[18],并且该药可以通过降低OA 患者关节液中IL-1,TNF-α 及NO 水平改善关节功能及疼痛[19]。本研究首次系统地阐述了山奈酚通过调控BAX、BCL-2、CASP3 干预KOA 的作用机制。
作为天然食品药品的化学活性成分,山奈酚的副作用较小而作用广泛,受到了越来越多的关注,此前已有多项研究证实山奈酚对KOA 有积极作用。已有研究发现山奈酚通过调控NF-κB 和MAPK 通路表现出很强的抗炎和抗关节炎作用[6,7]。此外,Jiang 等[20]的研究发现山奈酚可能通过下调miR-146a、抑制Decorin 的表达而干预脂多糖诱导的软骨ATDC5 细胞凋亡和炎症反应。近期研究发现山奈酚可通过调节软骨细胞XIST/miR-130a/STAT3 轴抑制炎症和细胞外基质降解[21]。也有临床试验证实山奈酚在减轻KOA 疼痛和症状方面疗效显著[22]。网络药理学作为药物研究的一种方法,融合了药理学和生物学的多重优势,以药物-成分-靶点-通路的网络模式为特点,为药物与疾病之间的联系提供研究方法,并能反映药物多靶点、多通路的作用关系[8]。本研究通过网络药理学方法阐述山奈酚治疗KOA 的作用机制。笔者通过挖掘山奈酚和KOA 疾病发生、发展密切相关的靶基因,并构建了山奈酚与KOA 之间靶基因的网络关系,发现BCL2、BAX、CASP3、NOS2 和JUN 等是山奈酚干预KOA 的重要靶点。通过GO 和KEGG 富集分析,山奈酚参与外源性凋亡信号通路、凋亡信号通路的负调控和氧化应激反应等生物学过程干预KOA,且与细胞凋亡、肿瘤坏死因子信号通路等通路有关。细胞凋亡是一种受基因调控的程序性细胞死亡方式[23],对软骨发育和维持适当的动态平衡至关重要[24]。软骨退变是KOA 的关键特征,许多实验研究均表明软骨细胞凋亡在KOA 的进展中起着关键作用[25]。在KOA 病程中,软骨细胞在多种原因导致的炎症微环境刺激下发生凋亡,导致软骨功能受损[26]。因此,抑制软骨细胞凋亡可作为治疗KOA的重要方法。细胞凋亡机制非常复杂,与一系列的信号分子相关,其中BCL-2、BAX 和CASP3 是细胞凋亡通路中3 个关键的分子[27]。本实验分子对接验证了山奈酚与BCL-2、BAX 和CASP3 的结合能力,发现其不仅具有明显的结合能力,而且结合活性强。
Caspase 家族作为细胞凋亡的核心,最早发现于1985 年[28],根据其结构和功能可分为启动型和执行型,其中启动型Caspases 可以激活执行型CASP3,放大凋亡信号通路,激活的CASP3 可触发凋亡的级联反应,导致细胞快速死亡[29]。BCL-2 蛋白家族调节线粒体膜通透性,既可以促进凋亡又可以抗凋亡,其中抗凋亡蛋白包括BCL-2、BCL-X、BAG 等,促凋亡蛋白包括BAX、BCL-10、BID 等,这些蛋白具有特殊的意义,因为它们可以决定细胞凋亡还是终止凋亡[30]。因此抑制BAX、CASP3 的表达,促进BCL-2 的表达对降低软骨细胞凋亡至关重要[27]。研究表明,氧化应激与细胞凋亡密切相关,是机体内自由基产生的一种负面效应,在KOA 的发展中起着重要作用,活性氧的积累会对软骨细胞合成代谢的相关进程产生干扰,导致软骨细胞功能紊乱和变性,进而导致细胞凋亡[31]。而细胞外激刺激可通过TNF 受体基因家族激活外源性凋亡途径[32]。这些生物学过程和信号通路与本研究的GO和KEGG 富集结果一致,因此,细胞凋亡是山奈酚治疗KOA 的潜在分子机制。
本研究还对山奈酚治疗KOA 的疗效以及其对细胞凋亡关键靶点BCL-2、BAX 和CASP3 的调控进行了实验验证。实验结果表明,番红O-固绿染色发现DMM 诱导的小鼠膝关节软骨的退变,而山奈酚对软骨退变有明显的改善作用,且调控了软骨中BCL-2、BAX 和CASP3 蛋 白 水 平,与GO 和KEGG富集结果一致,本研究表明山奈酚组软骨凋亡水平受到抑制,通过降低KOA 小鼠软骨BAX、CASP3和增加BCL-2 蛋白水平发挥了延缓KOA 疾病进程的作用。
综上所述,本研究借助网络药理学及动物实验对山奈酚治疗KOA 潜在分子机制进行研究。研究结果证实山奈酚是一种潜在的治疗KOA 的有效药物,而抑制细胞凋亡是其可能的机制。
作者贡献度说明:
论文设计:卢敏,邝高艳;文献检索:米倚林,许晓彤;数据统计:米倚林,易南星,许晓彤,杨烙坚;图表制作:米倚林,易南星,李佳宾,陈树源;文稿撰写:米倚林,易南星;基金获取:卢敏,邝高艳。
