刺槐素对鞭毛蛋白诱导的小鼠骨髓巨噬细胞NLRC4 炎症小体活化的影响
2022-09-17王兆霞张晓玲叶勒丹马汉吴选霞
王兆霞,补 娟,张晓玲,叶勒丹·马汉,吴选霞,周 玲
(1.新疆医科大学,新疆 乌鲁木齐 830000;2.新疆维吾尔自治区人民医院,医学研究与转化中心,新疆 乌鲁木齐 830000)
NLRC4 炎症小体是一种参与炎症反应的多聚蛋白复合物,可通过识别病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)或内源性的损伤相关分子模式(damage associated molecular patterns,DAMPs)活化,进一步激活半胱氨酸天冬氨酸特异蛋白酶-1(cysteine-aspartic proteases-1,caspase-1),促进白介素-1β(interleukin-1β,IL-1β)前体和白介素-18(interleukin-18,IL-18)前体切割为活性形成参与炎症反应。另一方面,caspase-1还可通过切割蛋白消皮素D(gasdermin D,GSDMD),释放N 端结构域并作用于细胞膜上,使其完整性丧失,引起细胞焦亡(pyroptosis)[1]。多项研究证明,NLRC4 炎症小体在如心肌梗死[2,3],缺血性脑卒中[4]、糖尿病肾病[5]、哮喘[6]、结肠炎[7]、肺炎[8,9]等多种疾病中均发挥重要作用,因此抑制NLRC4 炎症小体的激活对治疗相关疾病具有重要临床意义。
刺槐素是一种黄酮类化合物,具有抗肿瘤、抗炎、抗氧化、神经保护等作用,对缺血性脑卒中[10,11]、肺炎[12]、关节炎[13]、结肠炎[14]等炎症相关疾病均具有保护作用,抗炎抗氧化机制比较复杂。前期课题组研究发现刺槐素可抑制含NLR 家族Pyrin 域蛋白3(NLRP3)炎症小体的活化进而减少小鼠骨髓巨噬细 胞 中IL-1β 的 释 放[15]。NLRP3 炎 症 小 体 和NLRC4 炎症小体同属于NLR 家族,激活后可介导caspase-1 活化,促进IL-18 以及IL-1β 的成熟与分泌,参与炎症反应[16]。刺槐素是否能抑制NLRC4 炎症小体活化目前尚未见文献报道。本研究通过利用小鼠骨髓巨噬细胞BMDMs,鞭毛蛋白诱导NLRC4 炎症小体激活,通过检测Pro-caspase-1、Pro-IL-1β、IL-1β、IL-18 等相关因子,以此探讨刺槐素对NLRC4炎症小体的活化及细胞损伤的影响,为刺槐素的药理作用研究提供一定的理论基础。
1 材料与方法
1.1材料 刺槐素(Acacetin)购自美国sigma 公司;鞭毛蛋白购自美国InvivoGen 公司;DMEM(高糖)培养基、PBS、0.25%胰蛋白酶溶液等均购自上海Excell Bio 公司;RIPA 裂解液购自Abcam 公司;IL-1β 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、IL-18 ELISA 试剂盒购自杭州联科生物有限公司;caspase-1 抗体和IL-1β抗体购自美国Abcam 公司;LDH 试剂盒购自南京建成公司;荧光倒置显微镜购自日本尼康公司;蛋白电泳仪、化学发光成像仪、多功能酶标仪均购自美国BIO-RAD 公司。
1.2 方法
1.2.1小鼠骨髓巨噬细胞(BMDMs)分离培养 选用体质量(25±5)g 的3 月龄C57BL/6 小鼠,购自新疆医科大学(许可证号:SCXK(新)2018-0002)。小鼠自由进食饮水,饲养环境为室温为21~25℃,相对湿度为50%~60%,通风良好。颈椎脱臼处死,分离出小鼠两侧股骨至超净台,分离肌肉,暴露骨质后从两端剪开,用注射器将骨髓细胞吹至50 mL 离心管,然后离心1 500 r/min,5 min。红细胞裂解液重悬,反复吹打,静置3 min 后加入含10%FBS 及1%双抗的DMEM 培养基混匀,1 500 r/min,5 min。用含粒细胞巨噬细胞集落刺激因子(10 ng/mL)的DMEM 培养基重悬。反复吹打使细胞混匀,然后将细胞悬液转移到培养皿,于37℃细胞培养箱培养。每天显微镜下观察细胞状态,呈长梭形,说明状态良好,开始后续实验。
1.2.2 细胞分组及培养 待细胞培养覆盖至80%培养皿时,将其分为4 组:对照组、LPS 组、LPS+鞭毛蛋白组和LPS+Acacetin+鞭毛蛋白组。对照组:给予BMDM 加入完全培养基;LPS 组:加入完全培养基,再加入LPS(50 ng/mL,3 h);LPS+鞭毛蛋白组:加入完全培养及LPS(50 ng/mL,3 h),再加入鞭毛蛋白(10 μmol/L)刺激0.5 h;LPS+Acacetin+鞭毛蛋白组:加入完全培养基、LPS(50 ng/mL,3 h)及Acacetin(10 μmol/L)刺激0.5 h;再加入鞭毛蛋白(10 μmol/L)处理0.5 h。
1.2.3 蛋白质免疫印迹技术(western-blot,WB)检测pro-caspase-1、pro-IL-1β、caspase-1 和IL-1β 的表达水平 将离心后的无细胞上清转移至新的离心管中,加入等体积的甲醇和四分之一体积的氯仿,混匀,12 000 r/min 离心5 min,弃上清,再加入甲醇,离心5 min,弃上清,55℃金属浴干燥5 min 后备用;收集细胞样本,胰酶消化离心后,加入500 μL RIPA裂解液(已加入蛋白酶抑制剂),充分混匀,冰上放置40 min 后,12 000 r/min,4℃,离心15 min 收集上清备用。用BCA 法蛋白定量后取30 μg 进行SDSPAGE 电泳,湿转法将凝胶上蛋白转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,在室温下用5%脱脂奶粉封闭2 h,分别加入抗体caspae-1(1∶1000)、IL-1β(1∶500)和β-actin(1∶1000),4℃摇床孵育过夜,TBST 水洗3 次,每次10 min,加入对应的稀释二抗溶液(1∶5000),室温下摇床孵育1 h,TBST 水洗3 次,每次10 min,增强化学发光剂(enhanced chemilum inescence,ECL)显色并用凝胶成像系统拍照。
1.2.4 ELISA 法 检 测 细 胞 上 清 中IL-1β、IL-18 和TNF-α 的含量 按照上述步骤处理细胞24 h,收集各组细胞的上清液,按照酶联免疫吸附试剂盒说明书 的 提 示 按 步 骤 检 测IL-1β、IL-18 和TNF-α 的水平。
1.2.5 乳酸脱氢酶(LDH)检测 收集每组细胞上清液,按照LDH 试剂盒说明书进行操作。酶标仪检测波长450 nm 吸光度值。1.3 统计学处理
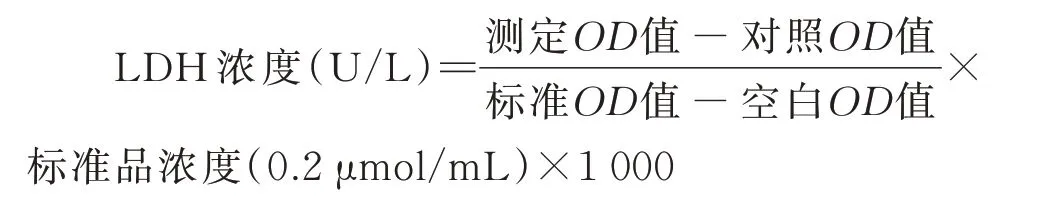
采用SPSS21.0 统计学软件进行分析。各组实验数据以平均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 刺槐素对NLRC4 炎症小体活化的影响
Western blot 结果见图1,各组细胞裂解液中Pro-caspase-1、Pro-IL-1β 蛋白表达比较差异无统计学意义(P>0.05);与对照组相比,LPS+鞭毛蛋白组细胞上清液caspase-1、IL-1β 的表达量明显上调,差异具有统计学意义(P<0.05);与LPS+鞭毛蛋白组相比,LPS+Acacetin+鞭毛蛋白细胞上清液caspase-1、IL-1β 的表达量明显下降,差异具有统计学意义(P<0.05),见表1、2。

图1 刺槐素对鞭毛蛋白诱导的巨噬细胞的Pro-caspase-1、Pro-IL-1β、caspase-1、IL-1β 蛋白水平的影响Fig 1 Effect of Acacetin on expression of Pro-caspase-1,Pro-IL-1β,caspase-1,IL-1β protein in flagellin-induced macrophage inflammatory
表1 刺槐素对鞭毛蛋白诱导的巨噬细胞裂解液中Pro-caspase-1、Pro-IL-1β 蛋白水平的影响(n=3,±s)Tab 1 Effect of Acacetin on expression of Pro-caspase-1,Pro-IL-1β protein in flagellin-induced macrophage lysate(n=3,±s)

表1 刺槐素对鞭毛蛋白诱导的巨噬细胞裂解液中Pro-caspase-1、Pro-IL-1β 蛋白水平的影响(n=3,±s)Tab 1 Effect of Acacetin on expression of Pro-caspase-1,Pro-IL-1β protein in flagellin-induced macrophage lysate(n=3,±s)
组别对照组LPS 组LPS+鞭毛蛋白组LPS+Acacetin+鞭毛蛋白组FP Pro-caspase-1 0.685±0.015 0.656±0.081 0.694±0.090 0.666±0.057 0.197 0.896 Pro-IL-1β 0.820±0.050 0.823±0.050 0.864±0.016 0.873±0.052 1.142 0.389
表2 刺槐素对鞭毛蛋白诱导的巨噬细胞上清液中caspase-1、IL-1β 蛋白水平的影响(n=3,±s)Tab 2 Effect of Acacetin on expression of caspase-1,IL-1β protein in flagellin-induced macrophage supernatant(n=3,±s)

表2 刺槐素对鞭毛蛋白诱导的巨噬细胞上清液中caspase-1、IL-1β 蛋白水平的影响(n=3,±s)Tab 2 Effect of Acacetin on expression of caspase-1,IL-1β protein in flagellin-induced macrophage supernatant(n=3,±s)
注:与对照组比较,△P<0.05;与LPS 组比较,▲P<0.05;与LPS+鞭毛蛋白组比较,◇P<0.05。
组别对照组LPS 组LPS+鞭毛蛋白组LPS+Acacetin+鞭毛蛋白组FP caspase-1 0.153±0.010 0.174±0.009 0.505±0.020△▲0.352±0.080△▲◇47.3<0.00 01 IL-1β 0.066±0.005 0.073±0.004 0.411±0.030△▲0.189±0.029△▲◇174.2<0.00 01
2.2 刺槐素对鞭毛蛋白诱导的小鼠骨髓巨噬细胞炎性因子释放的影响
与对照组比较,LPS+鞭毛蛋白组细胞上清液IL-1β、IL-18 和TNF-α 的表达量上调(P<0.05);与LPS+鞭毛蛋白组相比,LPS+刺槐素+鞭毛蛋白组细胞上清液IL-1β 的表达量下降,差异具有统计学意义(P<0.05);IL-18 和TNF-α 的表达量下降,但差异无统计学意义(P>0.05)见表3。
表3 刺槐素对鞭毛蛋白诱导的巨噬细胞的上清液中IL-1β、IL-18 和TNF-α 水平的影响(pg/mL,n=3,±s)Tab 3 Effect of Acacetin on expression of IL-1β,IL-18 and TNF-α protein in flagellin-induced macrophage supernatant(pg/mL,n=3,±s)

表3 刺槐素对鞭毛蛋白诱导的巨噬细胞的上清液中IL-1β、IL-18 和TNF-α 水平的影响(pg/mL,n=3,±s)Tab 3 Effect of Acacetin on expression of IL-1β,IL-18 and TNF-α protein in flagellin-induced macrophage supernatant(pg/mL,n=3,±s)
注:与对照组比较,△P<0.05;与LPS 组比较,▲P<0.05;与LPS+鞭毛蛋白组比较,◇P<0.05。
组别对照组LPS 组LPS+鞭毛蛋白组LPS+Acacetin+鞭毛蛋白组FP IL-1β 47.735±1.265 85.443±42.909 1 519.461±56.019△▲656.763±57.439△▲◇6 884.1<0.000 1 IL-18 1.294±0.686 1.942±1.452 11.291±0.349△▲10.293±1.197△▲82.13<0.000 1 TNF-α 19.346±14.528 1 558.217±67.179△2 978.403±58.542△▲2 811.843±245.629△▲329.1<0.000 1
2.3 刺槐素对鞭毛蛋白诱导的小鼠骨髓巨噬细胞损伤的影响
与对照组相比,LPS 组的LDH 活性显著升高,LPS+鞭毛蛋白组LDH 的活性则升高更明显(P<0.05),与LPS+鞭毛蛋白组相比,LPS+Acacetin+鞭毛蛋白组LDH 活性明显降低,差异具有统计学意义(P<0.05),见表4。
表4 刺槐素对鞭毛蛋白诱导的巨噬细胞上清液中LDH 活性的影响(U/L,n=3,±s)Tab 4 Effect of Acacetin on the activity of LDH in flagellininduced macrophage supernatant(U/L,n=3,±s)
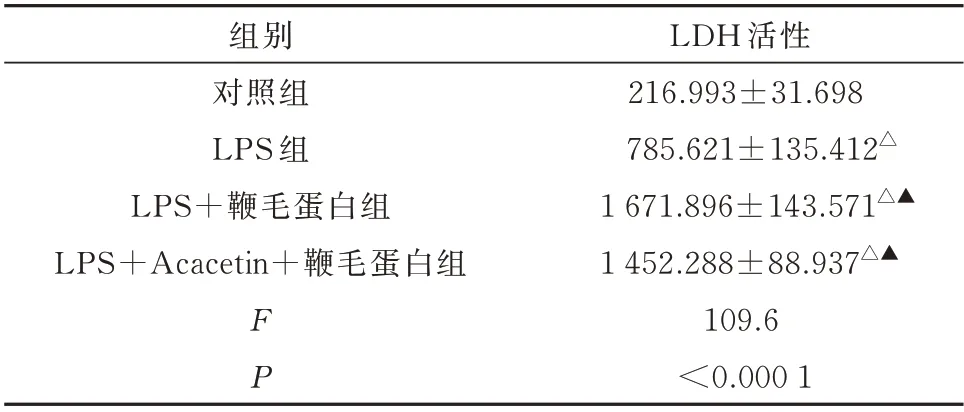
表4 刺槐素对鞭毛蛋白诱导的巨噬细胞上清液中LDH 活性的影响(U/L,n=3,±s)Tab 4 Effect of Acacetin on the activity of LDH in flagellininduced macrophage supernatant(U/L,n=3,±s)
注:与对照组比较,△P<0.05;与LPS 组比较,▲P<0.05
组别对照组LPS 组LPS+鞭毛蛋白组LPS+Acacetin+鞭毛蛋白组FP LDH 活性216.993±31.698 785.621±135.412△1 671.896±143.571△▲1 452.288±88.937△▲109.6<0.000 1
3 讨论
NLRC4 炎症小体是参与免疫应答的重要的感受器,可引起炎症反应和细胞焦亡。多项研究证明,NLRC4 炎症小体在多种炎症相关疾病中扮演重要角色,因此抑制NLRC4 炎症小体的活化可能是治疗炎症相关疾病的潜在靶点。Ahn 等[17]在细胞实验发现,金丝桃苷可通过减少IL-18、IL-1β 和caspase-1 的分泌,抑制NLRC4 炎症小体的激活;Ahn等[18]通过骨髓巨噬细胞实验发现,亚甲蓝可剂量依赖性地抑制鞭毛蛋白介导的IL-1β 和caspase-1 的分泌,说明亚甲蓝可抑制NLRC4 炎症小体的激活,从而发挥抗炎作用;Hou 等[19]研究发现,蓝萼甲素可减少caspase-1 和IL-1β 的成熟和分泌,通过抑制NLRC4 炎症小体活化发挥抗炎作用。
刺槐素(Acacetin)又称刺槐黄素、阿卡西汀、金合欢素,是一种黄酮类化合物,多个研究证实刺槐素具有抗炎作用。如Wu 等[20]通过在小鼠体内体外实验中发现,刺槐素可通过减少肺组织中的TNF-α和IL-1β 的释放,抑制活性氧的产生,减轻肺组织水肿,从而保护LPS 诱导的细胞损伤;Ren 等[14]研究发现,刺槐素可通过使NO、IFN-γ、iNOS 的分泌减少,IL-1β、TNF-α、IL-6 的表达下调,进而减轻结肠黏膜结构的破坏、溃疡和炎症浸润,使体重减轻,出血性腹泻和结肠长度缩短等症状减轻,从而对溃疡性结肠炎发挥保护作用;郑建君等[11]通过动物实验研究发现,刺槐素可通过抑制TGF-β1、Smad3 mRNA 和蛋白的表达,抑制TGF-β1/Smad3 信号通路,对急性脑梗死大鼠表现出较强的神经保护作用。
本研究通过用BMDMs 细胞实验,利用鞭毛蛋白刺激小鼠骨髓巨噬细胞来激活NLRC4 炎症小体,探讨刺槐素对NLRC4 炎症小体活化的影响。研究结果显示,LPS 组上清液中成熟的caspase-1 和IL-1β 的表达量和对照组无明显差异,LPS+鞭毛蛋白组NLRC4 炎症小体活化后上清液中成熟的caspase-1 和IL-1β 明显升高,加入刺槐素干预后,可显著抑制caspase-1 和IL-1β 的表达,并减少炎性因子IL-1β 和IL-18 的释放,但对pro-caspase-1 和pro-IL-1β 的表达影响不显著,表明刺槐素可抑制IL-1β 的分泌,对产生无影响。因此,笔者推断刺槐素可抑制鞭毛蛋白诱导的小鼠骨髓巨噬细胞NLRC4 炎症小体的活化,减少炎症反应。
LDH 通常存在于细胞质中,当细胞质膜受损或者死亡时可释放到细胞外。因此,笔者通过检测LDH 的浓度来反映细胞的损伤情况,本次研究结果显示用鞭毛蛋白刺激巨噬细胞后LDH 的浓度明显上升,经刺槐素治疗后LDH 的浓度显著下降,说明刺槐素可减少细胞的损伤。
综上所述,刺槐素可抑制鞭毛蛋白诱导的NLRC4 炎症小体的激活,降低细胞炎性反应,减少细胞损伤,为后续进一步对刺槐素的研究和临床应用提供理论基础。但刺槐素抑制NLRC4 炎症小体活化的具体机制尚不明确,今后将进一步研究其具体作用机制,这也是下一步的重点研究内容。
作者贡献度说明:
王兆霞:负责参与实验、查阅文献及论文撰写;补娟:负责课题设计指导及实验指导;张晓玲:负责试剂和相关耗材购买,并参与实验;叶勒丹·马汉:负责数据分析;吴选霞:负责参与实验;周玲:负责课题设计、文章写作指导。
