切向流过滤结合超速离心分离小细胞外囊泡方法的建立
2022-09-17王灵李梦诗徐莎陈国栋王越
王灵,李梦诗,徐莎,陈国栋,王越
1.海军军医大学转化医学研究中心干细胞与再生医学研究室,上海 200433;2.海军军医大学转化医学研究中心,上海 200433;3.上海市细胞工程重点实验室,上海 200433
小细胞外囊泡是由细胞分泌的纳米级囊泡,内部含核酸、蛋白质、小分子等物质,能在细胞间发挥信息交流的作用[1-2]。近年来陆续有研究报道,外泌体等小细胞外囊泡由于与母本细胞具有较高的相似性,相较于人工纳米颗粒,具有更低的免疫清除率和细胞毒性,有望成为新一代的体内药物载体[3-4]。目前的研究发现,几乎所有类型的细胞均能分泌小细胞外囊泡,基于细胞外囊泡的载药研究已逐步由实验室研究转向临床应用[5]。但在细胞外囊泡载药治疗研究的开展过程中,如何大批量获取细胞外囊泡成为瓶颈问题[6]。
常规的小细胞外囊泡分离方法主要包括超速离心法[7]、密度梯度分离[8]、尺寸排阻色谱柱[9]、聚乙二醇沉淀法[10]等。聚乙二醇沉淀法易获取、产量较高,但会同时沉淀出其他杂蛋白;密度梯度分离和尺寸排阻色谱柱分离纯度较高,但获取效率较低,耗时偏长;超速离心法最为常用,但处理体积受到仪器限制,难以进行大批量分离[11-12]。在过去几年中,切向流过滤逐步在脂质体、慢病毒等纳米颗粒分离中推广应用,与传统死端过滤不同,切向流过滤系统中的流体沿膜包表面切向流动,既不会堵塞过滤孔径,也可根据粒径大小适时调整,是一种有效的放大工艺[13]。
考虑到小细胞外囊泡的直径通常小于200 nm,其物理尺寸与脂质体、病毒类载体尺寸类似,因此我们使用0.45 μm和300 kD膜包切向流过滤对细胞上清中的小细胞外囊泡进行富集浓缩。本研究采用切向流过滤结合超速离心法分离小细胞外囊泡,以期提升小细胞外囊泡的分离效率,为细胞外囊泡载药的拓展应用提供实验依据。
1 材料与方法
1.1 细胞 人源脐带间充质干细胞购自弗元(上海)生物科技有限公司。
1.2 主要试剂及仪器 新生牛血清和BCA试剂盒购自碧云天生物技术有限公司;兔抗人CD63单克隆抗体(ab134045)和兔抗ALIX单克隆抗体(ab275377)购自美国Abcam公司;兔抗人CD9单克隆抗体(#13-174)和HRP标记的山羊抗兔IgG购自美国CST公司;切向流过滤夹具和膜包(规格分别为0.45 μm和300 kD)均购自杭州九龄科技有限公司;Amicon Ultra-15超滤离心管购自德国默克生命科学公司;纳米颗粒追踪分析仪(ZetaView PMX 110)购自德国Particle Metrix公司;超速离心机(XPN-100,配套转子为SW 32 Ti)购自美国贝克曼库尔特有限公司。
1.3 原始物料的配置 将新生牛血清置4℃解冻,加入DMEM基础培养基中,制成含10%新生牛血清的培养基作为测试分离小细胞外囊泡的原始物料。
1.4 细胞培养 将人源脐带间充质干细胞置于T25培养瓶中,加入完全培养基(含5%血小板裂解液和1%青-链霉素的DMEM基础培养基)5 mL,于37℃,5%CO2细胞培养箱中培养。当细胞融合度达70%~80%时,传代培养。
1.5 间充质干细胞条件培养基的获取 取培养的脐带间充质干细胞,在细胞融合至90%时弃去原培养基,PBS洗涤3次后添加无血清培养基DMEM培养24 h,收集间充质干细胞条件培养基,置-80℃保存。
1.6 超速离心法分离小细胞外囊泡 取原始物料或脐带间充质干细胞上清,在4℃条件下,依次300×g离心10 min收集上清、2 000×g离心30 min收集上清、10 000×g离心30 min收集上清、100 000×g离心70 min弃上清收集沉淀,将沉淀用50 μL PBS重悬后,置-80℃保存。
1.7 切向流过滤浓缩分离、浓缩小细胞外囊泡 组装切向流夹具,安装0.45 μm膜包,取原始物料或脐带间充质干细胞上清,在4℃条件下解冻,通过切向流过滤获得流出液作为下一步物料。将切向流过滤膜包更换为300 kD膜包,取上一步的流出液作为物料进行过滤、浓缩,物料体积浓缩为200 mL时终止过滤,收集浓缩液。切向流过滤模式图见图1。
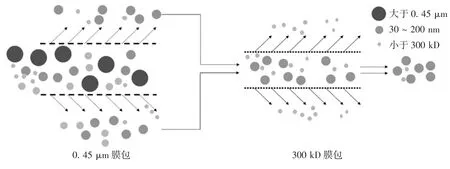
图1 切向流过滤模式图Fig.1 Pattern of TFF
1.8 100 kD超滤管超滤
1.8.1 1次超滤 取Amicon Ultra-15超滤离心管,加入15 mL切向流过滤浓缩液,放入摆桶转子,3 000×g离心15 min,回收离心获得的纯化产物即为1次100 kD超滤管浓缩产物。
1.8.2 2次超滤 取Amicon Ultra-15超滤离心管,加入15 mL 1次100 kD超滤管浓缩产物,放入摆桶转子,3 000×g离心15 min,回收离心获得的纯化产物即为2次100 kD超滤管浓缩产物。
1.9 细胞外囊泡形态的透射电镜观察 样本溶解后稍离心,吸取15 μL置于铜网上静置1 min,用滤纸将铜网上的样本吸干,吸取15 μL 2%醋酸双氧铀染色液,室温染色1 min,将样本置灯下烤10 min,透射电镜拍照观察。该检测委托和元生物技术(上海)有限公司进行。
1.10 切向流过滤后浓缩培养基的纳米颗粒追踪分析先用去离子水清洗样本池,再用聚苯乙烯微球(110 nm)校准纳米颗粒追踪分析仪(ZetaView PMX 110),再次用1×PBS清洗样本池,最后将样本用1×PBS稀释,进样检测。该检测委托和元生物技术(上海)有限公司进行。
1.11 蛋白表达的Western blot分析 在样本中加入等体积的RIPA裂解液(含1%蛋白酶抑制剂和磷酸酶抑制剂),置于冰上裂解30 min,用BCA试剂盒进行蛋白定量。取等量的蛋白,加入5×上样缓冲液,95℃金属浴10 min使蛋白变性,经10% SDSPAGE分离后转移至PVDF膜上,用5% BSA室温封闭1 h;分别加入CD63、ALIX、CD9抗体(均1∶1 000稀释),4℃孵育过夜;TBST缓冲液洗涤3次,加入HRP标记的山羊抗兔IgG(1∶5 000稀释),室温孵育1 h;清洗后加入增强型化学发光试剂(上海雅酶生物医药科技有限公司,SQ101)作用3 min,使用成像仪拍照观察。
2 结果
2.1 切向流过滤分离原始物料产物的鉴定 浓缩液产物经纳米颗粒追踪分析,发现颗粒直径主要分布在0~250 nm之间,见图2。对浓缩培养基进行透射电镜观察,发现存在大量杂蛋白,未见细胞外囊泡,见图3。提示需要后续工艺来进一步纯化细胞外囊泡。
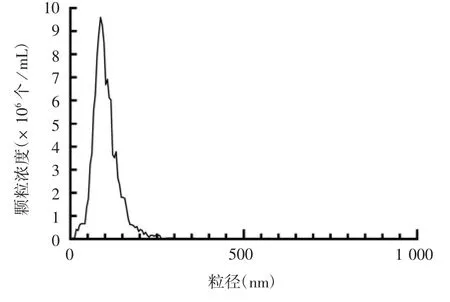
图2 切向流过滤浓缩产物的粒径分布Fig.2 Size distribution of concentrated product of isolate by TFF

图3 切向流过滤浓缩产物的透射电镜观察Fig.3 Transmission electron microscopy of concentrated product of isolate by TFF
2.2 100 kD超滤分离切向流过滤浓缩液产物的鉴定 浓缩液产物经100 kD超滤管1次和2次过滤纯化的产物经纳米颗粒追踪分析发现,颗粒直径仍主要分布在0~250 nm之间,但2次超滤会严重减少获得的颗粒数量,见图4。透射电镜观察发现,1次和2次超滤后的浓缩液里均未检测到囊泡样结构,仍存在较多的杂蛋白,见图5,因此,无法使用100 kD超滤纯化切向流过滤浓缩后的培养基。
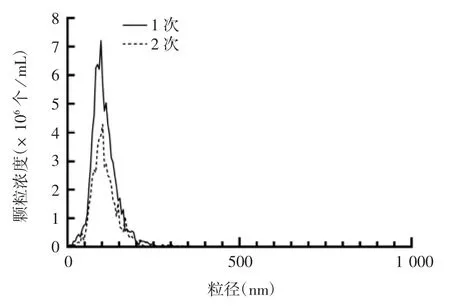
图4 切向流过滤浓缩产物经1次和2次100 kD超滤后产物的粒径分布Fig.4 Size distribution of concentrated products of isolates by TFF and subsequent 100 kD ultrafiltration for 1 and 2 times
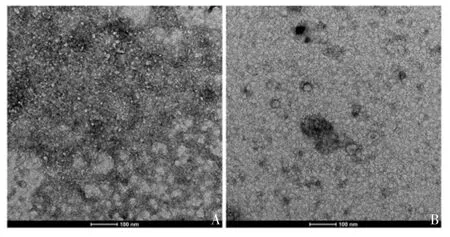
图5 切向流过滤浓缩产物经1次(A)和2次(B)100 kD超滤后的透射电镜观察Fig.5 Transmission electron microscopy of concentrated products of isolates by TFF and subsequent 100 kD ultrafiltration for 1(A)and 2(B)times
2.3 超速离心法分离切向流过滤浓缩液产物的鉴定超速离心产物经纳米颗粒追踪分析发现,纯化后的颗粒直径主要分布在0~250 nm之间,见图6。透射电镜下可在不同视野中均明确观察到囊泡样结构,见图7。表明使用切向流浓缩培养基后,可通过超速离心进一步分离纯化细胞外囊泡。
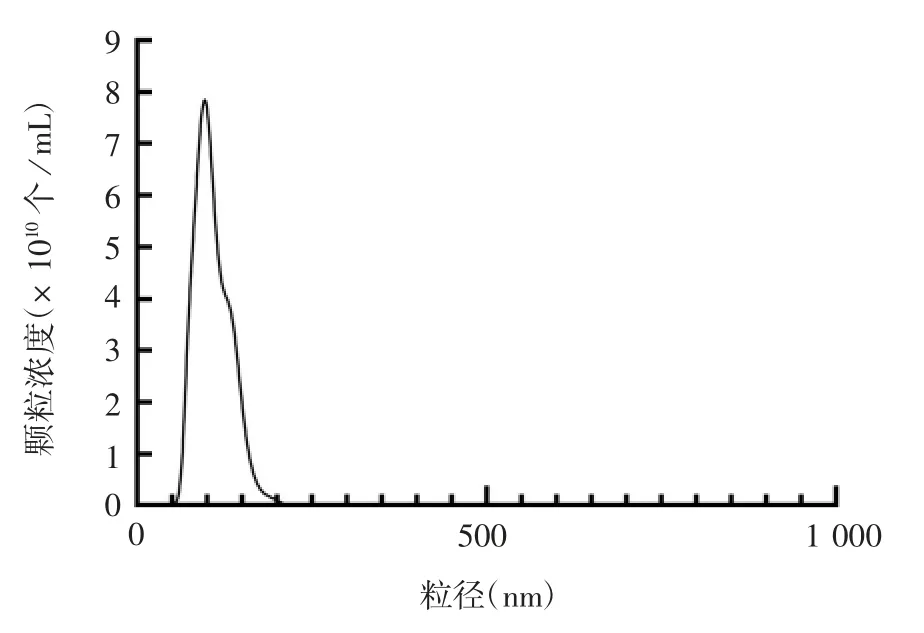
图6 切向流过滤浓缩产物经超速离心后的粒径分布Fig.6 Size distribution of concentrated product of isolate by TFF and subsequent ultracentrifugation
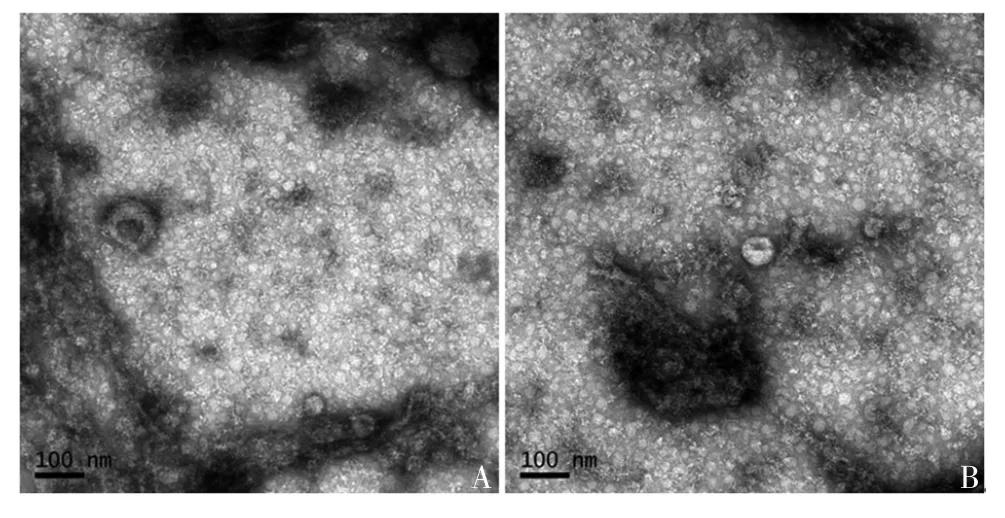
图7 不同视野下切向流过滤浓缩产物经超速离心后的透射电镜观察Fig.7 Transmission electron microscopy of concentrated products of isolates by TFF and subsequent ultracentrifugation under different visual fields
2.4 切向流过滤结合超速离心分离间充质干细胞条件培养基产物的鉴定 纳米颗粒追踪分析发现,纯化后产物的颗粒直径均主要分布在0~250 nm之间,见图8。透射电镜观察可见囊泡样结构,见图9。Western blot分析显示,纯化后的细胞外囊泡CD9、CD63和ALIX蛋白呈阳性表达,见图10,证明纯化的小细胞外囊泡中含有外泌体,因此该方法也可用于外泌体的分离提取。
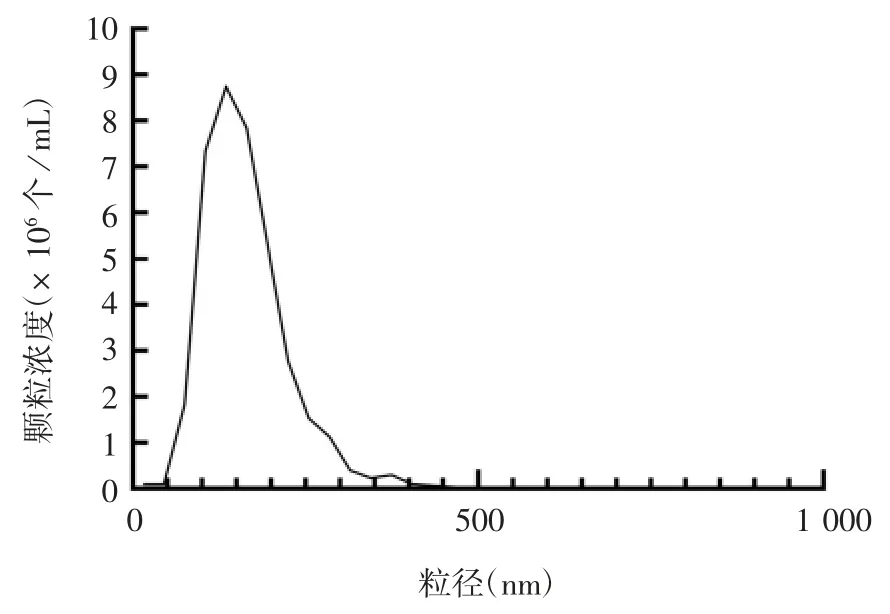
图8 切向流过滤结合超离分离脐带间充质干细胞上清产物的粒径分布Fig.8 Size distribution of product of umbilical cord mesenchymal stem cell supernatan tisolated by TFF combined with ultracentrifugation

图9 切向流过滤结合超离分离脐带间充质干细胞上清产物的透射电镜观察Fig.9 Transmission electron microscopy of product of umbilical cord mesenchymal stem cell supernatant isolated by TFF combined with ultracentrifugation
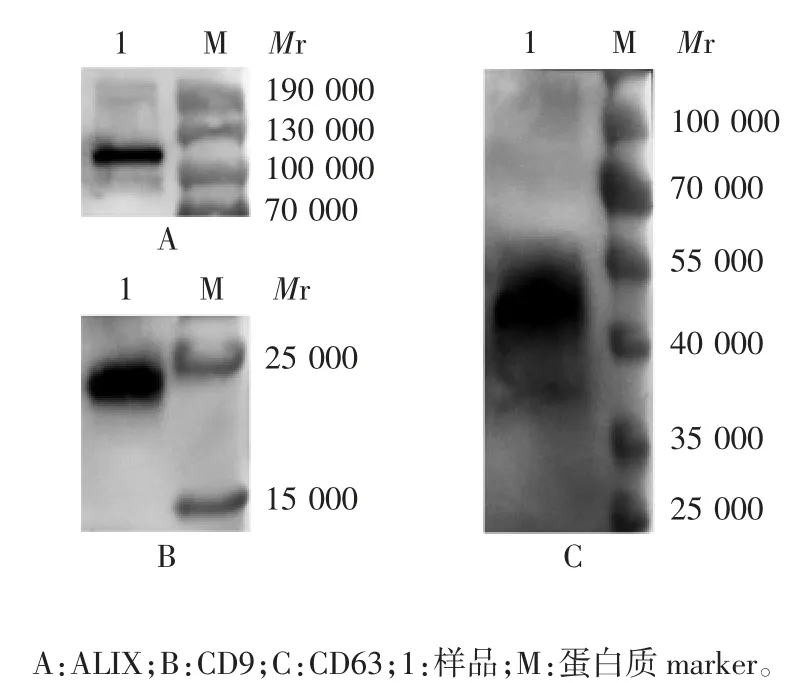
图10 切向流过滤结合超离分离脐带间充质干细胞上清产物的Western blot分析Fig.10 Western blotting of product of umbilical cord mesenchymal stem cell supernatant isolated by TFF combined with ultracentrifugation
3 讨论
由于血清中存在大量的细胞外囊泡,本实验配置含10%新生牛血清的DMEM培养基作为测试切向流分离小细胞外囊泡的原始物料。考虑到小细胞外囊泡粒径大小范围一般为30~200 nm[14],因此在切向流过滤系统中,选择0.45 μm膜包去除较大的杂蛋白和囊泡,选择300 kD膜包过滤去除小分子蛋白,并对培养基中的小细胞外囊泡进行浓缩。随后,本实验检测了100 kD超滤管过滤对切向流过滤浓缩液的分离效果,发现使用100 kD超滤管分别进行1次过滤和2次过滤均无法获得细胞外囊泡。
超速离心作为分离小细胞外囊泡的常规方法,能够有效地从细胞上清中分离、纯化小细胞外囊泡,但该方法能否用于分离浓缩后的细胞上清目前尚不明确。本实验发现,切向流过滤后的浓缩培养基能够通过超速离心获取细胞外囊泡,证明该方法可应用于实际生产中大批量的小细胞外囊泡分离。
以外泌体为代表的小细胞外囊泡治疗应用目前已得到越来越多的重视[15-16],但在相关临床试验开展过程中,如何快速、高效地分离小细胞外囊泡一直是亟待解决的问题[17-18]。聚乙二醇沉淀法、尺寸排阻柱法等方法在分离过程中会引入化学试剂,难以应用于临床治疗中;超速离心法不涉及外源物质的添加,但分离耗时较长,难以应用于产业化批量制备[19-23]。前期有研究发现,可使用切向流过滤来富集外泌体[24-26],但切向流过滤与超速离心法的结合能否进一步提升小细胞外囊泡的分离效率尚不明确。本实验在前期研究的基础上,进一步证明了切向流过滤结合超速离心法在有效获得细胞上清中小细胞外囊泡的同时能够缩短实验时间,提升小细胞外囊泡的分离效率,因此,该方法有望在细胞外囊泡的产业制备应用中进行推广。
