油茶炭疽菌侵染对油茶叶片内生细菌群落结构的影响
2022-09-16崔明秦张东华闫晓慧洪英娣马焕成伍建榕
崔明秦,张东华,闫晓慧,洪英娣,马焕成 ,伍建榕,*,刘 丽*
(1. 云南省高校森林灾害预警控制重点实验室/西南林业大学生物多样性保护学院,昆明650224;2. 西南地区生物多样性保育国家林业局重点实验室/西南林业大学林学院,昆明650224)
油茶Camellia oleifera,隶属于山茶目山茶科Theaceae山茶属Camellia,为常绿小乔木或灌木,是中国特有的木本油料树种,具有较高的经济和生态价值[1]。根据林业部门的统计截止2020年我国油茶种植面积约达7175万亩,油茶籽产量314万吨,茶油产量约72.1吨。油茶炭疽病是油茶栽培过程中最常见的真菌性病害,在各大油茶产区普遍发生[2]。在不同栽培地区该病的主要致病菌各不相同,主要包括炭疽菌属下的果生炭疽Colletotrichum fructicola、山茶炭疽C. camelliae、胶孢炭疽C. gloeosporioides、暹罗炭疽C.siamense等[3]。病菌以分生孢子借助雨水传播,可进行多次再侵染[4],并依次危害油茶叶片、枝条及果实,造成油茶大面积落叶、落果、落花和枯枝,导致油茶减产20%~30%,给油茶产业的健康发展造成了严重的经济损失[5]。
植物内生菌是指生活史中一定阶段或全部阶段定殖于植物器官、组织内部以及细胞间隙的一类微生物,主要包括内生真菌、细菌和放线菌。内生菌在与宿主共生的过程中,可通过为宿主植物提供所需的部分营养物质和激素来调节植物的生长发育[6],亦可合成和分泌部分抗菌素和酶等活性物质进而提高植物对环境的适应能力[7]。相对于宿主,植物微生物群落的快速进化大大加强了这种适应性[8]。同时内生菌还广泛参与宿主次生代谢产物的合成与转化,对宿主植物的种群结构、生存、进化和健康状态产生重大影响[9,10]。近年来,越来越多的研究发现,植物受到病原侵染后,会招募有益微生物为植物提供保护[11]。如基于系统发育芯片法研究发现,拟南芥受霜霉菌Hyaloperonospora arabidopsidis侵染后会诱导根际土壤中特定细菌的富集,从而形成可抑病的土壤[12]。甜菜受立枯病菌Rhizoctonia solani侵染后会富集几种根系内生细菌并激活一些生物合成基因簇,从而抑制疾病[13]。相比于备受关注的植物根部,作为植物全功能体一部分的“叶围”在植物抗逆过程中的作用同样不容忽视。
叶片是植物获取营养和能量代谢的重要场所,其内生微生物在植物抗病虫和抗逆等方面发挥着重要的作用[14]。Chen等[15]以拟南芥自发坏死突变体为材料验证了叶片内生细菌的稳态与植物健康息息相关,提出内生细菌群落的失衡是植物叶片表现出类似病害表型的原因。Yang等[16]研究发现水稻白叶枯抗病品种的叶片中拮抗白叶枯病菌的内生细菌丰度更高。可见,植物叶片内生细菌群落结构与植物病害的抗、感性密切相关。因此,了解植物受到病原浸染后,植物内生细菌群落结构的变化,对病害防治至关重要。本研究基于高通量测序技术解析油茶炭疽病侵染后对油茶叶片内生细菌群落结构、多样性的影响,并对叶片内生细菌群落功能进行预测。以期揭示油茶叶片内生微生物群落对炭疽病的应答规律,为进一步探讨油茶炭疽病的生防策略奠定基础。
1 材料与方法
1.1 材料采集
样品于2021年9月采自云南省德宏傣族景颇族自治州油茶栽培基地。该地区为南亚热带季风气候类型,雨量充沛,干冷同季,雨热同期;年温差小,有霜日少,无霜期长。年平均气温 18.4 ℃~20.3 ℃,年温差 11.8 ℃~12.8 ℃。油茶品种为云南本地品种(白花油茶)。试验选择在同一地块分别采集炭疽病发病叶片和健康植株的健康叶片2组样本,已有试验证明该栽培区油茶炭疽病原主要为C. fructicola和C.siamense[17]。其中发病组命名为C组,未病组命名为H组,每组6个重复样本,共12个样本。采集后装入密封袋中,带回实验室进行表面消毒。表面消毒流程为75%乙醇1 min,无菌水冲洗1次,用5%(有效氯)次氯酸钠溶液表面消毒5 min,无菌水冲洗3次。收集最后一次冲洗的无菌水并涂布于NA培养基,作为对照验证表面消毒效果。
1.2 总DNA提取
将表面消毒的叶片无菌剪为约1 cm×0.5 cm小块。采用E.Z.N.A™ Mag-Bind Soil DNA Kit试剂盒(OMEGA公司),提取叶片总基因组DNA,用琼脂糖凝胶电泳检测DNA完整性,并用Qubit3.0定量检测DNA样本浓度。
1.3 序列扩增及测序
将提取的总 DNA 作为模板,以 341F(5′-CCTACGGGNGGCWGCAG-3′),805R(5′-GACTACHVGGGTA TCTAATCC-3′)为引物对16SV3-V4区域进行扩增。PCR扩增体系为(200 µL)。
第一轮PCR反应条件:94 ℃预变性3 min;94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,5个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,20个循环;72 ℃ 5 min,10 ℃。第二轮扩增:95 ℃ 3 min;94 ℃ 20 s,55 ℃20 s,72 ℃ 30 s,5 个循环;72 ℃ 5 min,10 ℃。
反应产物通过 2%琼脂凝胶电泳检测。为了得到均匀的长簇效果和高质量的测序数据,使用 Qubit3.0荧光定量仪进行浓度测定。PCR扩增及测序工作由生物工程(上海)股份有限公司完成。
1.4 数据统计与分析
原始数据通过cutadapt 1.18去除引物接头序列,使用PEAR 0.9.8和PRINSEQ 0.20.4进行过滤优化和序列拼接得到有效序列。有效序列用Usearch 11.0.667基于97%的相似水平下对序列进行OTU聚类并进行生物信息统计分析(叶绿体、线粒体序列通过生工生物工程股份有限公司自写Python脚本进行剔除)。利用RDP classifier 2.12对比RDP数据进行物种注释和分类。基于OTU丰度信息,利用mothur 1.43.0做rarefaction分析,计算多样性指数(ACE、Chao1、shannon、Simpson)。并通过IBM SPSS Statistic 25.0对数据进行差异显著性分析。利用R 3.6.0制作曲线图、PCA图、物种相对丰度图。使用phyloseq 1.30.0根据系统发生进化树得到样品间距离矩阵进行主成分分析(基于Bray-Curtis距离算法)。使用STAMP 2.1.3进行差异分析,采用Welch's t-test检验。使用BugBase 0.1.0分析微生物组样品表型,对微生物群落进行表型分类。
2 结果与分析
2.1 基因序列分析
对12个样本内生菌进行测序,共获得高质量质控序列1255996条,平均长度407.25 bp,序列在97%的相似度水平下进行聚类共获得 649个OTU。
通过稀释曲线可以看出,随着测序深度的增加,各部位样本的稀释曲线斜率趋于平缓(图1),说明本次测序数据量足够。
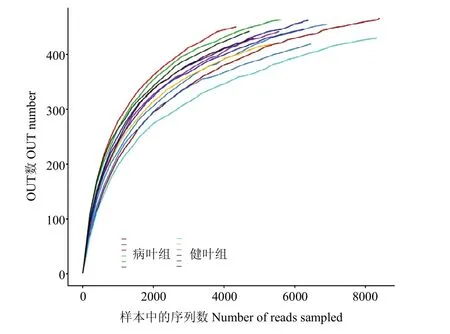
图1 油茶叶片内生细菌测序稀释曲线Fig. 1 Rarefaction curve of endophytic bacteria sequencing in Camellia oleifera leaves
2.2 油茶病健叶片内生菌Alpha多样性分析
表1可以看出云南油茶叶片所有样本的覆盖度均在98%以上,表明测序数据可以真实反应病、健叶片样本内生细菌菌群多样性;其中,感病组内生细菌Chao1、ACE指数显著高于健康组(P<0.05),Simpson和Shannon指数病、健叶片间无显著差异(P>0.05)。说明炭疽菌侵染后显著提高了油茶叶片内生细菌的丰度,但对多样性无显著影响。

表1 油茶叶片内生细菌多样性指数Table 1 Diversity indices of endophytic bacteria in Camellia oleifera leaves
2.3 云南油茶病健叶片内生菌Beta多样性分析
为了揭示样本的组间差异,基于Bray-Curtis距离进行了PCA分析(图2)。结果表明,PC1和PC2的样本差异贡献率分别为39.72%和14.16%。组内相似程度大于组间,说明炭疽菌侵染后使油茶叶片内生细菌群落构成趋于相近。

图2 云南油茶叶片内生细菌OTU水平上PCA分析Fig. 2 PCA analysis of endophytic bacteria in Camellia oleifera leaves at OTU level
2.4 云南油茶病健叶片内生菌群落组成
以97%相似水平对样本序列进行OTU聚类分析,云南油茶病健叶片内生细菌群落可分类到18个门,40个纲,63个目,100个科,130个属。
门水平上,病、健油茶叶片内生细菌均检测出18个门,无特有门。其中,相对丰度大于1%的共7个门(图3),分别为变形菌门Proteobacteria(27.71%,22.64%)、Bacteroidets 拟杆菌门(12.05%,11.25%)、Verrucomicrobia疣微菌门(4.59%,4.29%)、Acidobacteria 酸杆菌门(3.32%,3.24%)、Actinobacteria 放线菌门(2.25%,2.19%)、Planctomycetes 浮霉菌门(2.03%,1.79%)、Chloroflexi 绿弯菌门(1.34%,1.15%)。病、健叶片内生细菌均为变形菌门丰度最高,其次是拟杆菌门。

图3 门水平下的云南油茶叶片内生细菌群落组成Fig. 3 Community composition of endophytic bacteria inCamellia oleifera leaves at phylum level
属水平下的群落组成分析表明,炭疽病侵染后,病、健组内生细菌前20优势属相同(表2),但相对丰度具有一定差异。病组中相对丰度>1%的属为Methylobacterium、Panacagrimonas、Pontibacter、Gp7。健组中相对丰度>1%的属为Pontibacter、Panacagrimonas、Gp7。病组最优属为Methylobacterium,健组最优属为Pontibacter。
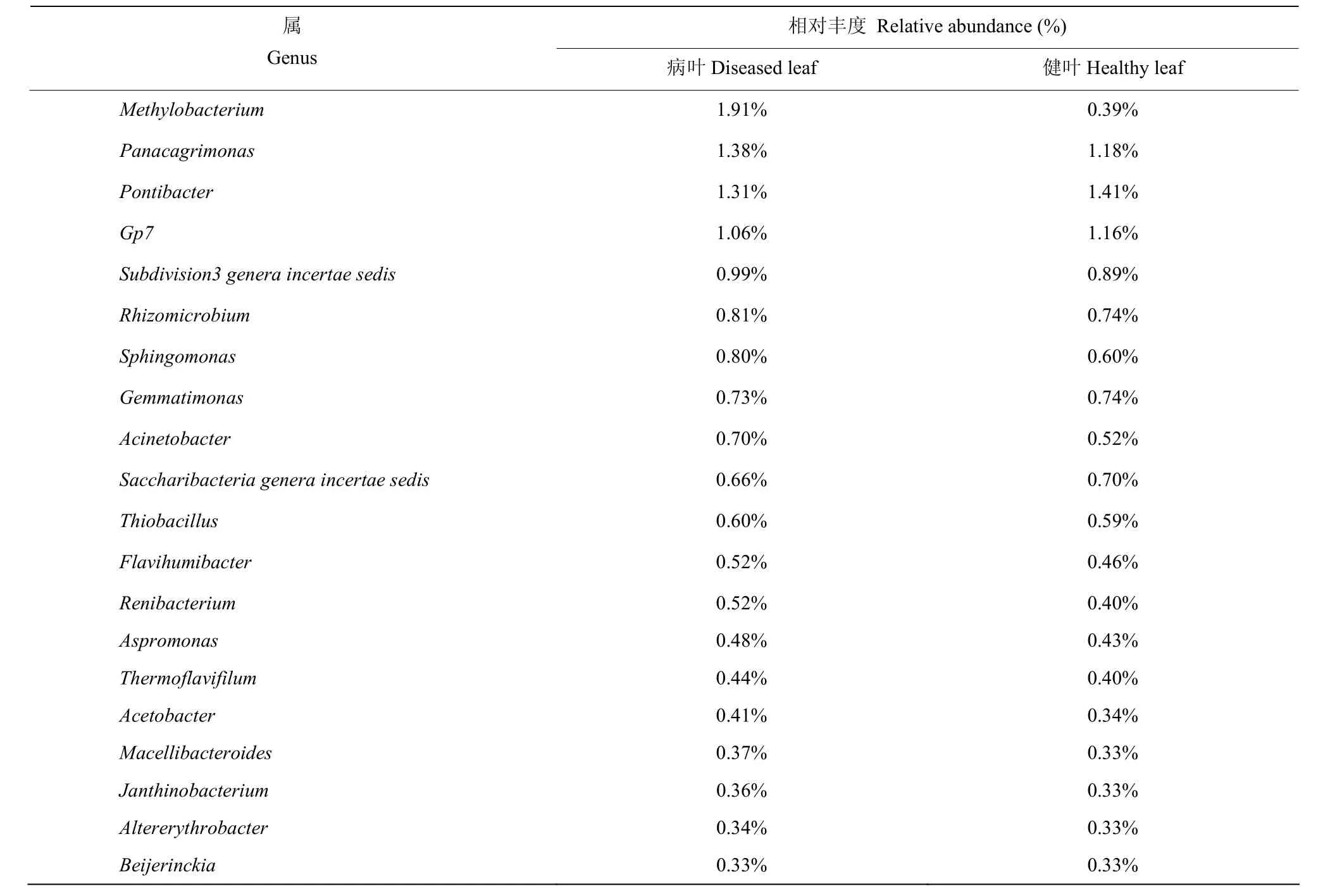
表2 油茶叶片内生细菌属水平相对丰度(前20属)Table 2 Relative abundance of endophytic bacteria in Camellia oleifera leaves at genus level (top 20)
组特有属为Belnapia0.03%、Achromobacter0.02%、Pantoea0.02%、Flavobacterium0.01%、Spirosoma0.01%。健组特有属为Legionella0.01%、Rhizorhabdus0.01%、Romboutsia0.01%。云南油茶病、健叶片内生菌还存在大量未鉴定及不可归类的属,相对丰度分别达到76.99%、79.99%,这表明云南油茶病健叶片中可能存在大量的新属种。
2.5 组间差异显著微生物分析
为了进一步寻找组间差异显著性物种,对云南油茶病、健叶片内生细菌进行了STAMP分析。结果如图4所示。在目分类水平(图4A)上,病组中有3个目的丰度显著高于健组。分别为Rhizobiales(C 4.17%,H 1.51%)、Rhodospirillales(C 1.90%,H 1.38%)和Clostridiales(C 0.16%,H 0.11%)目。
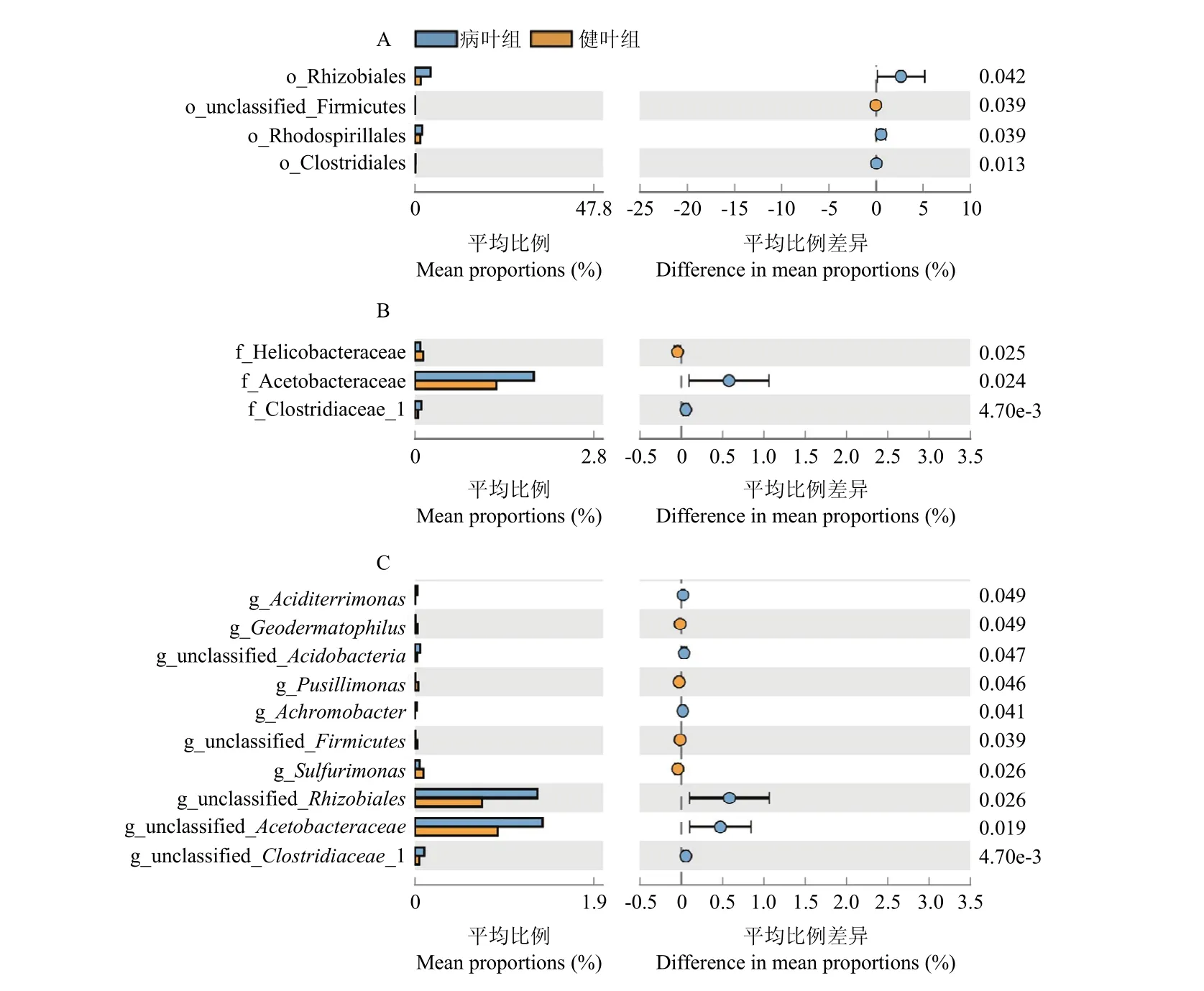
图4 基于STAMP分析的组间差异目(A)、科(B)、属(C)Fig. 4 Analysis of differences between groups based on STAMP at order (A)、family (B)、genus (C) level
在属分类水平(图4C)上,病组中共 6个属的丰度显著高于健组,依次为 Alphaproteobacteria 门Rhizobiales目下1未鉴定属(C 1.29%,H 0.71%),Alphaproteobacteria 门Rhodospirillales 目Acetobacteraceae科下1未鉴定属(C 1.34%,H 0.87%),Firmicutes 门Eubacteriales目 Clostridiaceae科下1未鉴定属(C 0.10%,H 0.04%),Actinobacteria门Acidimicrobiales 目Aciditerrimonas属(C 0.02%,H 0.01%)和1未鉴定属(C 0.05%,H 0.02%)、Proteobacteria门Burkholderiales目Achromobacter属(C 0.02%,H 0%)(P<0.05)。
病组 Actinobacteria门Geodermatophilus(C 0.01%,H 0.02%)、Proteobacteria门Sulfurimonas(C 0.05%,H 0.09%)、Pusillimonas(C 0.01%,H 0.03%)共3个属的丰度显著低于健组(P<0.05)。
2.6 云南油茶微生物表型和细菌功能潜力预测
基于16S rRNA的高通量测序结果,采用Bugbase数据库对云南油茶叶片内生细菌表型进行预测分析,病、健两组共检测到9种微生物表型(图5)。炭疽病菌侵染后,云南油茶叶片内生细菌菌群的生物膜形成、氧化胁迫耐受能力增强;革兰氏阳性菌、好氧、厌氧、兼性厌氧菌相对丰度增加,但革兰氏阴性菌相对丰度降低。进一步分析表明,生物膜形成、氧化胁迫耐受能力的增强主要是变形菌门下内生细菌相对丰度的增加。革兰氏阳性菌主要是放线菌门相对丰度增加,同时还特定增加了绿弯菌门的相对丰度。好氧微生物中,变形菌门、拟杆菌门、酸杆菌门、疣微菌门相对丰度增加。厌氧微生物中酸杆菌门、拟杆菌门、绿菌门、浮霉菌门相对丰度增加。革兰氏阴性菌主要是变形菌门的相对丰度下降。
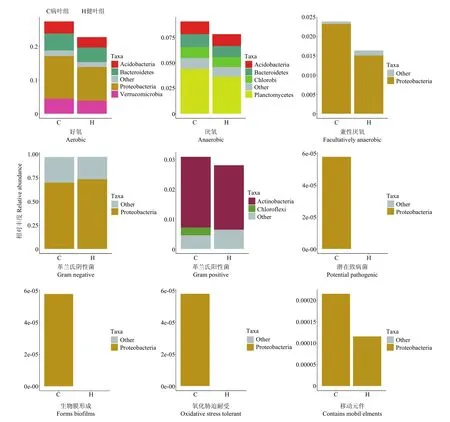
图5 基于Bugbase的油茶叶内生细菌表型预测Fig. 5 Phenotypic prediction of endophytic bacteria in Camellia oleifera leaves based on Bugbase
3 讨论
内生细菌与植物体建立和谐关系,有助于植物的生防、促生和抗逆等。本研究采用高通量测序技术对云南油茶炭疽病病、健叶片内生细菌群落进行研究。结果表明,云南油茶叶片受炭疽菌侵染后,内生细菌菌群多样性相对稳定,但菌群的丰度、OTUs数目显著高于健康叶片。肖蓉等[18]比较分析了患炭疽病与健康草莓根际土壤微生物群落,发现患病土壤细菌的OTUs数目及多样性指数均降低。樊俊等[19]研究发现烟草患青枯病后根际土壤细菌群落结构多样性高于健康烟草根际土壤。可见不同的病原侵染不同的寄主植物对植物微生物群落的多样性和丰富度的影响不具有一致性,这其中的具体规律和原因还有赖于对更多试验数据的归纳与总结。
云南油茶炭疽病菌侵染后改变了叶片内生细菌群落组成。在门水平上,病、健叶片最优内生菌门均为变形菌门,其次为拟杆菌门、疣微菌门、酸杆菌门、放线菌门。其中变形菌门是目前多数植物内生菌的优势菌门[20,21]。其他几个门虽是病、健叶片共有,但均为感炭疽病叶片中的相对丰度较高。向立刚等[22]研究发现感青枯病的烟株根际土壤中疣微菌门和酸杆菌门的相对丰度也增加,且疣微菌门和酸杆菌门的相对丰度与发病率呈正相关。另有证据表明酸杆菌门与疣微菌门成员之间有协同作用[23]。放线菌门是能产生抗生素及拮抗物质等多种代谢产物的革兰氏阳性菌,其功能已在不同类型土壤[24]、海洋、沉积物[25]等环境中分离获得的菌株上得以验证。因此,油茶叶片感染炭疽病后,这几个细菌门相对丰度增加可能对油茶叶片抵抗炭疽病的入侵有益。
目水平上,被炭疽菌侵染的油茶感病叶片中根瘤菌目、红螺菌目的相对丰度显著高于健康组。根瘤菌目下许多科属都有固氮作用,如克雷伯氏菌属Klebsiella[26]、根瘤菌属Rhizobium[27]等。这些可以联合固氮的植物内生菌不仅具有一定的促生作用,而且可以直接或间接地提高宿主植物的抗病性。在膜生物反应器(MBRs)中,生物膜的形成主要与根瘤菌目和红螺菌目有关[28]。
属水平上,甲基杆菌属Methylobacterium是感病叶片上的最优势属,且相对丰度高于健康叶片。刘晓菲等[29]研究发现,黄龙病入侵柑橘,随罹病程度的加深,甲基杆菌属的相对丰度也增加。甲基杆菌属是兼有甲基营养和甲烷营养特性的革兰氏阴性杆菌,具有固氮能力,可促进植物生长,还可通过分泌植物激素(细胞分裂素、生长素)与植物相互作用。此外,感病叶片中丰度显著高于健康叶片的Aciditerrimonas属多具有拮抗、产生抗生素及抑制土传病害[30]等功能。Achromobacter属可产生铁载体并抑制番茄枯萎病[31]。叶片感病后的特有属Spirosoma是拟杆菌门下的属,该属下的许多种表现出对紫外线等辐射的抗性,这是叶际微生物适生的一个重要属性[32]。可见,云南油茶被炭疽菌侵染后,激发了油茶叶片中内生细菌的防御。增强了一些具有潜在抗病性的内生菌的丰度。此外,本研究中油茶叶未归类到属的内生细菌相对丰度高达79%,可见油茶内生细菌还有很大的开发新属种的潜力。由于部分内生菌具有宿主专一性,尚有很多植物存在大量的未知内生菌。如玫瑰的内生细菌以未归类属为最优势菌属,相对丰度占33%[33],葱属植物未归类内生细菌的丰度占比高达70%[34]。植物内生菌未知属种的丰度一方面取决于该宿主内生菌研究的深度和广度,另一方面也受制于现有的已知物种数据库。
Bugbase主要进行细菌的表型预测,通过表型情况来解析微生物群落生态功能。本研究通过 Bugbase功能预测得知,在感病叶片中生物膜形成、移动元件、氧化胁迫耐受功能丰度增加。Mousa等[35]研究发现,小麦种子内生菌也会因镰刀菌的侵入形成生物膜介导的微菌落,以此形成物理屏障,阻止病原菌的入侵。此外,感病叶片中革兰氏阳性菌丰度增加,目前许多代表性的生防细菌都是革兰氏阳性菌[36],并有证据表明植物内生革兰氏阳性菌在植物抗病、营养互作等有利于植物健康生长的生物活性方面具有重要的作用[37]。Bugbase表型分析是基于OTU数据的预测分析,本研究中存在大量未分类的属种,因此会出现表型预测比较片面或有些样品的部分表型没有预测到等情况。进一步的宏基因组测序将可以给出相对准确的内生细菌的功能分析。此外,对微生物群落功能的全面准确的预测,还有赖于已有参考数据库的不断完善。
