核桃离体快繁技术研究
2022-09-16周传庆石宇佳王忠英梁美霞
●周传庆 石宇佳 王忠英 孟 雪 梁美霞※
(1.费县自然资源和规划局 山东 临沂 273499;2.鲁东大学农学院 山东 烟台 264025;3.费县国有塔山林场 山东 临沂 273421;4.淄博市林业保护发展中心 山东 淄博 255000)
核桃(Juglans regiaL.)又名胡桃、羌桃,为胡桃科(Juglandaceae)胡桃属(Juglans)落叶乔木。它与扁桃、腰果、榛子一起,被誉为世界四大干果[1]。核桃属植物在全世界约有23个种,我国有13个种[2]。因为核桃具有突出的健脑作用和丰富的营养价值,所以被越来越多的人所喜爱[3]。
目前核桃的播种育苗及嫁接育苗繁殖系数很低,不能满足核桃产业化、品种化的需要,经济效益不高。通过组织培养的方式进行难繁树种核桃的离体繁殖,有繁殖速度快、繁殖系数高的优点,并且可以很好地保留其亲本的优良性状[4-5]。研究表明,在核桃的组织培养过程中,消毒方法、取材时期和外植体种类等都会影响到其组织培养的成败。近年来,中外研究人员在核桃的组织培养及试管苗生根等方面虽然获得了一定的进展,但初接种污染率高、外植体分化较难、退化严重、增殖系数低、容易褐变等问题一直未能得到很好解决[6]。
本试验针对上述问题,开展提高核桃外植体初代培养的成活率,减少褐变,筛选芽增殖培养基配方研究,构建核桃的高效离体快繁技术。筛选出最佳的取材时间、取材部位、外植体消毒方法、组培苗初代及增殖培养基。通过茎尖、茎段离体培养的方法,缩短核桃的育苗周期,提高其繁殖系数,加速良种壮苗的推广应用。
1 材料与方法
1.1 材料
1.1.1 植物材料于2019年4月上旬到6月下旬,采集核桃新芽,剪成3~4 cm的茎尖和茎段,作为本试验的植物材料。
1.1.2 试剂与仪器标准MS培养基(4.43 g/L),蔗糖,琼脂,去离子水,植物激素IBA(1 mg/mL)、6-BA(1 mg/mL)、TDZ(0.1 mg/mL), 无 菌 水,1 mol/L的NaOH溶液,75%乙醇,0.1%升汞。烧杯,锥形瓶,电子分析天平,称量纸,磁力搅拌器,pH计,培养瓶,高压灭菌锅,超净工作台,镊子,剪刀,酒精灯等。
1.2 方法
1.2.1 外植体消毒方法采集并筛选长势一致的核桃新芽,剪取40个茎尖和40个茎段,剪取长度均为3~4 cm,经过2种不同的消毒灭菌操作,其中的20个茎尖、20个茎段采取以下消毒流程(方法一):流水冲洗→75%酒精浸泡40~45 s→无菌水冲洗3遍→0.1%升汞浸泡9 min→无菌水冲洗5遍,另外的20个茎尖、20个茎段采取如下消毒流程(方法二):流水冲洗→75%酒精浸泡30~35 s→无菌水冲洗3遍→0.1%升汞浸泡9 min→无菌水冲洗5遍。然后将外植体生长下部剪去1cm左右,分别接种于核桃初代培养基MS+TDZ 0.01 mg/L+IBA 0.01 mg/L+PVP 2 g/L+蔗糖30 g/L+琼脂7.5 g/L上。每隔5~7 d,观察其长势,分析不同的外植体消毒方法对核桃初代培养成活率的影响。
外植体的消毒灭菌需要注意,一是要尽可能地将外植体表面的微生物全部杀死,二是要尽量减少消毒剂对其组织和表层细胞的伤害。
1.2.2 不同采取时期的外植体对核桃初代培养的影响每隔7~10 d采取一次核桃新芽,将采回的芽体剪成3~4 cm的茎尖和茎段,流水冲洗后,在超净工作台上进行消毒,流程为:75%酒精浸泡30~35 s→无菌水冲洗3遍→0.1%升汞浸泡9 min→无菌水冲洗5遍。从外植体生长下部剪去1 cm左右,接种于4种含有不同植物生长调节剂组合的培养基上(表1)。每隔5~7 d,观察其长势,分析不同采取时期的外植体对核桃初代培养的影响。

表1 4种核桃初代培养基
1.2.3 不同部位外植体在核桃初代培养中的区别采集并筛选长势一致的核桃新芽,剪成3~4 cm的茎尖和茎段,以其茎尖和茎段两种不同类型的外植体各80个为试验材料,流水冲洗后在超净工作台上消毒灭菌,具体流程:75%酒精浸泡30~35 s→无菌水冲洗3遍→0.1%升汞浸泡9 min→无菌水冲洗5遍。从外植体生长下部剪去1cm左右,接种于4种不同浓度的植物生长调节剂组合的培养基上(表1)。每隔5~7 d,观察其长势,并分析不同部位的外植体在核桃初代培养中的区别。
1.2.4 不同植物生长调节剂组合对核桃初代培养的影响采集并筛选长势一致的核桃新芽,剪取3~4 cm的茎段,流水冲洗后在超净工作台上消毒灭菌,具体流程:75%酒精浸泡30~35 s→无菌水冲洗3遍→0.1%升汞浸泡9 min→无菌水冲洗5遍。从外植体生长下部剪去1cm左右,接种到4种MS添加了不同浓度的植物生长调节剂组合核桃初代的培养基上,放到培养室的培养架上进行培养。具体培养基配方,见表1。20~30 d后观察其长势,记录株高。
1.2.5 不同植物生长调节剂组合对核桃组培苗增殖的影响将核桃初代培养获得的组培苗在超净工作台上剪切成合适大小的形态,约2~3 cm,并去除其下部多余叶片以及衰老、枯萎的叶片,只留顶部的3~4片叶片。然后将其接种到4种MS添加了不同浓度植物植物生长调节剂组合的核桃增殖培养基上,放到培养室的培养架上进行培养。具体培养基配方,见表2。20~30 d后观察其长势,记录株高并计算增殖系数。公式:

表2 4种不同的核桃增殖培养基
增殖系数=瓶苗在一个周期内形成的有效苗数/接种苗数
2 结果与分析
2.1 消毒方法对外植体成活率的影响
本试验采取的两种外植体消毒方法中,使用方法二消毒后外植体的成活率较高,为70%。使用方法一消毒,由于酒精浸泡时间过长,伤害了外植体,表现褐变严重,成活率较低,为32.5%。
2.2 不同采取时期的外植体对核桃初代培养的影响
在本试验中,4月上旬到6月下旬,每隔7~10 d采取一次核桃新生茎尖及茎段外植体进行初代培养,结果表明:应在5月上中旬外植体半木质化时采取。因4月份核桃刚刚萌芽,采集的外植体过于幼嫩,消毒剂对其毒害过于严重,所以不易成活。而5月下旬至6月,外植体已完全木质化,难以剪切,而且其褐变程度和污染状况都较重。
2.3 不同部位的外植体在核桃初代培养中的区别
本试验中的核桃茎尖和茎段两种外植体,图1是不同部位的核桃外植体在初代培养中的生长状况。

图1 不同部位的外植体在核桃初代培养中的生长状况
由图1可看出:在初代培养中,茎尖和茎段外植体培养所获得的组培苗都生长良好,但经统计,茎尖成活率为55%,茎段成活率为85%。与茎尖相比,茎段的成活率高,污染和褐化程度较轻,因此,用茎段进行核桃的初代培养的效果更好。
2.4 不同植物生长调节剂组合对核桃初代培养的影响
核桃外植体在4种培养基上都能生长。具体生长结果,见表3。
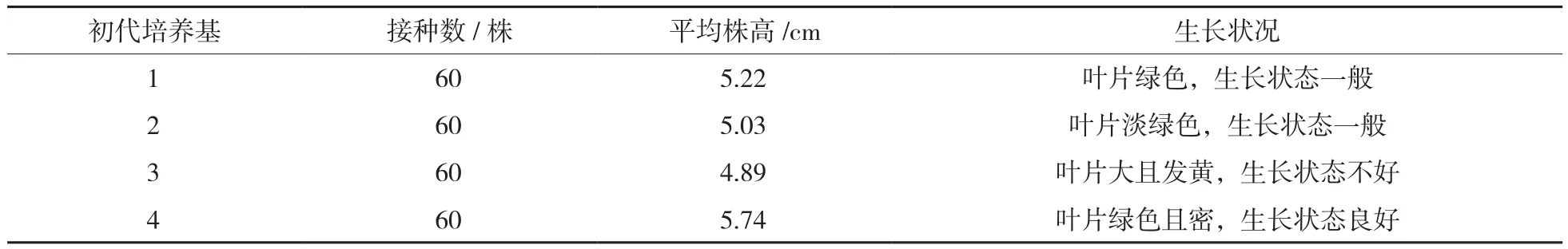
表3 核桃外植体在4种不同初代培养基上的生长状况
由表3可知,在核桃的初代培养中,茎段外植体在4号初代培养基上的高度较高,叶片绿且密,生长状态最佳。图2为核桃茎段在4号培养基上的生长状况。可以得出结论,4号培养基:MS+TDZ 0.01 mg/L+IBA 0.01 mg/L+PVP 2 g/L+蔗糖30 g/L+琼脂7.5 g/L为核桃初代培养的最佳培养基。

图2 核桃茎段在4号培养基上的生长状况
2.5 不同植物生长调节剂组合对核桃组培苗增殖的影响
核桃组培苗在4种增殖培养基上的生长效果,见表4。
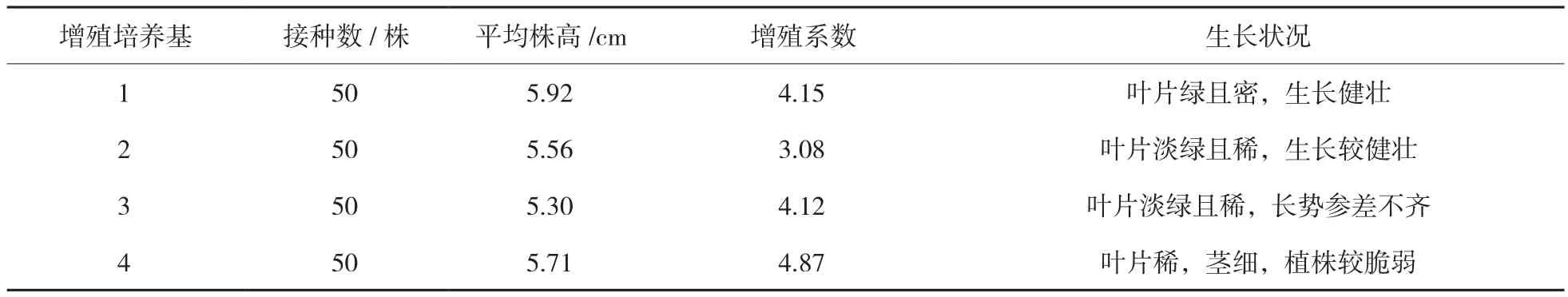
表4 核桃组培苗在四种不同的增殖培养基上的生长状况
由表4可知,核桃组培苗在1号增殖培养基上的株高较高,叶片绿且密,繁殖系数较高,生长状态最佳。因此,核桃组培苗的最佳增殖培养基为1号:MS+6-BA 1.0 mg/L+IBA 0.01 mg/L+蔗糖30 g/L+琼脂7.5 g/L。
3 结论与讨论
外植体材料的消毒灭菌是植物组织培养的第一步,也是其初代培养中最关键的一步。本试验采取升汞浸泡的方法对外植体进行消毒,但由于升汞有剧毒,国外多已不用,而用其他灭菌剂取代,如NaClO等[8]。
宫永红[8]研究提到了应注意缩短转瓶周期。开始时每天转移1次,3~4 d后当芽体基部不再变褐时,每隔2周转移1次。因此可以适当增大外植体的长度,但不要超过5 cm。因为外植体内可能含有内生菌,外植体的体积越大,其含有的内生菌数量越大。关于外植体的最佳取材大小,还需要一定的研究。
本试验得出的核桃初代最佳培养基为MS+TDZ 0.01 mg/L+IBA 0.01 mg/L+PVP 2 g/L+蔗糖30 g/L+琼脂7.5 g/L。核桃组培苗增殖最佳培养基为MS+6-BA 1.0 mg/L+IBA 0.01 mg/L+蔗糖30 g/L+琼脂7.5 g/L。其他研究中提到了DKW培养基,而本试验中采用的MS培养基也能达到培养目的。
在本试验组培苗的生根培养中,组培苗基部出现了易肿大且愈伤化的现象,可能是培养基IBA浓度过高所致,因此导致了生根试验失败。另外,在核桃的组织培养过程中,对于不同品种核桃的最佳培养基配方,也需要进一步研究。
通过组织培养的方式进行难繁树种核桃的离体繁殖,能实现核桃良种的快速繁殖,对于其工厂化育苗具有重要意义。
