迷迭香抗氧化成分乙醇浸提工艺优化及抗氧化性能研究
2022-09-16曾祥辉黄大川
王 莹,曾祥辉,黄 芳,黄大川,邓 慧
(邵阳学院 食品与化学工程学院,湖南邵阳 422000)
0 引言
迷迭香(Rosmarinius officinalis L.)属双子叶植物纲、唇形科,原产欧洲地区和非洲北部地中海沿岸[1],是一种天然、安全、无毒、耐高温且高效的抗氧化剂,活性成分主要为鼠尾草酸、鼠尾草酚和迷迭香酸[2-3],其弥补了BHA、BHT和TBHQ等人工抗氧化剂具有潜在毒性和副作用的缺陷[4],成为食品、医药和保健等领域研究热点之一[5-6]。因此,优化迷迭香中抗氧化剂的提取工艺与活性研究具有重要的意义。
迷迭香抗氧化成分的提取多采用溶剂提取法,一般是用乙醇作为有机溶剂在10:1的液料比(mL/g)下提取 2 h得到[7]。JACOTET 等[8]采用超声波和微波法提取迷迭香中的抗氧化成分,对比研究发现利用超声波来辅助提取能够增加鼠尾草酸和熊果酸的提取率,该方法耗时短,但容易破坏提取物中的活性成分。本文采用乙醇浸提法,以一种最简单、尽量不破坏有效成分的提取方法对迷迭香抗氧化成分进行工艺优化提取,再对其进行体外抗氧化活性研究,进一步为迷迭香研究提供理论参考。
1 试验材料与设备
1.1 试验材料
迷迭香阴干叶;乙腈、甲醇、磷酸均为色谱纯;鼠尾草酸标准品、迷迭香酸标准品(大连美仑生物有限公司,纯度≥98%);2,2-连氨基-双-二铵盐(ABTS,如吉生物科技,纯度≥98%);1,1-二苯基-2-三硝基苯肼(DPPH,如吉生物科技,纯度≥97%);无水乙醇、硫酸亚铁、过硫酸钾、磷酸二氢钠、铁氰化钾、三氯化铁和三氯乙酸等均为分析纯。
1.2 仪器与设备
VELOCITY 14R型离心机(Dynamica Scientific Ltd.);SHB-III型循环水式多用真空泵(巩义市中天仪器科技有限公司);U3000型高效液相色谱仪(Thermo Fisher Scientific);UV-1780型紫外-可见分光光度计(SHIMADZU);SCIENTZ-18N型冷冻干燥机(宁波新芝生物科技股份有限公司);RE-5299型旋转蒸发仪(巩义市予华仪器有限责任公司)。
2 试验方法
称取一定量的迷迭香粉末于锥形瓶中,按照单因素或者响应面试验所设定的条件向瓶中加入一定浓度和液料比的乙醇溶液,在室温下提取一定时间,离心抽滤后得迷迭香抗氧化成分提取液,上清液经旋转蒸发仪浓缩、冷冻干燥后得到迷迭香抗氧化成分粗提取物粉末。
2.1 单因素试验
设定乙醇浓度 60%,液料比 20:1(mL/g),浸提时间6天,其他条件固定,分别考察乙醇浓度(20%,40%,60%,80%,100%)、液料比[10:1,15:1,20:1,25:1,30:1(mL/g)]和浸提时间(2,4,6,8,10天)对迷迭香抗氧化成分得率的影响,每组试验重复3次,取平均值。
2.2 响应面试验
通过上述单因素试验得出各自条件下最佳的乙醇浓度、液料比和浸提时间,对其进行响应面优化试验。试验因素与编码水平见表1。
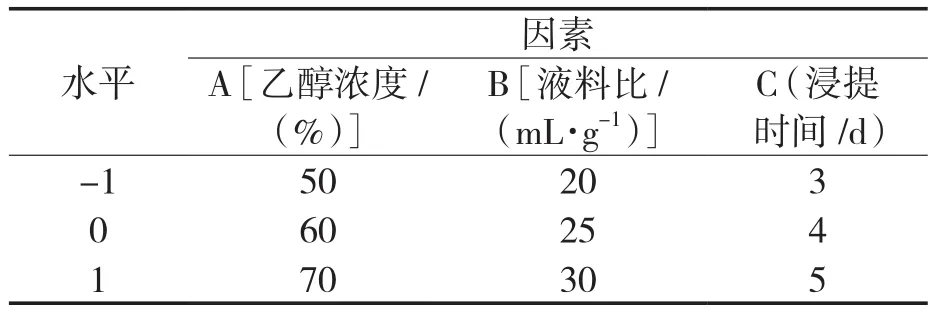
表1 Box-Behnken试验因素表Tab.1 Table of Box-Behnken test factors
3 测定方法
3.1 迷迭香抗氧化成分的测定
参照GB 1886.172—2016《食品安全国家标准 食品添加剂 迷迭香提取物》,采用王莹等[9]的色谱条件进行高效液相色谱(HPLC)测定迷迭香抗氧化成分(以鼠尾草酸、鼠尾草酚和迷迭香酸计)。
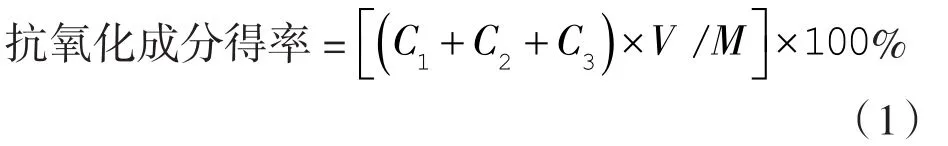
式中C1——试样溶液中鼠尾草酸浓度,mg/mL;
C2——试样溶液中鼠尾草酚浓度,mg/mL;
C3——试样溶液中迷迭香酸浓度,mg/mL;
V——试样溶液定容体积,mL;
M——试样的质量,mg。
3.2 ABTS自由基清除率测定
参考BKHAIRIA等[10]的方法,取2.0 mL不同浓度梯度样品溶液,分别加入2.0 mL ABTS工作液,置于室温避光反应30 min,在734 nm波长处进行吸光度值(ABS)的测定。
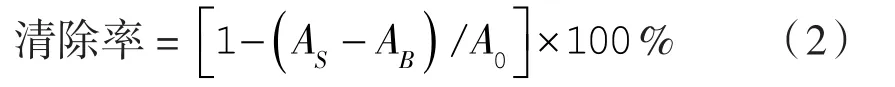
式中AS——样品反应组吸光度值;
AB——阴性对照组吸光度值;
A0——空白对照组吸光度值。
3.3 DPPH自由基清除率测定
参考慕钰文等的方法[11-12],取2.0 mL不同浓度梯度样品溶液,分别加入2.0 mL DPPH工作液,置于室温避光反应30 min,在517 nm波长处进行吸光度值的测定,计算如式(2)所示。
3.4 OH自由基清除率测定
参考DONG等[13]的方法,取1.0 mL不同浓度梯度样品溶液,分别加入1.0 mL FeSO4溶液、1.0 mL水杨酸溶液和1.0 mL H2O2溶液,37 ℃水浴反应30 min,在510 nm波长处进行吸光度的测定,计算如式(2)所示。
3.5 Fe3+还原力测定
参考黎克纯等[14]的方法,取1.0 mL不同浓度梯度样品溶液,分别依次加入2.5 mL磷酸二氢钠溶液和铁氰化钾溶液,50 ℃水浴反应 20 min;加入2.5 mL三氯乙酸溶液,离心处理10 min取上清液2.5 mL;加入2.5 mL蒸馏水,0.5 mL 三氯化铁溶液,置于室温反应10 min;在700 nm波长处进行吸光度值的测定。

式中AS——样品反应组吸光度值;
A0——空白对照组吸光度值。
3.6 数据处理
利用Design Expert 10进行响应面试验设计及数据处理,通过Excel绘图。
4 结果与分析
4.1 单因素试验
如图1所示,随着乙醇浓度的不断增大,抗氧化成分得率逐渐上升;当乙醇浓度为60%时,抗氧化成分得率达到最大;之后随着乙醇浓度的增大,抗氧化成分得率先呈现略微的下降趋势,进而大幅度的下降。可能是由于一些弱极性物质溶出量的增加,导致酚类物质向乙醇溶剂扩散速度减缓[15]。故乙醇浓度为60%时最佳。
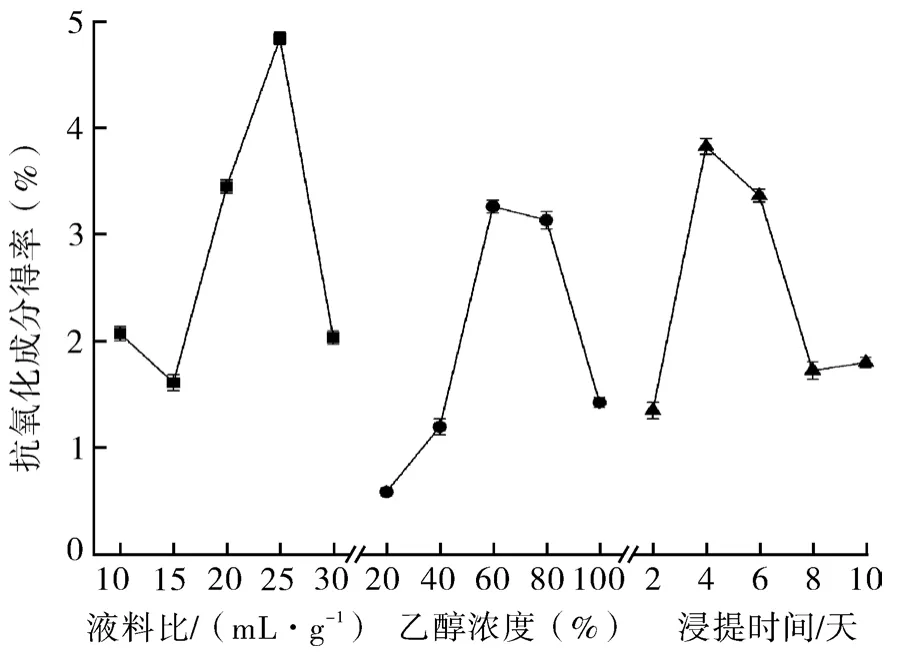
图1 各因素对迷迭香抗氧化成分得率的影响Fig.1 Effects of various factors on the yields of antioxidant components in rosemary
在乙醇浓度和浸提时间固定不变的情况下,随着液料比的增大,迷迭香抗氧化成分得率先减小随后逐渐增高;直到液料比为25 mL/g时,抗氧化成分得率达到最大值;之后呈现大幅度的下降趋势。这是由于液料比增大,溶剂的渗透和有效成分的溶解进行较快,达到一定的量后,较高的液料比会导致传质推动力增加[16],使得抗氧化成分得率下降。故液料比为25 mL/g时最佳。
在乙醇浓度和液料比固定不变的情况下,随着浸提时间的增加,抗氧化成分得率呈现大幅上升的趋势;直到浸提时间为4天时,抗氧化成分得率达到最大值;之后随着浸提时间的增加,抗氧化成分的得率出现大幅度的下降;接着呈现略微的上升趋势,趋于平缓。这可能是由于浸提时间过长导致酚类物质易分解损耗[17],得到的抗氧化成分反而减少,不利于提取。故浸提时间为4天时最佳。
4.2 Box-Behnken优化试验
4.2.1 回归模型的建立与检验
乙醇浓度、液料比和浸提时间对迷迭香抗氧化成分得率的响应面优化结果见表2。
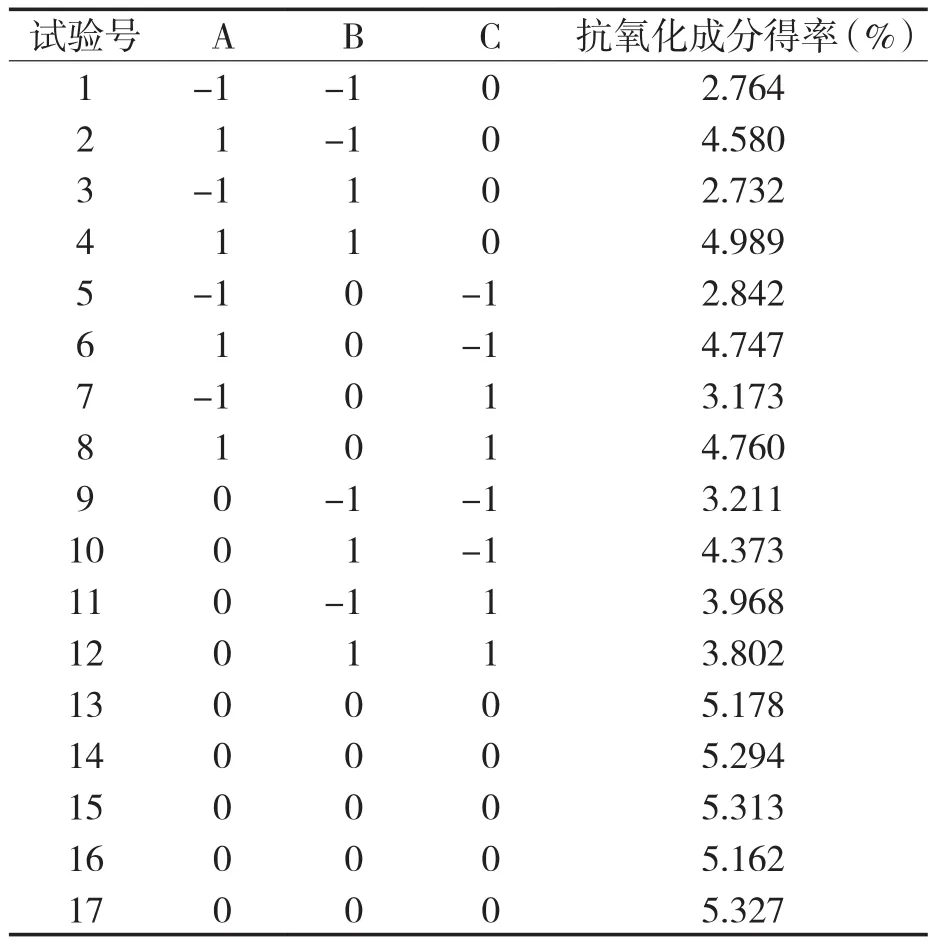
表2 响应面试验设计方案Tab.2 Design scheme of response surface test
对表2中的试验结果进行多元线性回归分析与模型的拟合,因变量与各自变量之间的关系可由如下二次多项式方程表示:

对该回归方程进行方差分析,结果见表3。
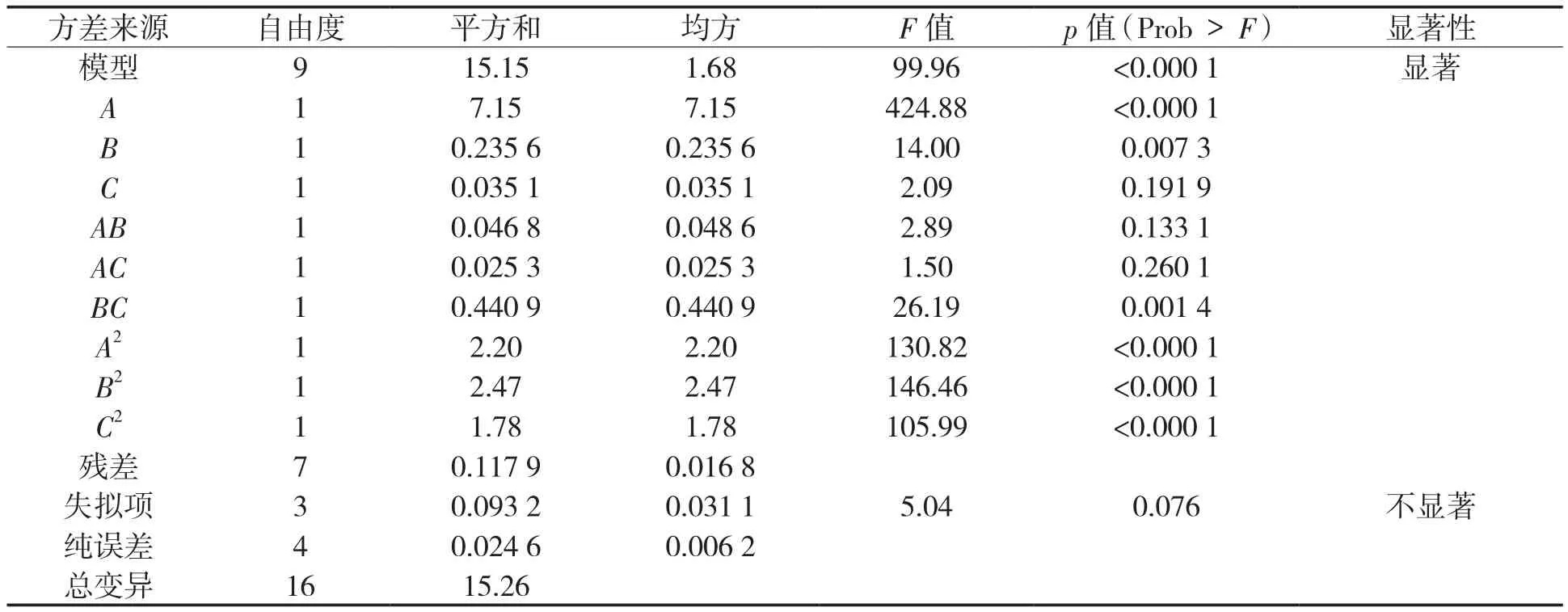
表3 抗氧化成分得率的二次多项式模型方差分析Tab.3 Variance analysis of quadratic polynomial model for yields of antioxidant components
该回归模型极显著(p<0.01),失拟项不显著(p>0.05),决定系数R2=0.992 3,校正决定系数Adj-R2=0.982 4,可知模型具有很好的预测能力。A,B,BC,A2,B2,C2在此模型中的影响均为显著(p<0.05),根据F值的大小可以推断,各因素的影响顺序为乙醇浓度>液料比>浸提时间。
4.2.2 两因素间的交互作用分析
由表3可知,液料比与浸提时间的交互作用对抗氧化成分得率有显著影响(p<0.05)。由回归方程得出的交互作用响应面如图2所示,乙醇浓度和液料比对抗氧化成分提取量的影响显著,而浸提时间对抗氧化成分提取量的影响不显著,与方差分析结果一致。
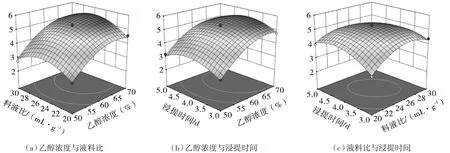
图2 各自变量之间的交叉作用对迷迭香中抗氧化成分得率的影响Fig.2 The effect of the cross-action between the respective variables on the yields of antioxidant components in rosemary
4.2.3 最佳条件优化及验证结果
通过响应面法得到乙醇浸提法提取迷迭香抗氧化成分最佳工艺条件:乙醇浓度66.688%、液料比 25.839:1(mL/g)和浸提时间3.967天,在此条件下的抗氧化成分得率为5.584 %。根据实际操作略作调整,在乙醇浓度65%、液料比26:1(mL/g)和浸提时间4天条件下,进行3次平行试验,测得抗氧化成分得率为5.418%,与理论值十分接近。
4.3 迷迭香提取物的抗氧化活性
由图3(a)可以看出,迷迭香粗提取物和VC对照组对ABTS自由基都具有较好的清除率。在一定范围内,增大粗提取物浓度可以明显提高对ABTS自由基的清除率,在0.02 mg/mL时,对ABTS自由基清除率为15.07%;当浓度增大至0.20 mg/mL时,ABTS自由基清除率也随之增加到85.56%,在这个范围内增幅极显著;在达到0.20 mg/mL后继续增大粗提取物浓度,ABTS自由基清除率变化极小。经数据处理得出,迷迭香粗提取物清除ABTS自由基的IC50值为0.081 mg/mL,VC对照组清除ABTS自由基的IC50值为 0.037 mg/mL,迷迭香抗氧化物质清除ABTS自由基的能力稍弱于VC对照组,属于抗氧化活性较强的一类物质。
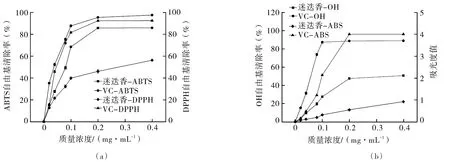
图3 迷迭香提取物及对照品的抗氧化活性能力Fig.3 Antioxidant activity of rosemary extract and its reference substance
迷迭香粗提取物和VC对照组对DPPH自由基的清除率随着浓度的增加一直稳步上升,清除率由浓度为0.02 mg/mL的12.56%增长至浓度为0.40 mg/mL时的56.11%,增幅明显。通过比较可以看出,VC趋势线远高于迷迭香粗提取物趋势线,经计算得出粗提取物清除DPPH自由基的半数抑制浓度为0.280 mg/mL,VC对照组清除DPPH自由基的半数抑制浓度为0.046 mg/mL,迷迭香粗提取物对DPPH 自由基具有较好的清除活性,但弱于VC对照组。
如图3(b)所示,迷迭香粗提取物浓度为0.02 mg/mL时,OH自由基清除率仅只有3.27%;当迷迭香粗提取物浓度增加至0.40 mg/mL时,清除率上升到47.44%。在迷迭香粗提取物浓度由0.20 mg/mL增加至0.40 mg/mL的过程中,OH自由基清除率无明显变化。计算得出迷迭香粗提取物清除OH自由基的IC50值为0.360 mg/mL,VC对照组清除OH自由基的IC50值为0.049 mg/mL。由于迷迭香粗提取物中含有大量杂质,在相同浓度下,VC对照组所表现出的对OH自由基的清除能力明显强于迷迭香粗提取物。
对Fe3+还原力进行测定实则是对样品的供应电子能力进行检测,吸光值越大,还原力越强。由图可知,不同质量浓度的迷迭香粗提取物和VC对照组均对Fe3+具有一定的还原能力。迷迭香粗提取液在浓度从0.02 mg/mL增加至0.40 mg/mL时,其ABS值从0.065增加至0.915,一直呈现上升状态。虽然在相同质量浓度下VC对照组对Fe3+的还原力比迷迭香粗提取物更强,但未经纯化和富集处理的迷迭香粗提取物仍旧呈现出随着质量浓度的增大,其对Fe3+还原力也不断增大。
5 结语
本文建立乙醇浸提法提取迷迭香抗氧化成分的最佳工艺条件,在乙醇浓度65%、液料比26:1(mL/g)和浸提时间4天的条件下,测得抗氧化成分得率为5.418%,模型预测能力较好。在迷迭香粗提取物所测定质量浓度范围内,ABTS、DPPH、OH自由基清除能力以及Fe3+还原力随着质量浓度的增大而增大,其中对ABTS、DPPH、OH自由基的 IC50值分别为 0.081,0.280,0.360 mg/mL。迷迭香粗提取物表现出较好的抗氧化活性。该研究可为迷迭香天然抗氧化成分的综合开发利用提供理论参考依据。
