生物诱导剂和杀菌剂对新疆红枣黑斑病抗性的影响
2022-09-16马玉珊范盈盈钦巧眉张锐利
马玉珊,范盈盈,刘 敏,钦巧眉,王 艳,王 成,张锐利
(1. 塔里木大学 食品科学与工程学院,新疆 阿拉尔 843300;2. 新疆农业科学院 农业质量标准与检测技术研究所,新疆 乌鲁木齐 830091;3. 农业农村部农产品质量安全与风险评估实验室(乌鲁木齐)/新疆农产品质量安全重点实验室,新疆 乌鲁木齐 830091;4. 新疆大学 生命科学与技术学院,新疆 乌鲁木齐 830000)
红枣(Ziziphus jujubaMill.)是我国特有的果品之一,占全球红枣产量的90%以上[1]。随着新疆红枣产量的升高,由链格孢菌(Alternaria alternata)侵染引起的黑斑病发病率也逐渐升高,在红枣黑斑病大面积暴发时期南疆和田和阿克苏等地区的红枣黑斑病发病率达30%[2],病重枣园发病率高达70%[3],黑斑病会造成红枣减产达40%以上[4],严重降低枣农的经济收益。目前,红枣黑斑病的防控主要集中在化学防控方面,例如喷施戊唑醇,该药剂具有杀菌谱广、活性高、持久长效等优点[5],但使用化学杀菌剂会导致病菌产生耐药性和农药残留的问题[6]。因此,开发更加安全、环保的病害防控方法成为当务之急。
近几年,生物防控技术成为控制植物病害的重要手段,其中利用生物诱导剂和杀菌剂是热点之一。生物诱导剂水杨酸(Salicylic acid,SA)是一种类似植物激素的内源信号分子,能诱导植物产生抗病性,促使多种病程相关蛋白表达,防御病原体,在病原侵染诱导植物抗性的形成中起着重要作用[7]。已报道SA 能增强草莓[8]、杧果[9]、柑橘[10]等果实对病原菌侵染的抗性,减少产品在贮藏过程中的腐烂和采后损失。 外源喷施茉莉酸甲酯(Methyl jasmonate,MeJA)也可以刺激植物相关防御基因的表达,有效诱导植物抗病性。研究发现,MeJA 可以有效增强樱桃[11]、草莓[12]和菠萝[13]果实中过氧化物酶(Peroxidase,POD)、多 酚 氧 化 酶(Polyphenol oxidase,PPO)、超 氧 化 物 歧 化 酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)等抗氧化酶的活性。HU 等[14]研发合成了源自哈茨木霉JF309 的纳米硒溶液(Trichoderma harzianumselenium nanoparticle,TSNP),发现TSNP 处理显著抑制了链格孢菌(Alternaria alternata)的生长和毒素的产生,具有较好的抗真菌特性。
目前,虽然在草莓、杧果、樱桃等植物果实真菌病害上有使用生物源诱导剂、杀菌剂的报道,但是其用于红枣黑斑病防控的研究还较少。因此,以生物诱导剂SA、MeJA 以及生物源杀菌剂TSNP为供试药剂,戊唑醇(WZ)为化学杀菌剂对照,清水处理为空白对照(CK),接种链格孢菌,进行红枣抗病性田间试验,通过抗病相关酶活性及酶基因表达判断不同生物诱导剂和杀菌剂对红枣抗病性的影响,并比较红枣营养品质的变化及不同处理的自然发病率,筛选防控红枣抗黑斑病效果较好的诱导剂或者杀菌剂,为新疆红枣黑斑病的生物防控提供技术支持。
1 材料和方法
1.1 材料与试剂
试验于2021 年在新疆阿拉尔市十团6 连枣园(81.31°E、40.65°N)进行,供试红枣品种为骏枣,树龄10 a左右。
链格孢菌(Alternaria alternata)SH04,从阿克苏病枣中分离得到。
木霉源纳米硒溶液(TSNP)由中国科学院上海营养与健康研究所武爱波课题组提供。
主要试剂:MeJA、SA、WZ、氯化硝基四氮唑兰、二硫苏糖醇、牛血清蛋白质、曲拉通-100、乙二胺四乙酸二钠、聚乙烯聚吡咯烷酮、巯基还原剂(北京索莱宝公司);醋酸钠(美国Sigma-Aldrich 试剂公司);Na2HPO4·12H2O(西陇化工股份有限公司);NaH2PO4·2H2O、L-蛋氨酸、核黄素、硼酸、L-苯丙氨酸、愈创木酚(生工生物工程上海股份有限公司);聚乙烯吡咯烷酮(源叶生物公司);30%过氧化氢(成都市科隆化学品有限公司);无水乙醇(天津市鑫铂特化工有限公司);乙二胺四乙酸、冰醋酸、聚乙二醇6000(天津市福晨化学试剂厂);抗坏血酸(天津市天新精细化工开发中心);硼砂、磷酸二氢钠、磷酸氢二钠(天津市致远化学试剂有限公司);邻苯二酚(天津市光复精细化工研究所);果糖、葡萄糖、蔗糖标准品(美国Sigma-Aldrich 试剂公司);17种氨基酸混合标准溶液(德国赛卡姆公司)。
1.2 仪器与设备
UV-2700 型紫外可见分光光度计(日本岛津公司)、水浴恒温振荡器(金坛市宏华仪器厂)、涡旋混合仪(上海汗诺仪器有限公司)、电热恒温水浴锅( 上海博迅实业有限公司医疗设备厂)、Biofugerstratos 全能型高性能台式冷冻离心机(德国贺利氏公司)、DW-HL508 型超低温冷冻储存箱(中科美菱低温科技股份有限公司)、DW-86W100 型医用低温保存箱(海尔集团公司)、XSE204 型电子天平(梅特勒-托利多仪器有限公司)、E200 型生物显微镜(日本Nikon 株式会社)、SureCycle 8800 型PCR仪(安捷伦科技有限公司)、LightCycler®96 型实时荧光定量PCR 仪(德国罗氏诊断有限公司)、8400型全自动凯氏定氮仪(丹麦FOSS 公司)、S-433D 型氨基酸分析仪(德国SYLM公司)。
1.3 方法
1.3.1 链格孢菌孢子悬浮液的制备 将供试链格孢菌在PDA 培养基上25 ℃培养7 d,少量多次用无菌水冲洗平板,用接种环轻轻刮下平板上的孢子,全部收集于50 mL 三角瓶中,将孢子悬浮液在微型旋涡混合器上振荡30 s 使孢子分散,然后用双层纱布过滤。过滤后的孢子悬浮液用血球计数板记数,并调节使滤液中孢子浓度达到1×106cfu/mL。
1.3.2 试验设计 以MeJA、SA 为供试诱导剂,TSNP 为供试生物杀菌剂,WZ 为对照化学杀菌剂,根据预试验浓度筛选结果将以上药剂依次配制为100、5 000、25、200 μmol/L,清水处理为空白对照(CK),分别在田间枣树幼果期、膨大期和白熟期对枣果进行喷施,每个处理5 棵枣树,共计25 棵树,每棵树喷2 L,每15 d 喷施1 次,在枣果成熟后测定自然发病率及枣果营养品质。另在全红期,每棵树在4 个方位分别挑选大小均匀、健康枣果12 个,接种10 μL 链格孢菌菌悬液,分别采集CK 和不同处理接种后1、3、5、7 d 的红枣,取病健交界处用锡箔纸包裹,液氮冷冻带回实验室,-80 ℃超低温冰箱保存,测定不同处理枣果接种链格孢菌后不同时间的抗病酶活性及抗病酶基因相对表达量。
1.3.3 黑斑病自然发病率测定 各枣果成熟后,随机采集各处理枣果,测定黑斑病自然发病率。记录出现病害的枣果数量及总枣果数量,计算自然发病率。自然发病率=发病枣果数/总枣果数×100%。
1.3.4 红枣采后营养品质测定 各处理枣果成熟采收后,枣果中葡萄糖、果糖和蔗糖含量测定参考GB/T 5009.8—2016《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》;还原糖含量测定参考GB 5009.7—2016《食品中还原糖的测定》,采用直接滴定法测定;17种氨基酸含量测定参考GB/T 5009.124—2016《食品中氨基酸的测定》,采用氨基酸全自动分析仪测定;总酸含量测定参考GB/T 12456—2021《食品中总酸的测定》,采用酸碱指示剂滴定法测定;蛋白质含量测定参考GB 5009.5—2016《食品中蛋白质的测定》,采用凯氏定氮法测定。
1.3.5 抗病相关酶活性测定 POD、PPO、SOD、CAT、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、苯丙氨酸解氨酶(Phenylalnine ammonialyase,PAL)活性测定参照曹建康等[15]的方法。酶液提取:称取5.0 g 果蔬组织样品,置于研钵中,加入5.0 mL缓冲液,在冰浴条件下研磨成匀浆,于4 ℃、12 000×g离心30 min,收集上清液即为酶提取液,低温保存备用。以每分钟每克鲜质量果蔬样品吸光度分别在470、420 nm 波长处变化1 为1 个POD、PPO 活力单位(U),单位为U/g;以每分钟每克鲜质量果蔬组织的反应体系对氮蓝四唑(NBT)光化还原的抑制为50%时为1 个SOD 活力单位(U),单位为U/g;以每克鲜质量样品每分钟吸光度分别在240、290 nm 波长处变化0.01 为1 个CAT、APX 活力单位(U),单位为U/g;以每小时每克鲜质量果蔬组织反应体系吸光度值增加0.01为1个PAL活力单位(U),单位为U/g。
1.3.6 抗病相关酶基因相对表达量测定 取1.3.2中冷冻的红枣果实提取总RNA,反转录为cDNA,采用TIAN GEN®Super Real PreMix Plus(SYBR Green)试剂盒进行测定。以ACT1为内参基因,按照qPCR引物设计原则设计特异性引物(表1)。通过RTqPCR 检测红枣抗病酶相关基因POD、PPO、CAT、SOD、APX和PAL的相对表达量,每个处理设置3 个生物学重复,通过2-△△CT计算基因相对表达量[16]。
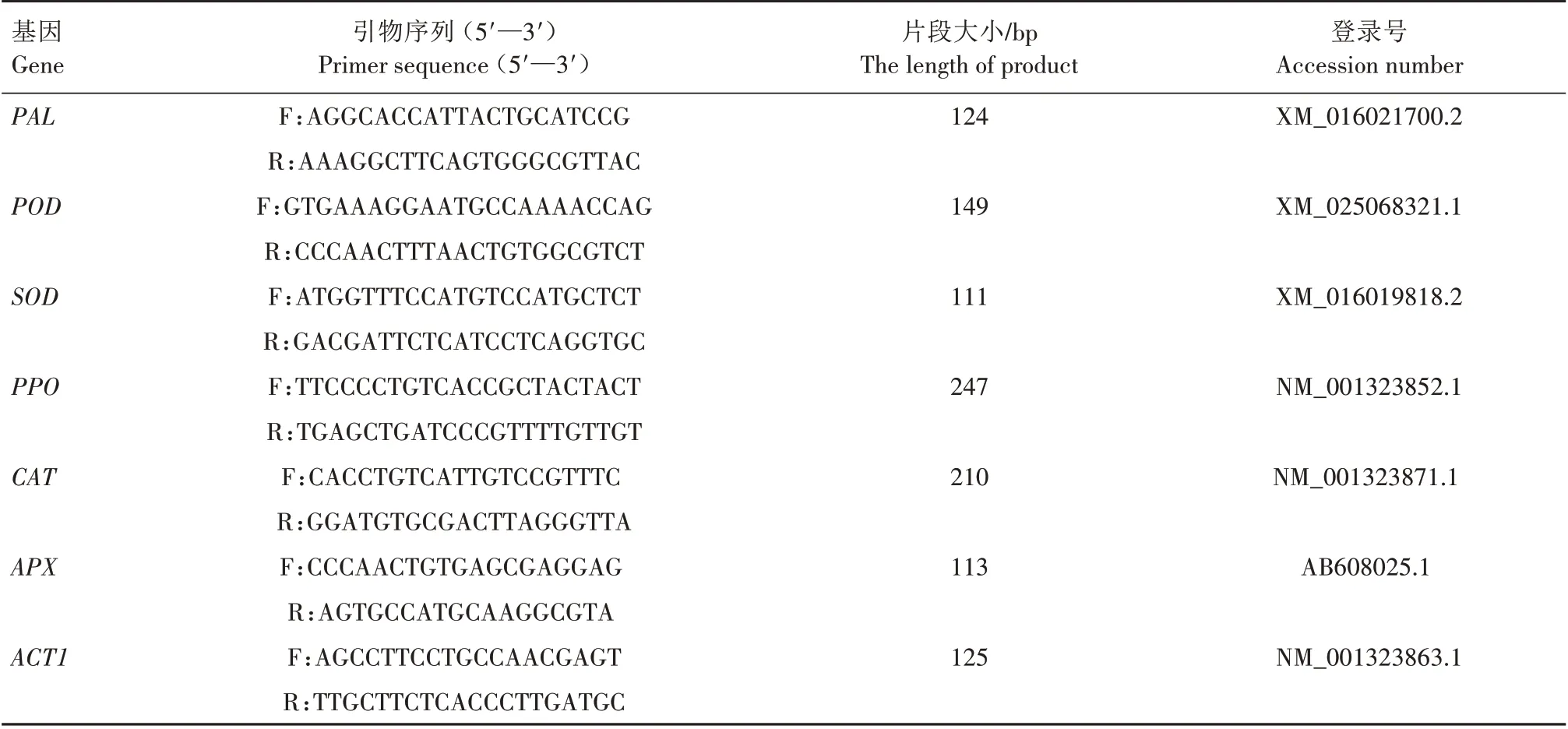
表1 RT-qPCR引物信息Tab.1 Primer information for RT-qPCR
1.4 数据处理与分析
采用Excel 2019 建立数据系统,用Origin 2018软件进行营养品质、抗病酶活性和抗病酶基因相对表达量分析,用SPSS 26.0软件进行差异显著性分析。
2 结果与分析
2.1 不同生物诱导剂和杀菌剂处理对红枣果实黑斑病自然发病率的影响
如图1 所示,不同生物诱导剂和杀菌剂处理均能有效降低红枣果实黑斑病的自然发病率,增强枣果对黑斑病的抗性。CK 自然发病率为19.17%,MeJA、SA、TSNP 和WZ 处理红枣果实自然发病率分别 为4.57%、5.60%、2.78% 和6.29%,以MeJA 和TSNP 处理红枣果实对黑斑病的防效较好,自然发病率分别比CK显著降低76.16%和85.50%。

图1 不同生物诱导剂和杀菌剂处理枣果黑斑病的自然发病率Fig.1 Natural incidence rate of jujube black spot in different biological inducers and fungicides treatments
2.2 不同生物诱导剂和杀菌剂处理对采后红枣果实营养品质的影响
由表2 可知,各处理红枣果实总酸和蔗糖含量分别为11.20~12.48 g/kg 和253.38~279.68 g/kg。与清水对照(CK)相比,不同生物诱导剂和杀菌剂处理红枣果实中总酸和蔗糖含量无显著差异。SA、WZ处理红枣果实还原糖含量分别为246.10、247.77 g/kg,与CK 差异不显著,但二者葡萄糖含量均显著高于CK,分别提高18.27%、19.38%。SA 处理红枣果实中果糖含量(157.68 g/kg)显著高于CK 和其他处理,较CK 提高16.73%。WZ 处理红枣果实蛋白质含量显著低于CK,比CK降低12.07%。MeJA、TSNP处理红枣果实果糖、葡萄糖含量与CK 相比无显著差异,仅还原糖含量显著低于CK。
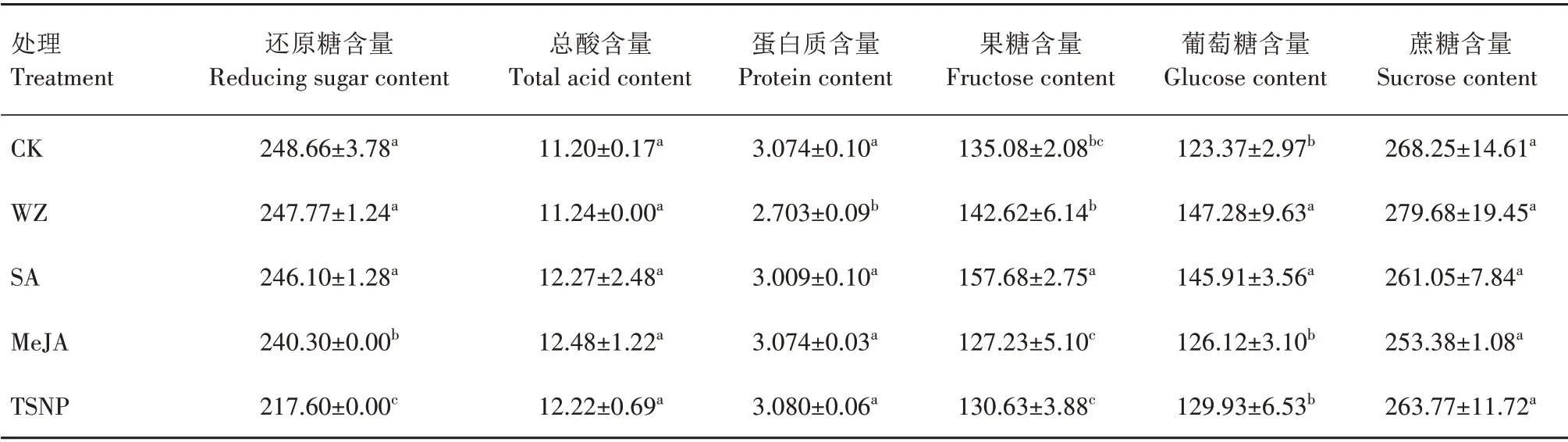
表2 不同生物诱导剂和杀菌剂处理红枣果实的营养品质Tab.2 Nutritional quality of jujube fruits treated with different biological inducers and fungicides g/kg
不同生物诱导剂和杀菌剂处理红枣果实中均可检测到17 种氨基酸(表3),其中包括人体必需的8 种氨基酸以及幼儿体内不能自身合成的精氨酸(Arg)和组氨酸(His)[17]。由表3 可知,各处理红枣果实中以TSNP处理氨基酸总量最高,为2.047%,比CK 提高0.59%,其次为CK、MeJA 处理、SA 处理,WZ处理作为化学杀菌剂对照,含量最低,为1.856%,比CK 降低8.80%。由此说明,与生物诱导剂和生物杀菌剂相比,化学杀菌剂对红枣果实中氨基酸的形成影响较大,导致红枣果实中氨基酸总量低于其他处理。不同生物诱导剂和杀菌剂处理红枣果实中天门冬氨酸(Asp)含量与CK 相比具有显著差异(P<0.05),其中MeJA、TSNP 处理高于CK,比CK 分别提高13.81%、3.35%,SA、WZ 处理低于CK,比CK 分别降低16.17%、24.65%。SA 处理红枣果实丝氨酸(Ser)、缬氨酸(Val)含量分别较CK 降低17.14%、11.11%。MeJA 处理红枣果实His 含量比CK 显著提高24.56%。

表3 不同生物诱导剂和杀菌剂处理红枣果实的17种氨基酸含量Tab.3 17 amino acids contents in jujube fruits treated with different biological inducers and fungicides %
2.3 不同生物诱导剂和杀菌剂处理对红枣果实抗病相关酶活性的影响
如图2A 所示,接种链格孢菌后第1—3天,不同生物诱导剂和杀菌剂处理红枣POD 活性明显高于CK;接种后第5 天,CK 与MeJA 处理POD 活性有所升高;接种后第7 天,所有处理POD 活性均有所升高,其中MeJA 处理和TSNP 处理急剧升高且显著高于CK(P<0.05),分别是CK 的1.14、1.83 倍。表明MeJA 和TSNP 处理能够在一定程度上提高红枣果实的POD活性。
由图2B 可知,接种链格孢菌后第3—5 天,CK、MeJA 处理、TSNP 处理和WZ 处理红枣PPO 活 性 均急剧升高;接种后第7 天,除SA 处理PPO 活性急剧升高,其他处理均有所下降,但SA、MeJA、TSNP、WZ处理红枣PPO 活性均高于CK,分别是CK 的9.75、13.75、14.00、7.75 倍。结果表明,不同生物诱导剂和杀菌剂处理均可显著提高红枣果实PPO 活性,以MeJA和TSNP处理效果最佳。
如图2C 所示,接种链格孢菌后第1—7 天,不同生物诱导剂和杀菌剂处理红枣SOD 活性均呈下降趋势。接种后第3 天,SA 处理红枣果实SOD 活性最高,是CK 的6.56 倍;接种后第5 天,TSNP 处理SOD活性有所升高,是CK 的2.51 倍;接种后第3—7 天,各生物诱导剂和杀菌剂处理红枣果实SOD 活性均高于CK。可见,不同生物诱导剂和杀菌剂处理均可提高红枣果实SOD活性。
如图2D 所示,接种链格孢菌后第1 天,CK CAT活性高于4 个诱导剂处理;接种后第3—7 天,TSNP处理CAT活性持续升高,在第7天达到最高,且明显高于CK,是CK 的1.37 倍,而其他处理均低于CK。结果表明,TSNP 处理可显著提高红枣果实的CAT活性。
如图2E 所示,接种链格孢菌后第1—7 天,MeJA、TSNP处理和CK枣果APX活性均呈现先下降再升高的趋势。接种后第5 天,不同生物诱导剂和杀菌剂处理红枣果实APX 活性均高于CK;接种后第7 天,MeJA、TSNP 处理红枣果实APX 活性分别是CK的1.09、1.37倍。结果表明,不同生物诱导剂和杀菌剂处理在接种链格孢菌后第5天均可提高红枣果实APX活性,整体上以MeJA和TSNP处理效果最佳。
如图2F 所示,接种链格孢菌后第1 天,MeJA、TSNP 处理红枣果实PAL 活性均高于CK;接种后第3 天,MeJA 处理红枣果实PAL 活性最高,是CK 的1.35倍;接种后第5天,不同生物诱导剂和杀菌剂处理红枣果实PAL活性均高于CK;接种后第7天,SA、TSNP处理红枣果实PAL活性均高于CK,分别是CK的1.21、1.10 倍。结果表明,不同生物诱导剂和杀菌剂处理在接种后第5天均可不同程度提高PAL活性。
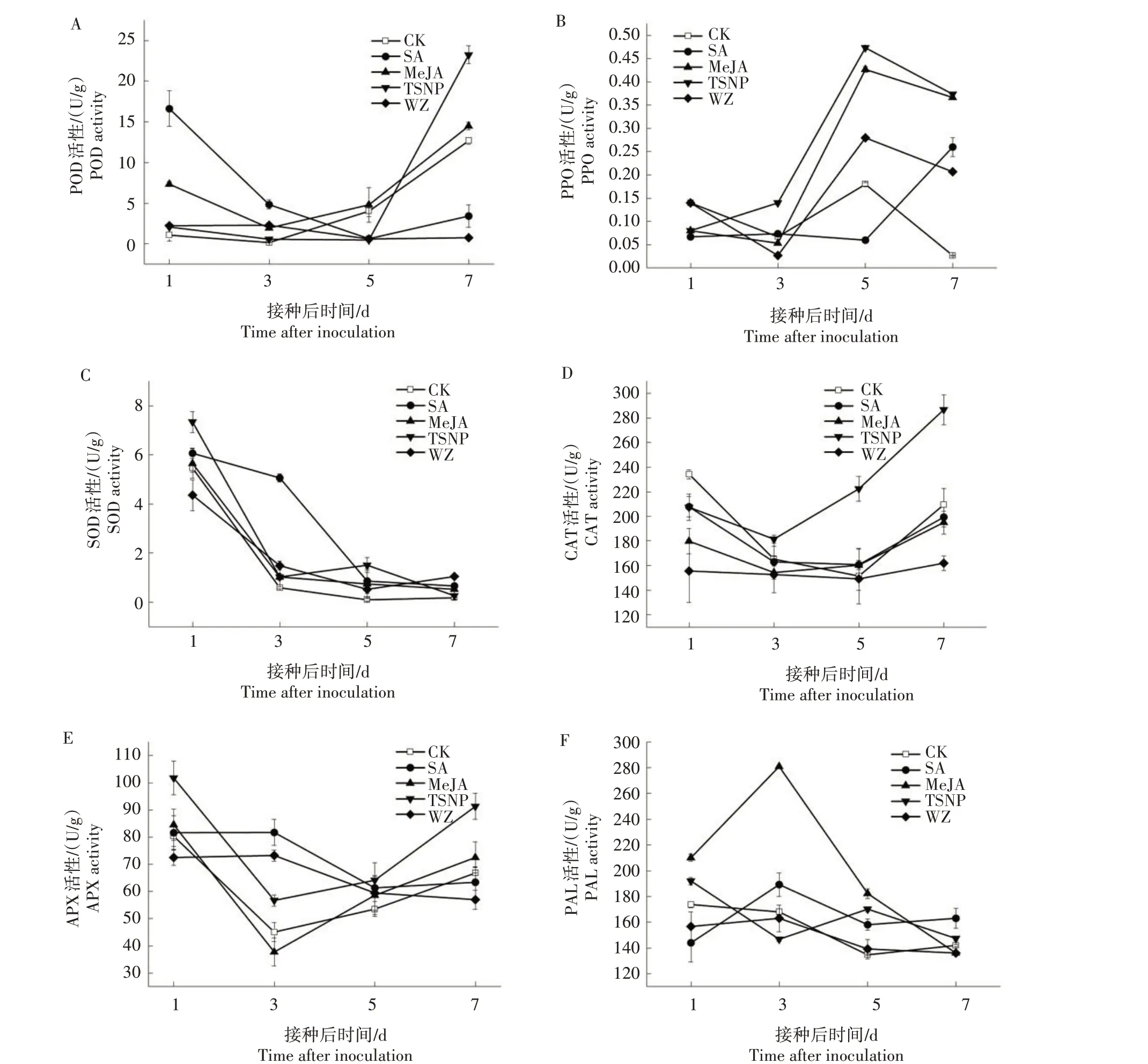
图2 不同生物诱导剂和杀菌剂处理对红枣果实POD、PPO、SOD、CAT、APX和PAL活性的影响Fig.2 Effects of different biological inducers and fungicide treatments on the activities of POD,PPO,SOD,CAT,APX and PAL in jujube fruit
2.4 不同生物诱导剂和杀菌剂处理对红枣果实抗病相关酶基因相对表达量的影响
如图3A 所示,接种链格孢菌后第1、7 天,MeJA处理红枣果实POD相对表达量比CK 分别提高了27.97%、49.06%,TSNP处理比CK分别提高38.42%、67.70%。结果表明,MeJA 处理和TSNP 处理不同程度提高了红枣POD基因的表达量。
如图3B 所示,接种链格孢菌后第1—5 天,MeJA、TSNP、WZ处理和CK的红枣PPO基因表达均呈现上升趋势,且MeJA 处理和TSNP 处理明显高于CK。接种后第1、3、5 天,MeJA 处理比CK 分别提高23.10%、40.67%、35.40%,TSNP 处理比CK 分别提高31.32%、56.46%、49.22%;接种后第7 天,不同处理红枣的PPO基因表达量均有所下降,但生物诱导剂和杀菌剂处理均高于CK。
如图3C 所示,接种链格孢菌后第1—5 天,不同处理红枣SOD基因表达均呈下降趋势。接种后第1、3 天,MeJA、TSNP、WZ 处理红枣SOD基因表达量均高于CK,其中MeJA 处理比CK 分别提高11.81%、16.41%,TSNP处理比CK分别提高17.50%、26.88%,WZ 处理比CK 分别提高16.49%、24.91%;接种后第5 天,SA 处理红枣SOD基因表达量明显高于CK,比CK 提高36.96%;接种后第7 天,SA、MeJA、TSNP、WZ 处理均高于CK,比CK 分别提高14.80%、60.00%、76.79%、61.26%。结果表明,MeJA、TSNP、WZ处理能不同程度提高红枣SOD基因的表达量。
如图3D 所示,接种链格孢菌后第1—7 天,MeJA、TSNP 处理红枣CAT基因表达量呈现上升趋势。接种后第3、5、7 天,MeJA 和TSNP 处理红枣CAT基因表达量均高于CK,比CK 分别提高41.05%、55.43%、26.87% 和 72.45%、58.60%、42.42%。表明MeJA、TSNP 处理不同程度提高了红枣CAT基因的表达量。
如图3E 所示,接种链格孢菌后第1 天,不同生物诱导剂和杀菌剂处理红枣APX基因相对表达量均高于CK;接种后第3、5、7 天,MeJA 处理和TSNP处理红枣APX基因相对表达量保持上升趋势,且均高于CK,比CK 分别提高16.25%、29.24%、17.60%和59.33%、34.70%、40.43%。结果表明,MeJA、TSNP处理不同程度提高了红枣APX基因的表达量。
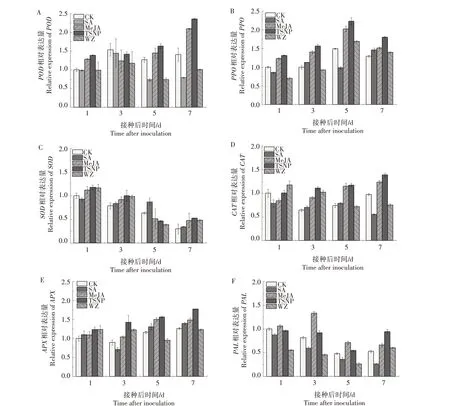
图3 不同生物诱导剂和杀菌剂处理对红枣果实抗病相关酶基因相对表达量的影响Fig.3 Effects of different biological inducers and fungicide treatments on the relative expression of disease resistance related enzyme genes in jujube fruit
如图3F所示,接种链格孢菌后第1—7天,SA处理和CK 红枣果实PAL基因相对表达量均呈现下降趋势;WZ 处理红枣果实PAL基因相对表达量在接种后1—5 天呈下降趋势,但在接种后第7 天有所上调;接种后第3、5、7天,MeJA 处理和TSNP 处理红枣PAL基因相对表达量均高于CK,比CK 分别提高63.19%、47.78%、26.03% 和 12.31%、12.98%、79.06%。结果表明,MeJA、TSNP 处理在接种后第3、5、7天提高了红枣PAL基因的表达量。
3 结论与讨论
诱导抗病性是防治植物病害的重要策略之一,诱导剂处理可以激活红枣中相关防御系统,提高果实的抗病性。本研究中生物诱导剂SA、MeJA 和杀菌剂TSNP、WZ 在田间试验中对红枣黑斑病的防治效果均较好,抗病性相关指标均有不同程度的提高,且不同生物诱导剂和杀菌剂处理对红枣果实营养品质的影响也不尽相同。
碳水化合物、氨基酸、脂肪酸和有机酸的初级代谢物很常见,在植物发育中发挥着重要作用[18],它们是基础营养素,有助于形成枣的独特风味[19]。包括葡萄糖、果糖和蔗糖在内的糖类广泛分布在大枣中,它们的甜味决定了红枣的风味品质[20]。氨基酸是另一种关键营养素,是蛋白质的组成部分,在人类健康中发挥着重要作用[21]。它们也是食品中重要的风味物质和香气前体[22]。此外,一些氨基酸对食品的风味品质也起着重要作用。色氨酸(Trp)、异亮氨酸(Ile)和亮氨酸(Leu)会产生苦味[23],而酪氨酸(Tyr)和苯丙氨酸(Phe)会产生鲜味[24]。本研究中,MeJA 和TSNP 处理红枣果实与CK 相比,Ile 和Leu 2种苦味氨基酸含量无显著差异,但均低于CK;Tyr 和Phe 含量与CK 相比无显著差异。脯氨酸(Pro)和Asp 含量在红枣氨基酸含量中占比最大,与张艳红等[25]、GUO 等[26]、刘杰超等[27]的研究结果基本一致。
弓德强等[28]研究表明,采前SA处理提高了杧果贮藏期SOD、POD 和CAT 等抗氧化酶活性。本研究中,SA 处理在接种链格孢菌后第3 天不同程度提高了红枣果实POD、SOD、APX 和PAL 活性,降低了CAT 活性,与XU 等[29]报道的樱桃果实经SA 处理后不仅提高了CAT 活性,而且刺激了CAT基因的表达结果不一致。大量研究[30‑32]表明,SA 处理可以通过提高POD、PAL 等抗病相关酶活性,调节相应酶基因的表达,在果实中建立诱导抗性,增强果实的抗病性。PAL 是苯丙烷途径的关键酶,PAL 活性的增强与植物细胞壁的木质化有关,可以直接抑制病原菌的侵染[33]。WZ 作为一种化学杀菌剂,在本研究中处理红枣果实后,与CK 相比PPO、SOD 活性有所提高,相应的酶基因表达量也有所上调。MeJA 被证明是一种参与植物防御机制的信号分子[34],能够有效诱导次生代谢物产生和寄主对病原体的抗性,并刺激植物抗逆蛋白和防御基因的表达[35],抑制李子腐烂,提高李子储存质量[36]。在本研究中,接种链格孢菌后,MeJA、TSNP 处理不同程度增强了红枣果实POD、PPO、SOD、APX、PAL 活性,并刺激了相应酶基因的表达。POD、PPO、CAT、APX 与植物抗病性密切相关,其活性的增加及相应基因表达的上调,提高了红枣果实的防御系统活性,可有效诱导红枣果实建立抗病性。SARACOUGLU 等[37]研究证明,20 μmol/L MeJA 处理更有利于诱导蓝莓果实POD、PPO等抗病相关酶活性提高,增强果实的抗病性,降低病害的发生。姜璐璐[38]则发现,MeJA 能提高葡萄果实中的CAT、SOD、PAL 和POD 活性,与本研究的结论有一定差异。诱导果实抗病性是一个复杂的反应过程,不同类型的果实、果实成熟度、诱导剂处理方式和果实感病程度等因素均会影响抗病相关酶活性的变化,造成即使同样的诱导剂也会出现不同的反应结果。
综上所述,SA、MeJA、TSNP 和WZ 均可不同程度地降低红枣黑斑病的自然发病率,提高红枣果实抗黑斑病相关酶活性,刺激酶基因的表达,诱导红枣果实产生抗病性,而不同生物诱导剂和杀菌剂对红枣营养品质的影响各不相同。总体来看,以MeJA 和TSNP 诱导效果最佳,可以作为有效的生物防控诱导剂和杀菌剂。
