江西樱花褐斑病菌的鉴定及其对杀菌剂的敏感性
2022-09-15廖振军曾慧兰高灿周素云刘桂生李润根
廖振军,曾慧兰,高灿,周素云,刘桂生,李润根*
江西樱花褐斑病菌的鉴定及其对杀菌剂的敏感性
廖振军1,2,曾慧兰1,2,高灿1,2,周素云1,2,刘桂生3,李润根1,2*
(1.宜春学院生命科学与资源环境学院,江西 宜春 336000;2.江西省作物生长发育调控重点实验室,江西 宜春 336000;3.江西高安巴夫洛生态谷有限公司,江西 高安 330800)
为明确江西樱花褐斑病病原菌的种类,以樱花典型褐斑病叶片为材料,采用组织分离法,通过形态特征鉴定并结合SSU、LSU、ITS、和等基因分子生物学方法进行病原鉴定。结果表明:江西樱花褐斑病病原菌为交链格孢();采用生长速率法测定病原菌对10%苯醚甲环唑水粉散剂、12.5%烯唑醇可湿性粉剂、2×108cfu/g木霉可湿性粉剂、500 g/L异菌脲水悬浮剂、400 g/L氟硅唑乳油、325 g/L苯甲·嘧菌酯水悬浮剂、430 g/L戊唑醇水悬浮剂、250 g/L嘧菌酯水悬浮剂等8种药剂的敏感性,苯醚甲环唑、烯唑醇和木霉等对病原菌有明显的抑制作用,EC50值分别为0.001、0.022 mg/L和0.168个孢子/mL。推荐这3种药剂作为江西樱花褐斑病防治的优选药剂。
樱花褐斑病;交链格孢;病原鉴定;杀菌剂;敏感性;江西
江西优越的气候和立地条件十分适合樱花生长。随着樱花栽培面积的不断扩大和年限的延长,樱花病害发生有加重的趋势。已报道的樱花病害主要有樱花根癌病[1–2]、樱花褐斑穿孔病[3–4]等。2020 年5—6 月,江西高安等地发生较严重的樱花褐斑病,发病严重地块的发病率达90%,大量樱花叶片褐腐、脱落,严重影响了樱花的正常生长和观赏品质。笔者采集具有典型褐斑病症状的樱花叶片,采用组织分离法和生长速率法,运用形态学观察和分子生物学鉴定方法确定了褐斑病病原菌,并筛选出抑菌效果较好的杀菌剂。现将结果报告如下。
1 材料与方法
1.1 材料
于2020年5月中旬,在江西高安巴夫洛生态谷有限公司基地采集樱花褐斑病发病叶片。
植物DNA提取试剂盒,天生化科技(北京)有限公司产品。
供试药剂: 10%苯醚甲环唑水粉散剂、325 g/L苯甲·嘧菌酯水悬浮剂、250 g/L嘧菌酯水悬浮剂为先正达南通作物保护有限公司产品;12.5%烯唑醇可湿性粉剂为四川润尔科技有限公司产品;2×108cfu/g木霉可湿性粉剂(牛博士)为山东泰诺药业有限公司产品;500 g/L异菌脲水悬浮剂为江西禾益化工股份有限公司产品);400 g/L氟硅唑乳油为江门市大光明农化新会有限公司产品;430 g/L戊唑醇水悬浮剂为拜耳股份公司产品。
1.2 方法
1.2.1樱花褐斑病病原菌的分离与鉴定
采用组织分离法,用马铃薯葡萄糖琼脂培养基(PDA)[5]对樱花褐斑病病原菌进行分离纯化,纯化后的菌株接种至马铃薯胡萝卜琼脂培养基(PCA)[6]上,于 25 ℃、每天12 h光暗交替培养。参照陈捷[7]、陆家云[8]和张天宇[9]记录的方法,观察记载病原菌落的形态、分生孢子、分生孢子链的形态特征。
将培养7 d后的病原菌打取直径0.5 cm的菌块,采用刺伤接种方法,在灭菌的健康樱花叶片上接种。接种后的叶片放置培养皿中,25 ℃保湿培养,观察叶片发病情况。待叶片发病后,再从叶片病健部位分离病原菌,并与初分离获得的菌株性状进行比较。
用植物基因组DNA提取试剂盒提取病原菌的DNA。以SSU(NS1/NS4)、LSU(LR0R/LR5)、ITS (ITS1/ITS4)(gpd1/gpd2)(RPB2–5F/ RPB2–7cR)1(EF–1F/ EF–1R)(Alt–for / Alt–rev)和组蛋白(H3–1a/H3–1b)等引物[10–12]扩增菌株的基因序列。扩增产物经琼脂糖凝胶电泳纯化后,交生工生物工程(上海)股份有限公司测序。测序结果与NCBI官网菌属内其他物种进行Blast比对分析。运用MEGA 5.2.2,采用最大似然法构建系统发育树。
1.2.2杀菌剂对病原菌的室内毒力测定
参考李润根等[13]方法,配制PDA含药培养基:苯醚甲环唑质量浓度分别为0.200 0、0.020 0、0.002 0、0.001 0、0.000 2、0.000 1 mg/L;烯唑醇质量浓度分别为0.125、0.012 5、0.002 5,0.001 25、0.000 25、0.000 125 mg/L;木霉质量浓度分别为5.0、2.0、1.0、0.5、0.33、0.20 mg/L;异菌脲质量浓度分别为100.00、25.00、10.00、5.00、0.50、0.25 mg/L;氟硅唑质量浓度分别为40.00、8.00、0.80、0.20、0.133、0.08 mg/L;苯甲·嘧菌酯质量浓度分别为65.000、32.500、6.500、3.250、0.650、0.325 mg/L;戊唑醇质量浓度分别为86.000、21.500、8.600、4.300、0.430、0.143 mg/L;嘧菌酯质量浓度分别为500、50、5、2.5、0.833、0.5 mg/L,均以加入等量无菌水的培养基为对照。采用生长速率法进行药剂筛选。接种直径为5 mm的菌饼,每天12 h光暗交替、25 ℃恒温培养,每个处理重复3 次。7 d后取出,用十字交叉法测量菌落直径,并计算抑菌率[13]。利用Excel和SPSS 22.0求各药剂毒力回归方程、相关系数、EC50和EC90。
2 结果与分析
2.1 樱花褐斑病症状及病原菌的致病性
江西高安樱花褐斑病5月上旬始发,5月中下旬进入盛期,重病株发病率达90%以上。褐斑病菌主要侵染叶片,新叶较老叶发病严重。病斑呈圆形、近圆形或不规则形,中央褐色,部分边缘淡黄色,后期病斑常在叶片背面形成大斑,叶片黄化,脱落(图1– 1、图1–2)。
对采集的病叶进行病菌分离、纯化,共获得8个真菌分离物,这些分离物在PDA平板上的培养性状基本一致。选取代表性分离物yh9–5菌丝块接种在健康樱花叶片上,先出现褐色斑点,后逐渐扩大成圆形,最后圆形连成一片,病斑呈水渍状,淡褐色。接种yh9–5菌株后7 d开始发病,至12 d时症状明显(图1–4),而对照没有症状(图1–3)。从发病叶片上分离的菌株与接种的病原菌一致,确定yh9–5为樱花褐斑病病原菌。
2.2 樱花褐斑病病原菌的鉴定结果
病原菌yh9–5菌落呈圆形,初期无色,后转为灰白色,生长较快,菌丝密,气生菌丝呈灰白色、发达,菌落较平滑,背面呈青褐色,具灰白色轮纹(图1–5、图1–6);次生分生孢子梗或孢子侧向分支,形成短孢子链,直立或弯曲,分生孢子呈深褐色,倒梨形、卵形或倒棍棒形,有0~4个横隔,多数有4个横隔,0~4个纵隔,部分孢子具柱状喙,分生孢子大小(12.7~30.9) µm×(8.2~19.3) µm(图1–7、图1–8、图1–9)。初步确定菌株为链格孢属。

1 田间发病叶片;2 田间发病植株;3 PDA接种12 d樱花叶片;4 yh9–5接种12 d樱花叶片;5 PCA 培养7 d 时菌落正面;6 PCA 培养7 d 时菌落背面;7 yh9–5产孢表型;8 yh9–5分生孢子梗;9 yh9–5分生孢子。
选取SSU、LSU、ITS、基因序列进行扩增,得到大小分别为1018、838、539、586、250、724、481 bp的片段。采用基因序列进行扩增,得到大小约为534 bp的片段。将获得的SSU等7基因序列,利用NCBI网站和软件MEGA5.2.2选用模式种(F)issl的11个种和1 个复合种[14]等近缘种建立系统发育树,结果,yh9–5与菌株AC82[15]聚在一支,确定引起江西樱花褐斑病的病原菌yh9–5为交连格孢()(图2)。
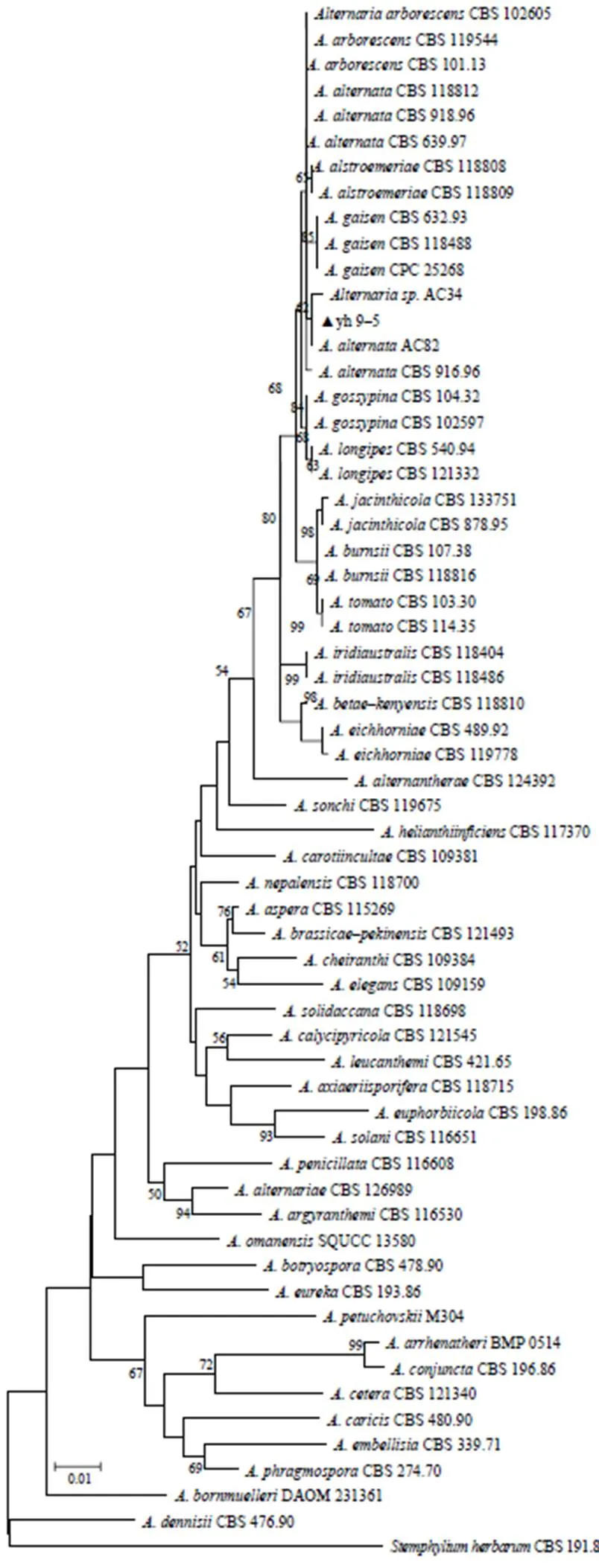
图2 基于SSU、LSU、ITS、GAPDH、TEF、RPB2和Alt al基因整合序列构建的樱花褐斑病菌株及相似病菌的系统发育树
2.3 杀菌剂对樱花褐斑病菌的室内毒力
8种杀菌剂对yh9–5菌丝的生长均有抑制作用。苯醚甲环唑、烯唑醇和木霉等药剂的EC50值分别为0.001 mg/L、0.022 mg/L和0.168 个孢子/mL,抑菌作用较明显;异菌脲和氟硅唑对yh9–5菌丝生长的EC50值分别为0.763、0.932 mg/L。为进一步确定供试药剂对yh9–5菌的抑制作用,对8种药剂的EC90值进行分析比较,其中,EC90值较小的有苯醚甲环唑、异菌脲和氟硅唑等(表1)。

表1 8种杀菌剂对病原菌菌丝生长的毒性
从毒力回归方程来看,病原菌对异菌脲最敏感,而对嘧菌酯最不敏感。
3 小结与讨论
根据江西高安樱花褐斑病病原菌的形态学鉴定结果,结合多基因联合构建系统发育树,确定樱花褐斑病病原菌菌株yh9–5为交链格孢。yh9–5与(F)issl模式种聚为一群,都归属于.一类,但又不与模式菌株.CBS 918.96聚为一支。冯中红等[14]研究认为,由于对种的界限尚未明确界定,链格孢组群内种的关系仍存在许多争议[14],说明链格孢种级分类体系仍需完善。
8种药剂对菌株yh9–5均有一定的抑制作用,苯醚甲环唑的抑菌作用最强,烯唑醇、异菌脲的抑菌作用较强,嘧菌酯的抑制作用最差,这与范文忠等[16]的研究结论类似,但与刘俏等[17]研究的樱桃叶斑病菌差异较大,可能是不同链格孢菌株所致。木霉系生物农药的抑菌效果也很好,因此,推荐使用苯醚甲环唑、烯唑醇和木霉等防治樱花褐斑病。
[1] 倪大炜,沈杰,张炳欣.日本樱花根癌病病原菌的鉴定及其防治[J].微生物学通报,1999,26(1):11–14.
[2] 王志龙,金杨唐,谭志文,等.宁波樱花根癌病病原细菌鉴定[J].植物保护,2014,40(3):147–150.
[3] 汤春梅,杨庆森.天水城市园林植物真菌病害调查初报[J].甘肃农业科技,2016(11):35–37.
[4] 刘秀丽,张楠楠.樱花穿孔性褐斑病防治试验[J].山东林业科技,2014,44(5):86.
[5] 梁萍,宁平,简峰,等.黄脉爵床棒孢霉叶斑病病原菌及其生物学特性鉴定[J].植物病理学报,2018,48(6):758–765.
[6] 龙巧芳,梁文,蒋芹娜,等.贵州六盘水地区大白菜黑斑病病原菌鉴定及培养特性研究[J].中国蔬菜,2022(1):89–95.
[7] 陈捷.现代植物病理学研究方法[M].北京:中国农业出版社,2007.
[8] 陆家云.植物病原真菌学[M].北京:中国农业出版社,2001.
[9] 张天宇.中国真菌志(第十六卷)链格孢属[M].北京:科学出版社,2013.
[10] WOUDENBERG J H C,SEIDL M F,GROENEWALD J Z,et al.section:species,formae speciales or pathotypes?[J].Studies in Mycology,2015,82:1–21.
[11] 宋博,朱晓锋,徐兵强,等.库尔勒香梨果萼黑斑病病原鉴定及其ITS、GPD 和EF-1α序列分析[J].园艺学报,2016,43(2):329–336.
[12] 李映程,张国丽,任毓忠,等.基于 rDNA-ITS和组蛋白 3基因序列分析鉴定新疆棉花叶斑病病原[J].棉花学报,2018,30(3):272–281.
[13] 李润根,曾慧兰,卢其能,等.百合枯萎病菌的鉴定及其对杀菌剂敏感性研究[J].园艺学报,2021,48(1):162–172.
[14] 冯中红,孙广宇.链格孢属及相关属分类研究新进展[J].菌物研究,2020,18(4):294–303.
[15] NISHIKAWA J,NAKASHIMA C.Japanese species ofand their species boundaries based on host range[J].Fungal Systematics and Evolution,2020(5):197–281.
[16] 范文忠,冯时,姜仁婧,等.紫穗槐叶斑病病原菌生物学特性及药剂敏感性[J].东北林业大学学报,2020,48(7):128–132.
[17] 刘俏,宁楠楠,马永强,等.青海省樱桃叶斑病菌生物学特性及室内药剂毒力测定[J].植物保护,2021,47(3):136– 143.
Identification of the pathogen causing brown spot inin Jiangxi and its sensitivity to fungicides
LIAO Zhenjun1,2,ZENG Huilan1,2,GAO Can1,2,ZHOU Suyun1,2,LIU Guisheng3,LI Rungen1,2*
(1.College of Life Science and Environmental Resource, Yichun University, Yichun, Jiangxi 336000, China; 2.Jiangxi Key Laboratory of Crop Growth Regulation, Yichun, Jiangxi 336000, China; 3.Jiangxi Gaoan Bafuluo Ecological Valley Co. Ltd, Gaoan, Jiangxi 330800, China)
To clarify the specific pathogentic species of brown spot in,typical infected leaves were used as materials. Traditional tissue separation method and morphological identification method were combined with analysis of multilocus of SSU, LSU, ITS,,,,andto identify the pathogen. Andwas identified as the pathogen of brown spot inThe growth rate method was used to determine the sensitivity of the pathogen to 8 fungicides including 10% difenoconazole(WG), 12.5% diniconazole(WP), 2×108cfu/g trichoderma (WP), 500 g/L isocarbazide(SC), 400 g/L flusilazole(EC), 325 g/L difenoconazole-azoxystrobin(SC), 430 g/L tebuconazole(SC), 250 g/L azoxystrobin(SC). Difenoconazole, diniconazole and trichoderma had stronger inhibitory effect against the pathogen, with the concentration for 50% of maximal effect(EC50) being 0.001 mg/L, 0.022 mg/Land 0.168 spores/mL respectively. These three fungicides mentioned above were recommended as the best fungicides for the pathogen of brown spot inin Jiangxi Province.
brown spot of in;; pathogen identification; fungicides; sensitivity; Jiangxi
S432.1
A
1007-1032(2022)04-0449-05
廖振军,曾慧兰,高灿,周素云,刘桂生,李润根.江西樱花褐斑病菌的鉴定及其对杀菌剂的敏感性[J].湖南农业大学学报(自然科学版),2022,48(4):449–453.
LIAO Z J,ZENG H L,GAO C,ZHOU S Y,LIU G S,LI R G.Identification of the pathogen causing brown spot inin Jiangxi and its sensitivity to fungicides[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(4):449–453.
http://xb.hunau.edu.cn

2022–02–15
2022–04–11
江西省科学技术厅重点研发项目(20161BBF60040)
廖振军(1970—),男,江西宜春人,硕士,副教授,主要从事园林植物应用研究,ycxylzj@163.com;*通信作者,李润根,硕士,教授,主要从事植物病理学研究,13507058200@163.com
责任编辑:罗慧敏
英文编辑:罗维
