辣椒细胞质雄性不育突变体CMS102的败育机理及其育性遗传
2022-09-15杨慧萍潘路招汤冰倩邹学校戴雄泽刘峰
杨慧萍,潘路招,汤冰倩,邹学校,戴雄泽,刘峰*
辣椒细胞质雄性不育突变体的败育机理及其育性遗传
杨慧萍1,潘路招5,汤冰倩1,邹学校2,3,4,戴雄泽2,3,4,刘峰2,3,4*
(1.湖南大学研究生院隆平分院,湖南 长沙 410125;2.湖南农业大学园艺学院,湖南 长沙 410128;3.园艺作物种质创新与新品种选育教育部工程研究中心,湖南 长沙 410128;4.蔬菜生物学湖南省重点实验室,湖南 长沙 410128;5.南京农业大学园艺学院,江苏 南京 210095)
以辣椒细胞质雄性不育突变体及其相应的恢复系ST–8为材料,对其造孢期、小孢子母细胞期、小孢子减数分裂期、四分体时期、单核小孢子期、双核小孢子期和花粉粒成熟期的花蕾进行细胞学形态观察,测定小孢子减数分裂期、四分体时期、单核小孢子期和双核小孢子期发育时期的花蕾中与育性相关的生理活性物质的含量。结果表明:败育发生在四分体时期,绒毡层过度膨大挤压四分体,使其不能正常发育成单核小孢子,属于孢子体不育;花蕾中可溶性蛋白和游离脯氨酸含量低于ST–8的,可溶性糖、MDA含量及POD酶活性高于ST–8的;构建F2遗传分离群体并调查其育性,对的育性进行遗传学分析,2育性恢复由1对显性基因调控。
辣椒;细胞质雄性不育突变体;花药细胞形态学;生理生化特征;育性
植物雄性不育现象在开花植物中普遍存在,是指植物在有性繁殖过程中雄蕊发育异常或无法产生具有正常功能的花粉,但雌蕊发育正常且功能无异常[1]的现象,目前已在约150多种高等植物中被报道[2]。雄性不育现象运用在农作物的杂种优势生产中,可以大幅提高农作物的产量和品质,促进农业生产的发展。在水稻、小麦、玉米、油菜、辣椒、番茄等重要农作物的生产中都大量选用杂交品种[3]。辣椒(L.)是中国种植面积最大的蔬菜作物[4],属常异花授粉作物,具备很强的杂种优势。杂交制种可以极大地提高辣椒的产量、抗性和改善品质[5]。细胞质雄性不育可以通过三系配套育种实现大量生产商品杂交种子,而细胞质雄性不育材料是群体改良和利用杂种优势的重要育种工具,全面研究其不育机理有利于选育出优良不育系,充分发挥三系法育种优势。
植物雄性不育败育一般发生在小孢子四分体时期前后,多数表现为绒毡层过早或延迟的细胞程序性死亡(PCD)[6]。在辣椒细胞质雄性不育系8214A花药发育过程中,由于绒毡层细胞高度液泡化,过早出现PCD特征,在减数分裂时期开始退化,导致部分小孢子母细胞提前退化死亡[7]。LIU等[8]发现,番茄雄性不育突变体中绒毡层细胞异常膨大和空液泡化,加之绒毡层PCD延迟,退化没有发生,最终导致花粉母细胞被挤压而死亡,从而发生败育。
植物花药的正常发育是一系列生理生化过程协同作用的最终结果,受到体内外各种因素的调控,异常的生理生化反应会影响花药发育的全部过程,引发雄性不育现象[9]。花药内可溶性糖、可溶性蛋白质以及游离脯氨酸等营养物质的代谢异常变化可能会导致雄性不育的发生[10]。小麦花粉败育机制研究中发现抗氧化酶的异常表达破坏了抗氧化系统的平衡,与绒毡层的PCD异常有关[11]。在大豆不育系花蕾期SOD和CAT的活性显著低于保持系,而POD高于保持系,这使得不育系小孢子中ROS代谢紊乱,导致小孢子败育[12]。辣椒雄性不育中有关ROS代谢相关抗氧化酶类的报道较少,主要集中在POD、SOD和CAT活性的变化以及相关酶谱带的差异[13]。由于遗传因素和环境条件的不同,不同遗传背景的雄性不育材料在生理生化指标上存在一定差异,因此,重要生理活性物质的测定对研究植物雄性不育的败育机理具有重要意义。
目前,已在多种蔬菜作物中构建突变体库[14]。YANG等[15]利用EMS诱变构建了辣椒突变体库并成功筛选出矮杆辣椒突变体,为辣椒育种提供了新资源,能加速辣椒分子育种的发展及新品种选育的进程。冯文鹏等[16]利用辣椒反向温敏雄性核不育突变体研究了辣椒育性转化的临界温度及影响育性的重要因素,并明确了该突变体的育性是由隐性单基因控制的质量性状。
笔者以选育的辣椒不育突变体为材料,观察其花药组织结构,发现花粉败育发生在四分体时期,与绒毡层发育异常有关。通过测定相关生理指标,发现不育突变体和ST–8花蕾中涉及败育发生的重要营养代谢物质和酶活性变化差异明显。对不育突变体的育性进行遗传学分析,表明其育性是由1对显性恢复基因调控的。
1 材料与方法
1.1 材料
供试辣椒材料恢复系ST–8、保持系8214和雄性不育突变体,均由湖南农业大学园艺学院辣椒课题组提供。突变体植株由ST–8经EMS诱变筛选获得。
1.2 方法
1.2.1辣椒遗传群体的构建
以突变体为母本,ST–8和8214分别为父本进行杂交,获得2个F1群体;将×ST–8 F1群体进行自花授粉,从而获得F2群体;将F2代种子播种至含营养基质的105孔育苗穴盘中,放置在人工气候温室培养,培养条件为28 ℃、16 h光照和20 ℃、8 h黑暗,光照度为10 000 lx,相对湿度为60%~70%。待幼苗长出4~5片真叶后(约28~30 d),移栽至薄膜大棚中种植,逐株编号,常规栽培。将与(×ST–8)F1杂交,获得回交群体BC1。
1.2.2花粉活力统计
分别采集不育突变体和ST–8的成熟未开放的花蕾,采用I2–KI法测定花粉活力。待F1和F2和BC1群体植株基本处于盛花期时,观察花药大小和花粉情况,对群体各单株的育性进行统计判断。于晴天10:00左右观察为宜,当天开放花朵花药基本已开裂,可育株花朵花药饱满,布满花粉;不育株花药干瘪,无花粉散出。对肉眼无法判断的植株,则选取3朵成熟未开放的花朵逐一进行I2–KI染色,根据花粉活力染色结果判断育性并统计记录,共调查3次,时间间隔5 d左右。分别计算F1和F2群体植株的育性分离比,对结果进行卡方检验。
1.2.3花药细胞学观察
辣椒盛花期时,分别选取不育突变体和ST–8不同大小的花蕾,参考辣椒花蕾分级的相关研究[16–17],将材料进行分级,即造孢期(Ⅰ)、小孢子母细胞期(Ⅱ)、小孢子减数分裂期(Ⅲ)、四分体时期(Ⅳ)、单核小孢子期(Ⅴ)、双核小孢子期(Ⅵ)、花粉粒成熟期(Ⅶ)和花蕾开放期(Ⅷ)。选取和ST–8的花蕾,采用甲苯胺蓝染色法[18]进行石蜡切片制片,观察小孢子发育过程的变化特征。
1.2.4生理生化指标的测定
分别选取60株和ST–8,于盛花期分别采集5个不同发育时期的花蕾,使用试剂盒(南京建成生物工程研究所)提取其中的可溶性糖、可溶性蛋白、游离脯氨酸、丙二醛和POD,用分光光度法分别测定这些生理活性物质的含量及酶活性。
1.3 数据处理
试验数据均使用Microsoft Excel 2019整理和计算,使用SPSS 26.0分析数据的显著性差异。
2 结果与分析
2.1 CMS102花药形态特征和花粉活力
分别对不育突变体和ST–8成熟开裂的花朵进行观察,发现成熟花朵除花药存在明显的形态差异外,其他组织无明显差别。ST–8花药饱满且体积较大,开裂后布满花粉粒(图1–1),的花药体积明显小于ST–8的,呈干扁皱缩状,并且开裂后无明显花粉散出(图1–2)。对花药进行I2–KI花粉活力染色,镜检发现ST–8成熟花药内的花粉粒数量多,大多数花粉粒体积较大,呈圆形且染色较深,只有少数花粉发育不良,呈浅黄色(图1–3),经统计,花粉活力为96.3%。成熟花药内无染色花粉粒,只有花药残渣(图1–4),说明突变体的花药内无花粉粒产生,属于完全败育类型。

1 ST–8花朵;2 CMS102花朵;3 ST–8花粉活力观察;4 CMS102花粉活力观察。
2.2 CMS102不同发育时期花蕾的花药显微结构
分别对和ST–8的花蕾发育进行连续观察,根据花蕾大小对花蕾的发育阶段进行初步分级,结合石蜡切片辅助验证,确定花蕾发育的8个时期,如图2所示。
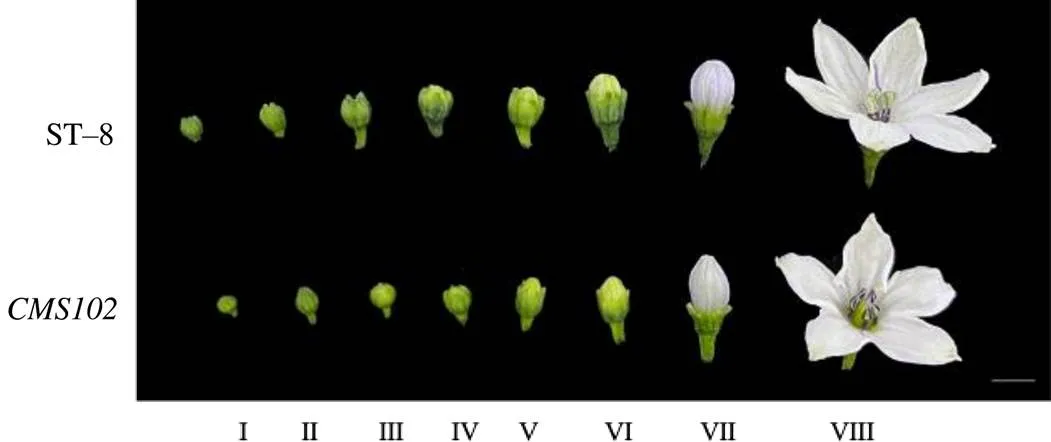
Ⅰ 造孢期;Ⅱ 小孢子母细胞期;Ⅲ 小孢子减数分裂期;Ⅳ 四分体时期;Ⅴ 单核小孢子期;Ⅵ 双核小孢子期;Ⅶ 花粉粒成熟期;Ⅷ 花蕾开放期。
图3结果表明,在四分体时期之前,和ST–8花药发育无明显差异,在造孢期,和ST–8花药都分化出造胞细胞(Sp),花药外壁细胞层由外到内分别依次为表皮层(Ep)和次生壁层(2°P);在小孢子母细胞期,次生壁层分化形成药室内壁(En)、中层(ML)和绒毡层(T),造胞细胞分化成小孢子母细胞,为减数分裂作好准备;小孢子母细胞进入减数分裂阶段,产生减数分裂细胞(MC),绒毡层开始与中层分离;在四分体时期,败育开始发生,花药内绒毡层细胞体积异常膨大并且高度液泡化,产生的四分体受到绒毡层的挤压,加之胼胝质不降解,导致四分体无法正常分离,不能发育成单核小孢子;在单核小孢子期绒毡层细胞和四分体都继而退化死亡。而ST–8花药内小孢子母细胞经减数分裂后形成四分体,绒毡层与中层分离,胼胝质逐渐降解,四分体正常分离,发育成单核小孢子,单核小孢子继续发育直至发育为成熟的花粉粒,绒毡层细胞在双核小孢子期完全退化。说明突变体的败育开始发生在四分体时期,由绒毡层细胞异常膨大和过早退化而导致花粉败育,属于孢子体不育类型。
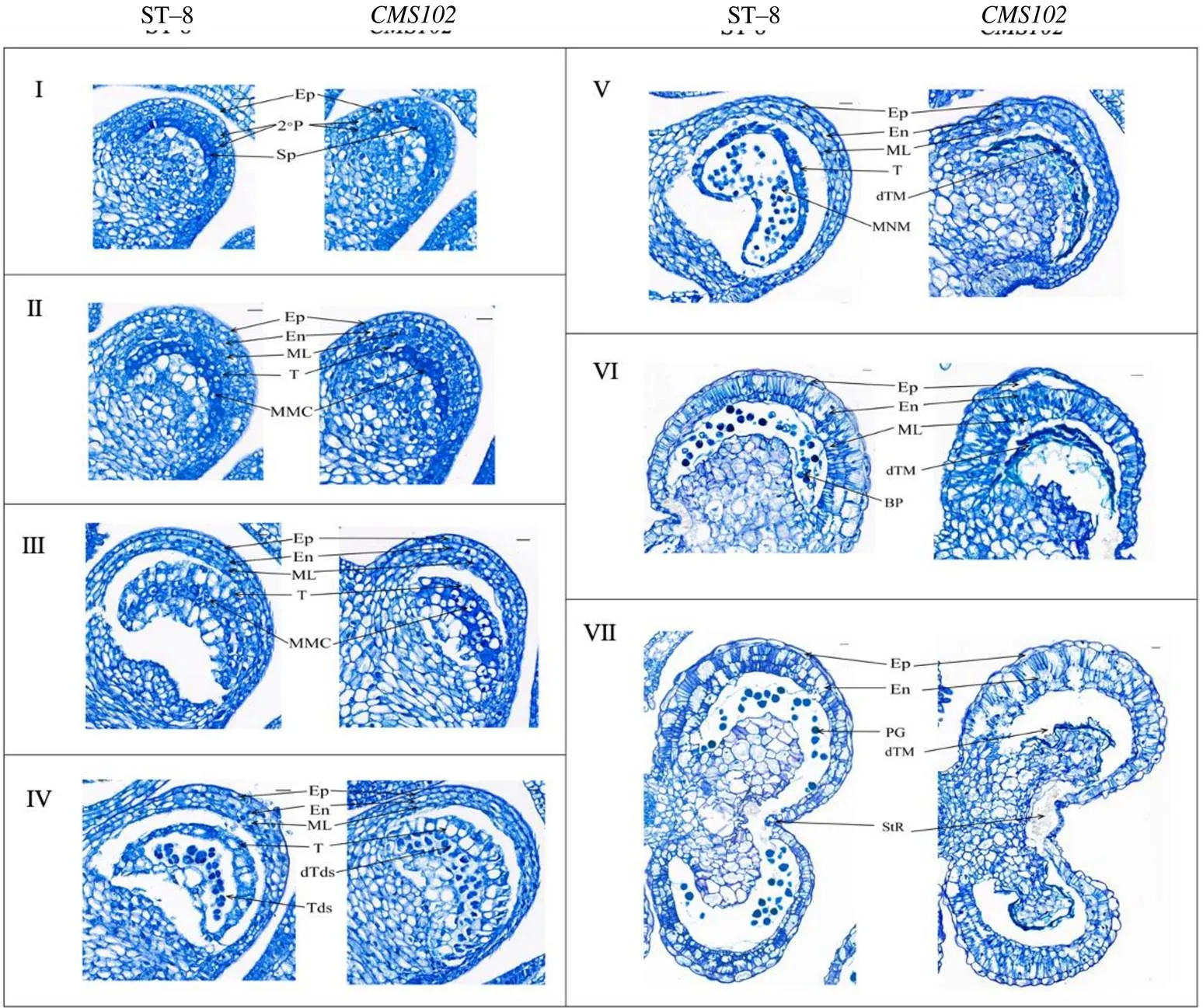
Ep 表皮;2°P 次生壁层;Sp 造孢细胞;En 药室内壁;ML 中层; T 绒毡层; MMC 花粉母细胞;Tds 四分体;dTds 死亡四分体;MNM 单核小孢子;dTM 死亡绒毡层;Bp 双核小孢子;PG 成熟花粉粒。
2.3 CMS102不同发育时期花蕾的生理生化特征
对突变体和恢复系ST–8小孢子减数分裂期、四分体时期、单核小孢子期、双核小孢子期和花粉粒成熟期花蕾的生理活性物质进行分析,可溶性糖、可溶性蛋白质、游离脯氨酸、丙二醛(MDA)含量及过氧化物酶(POD)活性测量结果(图4)表明,随着小孢子的发育,可溶性糖含量在恢复系花蕾中变化不明显,在花蕾中整体呈下降趋势,但中的含量高于恢复系,在第Ⅲ、Ⅳ、Ⅴ和Ⅶ时期均存在显著差异。
和ST–8花蕾发育过程中可溶性蛋白含量均呈下降趋势,在花蕾中的含量低于ST–8的。在第Ⅳ时期,花蕾中可溶性蛋白含量与ST–8的差值最大,且存在显著差异。
在第Ⅲ和Ⅳ时期,花蕾中游离脯氨酸的含量高于ST–8的,但在第Ⅴ期后,ST–8花蕾中脯氨酸含量迅速积累,远高于,在第Ⅵ期含量两者差值最大。
和ST–8花蕾中MDA含量在小孢子发育过程中都逐渐降低,且中的含量高于ST–8的,在第Ⅵ期,二者MDA含量存在极显著差异。
同一发育期内花蕾中POD活性均高于ST–8的,除第Ⅲ期外,都存在显著差异,在第Ⅵ期有最大差异。
2.4 CMS102育性的遗传
对子代育性进行的调查统计结果(表1)显示,与8214杂交后获得的F1代都表现为不育性状,说明突变体属于细胞质雄性不育类型,8214为其相应的保持系。与ST–8杂交获得的40株F1植株全表现为可育性状,表明可育性状为显性,且ST–8为的1个恢复系。将与(×ST–8)F1群体杂交后,获得回交群体BC1的子代中,可育植株与不育植株的比值接近1∶1;(×ST–8)F2代群体中可育植株为263株,不育植株为82株,分离比值接近 3∶1,经卡方检验后,实际比值与理论比值没有显著差异,说明育性性状的遗传符合孟德尔遗传规律,由1对单基因调控。以上结果表明,突变体材料的细胞质雄性不育恢复性受到1对显性核基因调控,可育对不育为显性。
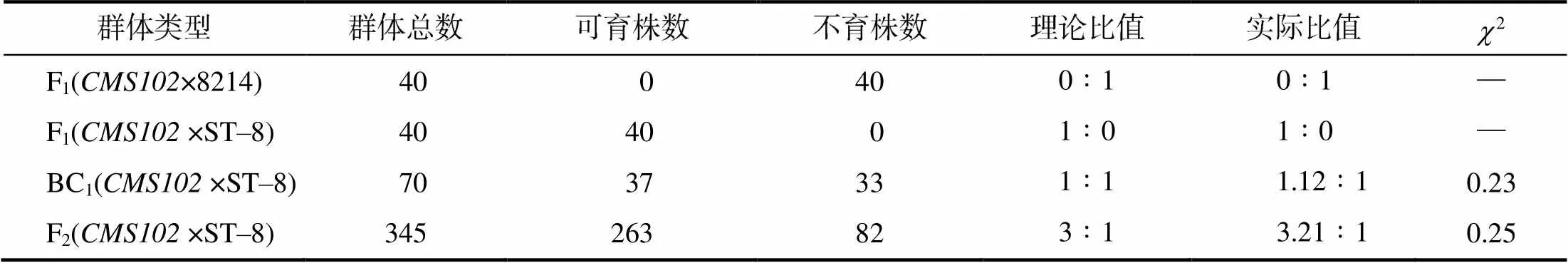
表1 突变体CMS102遗传群体子代育性统计
2> 3.84(1),< 0.05,差异显著;2< 3.84(1),> 0.05,差异不显著。
3 结论与讨论
植物正常花粉粒的形成包括雄蕊原基的分化、造孢细胞的产生、小孢子母细胞发育成花粉粒的过程,花粉粒的成熟和释放,任何一个阶段的发育异常都可能导致雄性不育的发生,无法产生或释放功能性花粉粒[19]。在不同辣椒的不育材料中,发生败育的时期和方式不完全相同。研究表明,辣椒细胞质雄性不育系8214A在减数分裂前期由于花粉母细胞核DNA受损,部分花粉母细胞降解,且无法形成正常的四分体,从而发生败育[20]。不育系8A小孢子败育发生在四分体时期,是由绒毡层的异常发育导致的花粉败育[21]。绒毡层细胞为花粉正常发育提供营养物质和孢粉素前体,异常的PCD可能会导致花粉败育[6,20]。本试验结果表明,细胞质雄性不育突变体败育开始发生在四分体时期,表现为绒毡层细胞异常膨大和提前PCD,体积过大的绒毡层细胞会挤压已成形的四分体,而绒毡层提前PCD可能会造成小孢子后期发育的营养物质供给不足,最终导致小孢子液泡化死亡。
植物雄性不育发生过程中会引起代谢紊乱,必然伴随着许多物质含量的剧烈变化。蛋白质和氨基酸在小孢子发育过程中有着重要作用,不仅能为花粉发育提供能量,促进细胞新陈代谢,也是细胞的重要组成物质[10]。前人研究表明,不育花蕾中的可溶性蛋白和游离脯氨酸的整体含量都明显低于可育花蕾[16, 17, 22],本研究结果与其一致,说明小孢子发育过程中,营养物质的积累不足可能会阻碍小孢子的正常发育,引起花粉败育。糖类物质既是花粉发育所需的主要营养物质和能量来源,也可以作为信号物质调控生命活动[23]。在不育花蕾中的可溶性糖含量均显著高于同期可育花蕾。不育花蕾中可溶性糖积累异常,可能与糖转运或蔗糖水解受阻有关[24]。在小孢子发育过程中,与恢复系花蕾相比,花蕾中POD酶活性和MDA含量都处于较高水平,说明POD无法及时清除花药细胞中产生的ROS,使其维持在较高水平。ROS水平高会破坏脂膜系统,造成细胞内生理代谢紊乱,可能引起败育[22, 25]。有研究表明,POD活性过高会降解IAA,影响营养物质在花药中的积累与代谢,导致花粉的败育[26–27]。营养物质的积累与代谢异常,以及细胞内ROS水平处于非稳态状态都可能导致雄性不育的发生,但其分子调控途径还有待研究。
目前从辣椒中发现的细胞质雄性不育材料较多,对控制不育性状的核基因进行定位并开发连锁分子标记能极大提高转育效率[28]。前人研究表明,辣椒细胞质育性是由单基因或多基因控制的质量性状或数量性状[29–31]。魏兵强等[30]对辣椒细胞质不育系8A的遗传规律研究表明,育性恢复受2对主效基因和多对微效基因调控。本研究通过构建F2分离群体对进行遗传分析,可育与不育单株的比值为3∶1,符合孟德尔遗传规律,表明育性受到1对显性恢复基因调控。与其他不同遗传背景的辣椒细胞质雄性不育材料77013A[31]和BA3[32]的研究结果类似,在不同遗传背景的辣椒CMS中存在不同的恢复基因,其遗传效应也有所不同,其中具有单基因遗传效应的恢复基因更具有研究与应用价值。
[1] KAUL M L H.Male Sterility in Higher Plants[M]. Berlin:Springer Science & Business Media,2012.
[2] DU K,XIAO Y,LIU Q,et al.Abnormal tapetum development and energy metabolism associated with sterility in SaNa-1A CMS ofL[J].Plant Cell Reports,2019,38(5):545–558.
[3] LI S,YANG D,ZHU Y.Characterization and use of male sterility in hybrid rice breeding[J].Journal of Integrative Plant Biology,2007,49(6):791–804.
[4] 邹学校,马艳青,戴雄泽,等.辣椒在中国的传播与产业发展[J].园艺学报,2020,47(9):1715–1726.
[5] WEI B,BOSLAND P W,ZHANG Z,et al.A predicted NEDD8 conjugating enzyme gene identified as acandidate Rf gene using bulk segregant RNA sequencing[J].Horticulture Research,2020,7(1):210.
[6] WEN J F,ZHAO K,LV J H,et al.Orf165 is associated with cytoplasmic male sterility in pepper[J].Genetics and Molecular Biology,2021,44(3):e20210030.
[7] QIU Y L,LIAO L J,LIU S Z,et al.Differences on the microsporogenesis and tapetal development of male fertile and cytoplasmic male sterile pepper (L.)[J].Grana,2017,56(3):215–227.
[8] LIU X Y,YANG M X,LIU X L,et al.A putative bHLH transcription factor is a candidate gene for male sterile 32,a locus affecting pollen and tapetum development in tomato[J].Horticulture Research,2019,6(1):88.
[9] ZHANG Z B,HU M H,XU W W,et al.Understanding the molecular mechanism of anther development under abiotic stresses[J].Plant Molecular Biology,2021,105(1/2):1–10.
[10] 冯小磊,范光宇,苏旭,等.植物雄性不育生理生化研究进展[J].作物杂志,2012(3):6–11.
[11] LIU Z H,SHI X Y,LI S,et al.Oxidative stress and aberrant programmed cell death are associated with pollen abortion in isonuclear alloplasmic male-sterile wheat[J].Frontiers in Plant Science,2018,9:595.
[12] 崔天宇,曹霞,孙佳尧,等.大豆质核互作雄性不育系花器官发育生理生化特性的变化[J].江苏农业科学,2021,49(24):75–81.
[13] 张锐,尚伟,许旭明.辣椒雄性不育的选育及利用研究进展[J].分子植物育种,2020,18(18):6143–6157.
[14] 崔霞,梁燕,李翠,等.化学诱变及其在蔬菜育种中的应用[J].西北农林科技大学学报(自然科学版),2013,41(3):205–212.
[15] YANG B Z,ZHOU S D,OU L J,et al.Construction of mutant population and analysis of dwarf mutants in “6421” (L.) through EMS Mutagenesis[J]. Agricultural Science & Technology,2016,17(6):1322–1325.
[16] 冯文鹏,周书栋,杨博智,等.辣椒反向温敏雄性核不育突变体E6421S不育特征及遗传规律研究[J].园艺学报,2019,46(6):1112–1122.
[17] 梁赛,贾利,王艳,等.辣椒细胞核雄性不育系主要农艺性状的对比及生理特性分析[J].中国蔬菜,2020(10):55–61.
[18] 侯杰.两个辣椒雄性不育系败育机理及育性稳定特性研究[D].长春:吉林农业大学,2017.
[19] COLOMBO N,GALMARINI C R.The use of genetic,manual and chemical methods to control pollination in vegetable hybrid seed production:a review[J].Plant Breeding,2017,136(3):287–299.
[20] QIU Y L,LIAO L J,JIN X R,et al.Analysis of the meiotic transcriptome reveals the genes related to the regulation of pollen abortion in cytoplasmic male-sterile pepper (L.)[J].Gene,2018,641:8–17.
[21] 王兰兰,王晓林,魏兵强,等.辣椒雄性不育系及保持系小孢子发育的细胞学比较[J].西北农业学报,2015,24(1):115–118.
[22] 侯杰,韩玉珠,李娇,等.辣椒雄性不育系及其保持系材料花蕾生理生化特性研究[J].长江蔬菜,2017(8):28–32.
[23] 李冰,潘秀清,武彦荣,等.茄子反向温敏雄性不育系可溶性糖含量及相关基因表达分析[J].中国瓜菜,2020,33(5):18–23.
[24] DHALIWAL M S,JINDAL S K.Induction and exploitation of nuclear and cytoplasmic male sterility in pepper (spp.):a review[J].The Journal of Horticultural Science and Biotechnology,2014,89(5):471–479.
[25] GUO J,WANG P,CHENG Q,et al.Proteomic analysis reveals strong mitochondrial involvement in cytoplasmic male sterility of pepper(L.)[J]. Journal of Proteomics,2017,168:15–27.
[26] 邓明华,文锦芬,邹学校,等.辣椒细胞质雄性不育系的物质代谢和过氧化物酶分析[J].云南农业大学学报,2007,22(6):791–794.
[27] 李玉青,王清连,韦春艳,等.棉花胞质雄性不育细胞形态学观察及生理生化特性的研究[J].西南农业学报,2020,33(1):58–63.
[28] 于海龙,任文静,方智远,等.蔬菜细胞质雄性不育的育性恢复研究进展[J].园艺学报,2021,48(5):1031–1046.
[29] WANG L H,ZHANG B X,LEFEBVRE V,et al.QTL analysis of fertility restoration in cytoplasmic male sterile pepper[J].Theoretical and Applied Genetics,2004,109(5):1058–1063.
[30] 魏兵强,王兰兰,陈灵芝,等.辣椒胞质雄性不育恢复性的主基因+多基因混合遗传分析[J].园艺学报,2013,40(11):2263–2268.
[31] ZHANG Z,ZHU Y,CAO Y,et al.Fine mapping of the male fertility restoration geneinL[J].Theoretical and Applied Genetics. Theoretische Und Angewandte Genetik,2020,133(4):1177–1187.
[32] CHENG J W,CHEN Y J,HU Y F,et al.Fine mapping of restorer-of-fertility gene based on high-density genetic mapping and collinearity analysis in pepper(L.)[J].Theoretical and Applied Genetics,2020,133(3):889–902.
Abortion mechanism and genetic analysis of fertility traits in cytoplasmic male sterile mutantof
YANG Huiping1,PAN Luzhao5,TANG Bingqian1,ZOU Xuexiao2,3,4,DAI Xiongze2,3,4,LIU Feng2,3,4*
(1.Longping Branch, Graduate School of Hunan University, Changsha Hunan 410125, China; 2.College of Horticulture, Hunan Agricultural University, Changsha, Hunan 410128, China; 3.ERC for Germplasm Innovation and New Variety Breeding of Horticultural Crops, Changsha, Hunan 410128, China; 4.Key Laboratory for Vegetable Biology of Hunan Province, Changsha Hunan 410128, China; 5.College of Horticulture, Nanjing Agricultural University, Nanjing, Jiangsu 210095, China)
The cytoplasmic male sterile lineand the restorer line ST-8 of capsicum were used as materials.The anther cytological morphology of flower buds in sporogenic stage, microspore mother cell stage, microspore meiosis stage, tetrad stage, uninucleate microspore stage, binucleate microspore stage and pollen maturity stage were observed.The contents of physiologically active substances related to fertility in flower buds in microspore meiosis stage, tetrad stage, mononucleate microspore stage and binucleate microspore stage were determined. The results showed thatabortion occurred in the tetrad stage, and the tapetum overexpanded and squeezed the tetrad, so that it could not normally develop into monokaryon microspore, which belonged to sporophyte sterility; the contents of soluble protein and free proline inbuds were lower than those in the restorer lines, while the contents of soluble sugar, MDA content and POD enzyme activity inmaterials were higher than those in restorer lines. The genetic segregation population of F2was constructed and its fertility was investigated, and the fertility ofwas analyzed. It was found that the fertility restoration ofmaterials was regulated by a pair of dominant genes.
pepper; cytoplasmic male sterility mutant; cell morphological observation of anther; physiological and biochemical characteristics; fertility
S641.3
A
1007-1032(2022)04-0423-07
杨慧萍,潘路招,汤冰倩,邹学校,戴雄泽,刘峰.辣椒细胞质雄性不育突变体的败育机理及其育性遗传[J].湖南农业大学学报(自然科学版),2022,48(4):423–429.
YANG H P,PAN L Z,TANG B Q,ZOU X X,DAI X Z,LIU F.Abortion mechanism and genetic analysis of fertility traits in cytoplasmic male sterile mutantof[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(4):423–429.
http://xb.hunau.edu.cn

2022–01–20
2022–06–08
国家特色蔬菜产业技术体系(CARS–24–A–15)
杨慧萍(1997—),女,湖南怀化人,硕士研究生,主要从事辣椒分子遗传育种研究,hpyangx@163.com;*通信作者,刘峰,博士,研究员,主要从事辣椒种质资源重要性状功能基因挖掘及新种质创制研究,liufengrich@126.com
责任编辑:罗慧敏
英文编辑:罗维
