姜黄素治疗动脉粥样硬化的分析及研究*
2022-09-15李清洁李世环徐凤男周巧逢龚金花李敏才
李清洁,李世环,徐凤男,周巧逢,2,龚金花,2,李敏才
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室;3.湖北科技学院医学部基础医学院)
动脉粥样硬化疾病(atherosclerosis,AS)是常见病,是高血压、糖尿病和慢性肾病等动脉血管病变的基础,是引起心血管疾病高发病率和高致死率的主要原因。然而AS发病机制尚未完全明确,一般认为是一种多环节参与的血管壁慢性炎症性疾病,目前AS药物治疗也没有明显的特异性药物[1]。
姜黄素(curcumin,CUR)是一种天然存在的多酚植物化学物质,其分子式C21H20O6。这种黄色疏水化合物对人类慢性疾病如炎症性疾病和神经退行性疾病具有积极的治疗作用。研究表明,CUR可以调节各种癌症标志,包括细胞无限增殖、癌症相关的炎症、癌症细胞死亡、信号通路、癌症血管生成和转移[2]。
网络药理学能够进行疾病靶点和药物靶点的预测,通过分子对接筛选出药物与疾病靶点的最优结合。我们借助网络药理技术期望筛选出CUR治疗AS潜在靶点,通过分析验证了EGFR、STAT3、CXCL8、CDKN-2A、BCL-2、TLR7、NOS-2、HSP902A这些评分较高基因是CUR治疗AS发挥作用的治疗靶点,并构建了AS中的钙化模型进行了初步验证,为未来的基础研究提供了新的见解及依据。
1 材料与方法
1.1 获取靶点
在TCMSP数据库查找CAS编号,然后在Pubchem中输入CAS号458-37-7,获取对应SMILES号;在Swisstarget prediction数据库中输入CUR的SMILES号,获得CUR预测靶点。通过Genecard、Drugbank数据库检索AS并相互补充,删除重复值后进行合并,获取AS作用靶点。将CUR预测靶点和AS作用靶点和输入韦恩在线软件,得到AS和CUR共同靶点,利用Metoscape网站对共同靶点进行GO富集分析和KEGG通路富集分析,并构建CUR与AS靶点与通路关系图[3]。
1.2 核心基因筛选及小分子对接
利用String在线数据库将共同靶点构建蛋白相互作用网络模型,保存结果TSV格式输入到Cytoscape-3.8软件中,进行网络拓扑学分析,根据P<0.01筛选核心靶基因。将度值排名前七靶基因,作为对接受体。以CUR作为配体,采用Autodocktools对接,以对接评分Affinity来筛选结合活性较好的靶点,其中对接评分Affinity<-4.25kcal/mol认为配体与靶点之间具有结合活性,得分<-5.0 kcal/mol表明结合活性较佳,得分<-7.0 kcal/mol表明两者之间有强烈的对接活性[4]。
1.3 细胞实验
采用大鼠原代平滑肌细胞构建细胞钙化模型,给予CUR刺激;提取蛋白、变性,Western blotting检测靶基因表达。
1.4 动物检测
实验分组为模型组和姜黄素组,每组7只大鼠。构建血管钙化大鼠模型,采用维生素D3肌肉注射5mg/kg和结扎内膜损伤以及外膜粉刷氯化钙方法,再给予CUR组喂养,直至三周后取材制片,镜下观察血管壁病变[5-6]。
1.5 统计学方法
2 结 果
2.1 共同靶点获取和分析
共同靶点生物学分析获取CUR预测靶点97个,获取AS治疗靶点1157个,取二者交集后获得26个共同靶点。对26共同作用靶基因进行GO分析,BP分析显示其参与细胞迁移、代谢过程、活性氧代谢和氧化应激损伤等生物过程(见图1A);MF分析表明其参与蛋白激酶、蛋白质结构区域特异性结合、转录因子和氧化还原酶活性等分子功能(见图1B);CC表明其参与囊腔、胞浆核周区、髓鞘、基质等细胞组分(见图1C);KEGG分析表明其参与JAK-STAT信号通路、EGFR酪氨酸激酶抑制剂拮抗、PI3K-AKT信号通路和细胞分化等通路调节(见图1D)。

A:GO-BP生物学过程分析;B:GO-MF分子功能分析;C:CC细胞组分分析;D:KEGG通路富集分析
2.2 筛选核心基因和分子对接
筛选核心基因和分子对接将31个靶基因输入String数据库,其PPI网络结果(见图2)输入Cytoscape分析得到7个核心基因EGFR、STAT3、CXCL-8、CDKN2A、NOS2、TLR7、BCL-2(见表1)。将7个核心基因与CUR进行分子对接,根据阈值得到6组配体-受体对接结果,其中EGFR、BCL-2、CXCL-8基因与CUR具有高结合力(见表2),其结合位点三维图见图3。

图2 姜黄素和动脉粥样硬化疾病交集靶点PPI网络关系图
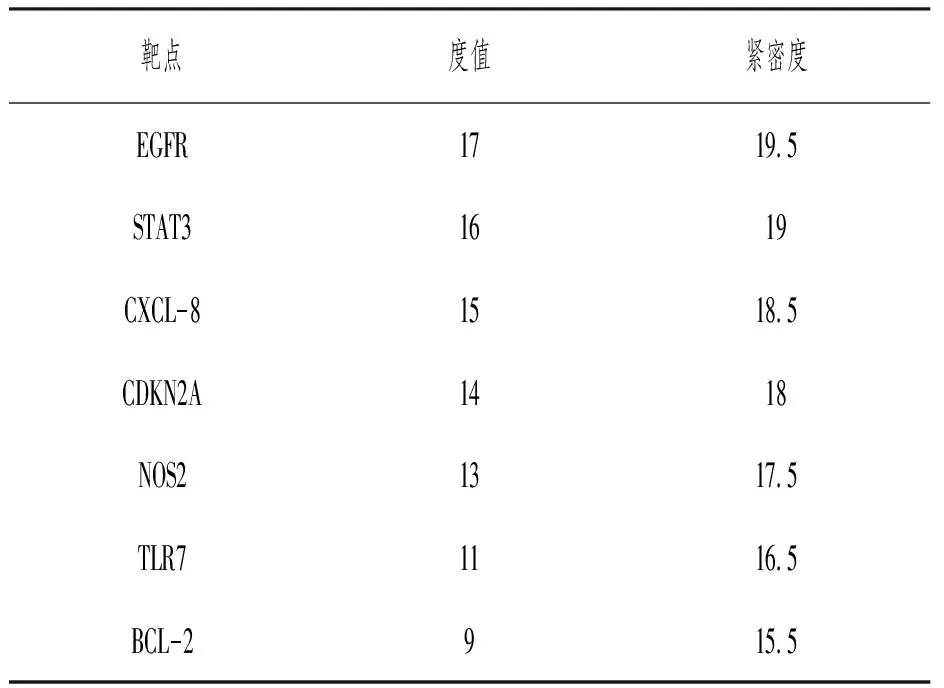
表1 核心靶点信息表
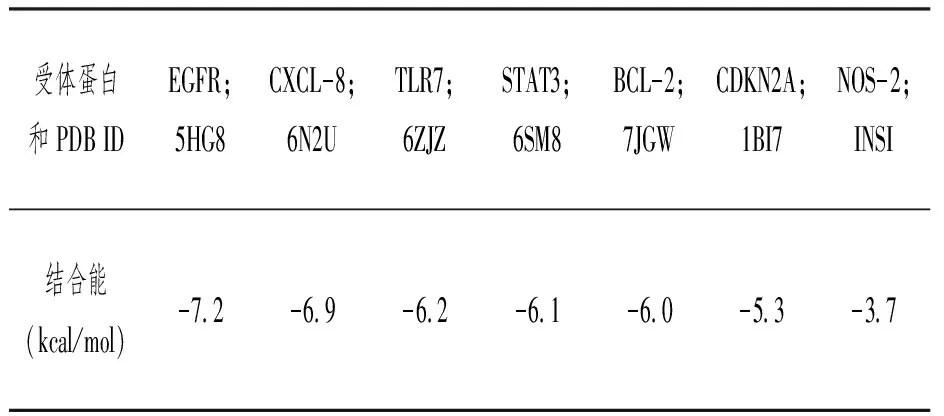
表2 姜黄素与关键靶点蛋白对接信息表
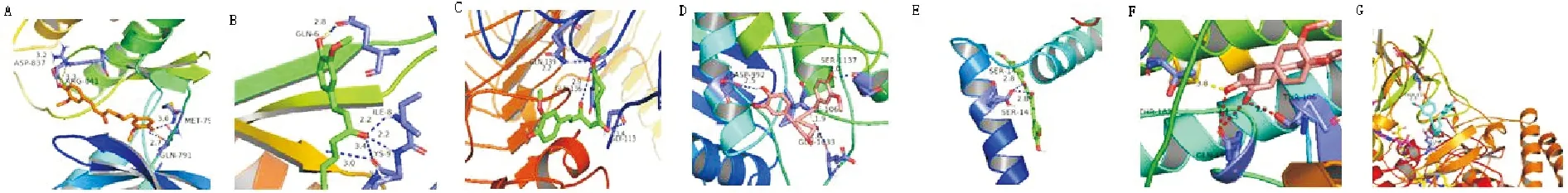
A-G图分别是姜黄素与EGFR;CXCL-8;TLR7;STAT3;BCL-2;CDKN2A;NOS-2蛋白对接图
2.3 CUR对平滑肌细胞钙化模型的影响
CUR抑制平滑肌细胞钙化以平滑肌细胞钙化为AS模型,通过茜素红染色检测细胞钙化水平[7]。与模型组相比,给予CUR浓度刺激,发现随着CUR浓度不断提高,茜素红染色降低,表明细胞内钙盐沉积逐渐下降(见图4)。

A:对照组;B:模型组;C-D:姜黄素组2.5、10μmol/L
2.4 CUR对血管钙化模型的影响
CUR减弱血管钙化模型组HE染色显示血管壁内膜增生、结构紊乱,钙盐沉积明显;CUR给药组血管壁结构较为完整,钙盐沉积少,显示CUR抑制血管钙化、促进血管壁结构完整性(见图5)。

A:模型组;B:姜黄素组
2.5 WESTERN检测相关蛋白的表达
CUR调节EGFR、STAT3、BCL-2表达首先我们WB检测成骨转录因子RUNX-2,与对照组相比,模型组RUNX-2表达上升,表明模型构建成功;与模型组相比,CUR组后RUNX-2表达下调(P<0.05),表明Cur抑制RUNX-2。我们进一步检测调节蛋白EGFR、STAT3、BCL-2表达,与模型组相比,CUR组BCL-2表达上调,提示CUR促进了抑制凋亡蛋白表达;与模型组相比,CUR组EGFR和STAT3表达下调(P<0.05),推测CUR调节EGFR、STAT3、BCL-2对AGE-RAGE和凋亡通路产生干预作用,抑制血管钙化(见图6)。
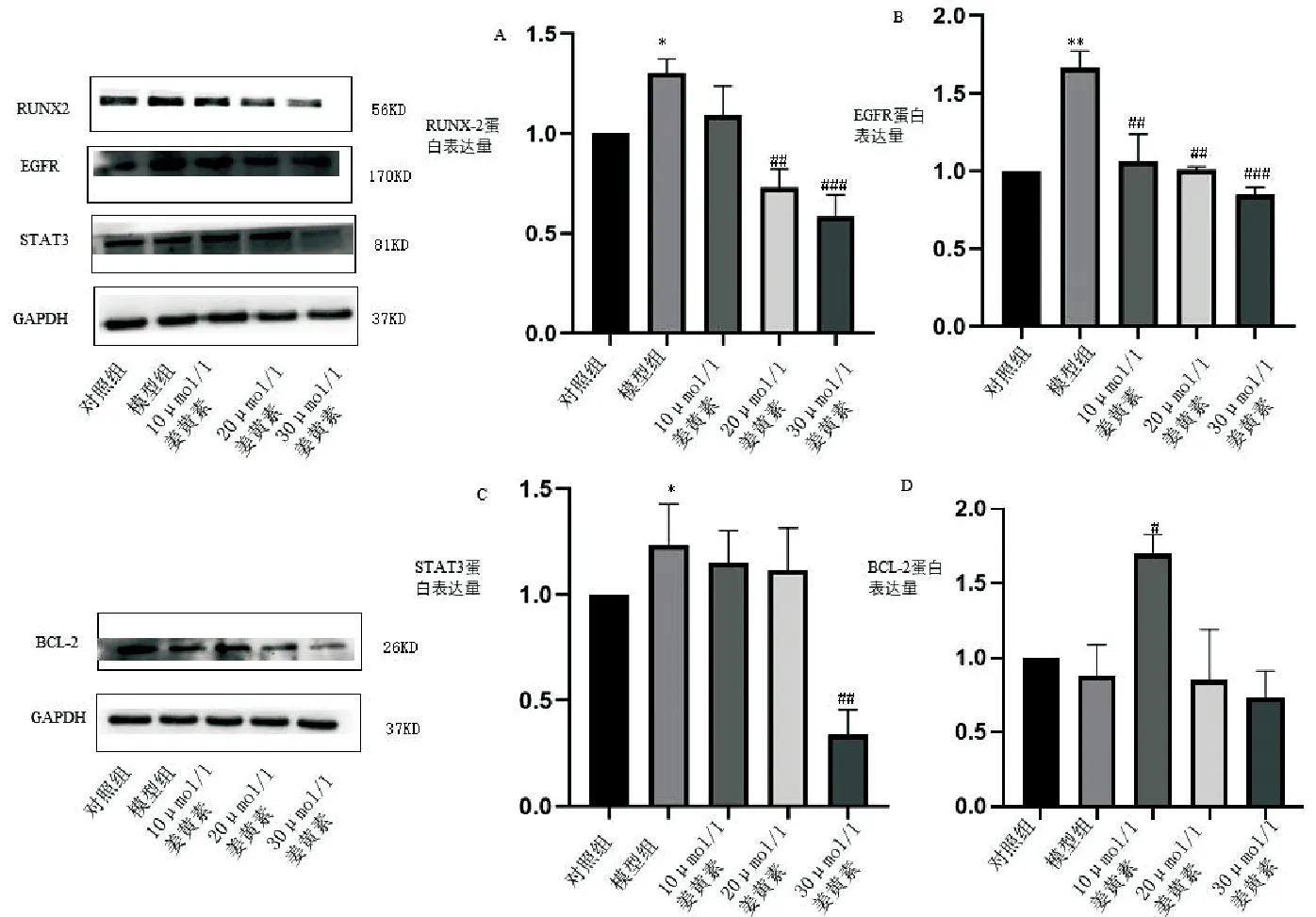
A-D分别是RUNX2、EGFR、STST3、BCL-2蛋白表达水平(与对照组相比,*P<0.05;与模型组相比,#P<0.05;n=3)
3 讨 论
本研究基于网络药理学方法研究CUR干预AS的相关基因,构建蛋白相互作用筛选出核心基因,通过分子对接分析CUR对EGFR、STAT3、BCL-2等的靶点作用;通过细胞培养和动物实验证明Cur具有抑制钙化作用,验证Cur调节EGFR、STAT3、BCL-2蛋白表达。
祖国古代医学中,虽无AS一词,但古籍《黄帝内经》中有脉络不通、血瘀、气滞、跛行等记载,这也许是AS病变严重时引起的临床表现[8],中医认为气血脉络不畅、气血痹阻导致该类疾病,因此,活血化瘀法是治疗AS的重要方法之一[9]。CUR是化学化瘀的常用药物,我们选择CUR对AS研究具有一定新颖性。
临床研究[10]表明AS患者存在显著病理改变,其主要病理学基础为动脉粥样硬化和血脂代谢异常,平滑肌细胞迁移到内膜不断的增生,由收缩表型转化为成骨表型,平滑肌细胞转变成具有合成和分泌功能的成骨样细胞,分泌成骨相关蛋白可以促进钙与羟基磷灰石结合,促进钙盐在血管壁沉积,导致血管动脉粥样硬化进展。本次研究实验组成骨转录因子RUNX-2表达上升,CUR减弱RUNX-2表达,在动物模型中显示CUR促进血管壁结构完整性,表明CUR抑制血管钙化进程。
我们筛选出EGFR、STAT3、BCL-2、CXCL-8核心基因,这些靶点可能在CUR干预AS生物过程中起关键作用。EGFR分布于血管上皮细胞,主要干预血管的生长、分化、增殖等,有研究[11]表明CUR可以抑制血管上皮细胞增殖。在AS血管钙化阶段存在细胞凋亡,促凋亡蛋白BAX表达上调、抑制凋亡蛋白BCL-2表达下降。本次研究表明,CUR可以下调BAX表达、上调BCL-2表达,表明CUR可能抑制VSMC凋亡。有研究[12-13]表明CUR介导STAT3抑制平滑肌细胞的迁移,与抑制JAK-STAT通路有关。
综上所述,我们采用网络药理学的方法,筛选出姜黄素治疗AS的相关核心靶点,如EGFR、STAT3等,前期分析表明这些靶点与细胞的生长,分化有关。预测姜黄素治疗AS可能是通过这些靶点调控细胞的增殖与分化。WESTERN检测了相关蛋白在不同实验分组情况下的蛋白表达水平,我们发现姜黄素影响钙化的平滑肌细胞在相关蛋白的表达,再通过HE染色发现姜黄素具有减少钙盐沉积,减弱钙化作用,这可能与姜黄素能够抑制内膜增生和抑制中膜的平滑肌细胞迁移和增殖有关。目前尚无姜黄素对治疗AS的过多网络药理学研究,因此,本文具有一定新颖性,但是本文也有局限性,网络药理学本身是一类预测结果,只能作为辅助验证相关结论,另外姜黄素是一类难溶性物质,难以在水中溶解,难以达到药物浓度等原因也限制了它的使用,下一步本课题将围绕姜黄素的难溶特性展开,准备制备成纳米粒,再进行下一步的相关研究。
