水产动物小分子热休克蛋白家族研究进展
2022-09-15李婷婷孙继红韩森荣刘丽邹雯静宋坚常亚青湛垚垚
李婷婷,孙继红,韩森荣,刘丽,邹雯静,宋坚,常亚青,湛垚垚
(大连海洋大学农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
热休克蛋白(Heat shock proteins,HSPs),又称热应激蛋白,是一类广泛存在于原核和真核生物体内具有高度保守性的生物大分子[1]。根据相对分子质量,可将热休克蛋白分为HSP100、HSP90、HSP70、HSP60 和小分子热休克蛋白(Small heat shock proteins,sHSPs5 个主要家族[2]。sHSPs 是指相对分子质量介于12~30 kDa 的热休克蛋白[3]。根据其结构、功能及表达部位,又进一步分为Ⅰ类和Ⅱ类两个主要亚家族。Ⅰ类亚家族成员无组织特异性表达,能参与泛素-蛋白酶体系统(Ubiqutin-proteasome system,UPS)介导的蛋白质降解过程,包括HSPB1、HSPB5、HSPB6 和HSPB8;Ⅱ类亚家族成员具有组织表达特异性,在哺乳动物的肌源性组织、睾丸组织和眼晶状体等部位特异性表达,包括HSPB2、HSPB3、HSPB4、HSPB7、HSPB9 和HSPB10[4,5]。除了典型Ⅰ类和Ⅱ类两类亚家族成员外,在后来的研究中又先后鉴定出了HSPB11、HSPB12 和HSPB15,3个非典型成员(表1)。
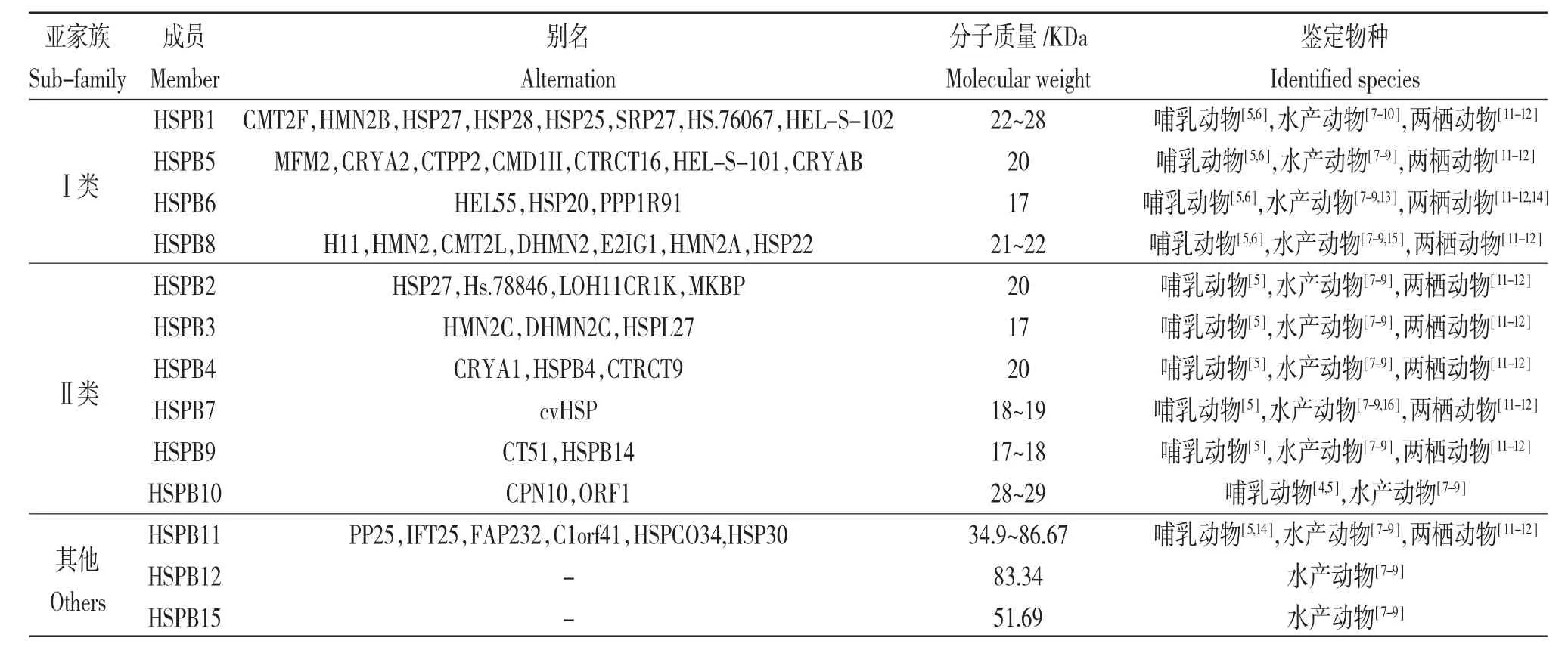
表1 常见小分子热休克蛋白家族成员统计Tab.1 Summary of members in common small heat shock proteins sub-family
截至2021 年4 月,美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中登录的sHSPs 家族基因序列信息多达10 858 条,其中所占比例较高的物种为哺乳动物(992 条;占比9.14%)和水产动物(814 条;占比7.50%)。但是,相较于哺乳动物,水产动物sHSPs 家族成员的研究相对滞后,主要集中在鱼类、腔肠动物及软体动物。研究表明,sHSPs 不仅在水产动物的生长发育过程中发挥重要作用,还可能参与介导水产动物的免疫防御反应。为进一步了解水产动物sHSPs 家族成员的系统进化关系及生物学功能,本文综述了近年来水产动物sHSPs 家族成员的序列特征、进化特点及生物学功能进行,旨在丰富水产动物sHSPs 家族基因的研究数据,为深入了解水产动物sHSPs 家族基因成员的生物学信息提供参考。
1 sHSPs 家族成员的特征
1.1 sHSPs 家族成员的分子结构特征
sHSPs 家族成员都具有可变的N 端结构域(N-terminal domain,NTD),灵活的C端结构域(C-terminal domain,CTD)和高度保守的α-晶状体结构域(alpha-crystalline domain,ACD)[17-19]。其中,NTD 由24~247 个氨基酸残基组成,富含芳香族氨基酸残基;NTD 的主要作用是影响sHSPs 低聚物的结构和发挥分子伴侣(Molecular chaperone)功能[18]。CTD 的氨基酸残基个数大都小于20 个,高度保守的IXI/V 结构将CTD 分为“尾巴”和“延伸”结构。CTD 的主要功能是增加sHSPs 四级结构的稳定性和复合物的溶解性。ACD 是由90~100 个氨基酸残基组成的β-三明治夹心结构,由7 或8 个反向平行的β-折叠片层构成,哺乳动物的sHSPs 缺乏β6 链,ATD 的主要功能是形成sHSPs 二聚体[19](图1)。
1.2 sHSPs 家族成员的表达特征
sHSPs 为最常见的分子伴侣,在发挥作用时会形成大型动态低聚物。该低聚物呈空心球状,在没有与目标蛋白结合前以非活性的形式存在[1]。当机体受到外源刺激或胁迫(如高温、低氧或磁场干扰等)而出现蛋白质折叠紊乱时,机体内的sHSPs 从非活性状态转变为激活状态,以不依赖ATP 的形式与错误折叠的蛋白(目标蛋白)相结合,将其隔离在低聚复合物中,并通过依赖ATP 的大分子热休克蛋白促进错误折叠蛋白的重新折叠,保证应激状态下机体内空间结构的稳定性[20];当外源刺激或胁迫消失后,随着错误折叠蛋白的减少,sHSPs 又逐渐恢复到非活性状态[9,15,16]。除了非活性状态到激活状态的转变之外,sHSPs 相对表达量的显著增加也是机体内sHSPs 家族成员响应外源刺激或胁迫的策略之一[6,21,22]。Pedro 等[21]对摇蚊幼虫Chironomus riparius进行了热休克(35℃)和异源物(镉,Cd)处理。结果显示,与对照组相比,热休克组和异源物处理组中摇蚊幼虫的hsp27 基因的相对表达量都显著增加;还有研究证实,鼠海马体神经元细胞的hspb1、hspb5、hspb6、hspb8 和hspb11 基因在亚砷酸、氧化和应激条件下的相对表达量都显著增加[6]。
2 水产动物中sHSPs 的研究进展
2.1 水产动物sHSPs 家族的主要种类及系统进化分析
目前,水产动物的sHSPs 家族成员主要集中在Ⅰ类亚家族(占比52.17%),而归属于Ⅱ类亚家族(占比33.33%)和其他亚家族(占比14.50%)的成员较少(表2)。将18 种水产动物中归属于Ⅰ类亚家族的sHSPs 的核苷酸序列与5 种哺乳动物和1 种两栖动物中相应的sHSPs 的核苷酸序列进行系统进化分析发现(图2),水产动物的HSPB1(除斑点叉尾Ictalurus punctatus 和克氏原螯虾Procambarus clarkii 外)聚为一支,最终与哺乳动物和两栖动物聚为一大支,表明HSPB1 在物种进化过程中相对保守。哺乳动物和两栖动物的HSPB8 亚型聚为较近的一支,最终与水产动物中的鱼类聚为一大支;水产动物中棘皮类的HSPB8 亚型和细粒棘球蚴Echinococcus granulosus 单独聚为一支,提示水产动物的HSPB8 亚型种内的差异性较大,且存在明显的种间分化现象。哺乳动物和两栖动物的Ⅰ类亚家族中的HSPB6 亚型聚为较近的一支,但是,水产动物中的鱼类和棘皮类的HSPB6 亚型则分别聚为一支。值得注意的是,哺乳动物和两栖动物的HSPB6 亚型最终没有与水产动物的HSPB6 亚型聚为一大支,而是与所有动物的HSPB5 亚型聚为一大支。这一结果在一定程度上证实了水产动物的HSPB6 亚型种内差异性较大,种间分化明显,与哺乳动物和两栖动物的HSPB6 亚型亲缘关系较远,而与哺乳动物和两栖动物的HSPB5 亚型亲缘关系较为密切。
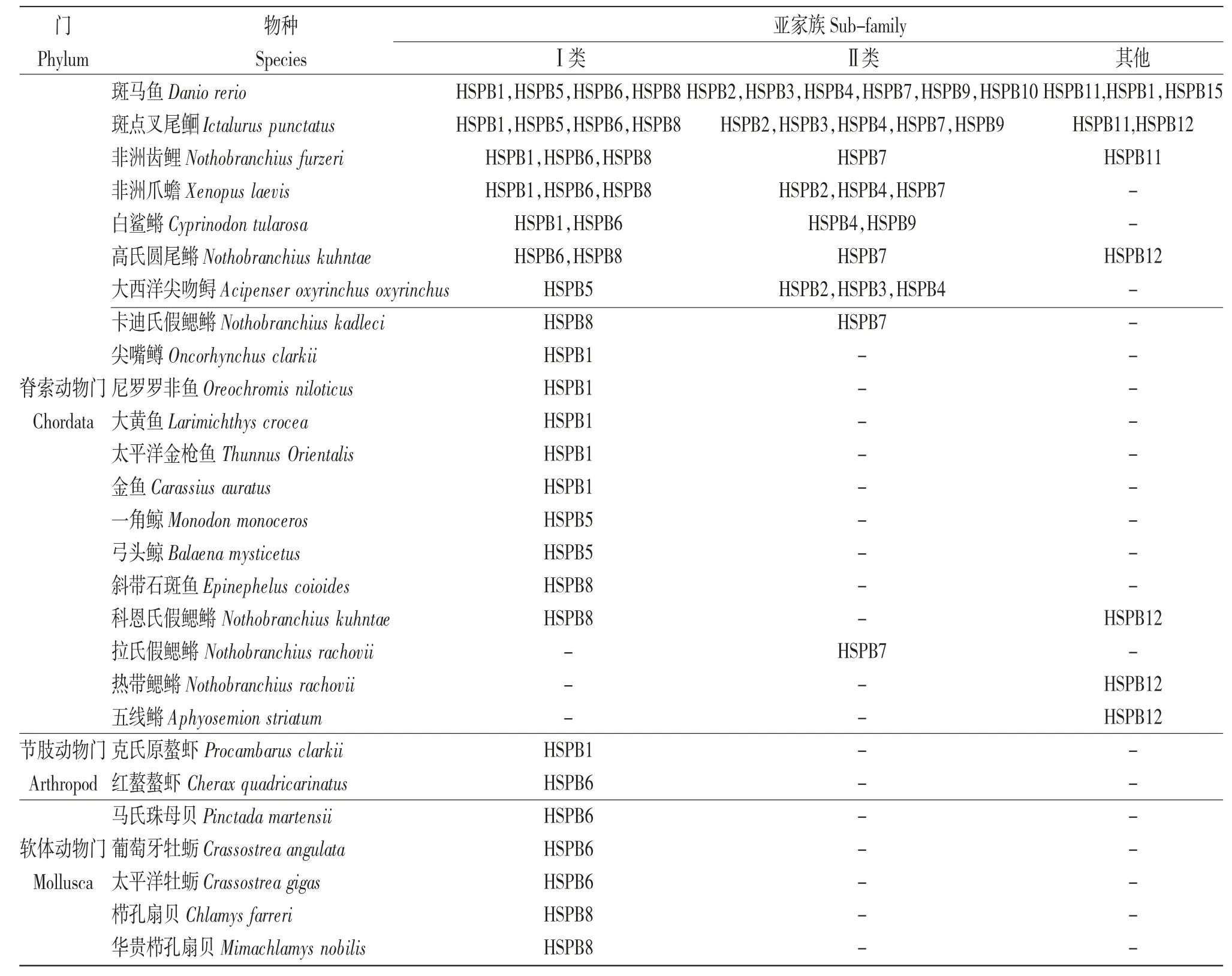
表2 NCBI 数据库中27 种水产动物小分子热休克蛋白家族成员核苷酸序列统计(截至2021 年3 月)Tab.2 Statistics of the nucleotide sequences of the members of the small-molecule heat shock protein family in 27 species aquatic animals in the NCBI database(up to March 2021)
将8 种水产动物归属于Ⅱ类亚家族的sHSPs的核苷酸序列与3 种哺乳动物和1 种两栖动物中归属于Ⅱ类亚家族的sHSPs 核苷酸序列进行系统进化分析发现(图3),所有分析物种(除斑点叉尾外)中的HSPB2 和HSPB3 亚型聚为一大支,HSPB9和HSPB10 亚型聚为一大支,表明HSPB2 和HSPB3亚型,HSPB9 和HSP10 亚型的核苷酸序列较相近,亲缘关系较密切。所有动物的HSPB7 亚型聚为较近的一大支。此结果表明,水产动物、哺乳动物和两栖动物的HSPB7 亚型在进化过程中相对保守。
2.2 水产动物sHSPs 家族的生物学功能
2.2.1 分子伴侣功能
分子伴侣是能够识别并结合错误折叠或装配,而本身不参与最终产物形成的一类蛋白[1]。αA-晶状体蛋白(αA-crystallin)是最早被发现具有分子伴侣功能的sHSPs[22],随后也证实,许多其他的sHSPs具有分子伴侣活性[15,16]。如在对小鼠αB-晶状体蛋白(αB-crystallin)进行敲除后发现,邻近的hspb2基因也受到破坏,αB-晶状体蛋白和hspb2 基因功能的丧失导致小鼠骨骼肌的退化[23,24]。
Magda 等[15]利用免疫共沉淀(Co-immunoprecipitation,Co-IP)、蛋白质免疫印迹(Western blot,WB)等技术研究了受精120 h 后斑马鱼Danio rerio胚胎中的hspb8 基因。结果分析表明,HSPB8 可以作为Bag3 分子伴侣,参与形成自噬(autophagy)诱导复合物。Emily 等[16]使用类转录激活因子效应物核酸酶(Transcription activator-like effector nuclease,TALEN)技术使斑马鱼hspb7 等位基因发生突变,hspb7 基因的突变导致细丝蛋白(Filamin-C,FLNC)的功能下降,导致斑马鱼心肌细胞修复损伤的能力下降,随后的免疫沉淀(Immunoprecipitation,IP)和WB 实验进一步证实HSPB7 是FLNC 的分子伴侣。
2.2.2 参与调节细胞的生长和分化
随着对水产动物sHSPs 的不断深入研究,发现某些水产动物细胞中的sHSPs 不仅具有分子伴侣功能,还参与维持机体的正常形态特征以及调节机体细胞的生长与分化[15,16]。
Magda 等[15]发现,给受精48 h 后的斑马鱼胚胎注射吗啉寡核苷酸后能干扰阻断HSPB8 的翻译,减少HSPB8 蛋白的表达,导致斑马鱼胚胎身体弯曲、心包水肿和生长速度减慢等形态变化,证明hspb8具有维持斑马鱼胚胎形态与生长的重要作用。Emily等[16]研究发现,与对照组相比,敲除了hspb7 基因的斑马鱼心脏形态畸形。
2.2.3 调节细胞凋亡
细胞调亡(Apoptosis)又叫程序性细胞死亡,是细胞内外环境发生改变、受到死亡信号的触发或在基因调控下引起的细胞死亡的过程[25,26]。sHSPs 作为细胞凋亡的调控因子可以通过多种方式调控细胞凋亡[10,25-27]。
斑节对虾Penaeus monodon 在感染对虾白斑综合症病毒(White spot syndrome virus,WSSV)2 h 后,其肌肉组织中hsp21 基因的相对表达量显著降低,随后脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(Tdt-mediated dutp nick-end labeling,TUNEL)检测发现,斑节对虾肌肉细胞内DNA 片段化的细胞数量增加,其肌肉细胞出现凋亡的症状,分析表明,对虾白斑综合症病毒可能通过抑制斑节对虾肌肉组织内hsp21 基因的相对表达量而诱导斑节对虾肌肉细胞的凋亡[27]。
石少婷等[10]发现,在栉孔扇贝中的“p38MAPKHSP27”通路中,扇贝多肽(Polypeptide from Chlamys farreri,PCF)可通过抑制p38MAPK 的活性,降低hsp27 磷酸化水平,抑制中波紫外线诱导的人角质形成细胞HaCaT 细胞凋亡。
2.2.4 免疫调节功能
sHSP 是水产动物先天性免疫(Innate immunity)的重要调节因子以及宿主和病原菌相互作用的关键参与者。研究证明,sHSPs 可调控水产动物响应病原菌的生理生化过程[28,29]。
Lei 等[29]研究发现,哈维氏弧菌(Vibrio harvey)感染后,太平洋牡蛎Crassostrea gigas hsp20 基因在其血细胞中的相对表达量显著上升。Li 等[28]通过qPCR 技术鉴定了鳗鲡弧菌Vibrio anguillarum 对菲律宾蛤仔Ruditapes philippinarum 中的两种sHSPs亚型——Vpshsp-21 和Vpshsp-2 基因表达的影响。结果显示,与对照组相比,VpsHSP-1 基因在6 h 和96 h 时的相对表达量显著增加,具有统计学差异;VpsHSP-2 基因的相对表达量在48~72 h 内急剧增加。两个基因的不同表达趋势表明,Vpshsp-21 和Vpshsp-2 基因参与菲律宾蛤仔对感染鳗鲡弧菌的响应过程[30-35]。
3 展望
综上所述,水产动物sHSPs 家族成员可在细胞生长发育、细胞凋亡及免疫应答等多种细胞生理过程中发挥重要作用,还可作为环境污染监测的分子标记物(表3)。因此,进一步深入研究水产动物sHSPs 家族成员在水产动物生长、发育和免疫应答等方面的功能和作用,不仅进一步加深了对水产动物sHSPs 家族成员及生物学功能的认识和理解,还可为水产动物资源保护、养殖增产以及病害防控等提供一定的分子生物学基础数据。
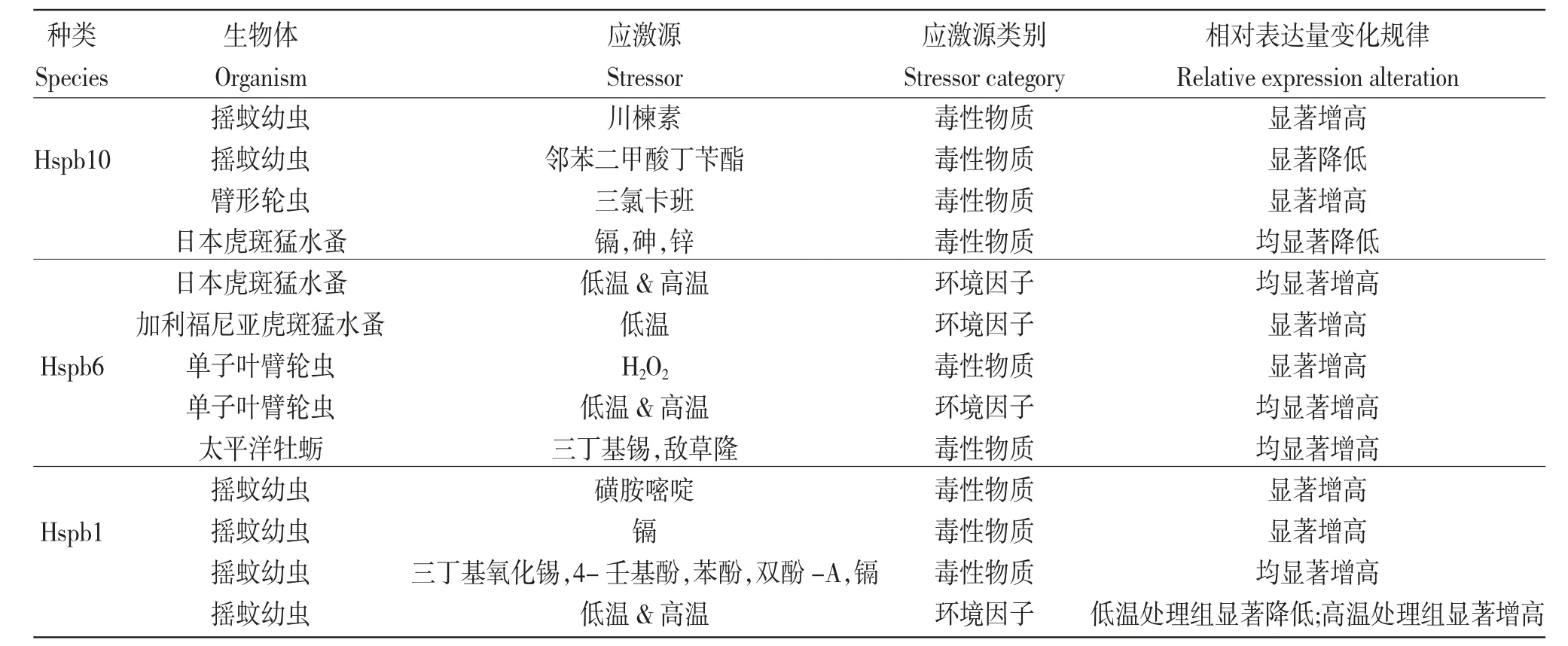
表3 6 种水生生物中小分子热休克蛋白对应激源响应表达规律的总结Tab.3 Summary of expression patterns of small heat shock proteins in 6 species aquatic organisms in response to stressors
目前水产动物sHSPs 家族成员的序列和结构信息仍来源于少数物种,且sHSPs 家族成员生物功能鉴定及解析的研究相对匮乏,今后应重点开展以下3 方面工作:首先,进步扩大水产动物的种类,丰富和充实水产动物sHSPs 家族成员的序列信息和结构信息,理清水产动物sHSPs 家族成员之间的系统进化地位及相互联系;其次,充分利用现代生物技术(如高通量测序、多组学联动分析等)和生物信息数据分析技术,深入开展不同种类水产动物sHSPs 家族成员的生物功能研究,进一步理清不同水产动物sHSPs 家族成员表达模式与规律的共性特征以及种属特异性特征及其在不同生理或病理条件下的响应规律,全面掌握水产动物sHSPs 家族成员的生物功能;最后,在理论研究的基础上,系统评估水产养殖动物中sHSPs 家族成员作为种质选育标记和养殖水环境检测标记物的开发潜力和应用价值,探索水产养殖动物sHSPs 家族成员作为种质选育标记和养殖水环境检测标记物的有效应用方式和方法。
