基于环介导等温扩增的抗虫基因超灵敏比色生物传感器构建
2022-09-14李佳乐林晟豪许文涛
李佳乐 林晟豪 许文涛,
(1. 中国农业大学食品科学与营养工程学院 农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083;2. 中国农业大学营养与健康系 食品精准营养与质量控制教育部重点实验室,北京 100083)
具有抗虫特性的转基因作物是借助DNA重组技术,将外源抗虫基因整合到对应生物体中,使其表达出良好的抗虫特性并且能稳定遗传给后代的一类作物。抗虫基因源于苏云金芽孢杆菌(Bacillus thuringiensis,Bt)中的Bt基因,该基因被广泛用作抗虫外源基因。目前,Bt基因中运用最广泛的是Cry1A基因,在已商业化的49个抗虫转基因作物转化体中有32 个含有Cry1A基因,占65.3%[1],而Cry1A基 因 又 包 括Cry1Ab、Cry1Ac、Cry1Ab/Ac、Cry1A.105[2]和mCry1Ac[3]。利用转基因技术改造的抗虫农作物可以很好的减少农药使用,减少农业生产成本,保护生态环境和人类健康[4-5]。目前一些商业化转基因作物已经得到了推广,包括抗虫水稻、玉米和棉花等。但由于抗虫转基因作物的推广和转基因技术的不断发展,对于相应的检测技术也提出了挑战。
目前,具有抗虫特性的转基因产品的检测可以从DNA、mRNA转录、蛋白质或代谢物水平等多个不同层面进行[6-8]。DNA和RNA水平的外源核酸检测技术具有高灵敏度、高特异性和稳定性,核酸检测方法则以PCR和环介导等温核酸扩增技术(loopmediated isothermal amplification,LAMP)为主[9-10]。LAMP最早由Notomi提出,在60-65℃恒温条件下,通过链置换DNA聚合酶(Bst DNA聚合酶)的作用,4-6条特殊设计的引物可以特异性结合到模板基因的6-8个区域上,可以在30-60 min完成核酸扩增[11]。该恒温方法常见的信号输出方式有比色法[12]、荧光法[10,13]、电化学法[14-15]。其中,比色法因其操作简单、现象明显、可以与微流控结合形成快速检测芯片等优势得到更为广泛的应用。目前比色法常用染料如基于pH变化的中性红[16]、羟基溴酚蓝(hydroxynaphthol blue,HNB)[17],基于Mg2+浓度的钙黄绿素[18],均可在检测终点形成明显的颜色变化,指示目标基因扩增反应的发生。
基于pH指示剂的方法原理是在LAMP扩增中,随着dNTP大量引入到扩增子中,会产生焦磷酸根和大量H+,而焦磷酸的部分水解也会产生一定量的H+,在弱缓冲体系下,积累的H+可以实现体系的pH明显降低,跨越pH指示剂的突变区间,使pH指示剂变色。LAMP体系反应前的pH值约为8.8,反应后下降到6.0-6.5,可以依据此选取指示剂以表征反应的发生[19]。通常选用的pH指示剂包括中性红[20]、苯酚红[21]、甲酚红[22]和二甲酚橙[23],分别能实现黄色到粉红色、粉红色到黄色、紫红色到黄色、粉红色到橙黄色的转变。然而上述4种常用的指示剂的颜色变化均为突变,尚不具备半定量潜力。溴百里酚蓝(bromothymol blue,BTB)是一种性能稳定的pH指示剂,其可以依据溶液pH由碱性到酸性实现由蓝色(pH 7.6)到黄色(pH 6.0)的渐变,发生颜色改变的pH区间与LAMP反应前后pH变化区间有很大重合,且颜色变化可以在自然光下由裸眼区分[24]。因为其在一定区间内随pH变化可以产生裸眼可视的明显颜色变化,在肉类[25]、奶类[26]质量安全的现场快速检测方面有良好的适用性。此外BTB还可以用于紫外分光光度计实现定量检测,例如,Ong等[27]利用pH 7.2的BTB溶液快速筛选可生产脂肽的菌株,并且可以在410 nm和616 nm处实现对脂肽的定量检测。Ramadan等[28]基于格列美脲(GLM)与BTB可形成黄色离子复合物开发了一种简便、精准的紫外分光光度法用于测定纯制剂和药物制剂中的GLM,可在412 nm处定量。近期,Gul等[29]还提出了一种基于BTB指示的非仪器化环氧化物检测方法,利用卤素脱卤酶(HheC)催化环氧化物底物开环引起pH变化从而使BTB变色,使用智能手机即可完成对图像采集和数据处理,完成对环氧化物含量的测定,大大降低了分析成本和难度。
但目前将BTB作为LAMP反应指示剂的相关研究暂无,基于此,本研究以科丰6号(Kefeng 6,KF6号)转基因水稻作为模式植物,根据Cry1Ac和Cry1Ab/Ac基因的同源区域设计6条LAMP特异性引物,选取BTB作为显色指示剂,构建pH响应的LAMP生物传感器,以期快速、灵敏、一步法筛查靶基因。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 本实验中的转基因作物均由实验室保存,测试样品品种及Cry1A基因具体信息见表1。所用天根生化科技(北京)有限公司的多糖多酚植物基因组DNA提取试剂盒和RNase A购于TIANGEN公司,dNTP Mixture购于日本TaKaRa公司,Bst 2.0 polymerase、10×Thermopol Reaction Buffer、MgSO4购于NEB公司,甜菜碱(betaine)购于美国Sigma,SYTO 9 Green Fluorescent Nucleic Acid Stain购于美国Invitrogen公司,溴百里酚蓝(BTB)购于天津市科密欧化学试剂有限公司,琼脂糖购于上海百晶生物技术有限公司,Tris购于北京博奥拓达科技有限公司。

表1 测试转基因及非转基因样品Cry1A基因具体信息Table 1 Test specific information of Cry1A gene in GMO and non-GMO samples
1.1.2 实验仪器 FQD-96A荧光定量PCR扩增仪(杭州博日科技股份有限公司)、NanoDrop one分光光度计(美国Thermo Fisher公司)、HZP-L502 pH计(华志电子科技有限公司)、SH-510凝胶成像系统(杭州申花科技有限公司)。
1.2 方法
本文的LAMP生物传感器利用环介导等温扩增实现Cry1Ac或Cry1Ab/Ac基因核酸信号放大,在保证酶活的同时将缓冲液的缓冲能力降低,使得LAMP反应前后体系有更大的pH变化,并以BTB为指示剂实现一步可视化检测。检测原理如图1所示。在LAMP扩增中有大量的DNA链合成,每一分子的dNTPs被合成到新的链上时都会产生一分子的焦磷酸根和H+,焦磷酸根的部分水解也伴随着一定量H+产生。以BTB为指示剂的LAMP生物传感器可以响应LAMP反应过程中产生的H+,从而实现体系从绿色到黄绿色,再到黄色的变色。
1.2.1 植物基因组DNA的提取 所有转基因和非转基因植物的基因组DNA提取参照天根生化科技(北京)有限公司的多糖多酚植物基因组DNA提取试剂盒说明书。所得的基因组使用NanoDrop one分光光度计测定基因组DNA浓度,并将基因组浓度调整至50、25和5 ng/μL。
1.2.2 引物序列设计 比较Cry1A基因中Cry1Ab(AY326434.1)、Cry1Ac(Y09787.1)、Cry1Ab/Ac(EU816953.1)、Cry1A.105[2]和mCryAc[3]的序列,选取Cry1 Ac和Cry1Ab/Ac的同源区域(附图1-A),及Cry1Ab、Cry1A.105和mCry1Ac的非同源区域为靶标基因(附图1-B),命名为Cry1Ac&Ab/Ac。利用LAMP Primer Explorer 5在线软件(http://primerexplorer.jp/e/v5_manual/index.html)设计3组引物,其中第二套与第三套的BIP引物相同(表2)。所有引物均由上海生工生物工程公司合成,PAGE纯化。

表2 LAMP引物设计表Table 2 LAMP primer design table
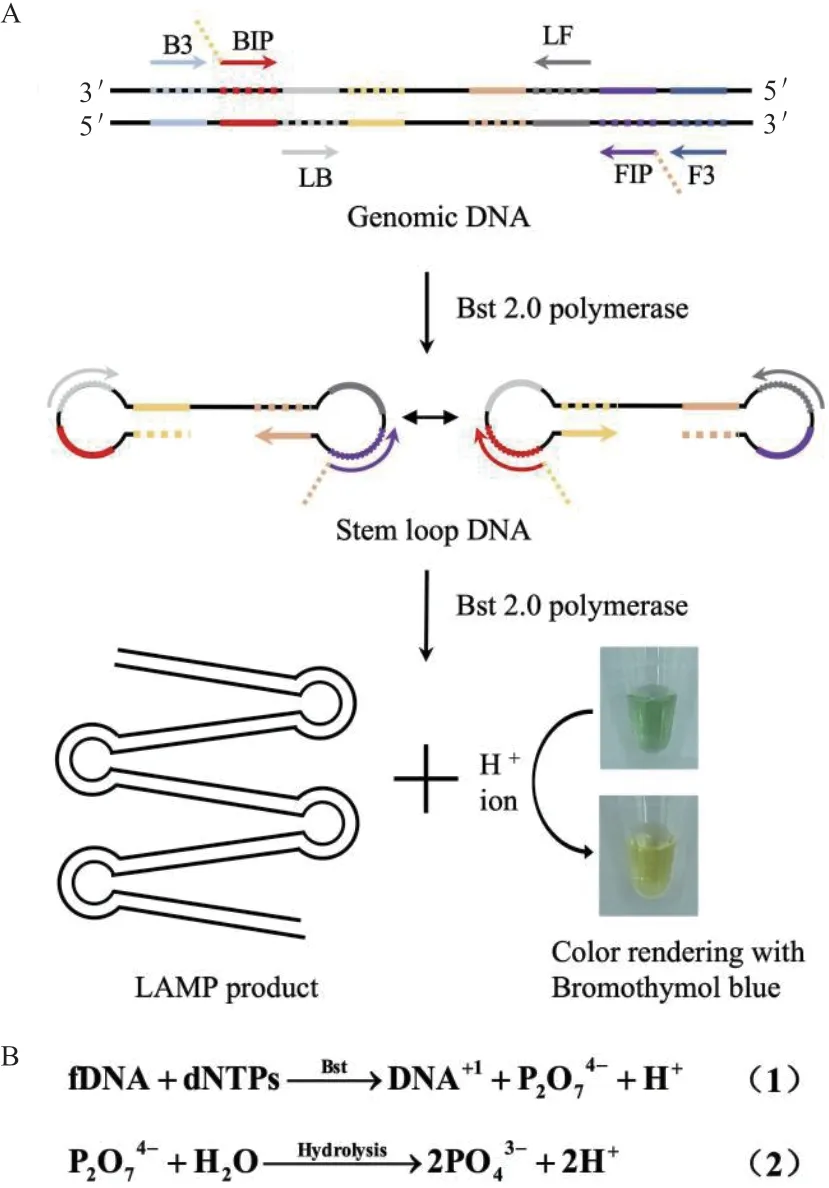
图1 检测原理图Fig. 1 Detection principle diagram
1.2.3 LAMP非开盖可视化体系的构建与优化 建立25 μL的LAMP扩增体系,包 括10×Isothermal amplification buffer、0.6 mol/L Betaine、0.5 mmol/L dNTP、3 mmol/L MgSO4、0.2 μmol/L F3和B3、1.6 μmol/L FIP和BIP、0.8 μmol/L LF和LB、0.4 μmol/L SYTO 9、8 U Bst 2.0 polymerase、400 pg/μL Kefeng 6转基因水稻基因组,以下涉及的所有操作均进行了3次生物学平行。反应液充分混匀后置于博日荧光定量PCR仪中,64℃反应1 h,每1 min读取一次FAM信号,85℃ 3 min。调整10×Isothermal amplification buffer中的Tris终浓度分别为0、6.5、13、19.5、26、32.5、39、52、65、130 mmol/L,并保持缓冲液的天然pH,随后在弱缓冲体系中添加1 μL的0.1% BTB pH指示剂,肉眼观察反应终点的颜色变化。最后优化0.1% BTB的添加量分别为0.75、1.0、1.25、1.5、2.0 μL。
1.2.4 LAMP特异性测试 分别以常见的商业化转基因作物的基因组DNA为模版,评价本文中LAMP方法的特异性。7种转基因作物分别为转基因水稻Kefeng8号、转基因水稻TT51、转基因玉米Bt11、转基因玉米Bt176、转基因玉米MON810、转基因棉花MON 15985、转基因甜菜H7-1,2种非转基因作物包括五优稻4号和粳稻糙米。采用优化后的LAMP反应体系,64℃恒温反应1 h,85℃ 3 min,添加1.5 μL BTB用于可视化分析,随着LAMP反应中H+的不断生成,构建的生物传感器能够响应pH的变化,当体系中存在靶标时响应为黄色,当没有靶标存在时则为绿色。裸眼判定终点后,结合琼脂糖电泳进行双重验证。
1.2.5 LAMP灵敏度分析 将Kefeng 6转基因水稻的基因组进行梯度稀释,依据公式:拷贝/μL=(ng/μL×NA)/(碱基对长度×109×650D)得到浓度分别为2.12×105、1.06×105、2.12×104、4.24×103、8.48×102、3.4×100、1.7×100拷贝/μL的基因组样品,通过琼脂糖电泳和可视化方法进行比较分析。
2 结果
2.1 最佳引物筛选
为了筛选出最优的引物,比较了3套引物的实时定量扩增曲线和终点时的凝胶电泳图。从图2-A中可以看出,Cry1Ac&Ab/Ac -2引物在20 min左右就出现了扩增曲线,相比于其他两套引物具有最小的Ct值。图2-B的电泳结果中Lane 3的条带亮度最强,表明Cry1Ac&Ab/Ac-2引物可以在相同扩增时间内得到最多的扩增产物。为了获得更低的检测限线和使得终产物中有更多的H+,选择Cry1Ac&Ab/Ac-2引物进行后续实验。

图2 引物筛选图Fig.2 Primer screening diagram
2.2 比色方法的可行性及优化
显色体系中的Tris浓度优化结果如图3-A所示,Tris的最优终浓度为3.25 mmol/L,而不是经典的20 mmol/L,可能是20 mmol/L的Tris终浓度的体系更具有普适性和扩增过程中的稳定性,但是3.25 mmol/L Tris的环境对于该体系的扩增初期最有利。BTB的添加量优化结果如图3-B,C所示,随着0.1%BTB的添加量的增加,即该生物传感器中的显色剂含量增加,可视化响应效果也随之增加,尤其在添加量0.75-1.5 μL时。但是可能是由于BTB溶液中含有乙醇,其添加量的增加对于传感器的LAMP扩增效率有一定抑制作用,但是抑制效果较小,所以优先考虑BTB的指示效果,选取其添加量为1.5 μL,见图3-B中的红框。
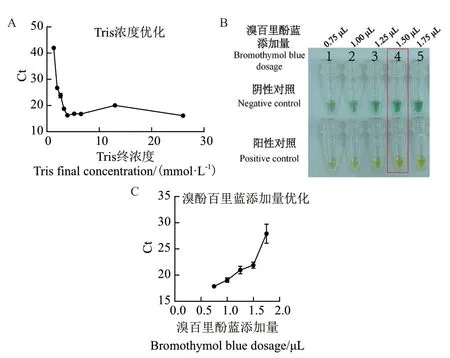
图3 比色方法可行性及优化Fig. 3 Feasibility and optimization of colorimetric method
2.3 特异性验证
在最优的体系条件下,LAMP生物传感器可以响应转基因水稻Kefeng 6、Kefeng 8、TT51和转基因棉花MON 15985这4种含有Cry1Ac或者Cry1Ab/Ac基因的转基因样本,裸眼可视化结果为黄色或黄绿色。转基因玉米Bt11、Bt176、MON 810、转基因甜菜H7-1、五优稻4号和粳稻糙米这6种不含有靶标基因的转基因或者非转基因作物则不能实现LAMP生物传感器的响应,裸眼可视化结果为绿色。琼脂糖电泳的结果与生物传感器响应的结果保持一致(图4)。
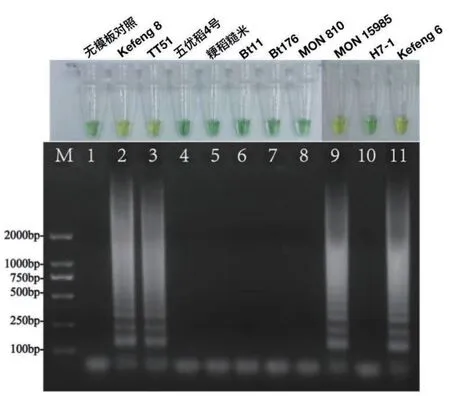
图4 LAMP方法特异性验证Fig. 4 Specificity verification of LAMP method
2.4 灵敏度分析
LAMP生物传感器对于2.12×105-1.7 拷贝/μL的样本的响应都为黄色,琼脂糖凝胶电泳的表征也具有典型的梯型扩增条带,表明该生物传感器的检测灵敏度可以达到1.7 拷贝/μL,相比于其他检测方法(附表1),具有更高的灵敏度。并且随着靶标基因的拷贝数降低,LAMP扩增中产生的H+未达到饱和,该生物传感器在响应黄色信号的同时还保持有绿色色调(图5)。相比于琼脂糖电泳分析中的结果,该生物传感器对于在检测限附近不同浓度的靶标所响应的颜色有细微的可视化区别,说明该方法具有一定的半定量潜力,在仪器分析下可以实现半定量。

图5 LAMP方法灵敏度分析Fig. 5 Sensitivity analysis of LAMP method
3 讨论
转基因作物在带来一系列好处的同时也可能对环境和人类健康造成威胁,其中抗虫基因作物的扩增风险较高,为了保障公民的知情权,建立新型的抗虫基因检测方法对于完善我国转基因检测体系具有重要意义。Cry1A基因是使用频率最高的外源抗虫基因,该基因还可以进一步细分为其他基因。为了进一步区分Cry1A抗虫基因家族的具体特异性基因,本文针对Cry1Ac与Cry1Ac/Ab基因的的同源区域设计了3套特异性LAMP引物。
转基因作物基因水平检测的金标准仍然是PCR方法,但是PCR方法依赖热循环仪,这限制了其在现场检测的运用。而近10年兴起的环介导等温扩增技术弥补了这一缺陷,并伴生了包含有比色、荧光、电化学等方式的生物传感器。这些传感器中比色方法可以实现一步裸眼可视化、成本低廉、仪器要求低,但是目前的比色试剂的研发集中于HNB和中性红。随着NEB等公司的中性红比色试剂盒的上市,这一同质化现象进一步加深。
本研究根据LAMP反应过程中能够产生大量H+,以及Bst 2.0聚合酶能够耐受6.0-10.0的pH变化的基础[19],挑选了在pH 6.0-7.6存在连续变色现象的pH指示剂BTB作为显色剂。与中性红类似,使用BTB作为显色剂也具有一系列优点,如裸眼可视化、显色现象明显、一步闭管操作、操作简单等。同时该方法还具有中性红不具备的优势:(1)BTB水溶性更好,只需溶解在20%的乙醇溶液中,而同质量的中性红需要溶解在60%的乙醇溶液中,所以添加BTB指示剂可以更少地在体系中引入乙醇,降低乙醇对于反应的影响。(2)BTB在变色区间内会实现蓝色、蓝绿色、绿色、黄绿色、黄色的依次转变,中性红则为黄色至红色的突变。所以BTB的比色结果更加丰富,可以与比色卡联用,更具有商业化潜力。
选择了pH比色试剂后,本文对于LAMP体系的缓冲能力进行了调整,相比于在无缓冲能力的体系中直接使用pH指示剂,本研究保留了体系的部分缓冲能力,使Bst酶在扩增过程中的环境更接近于理论最优。不过Bst酶的缓冲体系仍然需要进一步优化,在本研究中尚只能实现反应前后从绿色转变为黄绿色再转变为黄色,若想要实现反应前后从蓝色转变为黄色,在兼顾反应效率的同时,还需要进一步调整体系的初始pH、缓冲能力以及增加H+的产生量。
4 结论
本文针对Cry1Ac/Ab和Cry1Ac的同源序列设计LAMP引物,并首次在弱缓冲体系中引入BTB作为生物传感器的响应试剂,一步法实现比色信号输出。该方法可以在1 h内检测到1.7 拷贝的Cry1Ac或Cry1Ac/Ab基因,同时具有良好的特异性。
文章所有附图、附表数据请到本刊官网下载(http://biotech.aiijournal.com)。
