超分辨率超快超声脊髓微血管成像方法*
2022-09-14郁钧瑾郭星奕隋怡晖宋剑平他得安梅永丰许凯亮
郁钧瑾 郭星奕 隋怡晖 宋剑平 他得安 梅永丰 许凯亮†
1) (复旦大学信息科学与工程学院,生物医学工程中心,上海 200438)
2) (复旦大学工程与应用技术研究院,上海 200438)
3) (复旦大学附属华山医院神经外科,上海 200040)
4) (复旦大学材料科学系,上海 200438)
脊髓功能对神经传导通路至关重要,脊髓血管受损及伴随的继发性损伤与脊髓功能状态密切相关.因而,脊髓内微血管网络结构和血流状态在脊髓功能在体、精准与实时评价中具有重要前景.临床常用的血管造影手段存在分辨率低、放射性、设备笨重和使用不便等问题,无法全面满足脊髓血流术中检查与预后跟踪的需求.本文以基于多角度复合平面波的超快超声技术为基础,应用超分辨率定位显微技术(ULM),实现了大鼠脊髓内微血管成像.基本原理为应用基于鲁棒主成分分析(RPCA)的滤波方法,分离脊髓组织信号和运动的造影微泡信号,通过微泡定位、轨迹追踪,实现亚波长分辨率的超分辨率超声成像.随后,引入基于傅里叶环相关系数方法,对成像分辨率进行量化分析;进而对微泡数量、有效轨迹、血管饱和度、血流速度和半高全宽范围等进行了定量评价.在体成像实验结果表明,ULM 可获得清晰的大鼠脊髓内微血流图像.定量分析表明,发射频率为15.625 MHz 的超声探头可实现13—16 µm 范围的分辨率,远小于100 µm 成像波长.综上,ULM 可被应用于脊髓内微血管精准成像,相关结果可为超分辨率脊髓功能监测与动态评价的进一步研究提供借鉴,对于脊髓损伤诊断、应急治疗与预后恢复等临床研究亦有一定的借鉴意义.
1 引言
脊髓作为中枢神经系统的中继站和反射中枢,对神经传导通路至关重要.脊髓损伤最初往往表现为其内微血管网络受损和局部血流灌注量缺失等,随后的组织缺氧、出血和水肿情况加速相关神经组织坏死[1],进而引发肢体麻木、功能障碍等继发性损伤[2,3].因而脊髓微血管及血流快速成像对脊髓结构与功能的在体、精准与实时评价具有重要意义.
当前,血管造影是实现在体微小血管成像及血流动力学变化监测不可或缺的临床诊断手段.血管造影的金标准包括磁共振血管造影(MRA)、计算机断层扫描成像血管造影(CTA)和数字减影血管造影(DSA).标准化检测手段DSA 对小血管成像精度优于CTA 与MRA,约为500 µm[4];但数百微米的分辨率仍不能对微血管进行成像.此外,CTA 和DSA 检查具有放射性,造影难度大,时间长,辐射量大,患者接受性较差[5];DSA 和CTA 均需造影剂,不适于严重的心、肝、肾功能衰竭、甲亢患者及碘过敏患者的检查,且无法实现血流动力学参量测量.此外,机体笨重、扫查耗时,以及不适用于复杂环境(如手术室)等缺点,也在一定程度上限制了它们在临床检查中的普遍应用,从而无法全面满足患者术中检查与预后跟踪的需求.
超声具有快速、无放射、价格低廉且易于携带等优点,更适于术中检查与预后跟踪等需要.现已被广泛用于人体软组织的临床成像与疾病诊断.当前,基于平面波的超快超声技术显著地提升了多普勒成像对小血流信号的灵敏度,从而可实现MRA,DSA 和CTA 无法实现的在体小血管成像[6].荧光激活定位显微(PALM)技术实现了光学衍射极限的突破[7],Couture 等[8]借鉴该思想发展了超声定位显微成像(ultrasound localization microscopy,ULM)技术[9].ULM 方法兼具高分辨率和深穿透力的优点,对比传统超声和超快超声成像,可对人体深层组织(如颅脑、脊髓、心脏、肾等)实现亚波长(接近1/10 波长,血管直径< 100 µm)的微血管成像[10],远优于当前临床应用的血管造影.2015 年,法国Langevin 研究所应用ULM 率先获得深脑小血管网络血流动力学成像结果,成像分辨率在10 µm左右[11].同年,Christensen-Jeffries 等[12]报道了超分辨率血流速度成像结果.随后,在大鼠肿瘤[13]、大鼠肾缺血[14]、糖尿病小鼠骨骼肌微血管[15]、兔淋巴结微血管[16]及兔眼部微血管[17]模型上均报道了微血管成像结果.此外,不少研究者对ULM 成像质量进行了探讨,Song 等[18]探讨了空间采样量化对ULM 成像的影响.Hingot 等[19]深入探讨了ULM 饱和度与成像时长的关系,以及ULM 图像分辨率量化评价[20]等核心问题.国内学界也就ULM 技术开展了相关工作.Zhong 等[9]曾对超声超分辨率微血流成像研究进展做了综述报告.Liu等[21]提出了一种基于子像素点的卷积神经网络,从而有望实现快速高效高鲁棒性的ULM 微血管图像重建.Xu 等[22]提出基于鲁棒主成分分析(robust principal component analysis,RPCA)方法可实现低信噪比下微泡的高效检出,进而提升大鼠脑ULM 图像质量.
相较于脑、脏器、肿瘤血流成像,脊椎复杂的骨结构特征、呼吸运动的干扰以及脊髓本身尺寸较小的特点,给脊髓内微血流超声成像带来挑战[23],2018 年,Khaing 等[24]应用超声微泡造影剂对椎板打开条件下的大鼠脊髓血流进行了对比度增强超声成像(contrast-enhanced ultrasound,CEUS),成功观察到了脊髓中的微血管结构.近年来,基于多普勒的超快超声可在无造影剂条件下实现脊髓微血管成像.2021 年,Zang 等[25]基于超快超声多普勒实现了无造影剂条件下的脊髓微血管成像,该结果成像分辨率与发射波长相当.Sui 等[26]使用基于RPCA 的随机降采样方法实现了快速、高性比的超快超声多普勒脑与脊髓微血流成像.Pezet 等[27]对脊髓慢性损伤的血管重建进行了观测.但对于脊髓微血流的量化分析均有待深入,特别是基于ULM 的脊髓微血管分辨率的评价仍有待深入.
为实现脊髓微血流网络超分辨超快超声成像,本文使用超快超声成像技术采集数据,以基于RPCA 的滤波方法对微泡回波信号成分提取[28],使用径向对称(radial symmetry,RS)定位算法定位微泡中心点坐标,通过叠加数以万计的超声微泡运动轨迹,最终获得大鼠脊髓微血管超分辨率图像.此外,对脊髓微血管成像血管饱和度、分辨率和微血流速度信息等进行了参数量化分析.
2 基本原理
ULM 的主要流程如图1 所示,首先对超快超声序列采集到的回波数据进行波束合成,接着采用基于RPCA 的滤波方法对组织回波与微泡回波信号进行分离,包括滤除高频噪声.
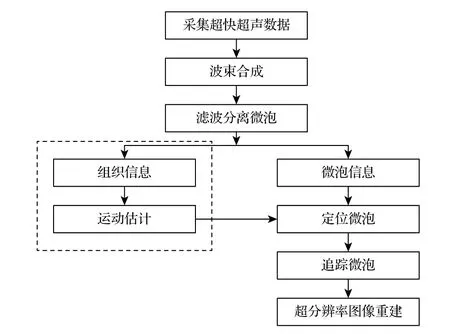
图1 超分辨率超快超声工作流程Fig.1.Workflow of Ultrafast Ultrasound Localization Microscopy.
2.1 超快超声成像
超快超声成像以平面波成像为核心,区别于聚焦波束逐行扫描整个目标区域,这种平面波成像模式下换能器所有阵元同时发射声波,产生一个平行于换能器阵列的超声平面波波前,从而可在单次传输过程中扫描整个目标区域.经组织散射后,所有阵元同时接收回波信号,经波束形成得到整个区域的超声图像.因此平面波成像一次发射即可得到一帧图像,与传统聚焦声束成像相比,能将成像帧率提高数百倍.此外,每帧图像采集时间可小于1 ms,这使得以高帧率测量组织运动、血液运动、造影剂运动情况成为可能[25],为在体血流动态成像与功能评价铺平了道路.
2.2 基于RPCA 的杂波滤除方法
分离组织与微泡信号常用的方法是基于奇异值分解(SVD)的时空杂波滤波方法[29],其原理是去掉表征高时空相关性组织信号的最大奇异向量以及表征噪声的最小奇异向量,剩下的奇异向量用来重建缓慢移动的微泡[28].然而,由于组织和微泡的频谱成分往往有重叠,SVD 方法在选择合适阈值以区分组织、微泡与噪声时仍然存在困难.近年来一些在微血管稀疏性方面的研究有助于改进杂波滤波,如RPCA[30,31].该策略将信号矩阵建模为低秩分量、稀疏分量和加性噪声的和,从而可以有效地分离出以微泡散射为主的稀疏分量.
采用低秩加稀疏模型可实现对组织和微泡信号的有效建模.其主要原理为,对某时间段内连续采集的Nt帧尺寸为 (Nz ×Nx) 的三维矩阵,将其转化 (Ns×Nt) 的二维矩阵A,其中Ns=Nz ×Nx,也即将Nt帧的图像重排为Nt个列向量.由于回波数据主要由强组织杂波、微泡回波和附加噪声分量组成,假设这三个分量是线性叠加的,那么回波数据矩阵X可以被描述为
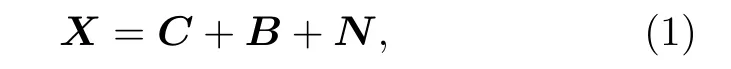
式中,C,B,N分别代表组织分量、微泡分量和噪声分量.当使用超快超声成像时,组织运动具有高的时空相干性,从而产生了低秩矩阵C.与组织不同的是,低浓度运动微泡的图像具有低相干和稀疏的特点,故而矩阵B不具有低秩的特征但具有稀疏性.噪声分量N的幅度小于微泡信号和组织回波,既非低秩也不稀疏.
从矩阵X中获得低秩矩阵C和稀疏矩阵B,可表述为一个凸规划(PCP)求解问题,其定义为
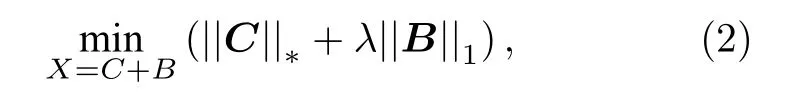

2.3 超分辨率定位显微
基于瑞利准则,由点扩散函数推导而来的成像分辨率往往限于半波长,即所谓的“衍射极限”[20].具体地,在声波衍射作用下,当发射波和接收波的平均点源的衍射距离接近发射波长的一半时,散射体的回波将会叠加在一起无法区分[8].散射体周围以R为半径的距离范围形成的球面波,散射强度为
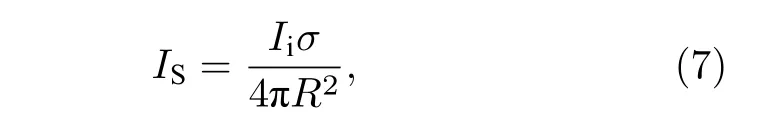
Ii为散射点与发射点之间的强度,σ为散射截面.除此之外,散射声的干扰会导致声散斑[33].但如果在任何点上都只能看到少数几个不同的源,那么可以根据成像系统的点扩散函数将这些源分离开,并精确地确定其位置.
采用超声造影剂作为强散射源,通过限制每幅图像中检测到的单个微泡的数量,可确保各个微泡回波不会相互干扰.对每一个微泡中心定位精度远高于系统的衍射极限分辨率.通过积累数千张图像中的微泡中心点的运动轨迹即可重建血管结构的超分辨率图像.从而实现在一定程度上兼具高分辨率和深穿透力的优点.
对于分离出的微泡回波信号,可以从每帧图像中提取、检测出独立运动的微泡,并使用RS 定位算法对微泡中心加以定位.RS 算法利用强度梯度来寻找微泡中心.在以其最大值为中心的对称强度剖面上,每一点的强度梯度总是指向该最大值,因而将微泡中心至等势线的距离最小化即可实现微泡定位.对于分离出的组织回波信号可用于估计由呼吸起伏产生的微小运动,进一步对微泡定位的结果进行运动校准.
在精确定位的基础上,使用基于Kuhn-Munkres算法的跟踪算法(simpletracker,Mathworks)可获得微泡的轨迹.即计算每个微泡与后续帧中所有微泡的距离,通过最小化总距离来对每个微泡在帧与帧之间的位置进行配对,从而确定每个微泡运动的轨迹与长度.此外,考虑噪声干扰、帧间配对失败或者微泡闪现时长过短等不利因素,长度过短的轨迹需要加以滤除,参考文献中所给出的经验值,小于15 帧长度的轨迹被视作不稳定轨迹而滤除[34].最后,累积一系列帧中插值过的轨迹,实现亚波长分辨率的微血管造影.同时,帧与帧之间微泡位置的差分可以用于计算微泡的运动速度,也即相应的血流速度.
2.4 基于傅里叶环相关的分辨率测定
依赖于单个精准点源的亚波长定位,ULM 可显著提高成像分辨率,进而突破衍射极限.借鉴光学纳米显微的标准方法[35,36]引入基于傅里叶环相关(Fourier ring correlation)测定分辨率,具体步骤如图2.原始轨迹列表被随机分成两组,构成两个子图像(流程示例图像选自图4 脊髓超分辨率结果的局部数据,也可以另行编程生成轨迹用于示例计算).分别计算子图像的二维傅里叶变换,再计算频谱F1和F2沿等空间频率环r(如图2 中红色与蓝色的等频率环)的归一化相关性((8)式),由此构建FRC 曲线.将分辨率定义为FRC 低于阈值的空间频率的倒数.
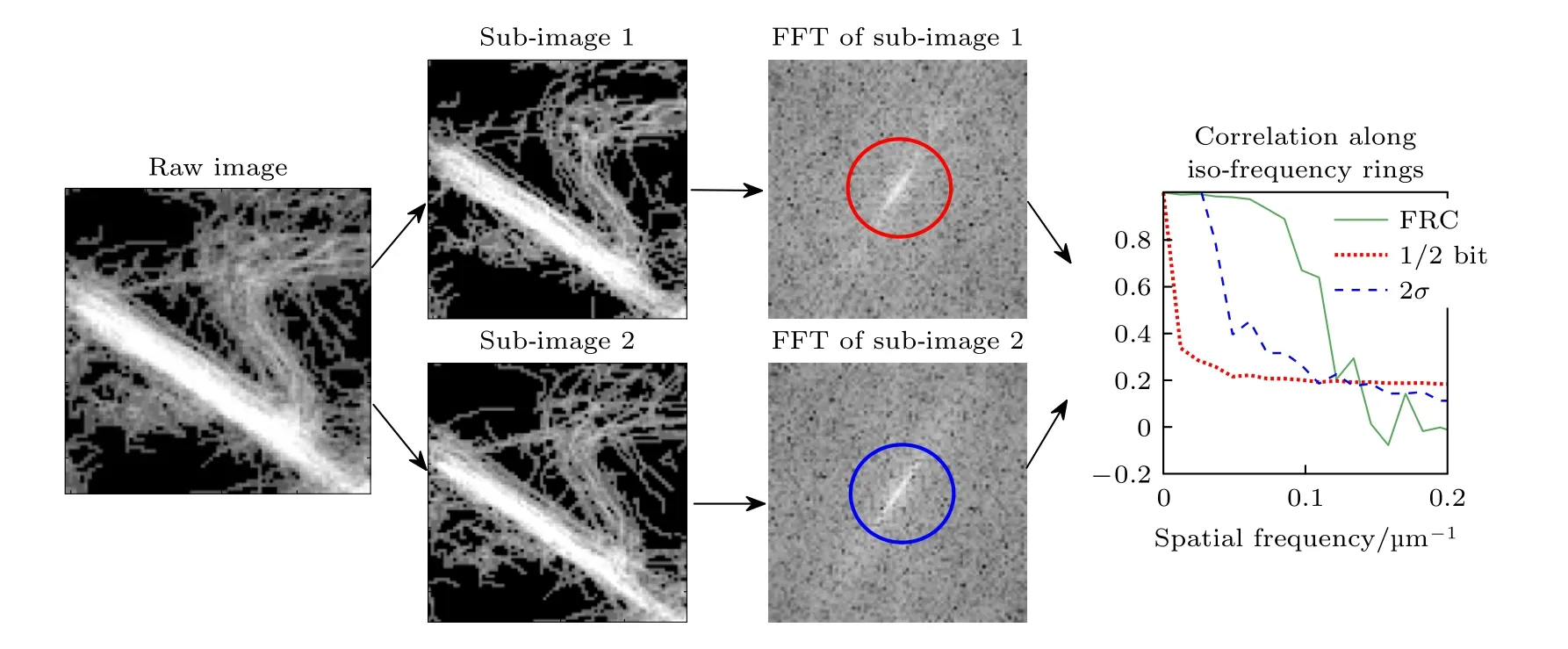
图2 基于FRC 曲线的分辨率测定Fig.2.Resolution measurement based on FRC curve.
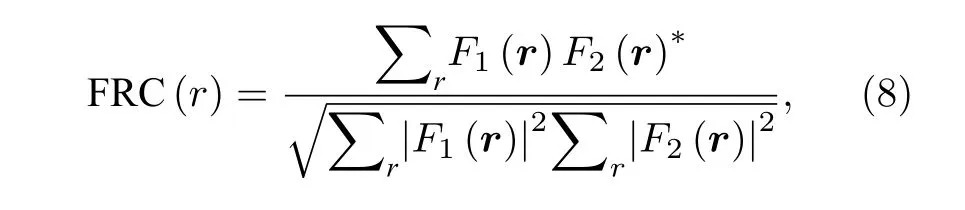
其中r=|r|,F1(r) 和F2(r) 为子图像Fourier 变换后的结果.
阈值曲线的选取有多种方式,固定阈值常见0.5 和1/7[35],变化的阈值曲线主要有基于σ阈值和bit 位的阈值曲线以及与这些曲线成比例的阈值曲线.本文使用2σ和 1/2 bit 阈值曲线,分别对应于高于两倍等效噪声水平的相关和填充半位所需的信息.分辨率被确定为与FRC 曲线的交点.在确定分辨率之前,FRC 曲线上可使用平滑滤波,如果可以观察到两个或更多的交叉,总是选择对应于较低分辨率的那一个.除了分辨率的估计以外,FRC 曲线的计算和分辨率的理论估计也有助于指导图像重建最小网格的选择,从而合适地表示微泡的密度分布.
3 实验设置
实验使用L22-14vX 线阵探头,具有128 个独立的阵元,每个阵元均可用作发射或接收,实验中所用发射频率为15.625 MHz,带宽14—22 MHz,相邻阵元间的间距是0.1 mm.对于B 模式成像和多普勒成像,超声序列发射15 个倾斜平面波(—10°—+10°均匀间隔),脉冲重复频率为31250 Hz.在超分辨率实验中,5 个发射角(—5°—+5°均匀间隔),帧率为1000 帧/s,共采集300 个数据块,每个数据块由600 帧合成帧组成.
所使用的动物模型遵循动物实验相关规定,通过复旦大学动物实验科学部动物福利与伦理委员会审批(批件号: 202202020Z).选择400 g 左右成年雄性Sprague-Dawley 大鼠,进行5 min 左右的异氟烷气体麻醉至身体松软便于后续进行全身麻醉,下腹腔注射浓度8%的水合氯醛溶液(每克体重注射5 µL)进行全身深度麻醉.暴露胸椎T7—11 节段椎板方便后续手术,其中胸椎T8—10 节段进行椎板打开手术,超声成像在该视野区间进行.椎板打开手术及成像实验过程中每隔1 h 补充注射0.3 mL 水合氯醛溶液.
超分辨率成像过程中,通过颈静脉注射超声微泡(SonoVue,Bracco,Milan,Italy).对于每瓶含59 mg 六氟化硫及25 mg 冻干粉的微泡制品,使用时加入4 mL 注射用生理盐水(0.9%NaCl)用力振摇后形成微泡混悬液.注射30 s 后,开始对大鼠脊髓的矢状面进行数据采集,采集前在B 超图像模式下确认选取包含脊髓前动脉的正中矢状切面进行成像.大鼠脊髓与超声探头之间使用加热至大鼠体温的超声耦合剂进行耦合.
4 实验结果
4.1 超快超声定位显微脊髓微血流结果
脊髓B 超成像结果如图3(a),脊髓的上下界面较为清晰,但在软组织信号的高回声影响下,无法直接呈现单个微泡.经过RPCA 滤波后,微泡和组织信号得以分离,任取一帧保留微泡信号的脊髓图像如图3(b),图中微泡的对比度相比于背景较高,特别是大血管中的微泡运动轨迹清晰.图3(c)为第150 个数据块中第300 帧微泡定位结果,图3(d)为第301 帧微泡定位结果,可以更为清晰地看到微泡在帧与帧之间运动的情况,红色圆点为算法定位的微泡中心.对于每帧图像,首先按强度值降序排列找出90 个候选微泡,然后筛去位于图像最边缘的微泡,再筛去算法定位中心与局部强度最大值之间偏移过大的微泡,剩下的就是用于下一步轨迹追踪的微泡.经过以上处理后,本数据中平均每帧有53 个微泡(在1000 Hz 帧率下采集的0.6 s 数据块中,每秒约采集31800 个微气泡),不同块之间微泡数量的标准差为10%.
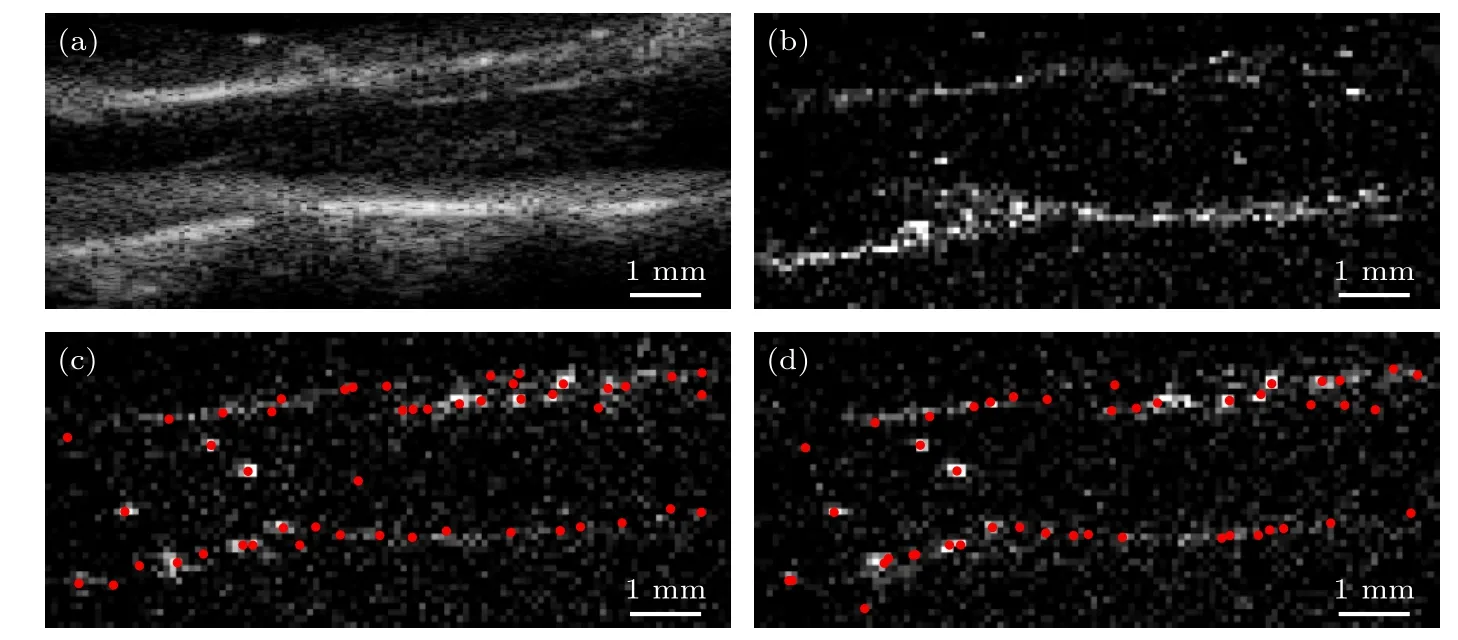
图3 ULM 处理过程结果 (a) 第150 个数据块中第200 帧回波信号的B 超图像;(b) 第150 个数据块中第200 帧分离出的微泡回波信号;(c) 第150 个数据块中第300 帧微泡定位结果;(d) 第150 个数据块中第301 帧微泡定位结果Fig.3.Results during ULM processing: (a) B-mode image of the 200th frame of block 150;(b) isolated signal of microbubbles after filtering from the 200th frame of block 150;(c) localization of microbubble centers in the 300th frame of block 150;(d) localization of microbubble centers in the 301th frame of block 150.
最终成像结果如图4 所示,血流密度图获得了较为清晰的大鼠脊髓内微血管网络结构重建,标尺为1 mm.此外,可较好地观察到脊髓内贯穿的小动脉分叉,直至末端分支点.相比之下,使用超快功率多普勒成像(图5(a))受到衍射的限制,只突出了大鼠脊髓的大血管,而没有区分波长尺度以下的细节.对比图4(b)ULM 血流方向图与图5(b)彩色多普勒血流图,ULM 可以更细致地区分血管依附在一起的上下行血流.
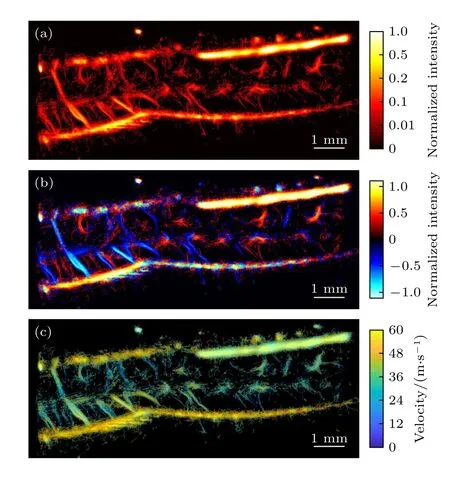
图4 超快超分辨率超声成像结果 (a) 脊髓血流密度图;(b) 脊髓血流方向图;(c) 脊髓血流速度图Fig.4.ULM Results:(a) Intensity map of spinal cord;(b) direction map of spinal cord;(c) velocity map of spinal cord.

图5 超快多普勒超声成像结果 (a) 功率多普勒血流图;(b) 彩色多普勒血流图Fig.5.Results of ultrafast Doppler imaging: (a) Power Doppler;(b) color Doppler.
图4(c)血流速度图展示了该方法测量微血管血流动力学的能力.大鼠脊髓矢状面内血流速度显示,大血管的动态范围可达cm/s,小血管的动态范围可达mm/s,血液流速相对较大的动脉分辨得很清晰,同一根血管内,某点的流速与该点距离血管中心的距离呈负相关,血管中心处的血流流速大,血管壁处血流流速小.并且大血管在血管中心支持更高的流量,与文献报道相符合[34,37].
4.2 分辨率和饱和度参数分析
成像过程中,算法定位到了700 多万微泡目标,瞬时微泡数量统计、累计微泡数量统计、血管饱和度统计如图6 所示.其中,瞬时微泡数量与各个时刻血管内微泡浓度成正比;血管饱和曲线表示的是图像上检测到的微泡所覆盖总面积占成像范围面积的比例随时间的变化,它反映了血管图像重建的时间过程.血管网络的拓扑结构不变,根据血管饱和度的定义,即使微泡浓度增加,饱和度曲线在平台期的稳定值依然基本不变.脊髓血管饱和度曲线(图6 蓝色)在一个快速阶段之后,在160 s 左右开始进入平台期,此时微泡基本充满了各血管,因而重建速度减慢,饱和度最终稳定在30%—40%;相同实验设置下对同一只大鼠进行脑部超分辨率血管成像,获得了相似的结果(图6 灰色).Hingot 等[20]也曾对大鼠脑部超分辨率成像进行微泡定位统计,对于一段时间持续性注射微泡的情况,饱和度曲线从150 s 左右开始进入平台期,饱和度最终稳定在40%—60%.虽然脊髓相较于大脑截面区域更小、整体血管相对纤细稀疏,但是通过血液循环进入脊髓内血管网络的微泡数量应与大脑应大体相当;从图6 的结果来看,两处组织中测得的血管饱和度曲线到达平台期的变化趋势相近,脑血流成像结果与文献[20]的结果具有一致性.
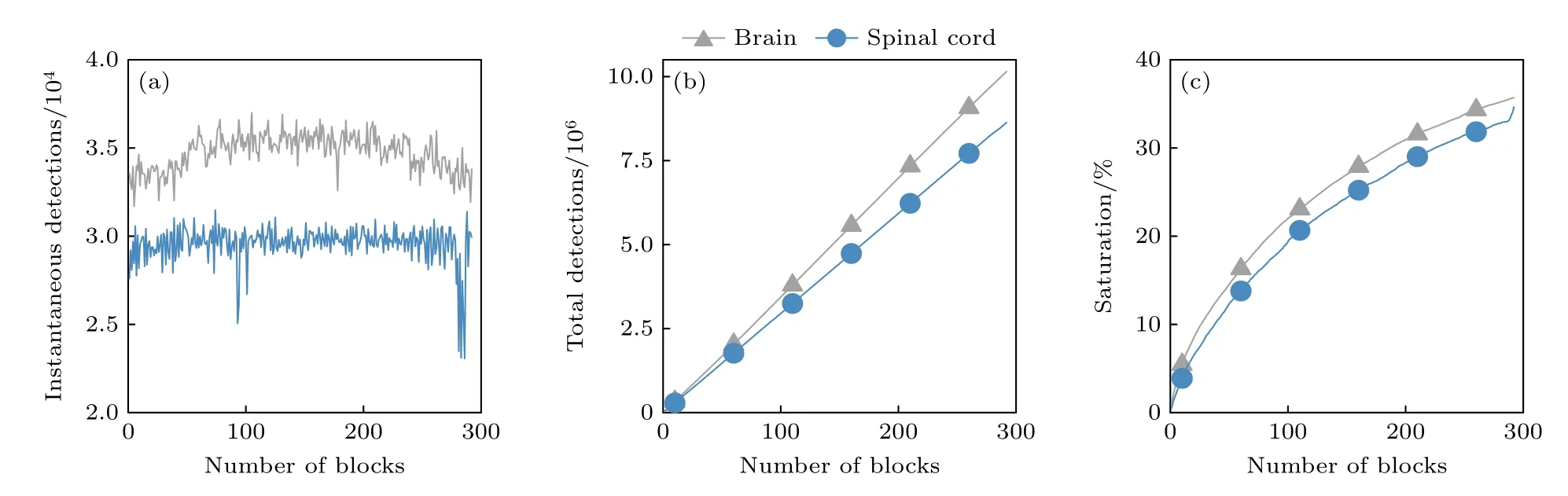
图6 微泡定位统计 (a) 瞬时微泡数量;(b) 累计微泡数量;(c) 饱和度随时间变化图曲线Fig.6.Quantification of microbubble localization: (a) Instantaneous detections;(b) accumulated detections;(c) saturation curve along time.
成像结果分辨率的测量同时使用了由半高全宽(full-width at half-maximum,FWHM)表征的传统定义分辨率与基于FRC 的分辨率.图7 对比了超快多普勒与超分辨率成像结果的分辨率.图7(a)为图5(a)脊髓超快多普勒血流图的局部放大图,选取的几条血管剖面半高全宽参数值测量结果如图7(b),空间分辨率约135—270 µm,第三条血管剖面结果表明,距离140 µm 的相邻血管可被较好地区分开.图7(c)为图4(a)脊髓超分辨率血流密度图的局部放大图,选取了几条含较多微泡的微血管剖面,其FWHM 参数值测量结果如图7(d),空间分辨率约28—35 µm,第三条血管剖面结果表明,距离28 µm 的相邻血管依然可以被较好地区分开.以上血管剖面的FWHM 结果与多普勒成像的图像分辨率相比,提升了4—10 倍.图7(e)为图4(b)脊髓超分辨率血流方向图的局部放大图,从白色方块标记出的感兴趣区域可以清晰地看到,原本在密度图中被视作一条血管的位置可在区分方向后进一步细分为两条相反流向的微血管.图7(f)为基于FRC 的分辨率测量结果,这里使用了2σ和1/2 bit 阈值曲线与FRC 曲线相交以确定分辨率,两个交点分别对应13 和16 µm 的空间分辨率,与文献中脑血流结果分辨率[11]保持一致.更为详细的ULM 参数结果包括微泡保留比例、轨迹保留比例、饱和度、血流速度范围、全图血管剖面FWHM 范围、分辨率测算结果均统计在表1 中.
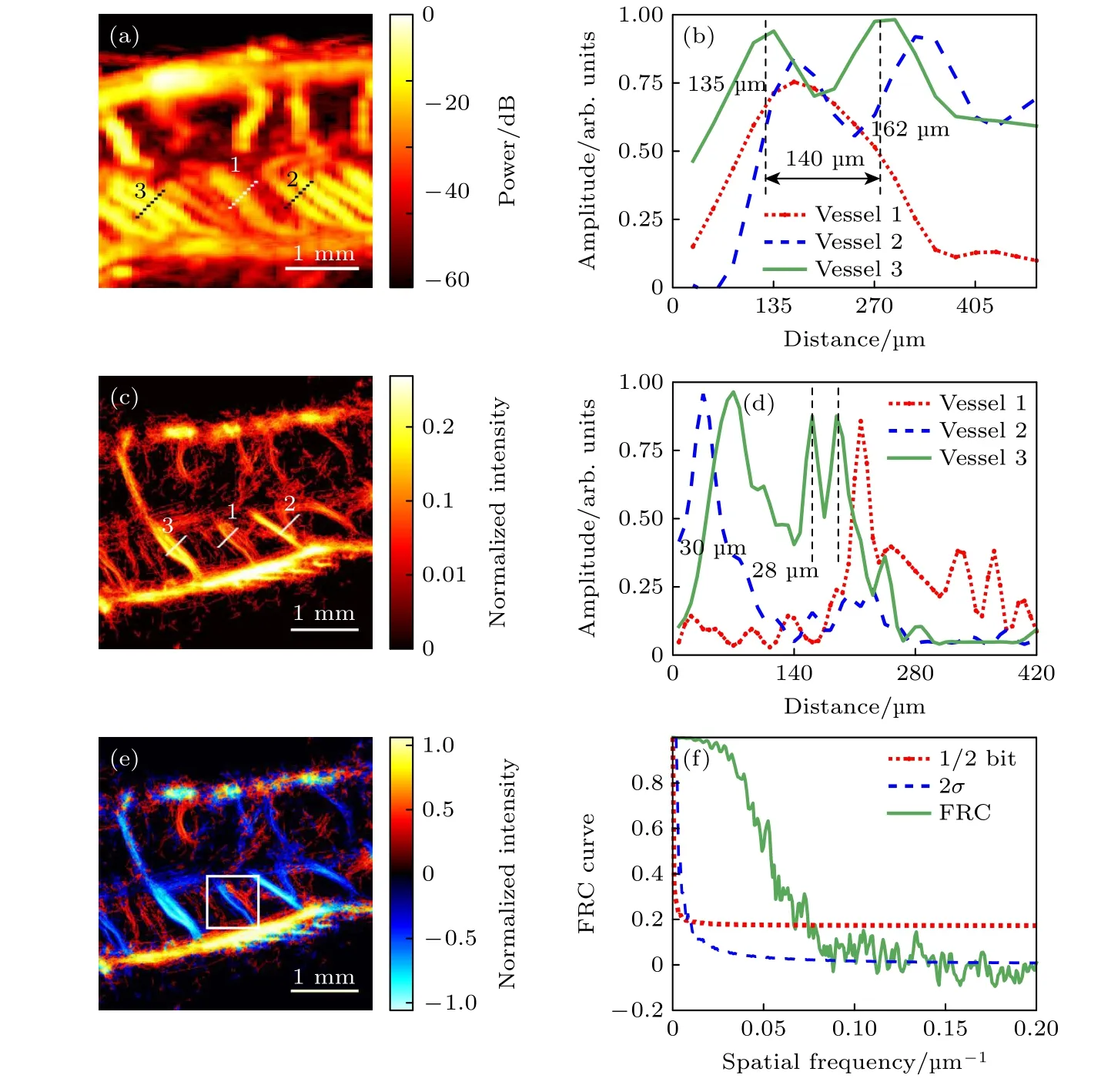
图7 超快多普勒与超快超分辨率超声成像结果分辨率测算 (a) 脊髓超快功率多普勒血流局部放大图;(b) 图(a)中部分血管剖面FWHM 结果;(c) 脊髓超分辨率血流密度局部放大图;(d) 图(c)中部分血管剖面FWHM 结果;(e) 脊髓超分辨率血流方向局部图;(f) 超分辨率血流密度图基于FRC 的分辨率结果Fig.7.Resolution measurements of ultrafast Doppler imaging and ULM: (a) Zoom in of power Doppler;(b) FWHM of vessels from panel (a);(c) zoom in of ULM intensity map;(d) FWHM of vessels from panel (c);(e) zoom in of ULM direction map;(f) resolution of ULM intensity map based on FRC curve.
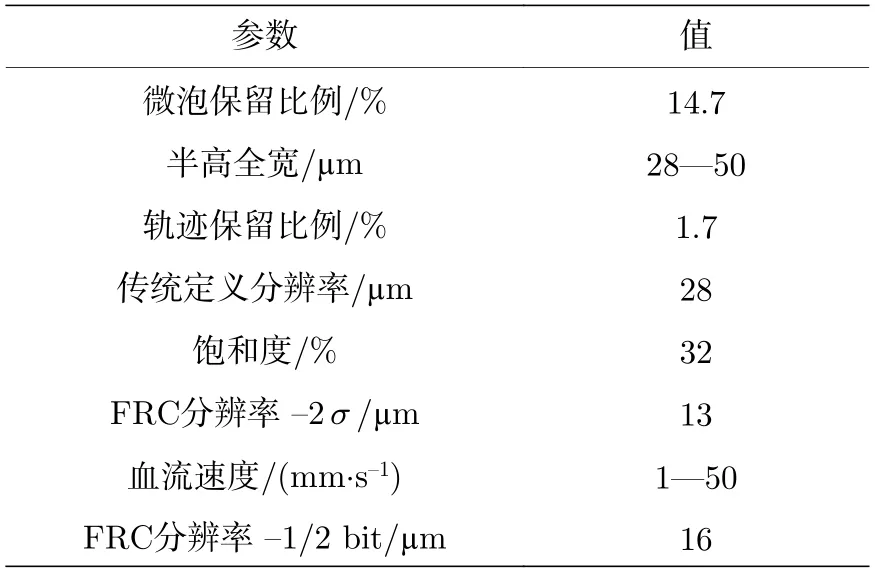
表1 ULM 参数统计结果Table 1. Results of ULM parameter measurement.
5 讨论
彩色多普勒成像具有角度依赖性,仅能确定血流速度的轴向分量,此外,在上下行血流同时出现时存在对应的正负频移相互抵消的情况,因此频移估计不准确不稳定,轴向速度估计也整体偏低[38].对比超快多普勒结果和ULM 结果,ULM 方法测得的速度范围在1—50 mm/s,而多普勒测得速度最高仅为在13 mm/s 左右,明显低于ULM 的测量结果.这是由于ULM 方法通过追踪微泡中心轨迹计算血流速度,从而克服角度依赖限制,可准确测量侧向移动的微泡,并提供角度无关二维速度估计.因而,ULM 技术可用于观察小血管弯曲、突然分支以及复杂的血流速度的变化,进而探究血管受损[27]和相关疾病的发生发展.
在ULM 成像过程中,饱和度与成像时间需要加以权衡.当饱和度曲线接近收敛状态时,通过叠加轨迹新增血管的信息较少,血管网络拓扑形态将不再会显著改变;并且由于大血管内流过的微泡比率高,其重建速度相对较快,部分毛细血管重建需要较长的图像采集时间[19].因此,损失一些血管细节可以有效减少成像时间,在饱和度曲线未达到平台期稳定值的情况下亦可获得血管结构图像.同时,本文目前的微泡运动轨迹保留比例较低,也可能导致所需的成像时间较长.后续研究可引入包括机器学习方法在内的先进信号处理技术,实现微泡运动轨迹的高效提取与识别.为了缩短超分辨率成像的时长,另一个可行方案为提高造影剂浓度,可使得单位时间内微泡数量增加.但是,高浓度微泡会导致微泡间点扩散函数的空间重叠,从而引起微泡中心定位偏差,给定位显微算法带来挑战.有学者提出了稀疏策略和相关深度学习方案,如通过考虑数据固有的时间结构,在时间相关域进行稀疏恢复[39];基于V-net 架构的三维卷积神经网络方法[40]或全卷积神经网络方法[41]也可在注射高浓度微泡的条件下恢复血管网络.总地来说,注射高浓度微泡可使得单位时间内微泡运动轨迹增加,促使饱和度曲线收敛速度相对加快;但浓度也不宜过高,针对不同的成像器官,相关最优浓度与采集时长仍有待进一步的临床研究加以澄清.
本研究目前是在椎板打开的情况下进行超分辨率成像.现有研究表明,经由颅骨可以实现脑部超分辨超声成像.但由于头骨诱导的信号衰减导致的低信噪比,整体上检测到的局部微泡的数量会减少[11],因而增加了最小可检测血管的限制.未来,通过结合基于未知模型的全波反演技术[42],超声骨成像技术[43]和基于已知速度模型的相位畸变校正方法[44],直接从射频数据中定位微泡以进一步提高分辨率,有望实现经椎骨超分辨脊髓微血流成像.从方法上采用二维面阵获得脊髓微血管的三维超声影像具有可行性,但现阶段三维探头的系统成本与实现复杂度仍相对较高.此外,也可借助数控电机精细控制超声探头空间扫查,以机械扫描的方式获取若干二维矢状面血流图像,经体空间重建获得三维血流成像.
6 结论
本文采用ULM 技术对大鼠脊髓微血流进行成像,以基于RPCA 的滤波方法分离组织与微泡回波信号,通过叠加超声微泡定位中心的运动轨迹,最终获得大鼠脊髓微血管超分辨率图像.脊髓血流密度图中可以清晰地看到脊髓上下两个界面的动脉血管以及内部的微血流分布,血流方向图可进一步区分血流密度图中无法分离的相邻血管,血流速度图对不同的血管有明确的速度测量.定量分析中,基于FWHM 的分辨率测定与基于傅里叶环相关的分辨率测定均证明,发射频率为15.625 MHz的超声探头可获得13—16 µm 左右分辨率的脊髓内微血管网络结构图像,远小于100 µm 成像波长,达到了亚波长分辨率.对比了超快超声多普勒微血流成像方法,ULM 的分辨率提升了4—10 倍,增强了脊髓损伤的诊断能力,对相关术中检查与预后跟踪也有一定的借鉴意义.
