基于无创指标的IgA 肾病诊断预测模型的建立与验证
2022-09-14汪丽珍何正佳鲍晓荣
王 娇,汪丽珍,王 昱,何正佳,鲍晓荣
复旦大学附属金山医院肾内科,上海 201508
IgA 肾病的主要特征为以IgA 为主的免疫球蛋白及补体成分在肾小球系膜区沉积,病变可累及肾小球、肾小管间质、肾内血管等多部位[1]。近年来,IgA 肾病已成为全球最常见的一种原发性肾小球疾病;在中国,其占原发性肾小球疾病的40%以上[2-3]。该病起病多隐匿,主要表现为不同程度的血尿及蛋白尿,在10~20 年内病情可进展至终末期肾脏病[4]。目前确诊IgA 肾病主要依赖肾脏病理检查,但由于肾活检为有创检查手段,容易导致出血等并发症[5-6],加重患者病情;同时,部分存在肾活检禁忌证的患者无法通过该检查手段确诊,而且,该技术在条件有限的基层医院开展难度大。基于上述肾活检技术实施的局限性,探索一种无创、方便、准确度高的诊断方式或许可为IgA肾病的临床诊断提供参考。
本研究通过分析我院收治的原发性肾小球肾炎患者的临床资料,探讨血IgA/C3、血纤维蛋白原、血尿情况(镜下血尿或肉眼血尿)、血浆白蛋白水平、24 h 尿蛋白、血脂等指标与IgA 肾病诊断的相关性,用多元logistic 回归分析法构建IgA肾病的无创诊断预测模型,并评价其诊断效能。
1 资料与方法
1.1 研究对象 选取2015 年10 月1 日至2021年6 月30 日在复旦大学附属金山医院肾脏内科住院经肾穿刺组织活检确诊为原发性肾小球疾病的患者。纳入标准:(1)肾脏病理证实为原发性肾小球疾病;(2)年龄≥14 岁;(3)eGFR≥30 mL·min·(1.73 m2)-1。排除标准:(1)自身免疫性疾病、病毒感染、恶性肿瘤、中毒、药物性肾损害、代谢性疾病导致的继发性肾病;(2)遗传性肾病;(3)存在免疫缺陷、严重感染、营养不良等可影响血清免疫球蛋白、补体、血浆白蛋白、血红蛋白、C 反应蛋白(CRP)等指标水平;(4)肾活检前使用激素、免疫抑制剂、降尿酸、降脂药物治疗;(5)临床数据不完整。本研究通过复旦大学附属金山医院伦理委员会批准(JIEC 2021-S59),所有患者均知情且签署知情同意书。
1.2 观察指标 收集患者年龄、性别、血压分级、体质量指数(BMI),肉眼血尿史,肾活检前实验室检查指标,包括肾功能、血浆白蛋白、血脂、免疫球蛋白、补体、尿常规、24 h 尿蛋白、凝血功能等,及肾组织病理检查(光镜、电镜及免疫荧光)结果。
1.3 诊断预测模型的构建和验证 将患者按65 ∶35 随机抽样,分为训练集(n=181)和验证集(n=95)。训练集中,将IgA 肾病与非IgA 肾病患者间差异性可能存在临床意义的指标纳入单因素分析,对P<0.2 的变量进行共线性分析,排除共线性后,采用向前的LR 法构建多因素回归模型,根据模型绘制可视化的Nomogram 图。在验证集中,对训练集中所建模型进行外部验证。绘制ROC 曲线,计算曲线下面积(AUC),评价预测模型对IgA 肾病与非IgA 肾病的区分度。绘制校准曲线,评价预测模型的校准度。
1.4 统计学处理 采用SPSS 22.0 统计软件完成数据分析,符合正态分布的计量资料以表示,2 组间比较采用独立样本t 检验;不符合正态分布的计量资料以M(P25, P75)表示,2 组间比较采用Mann-Whitney U 检验;分类资料以n(%)表示,采用检验进行组间比较。筛选纳入多因素分析的变量时,将α 放宽至0.2,其余检验水准(α)为0.05。采用R 语言绘制Nomogram 图。
2 结 果
2.1 一般资料分析 结果(表1)显示:276 例原发性肾小球疾病患者年龄15~78(42.83±13.50)岁,其中男性161 例、女性115 例,IgA 肾病131例、非IgA 肾病145 例。IgA 肾病患者中肾病综合征发生率为10.7%(14/131)、非IgA 肾病中肾病综合征发生率为55.9% (81/145),差异有统计学意义(χ2=62.2,P<0.001)。非IgA 肾病中包括膜性肾病85 例、系膜增生性肾小球肾炎18 例、局灶节段性肾小球硬化14 例、微小病变性肾病25例、系膜毛细血管性肾小球肾炎1 例、C3 肾小球肾炎1 例、肾小球足细胞病1 例。训练集181 例患者包括IgA 肾病85 例、非IgA 肾病96 例,年龄17~77(43.81±13.11)岁,男性99 例(54.7%);验证集95 例患者中IgA 肾病46 例、非IgA 肾病49 例,年龄15~78(40.97±14.09)岁,男性62例(65.3%)。
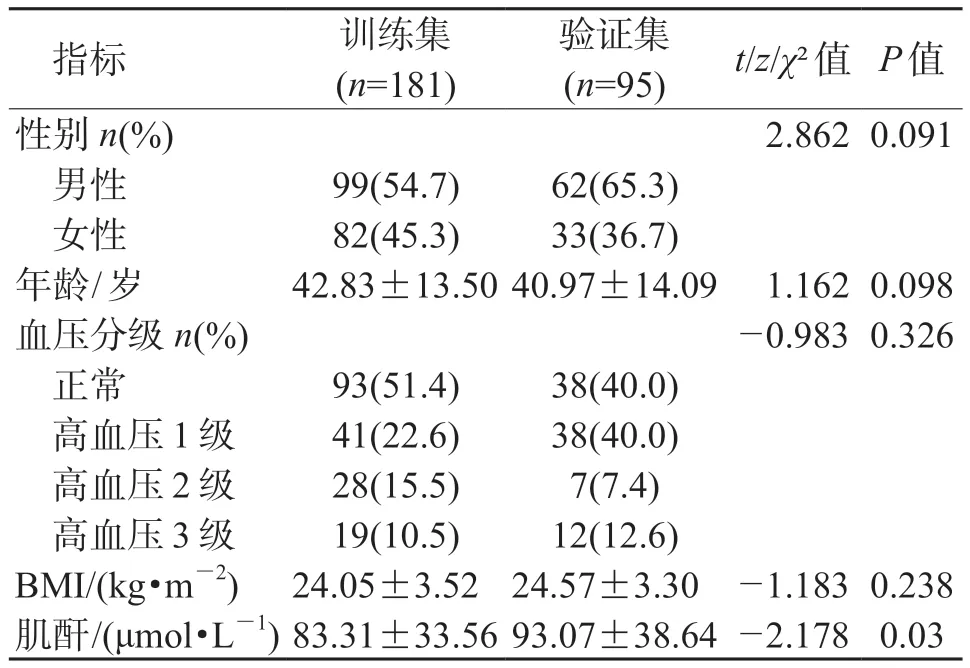
表1 训练集与验证集组间一般人口学资料及临床特征比较
2.2 训练集中IgA 肾病与非IgA 肾病患者临床资料的比较 结果(表2)显示:训练集中,IgA 肾病与非IgA 肾病患者性别、血压分级、BMI、血红蛋白、血CRP、血尿素氮水平等差异无统计学意义。IgA 肾病患者较年轻,血尿发生率高,血IgA、血IgA/C3、血IgG、血白蛋白、血肌酐水平较高(P<0.01);IgA 肾病患者 24 h 尿蛋白及血C3、纤维蛋白原、D-二聚体、乳酸脱氢酶、高密度脂蛋白、低密度脂蛋白、三酰甘油、总胆固醇水平较低(P<0.001)。

表2 训练集IgA 肾病组与非IgA 肾病组患者临床资料的比较
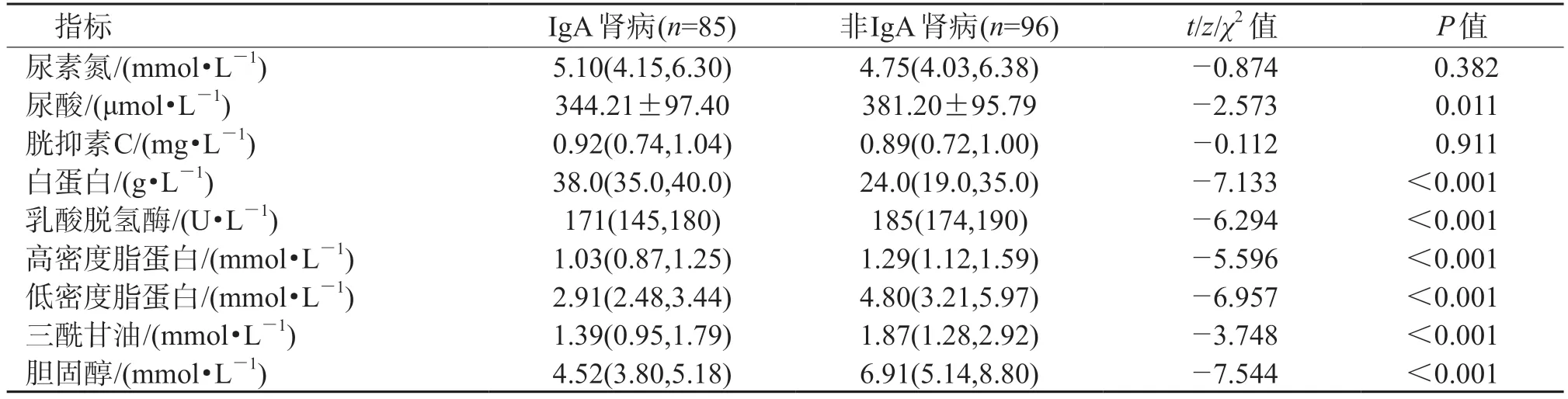
续表2
2.3 诊断预测模型的构建 结果(表3)显示:在训练集中,将年龄、性别、高血压分级、血尿情况、血IgA/C3、24 h 尿蛋白、血白蛋白、血肌酐、血尿素氮等上述28 个变量纳入单因素分析,将P<0.2 的20 个变量进行共线性分析,排除各因素共线性后(剔除血IgA、血C3、血低密度脂蛋白),将余17 个变量进一步纳入多因素logistic 回归分析,最终以血尿、血白蛋白、血IgA/C3、血纤维蛋白原、血高密度脂蛋白5 项指标构建IgA肾病诊断预测模型。回归方程为logit(P)=-3.568+0( 或 1.835×1 或 2.839×2)+1.288×IgA/C3-0.726×纤维蛋白原+0.121×白蛋白-1.987×高密度脂蛋白。图1 为该模型的可视化展示。
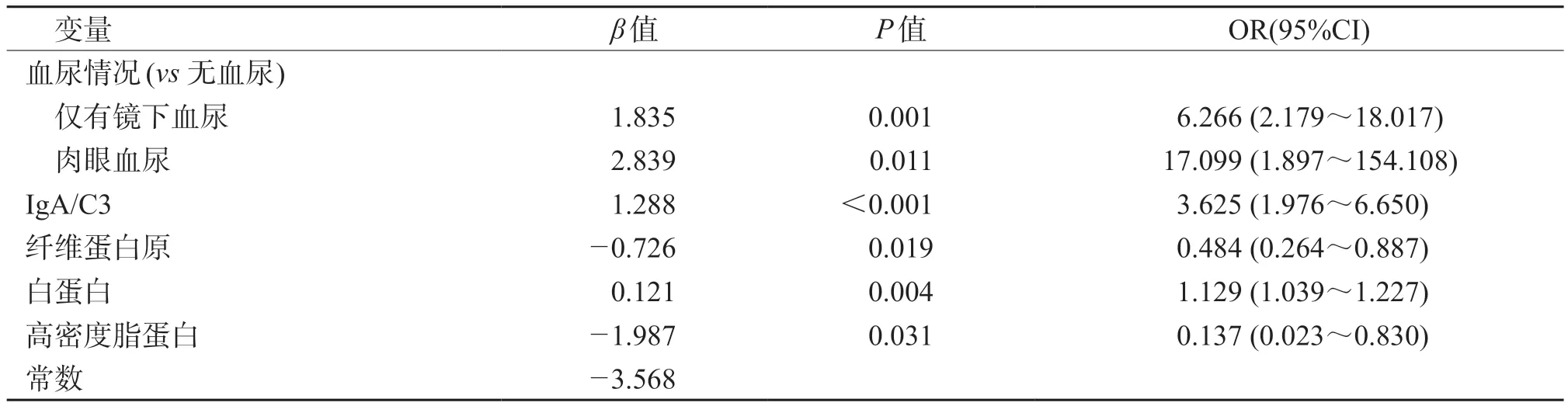
表3 多因素logistic 回归分析结果

图1 IgA 肾病诊断预测模型Nomogram 图
2.4 诊断预测模型效能评价
2.4.1 模型区分度 结果(图2)显示:训练集中,该模型预测IgA 肾病的AUC 为0.934(P<0.001,95%CI 0.899~0.970),AUC>0.75, 提 示 该 模型区分度较高;根据约登指数确定最佳诊断值为0.437,灵敏度为91.8%、特异度为85.4%。

图2 训练集诊断模型预测IgA 肾病ROC 曲线
2.4.2 模型校准度 通过Hosmer-Lemeshow 拟合优度检验来评价诊断预测模型的校准能力,结果显示,Hosmer-Lemeshow X2=7.106,P=0.525, 提 示模型预测值与实际观测值之间差异无统计学意义,该预测模型有较好的校准能力(图3)。
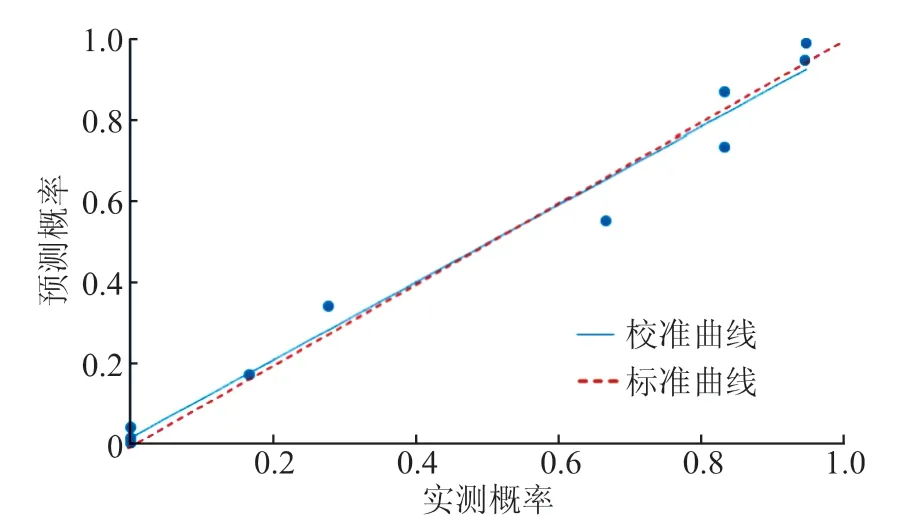
图3 训练集诊断预测模型校准曲线
2.5 诊断预测模型的外部验证 训练集中模型诊断最佳诊断界值为0.437,Nomogram 图中对应总分值为150 分。在验证集中,预测模型总分>150分者诊断为IgA 肾病,为阳性预测结果;总评分≤150 分者预测诊断为非IgA 肾病,为阴性预测结果。结果(表4、图4)显示:采用该分值时,模型预测IgA 肾病的灵敏度为76.1%、特异度为87.8%。在验证集中绘制ROC 曲线,AUC 为0.902(P<0.001,95%CI 0.837~0.968),说明建立的IgA 肾病诊断预测模型具有较好的准确性。

表4 验证集中模型诊断结果

图4 模型在验证集预测IgA 肾病ROC 曲线
3 讨 论
IgA 肾病主要通过肾活检明确诊断,肾活检作为一种有创检查手段,实施存在局限性,故探寻IgA 肾病的无创诊断方法引起研究者们的关注,其中可用于IgA 肾病诊断的新型生物标志物成为研究热点[7-9]。目前抗GdIgA1 特异性抗体这一新型生物标志物的临床价值已被认可[10-11],但尚未普遍应用于临床。而构建IgA 肾病无创诊断预测模型为该疾病诊断提供了新方向。
本研究通过对276 例原发性肾小球疾病患者的临床资料进行回顾性分析,最终将血尿情况、血白蛋白、纤维蛋白原、高密度脂蛋白共5 项指标纳入logistic 回归模型,并将该模型绘制成Nomogram 图,根据5 项指标总分预测是否为IgA肾病,总分越高,IgA 肾病可能性越高。该模型在训练集中的AUC 为0.934(P<0.001),最佳诊断界值为0.437,相应灵敏度为91.8%、特异度为85.4%,提示模型区分度好。Hosmer-Lemeshow 拟合优度检验P=0.525,校准度高。对该模型进行外部验证,显示该模型在验证集中的AUC 为0.902(P<0.001),说明该模型具有较好的准确性。将训练集诊断界值用于验证集,其对IgA 肾病诊断预测的灵敏度为76.1%,特异度为87.8%,提示基于上述5 项无创指标的诊断预测模型对IgA 肾病的诊断和鉴别诊断具有较高的临床价值。
郭丹丹等[12]将肉眼血尿、IgA/C3 比值、血白蛋白、血总胆固醇、年龄纳入IgA 肾病诊断模型,其在训练集和验证集中的AUC 分别为0.880 和0.887,校准曲线显示模型的预测概率与实际概率一致性良好,DCA 结果表明模型的安全性及患者的临床净获益较高。但该研究未将镜下血尿纳入模型,而血尿及蛋白尿为IgA 肾病主要表现,因此将镜下血尿与肉眼血尿结合纳入分析更为全面。本研究显示镜下血尿在IgA 肾病与非IgA 肾病患者间差异有统计学意义。
既往IgA 肾病诊断模型[12-15]中,最终纳入模型的指标不尽相同。其中Han 等[13]将血纤维蛋白原、年龄、血IgA、总胆固醇、D-二聚体5 项指标纳入logistic 回归模型,AUC 为 0.86(灵敏度85.9%、特异度 73.8%);Gao 等[14]建立的包含血纤维蛋白原、血IgA 水平和临床表现的组合方程预测IgA 肾病的预测价值较大。本研究结果与上述研究均表明了血纤维蛋白原预测IgA 肾病的重要性。本研究中IgA 肾病患者血纤维蛋白原水平低于非IgA 肾病患者,差异有统计学意义(P<0.001),与孟晓辉等[15]的研究结果一致。原因可能为与IgA 肾病患者肾病综合征发生率低于非IgA肾病患者。肾病综合征患者血中促凝及促聚集因子增加,而抗凝、抗聚集和纤溶机制受损,血液浓缩、激素和利尿剂的使用、高脂血症、低蛋白血症等原因引起血浆纤维蛋白原水平升高。同时,Han 等[13]及 Gao 等[14]均将血 IgA 水平纳入模型,但近年来相关研究结果[16-18]及本研究结果均提示,IgA 结合C3 较单纯IgA、C3 对IgA 肾病更具有诊断价值。
本研究131 例IgA 肾病患者中肾病综合征发生率为10.7%,145 例非IgA 肾病中肾病综合征发生率为55.9%,差异有统计学意义(P<0.001),这可能为IgA 肾病患者较非IgA 肾病患者血浆白蛋白水平更高及血脂水平更低的原因。本研究提示,IgA 肾病患者高密度脂蛋白水平低于非IgA 肾病组,与既往研究[19]相符。该研究表明慢性肾脏病中高密度脂蛋白水平与白蛋白负相关。由于慢性肾脏病患者脂蛋白转运酶活性异常,高密度脂蛋白亚型失调,阻碍逆胆固醇转运,失去了高密度脂蛋白对心血管的保护作用,促进动脉粥样硬化形成,增加了慢性肾脏病进展风险。
综上所述,本研究构建的模型中包含临床上较易获得、评估相对简单的指标,同时将模型通过Nomogram 图直观展示,结果提示该模型对IgA肾病诊断的灵敏度及特异度均较高,诊断效能较高,可用于IgA 肾病的诊断。但本研究为回顾性分析、样本量较少、为单中心研究,且患者eGFR≥30 mL·min·(1.73 m2)-1, 因 此 模 型 对 终 末 期CKD 患者不适用,同时未将血清抗GdIgA1 特异性抗体这一重要新型生物标志物纳入分析。因此,未来可采用前瞻性设计,增加抗GdIgA1 特异性抗体,加大样本量进行多中心研究。
利益冲突:所有作者声明不存在利益冲突。
