PAI-1 招募中性粒细胞调控IL-6/STAT3 信号通路促进脂多糖诱导的肺细胞损伤
2022-09-14窦懋森金文婷宋元林
窦懋森,金文婷,宋元林,潘 珏*
1. 复旦大学附属中山医院感染病科,上海 200032
2. 复旦大学附属中山医院呼吸与危重症医学科,上海 200032
急性肺损伤(acute lung injury, ALI)和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)主要表现为由各种局部和全身性损伤引起的呼吸衰竭,后期可发展为多器官功能衰竭[1]。尽管保护肺部的呼吸机策略已获得较好进展并改善了ALI/ARDS 预后,但由于缺乏有效的治疗手段和对疾病发生发展的了解不足,ALI/ARDS 患者病死率仍很高[2]。因此,阐明诱发肺损伤的分子机制对于寻找新的诊治靶点和开发临床治疗方法非常重要。
ALI/ARDS 患者常伴肺泡-毛细血管屏障高通透性导致的肺水肿和动脉氧合受损。此外,肺组织中大量炎症因子积聚和中性粒细胞浸润也是其主要分子特征[3-4]。当细菌脂多糖(lipopolysaccharide,LPS) 引 起ALI 时, 中 性粒细胞会被激活并被招募到肺泡间隙及肺组织中释放活性氧、中性粒细胞趋化因子、髓过氧化物酶(myeloperoxidase,MPO)和基质金属蛋白酶(matrix metalloproteinase,MMP)等物质[1,4-5]。这些物质虽然能对抗外来入侵的病原体,但过量释放时也会损伤肺上皮和内皮细胞。用普乐沙福(AMD3100,CXCR4 拮抗剂)、阿法链道酶(pulmozyme,人重组DNA 酶)或西维来司他(sivelestat,中性粒细胞弹性蛋白酶抑制剂)抑制中性粒细胞的活化和募集则能缓解感染相关ALI/ARDS 症状[6]。因此,中性粒细胞的招募对ALI/ARDS 的发生发展起重要作用,但其发挥作用的分子机制仍不明确。
纤溶酶原激活物抑制物-1(plasminogen activator inhibitor-1,PAI-1)是一种相对分子量为52 000 的糖蛋白,属于丝氨酸蛋白酶抑制剂超家族成员。PAI-1 能通过与靶蛋白酶相互作用来调节凝血和纤维蛋白溶解。生理情况下,PAI-1 能与组织型纤溶酶原激活物(tPA)和尿激酶型纤溶酶原激活物(uPA)结合而使之灭活[7-8]。研究[9]表明ARDS 患者炎症和凝血系统之间存在交叉联系,并提出了“免疫血栓”的观点。另有临床试验[10]结果显示,血浆PAI-1 是影响ARDS 预后的独立危险因素。因此,PAI-1 可能调节以中性粒细胞为中心的炎症过程,并进一步影响ALI/ARDS 的发展和预后。本研究利用LPS 诱导的损伤原代肺泡Ⅱ型上皮细胞(alveolar epithelial type Ⅱ cell, AEC Ⅱ)为模型,阐释PAI-1 能否通过趋化中性粒细胞进而促进肺损伤过程及基本机制,为临床更好地认识ALI/ARDS 和开发相关治疗靶点提供理论基础。
1 材料与方法
1.1 质粒构建和转染 PAI-1 基因扩增正向引物 为 5'-CGCGGATCCGCGATGGACTACAAGG ACGACGATGACAAGCAGATGTCTCCAGCCC TC-3';反向引物为 5'-CCGCTCGAGCGGTCAGG GTTCCATCACTTGGCCCATGAAAAG-3', 酶 切位点为BamHI 和XhoI,扩增 25 个。Flag(N'-DYKDDDDK-C')位 于PAI-1 的N 端。 随 后,PAI-1片段被克隆到pcDNATM3.1(+)形成pcDNA3.1-Flag PAI-1(Invitrogen 公 司 ), 并 进 行 DNA 测序。HEK293T 由天津市中医药研究院馈赠,加入 含 有 10%FBS(Hyclone 公 司) 及 50 g/L 青 霉素/链霉素的DMEM(Corning 公司)培养基中,在 37℃、5%CO2条件下培养。转染前 1 d,将5.0×105个细胞接种到6 孔板,当密度达75%时,用 lipofectamine 2000(Invitrogen 公司)对细胞进行转染,构建表达载体。第2 天用LPS 处理转染的HEK293T 细胞,观察Flag-PAI-1 是否被激活。
1.2 AEC Ⅱ的分离和培养 Sprague Dawley 大鼠购自上海斯莱克实验动物有限公司,均予以常规饮食。于80~90 日龄(最适交配时间)时将雄性和雌性大鼠合笼,最终获得怀孕19 d 大鼠,取出胎鼠。在超净工作台中,用75%乙醇对仰卧位固定的胚胎进行消毒[11-12]。在胸线中线处,用眼科弯钳沿横膈膜切开肋骨,暴露胸腔,用另一把无菌眼科弯钳肘部末端迅速取出肺组织,将肺放在含有链霉素和氨苄青霉素的PBS 培养皿中。用PBS 冲洗肺组织以洗净血迹,用直眼剪刀将肺组织粗略地剪成 1~3 mm 的组织片。用 5~8 倍体积的胰蛋白酶、在37℃水浴条件下消化肺组织片10~15 min。加入含有10% FBS 的DMEM 培养基终止胰蛋白酶反应,3 000×g 离心 10 min,去除多余的上清液。用含有10% FBS 的DMEM 培养基重悬细胞,接种到10 cm 培养皿里,在37℃、5%CO2条件下培养。
1.3 中性粒细胞分离和纯化 提取6~8 周龄Sprague Dawley 大鼠 5 mL 全血,抗凝。严格按照试剂盒使用说明将血液缓慢加入中性粒细胞分离液(P9200,Solarbio)的上层,室温下500×g 离心35 min。离心后小心吸取中性粒细胞层并用10 mL PBS 洗涤细胞,250×g 离心 10 min,弃上清,细胞重悬备用。
1.4 CCK8 检测细胞存活率 采用不同浓度(0、0.01、0.05、0.1、0.5、1 μg/mL) 的 LPS 处理HEK293T 细胞 6 h,以确定LPS 最适浓度。用DMSO、LPS(最适浓度)或LPS(最适浓度)+PAI-039(10 μmol/L)处理 AEC Ⅱ 6 h 后,收集细胞并进行计数,将1×105个AEC Ⅱ加入96 孔板中,分别于培养 0 h、24 h、48 h、72 h 和 96 h 时加入含有10% CCK8(ab228554,Abcam 公司)的培养基,在37℃、5%CO2条件下孵育3 h,在450 nm 处测量吸光度。PAI-039(HY-15253)为PAI-1抑制剂,购自MCE 公司。
1.5 ELISA 检测 PAI-1(大鼠中以PAI-1A 表示)重组蛋白加入中性粒细胞培养基中,采用大鼠ELISA 试剂盒,分别检测肿瘤坏死因子α(tumor necrosis factor-α,TNF-α;ab236712, Abcam)、白细胞介素 1β(interleukin-1β,IL-1β;ab255730,Abcam 公司)、白细胞介素-6(interleukin-6,IL-6;ab234570, Abcam 公 司 )、MPO(E4581,BioVision 公 司 )、MMP-1(ml002968, Mlbio 公司)和血小板/内皮黏附因子(platelet/endothelial cell adhesion molecule,PECAM;ab213175, Abcam公司)。将中性粒细胞悬浮在上层小室中,用DMSO、LPS 或 LPS+PAI-039 处理下层 AEC Ⅱ 2 h后,收集细胞培养基,1 000×g 离心 5 min 获得上清液,用ELISA 试剂盒分别检测IL-6、MMP-1 和MPO 的含量。
1.6 中性粒细胞迁移试验(Transwell) 采用5 μm 孔径的聚碳酸酯膜 Transwell 小室(Corning公司),在上层小室中加入5×104个中性粒细胞,使其悬浮在无血清的DMEM 培养基中(美仑公司);在下层培养皿中加入2×105个AEC Ⅱ,分别用 DMSO、LPS 或 LPS+PAI-039 处理 2 h。收集迁移到下层小室的中性粒细胞并计数。去除上室后,AEC Ⅱ继续培养24 h,用0.4%台盼蓝在室温下孵育5 min,对死细胞进行染色,在显微镜下对台盼蓝染色阳性的细胞进行计数并计算其所占比例。
1.7 免疫印迹试验 用细胞刮收集处理好的细胞,加入RIPA 缓冲液于冰上裂解30 min,4℃,12 000 ×g 离心 15 min。将上清液转移到 1 个新的离心管中,加入4×SDS 上样缓冲液,100℃,加热10 min。通过SDS-PAGE 电泳分离蛋白质样 品, 将 蛋 白 质 转 移 到 0.22 μm 厚 的 PVDF 膜(Millipore 公司)。该膜用5%脱脂牛奶封闭1 h,用特异性抗PAI-1(ab222754,Abcam 公司)、Flag(F3165, Sigma 公司)、磷酸化 STAT3(Tyr705;9145, Cell Signaling Technology 公 司 )、 磷 酸 化STAT3(Ser727;9134, Cell Signaling Technology公司)、STAT3(30835, Cell Signaling Technology公司)、Actin(66009-1-Ig, Proteintech 公司)抗体于4℃孵育过夜。隔日,吸除液体,TBST 清洗3 次,每次间隔 15 min,然后加入HRP 结合的亲和山羊抗兔IgG(H+L;SA00001-2, Proteintech公司)和HRP 结合的亲和山羊抗鼠IgG(H+L;SA00001-1, Proteintech 公司)室温孵育 1 h,TBST清洗3次,每次间隔15 min,使用ECL发光液显影。1.8 统计学处理 采用 Graphpad Prism 5.0 分析数据,以x±s 表示,并采用双尾非配对t 检验。检验水准(α)为0.05。
2 结 果
2.1 LPS 对 AEC Ⅱ 的 PAI-1 的 激 活 和 促 分 泌作 用 CCK8 结 果(图 1A) 显 示,LPS 刺 激HEK293T 细 胞 的 IC50 为 0.1 μg/mL。 免 疫 印 迹法结果显示,外源性PAI-1 蛋白在HEK293T 细胞中成功表达(图1B);与PBS 对照组相比,LPS处理组HEK293T 细胞中PAI-1 表达量增加(图1C);LPS 处理后,PAI-1 蛋白能被偶联Flag 抗体的蛋白A/G 磁珠从培养基中纯化出来(图1D)。
CCK8 结果(图1E)显示,与PBS 对照组相比,LPS 刺激后,AEC Ⅱ的活力显著降低。免疫印迹法结果(图1F)表明,LPS 处理后,AEC Ⅱ中PAI-1 蛋白表达量显著增加。ELISA 结果(图1G)表明,LPS 处理后,分泌到细胞培养基中的PAI-1 增加(P<0.01)。
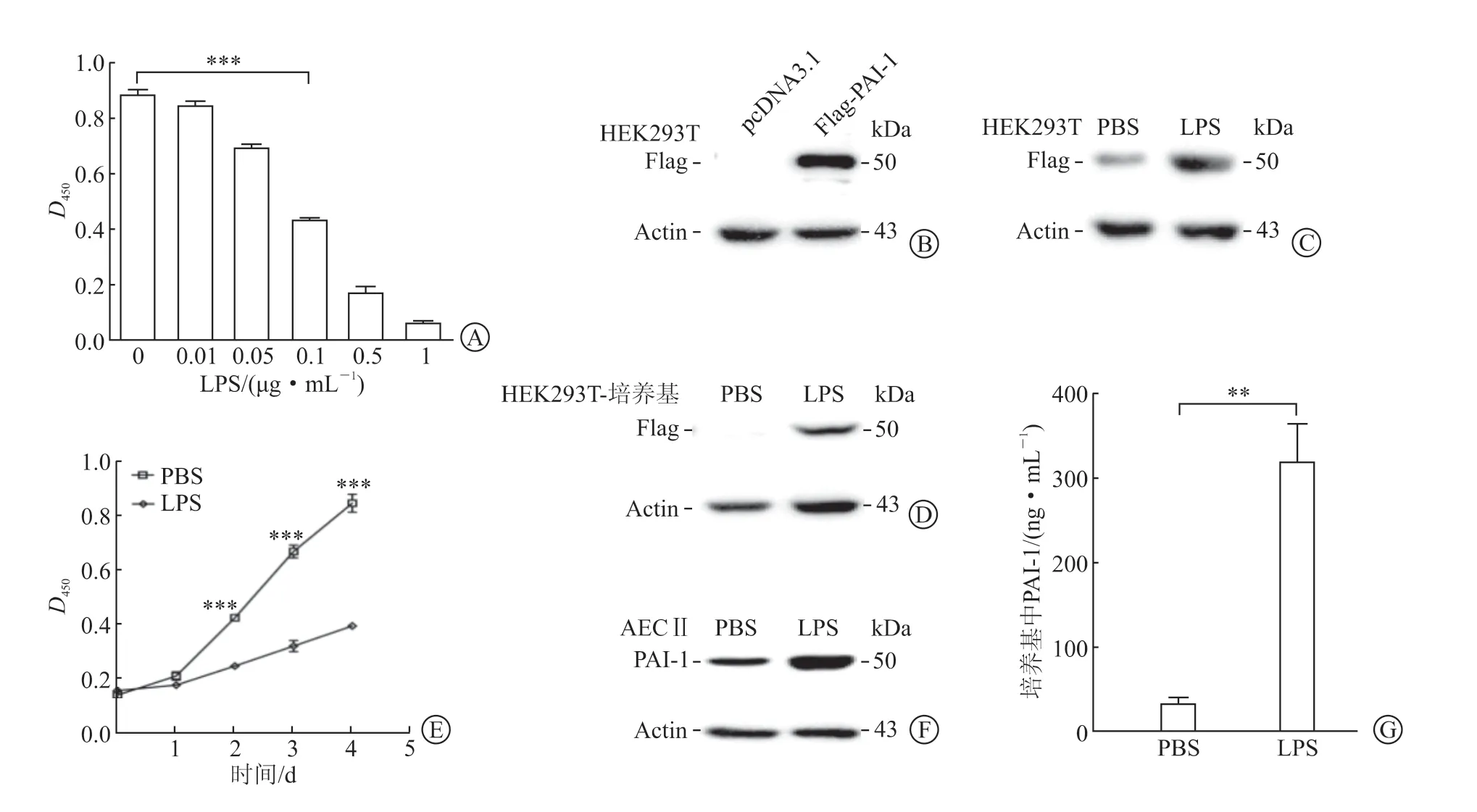
图1 LPS 对AEC Ⅱ细胞的PAI-1 的激活和分泌作用
2.2 PAI-039 对LPS 诱导的AEC Ⅱ细胞中PAI-1活化的抑制作用 免疫印迹法结果表明,与DMSO对照组相比,PAI-039 能显著抑制AEC Ⅱ中PAI-1的表达(图2A)及LPS 诱导AEC Ⅱ中PAI-1 的表达(图2B)。ELISA 结果(图2C)显示,PAI-039显著抑制LPS 诱导的PAI-1 蛋白分泌(P<0.01)。
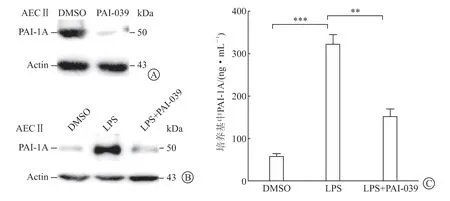
图2 PAI-039 对LPS 诱导的AEC Ⅱ中PAI-1 激活和分泌的抑制作用
2.3 PAI-1 招募中性粒细胞对LPS 诱导的AEC Ⅱ细胞损伤的促进作用 CCK8 结果(图3A)表明,PAI-1 显著增强中性粒细胞的活力(P<0.01)。Transwell 结果(图3B、3C)表明,PAI-1 重组蛋白能促进更多的中性粒细胞迁移到下层小室(P<0.01);LPS 处理组有更多的中性粒细胞迁移到下层小室(P<0.01);PAI-039 能显著抑制LPS 诱导的中性粒细胞迁移(P<0.01)。台盼蓝染色结果(图3D)表明,PAI-039 能显著减少LPS 诱导的AEC Ⅱ的死亡(P<0.001)。

图3 PAI-1 招募中性粒细胞对LPS 诱导的AEC Ⅱ细胞损伤的促进作用
2.4 PAI-039 对IL-6 分泌的抑制作用 ELISA 结果(图4A)表明,中性粒细胞培养基中加入PAI-1重组蛋白后,促炎症细胞因子IL-6 升高显著(P<0.01),MPO 和MMP-1 水平也升高(P<0.05)。ELISA 结果(图4B)表明,LPS 处理后,AEC Ⅱ中IL-6 水 平 升 高(P<0.001),MPO 和MMP-1水平升高(P<0.05);加入PAI-039 后,LPS 诱导的IL-6、MPO 和MMP-1 水平升高被逆转。

图4 PAI-039 对IL-6 分泌的抑制作用
2.5 抑制 PAI-1 或 STAT3 对 LPS 诱导的 AEC Ⅱ细胞损伤的减轻作用 免疫印迹法结果(图5A、5B)显示,与DMSO 对照组相比,LPS 处理后,AEC Ⅱ中STAT3 Tyr705 磷酸化水平显著升高,Ser727 磷酸化变化不明显;PAI-039 和AZD1480(JAK2 抑制剂)显著逆转LPS 诱导的AEC Ⅱ细胞中STAT3 Tyr705 磷酸化水平的升高。台盼蓝染色结果(图5C)表明,AZD1480 能改善LPS 诱导的AEC Ⅱ细胞损伤(P<0.01)。
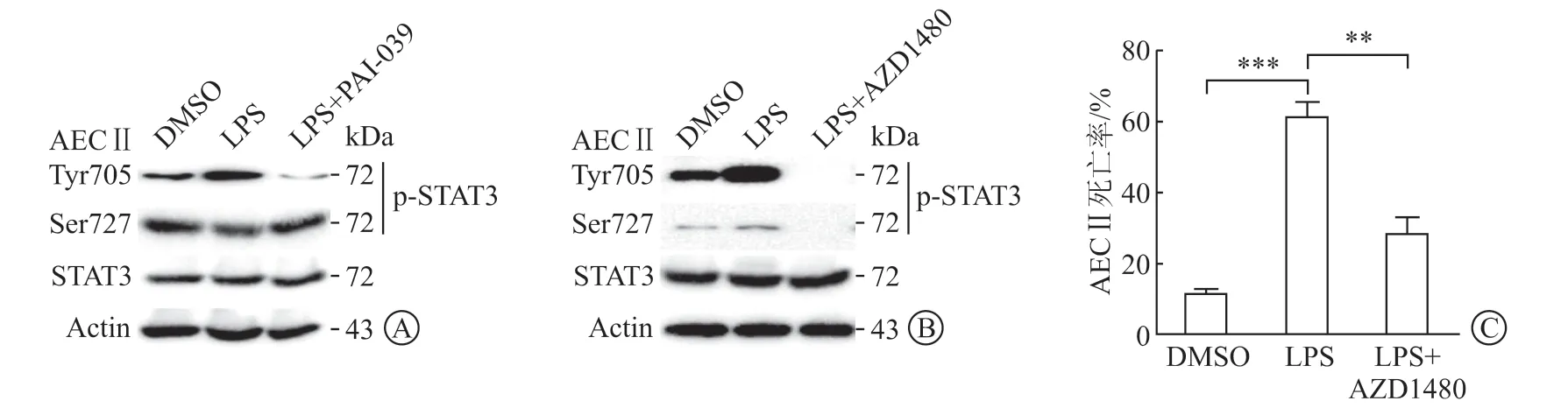
图5 抑制PAI-1 或STAT3 对LPS 诱导的AEC Ⅱ细胞损伤的减轻作用
3 讨 论
目前,纤维蛋白溶解和凝血系统与炎症系统之间的交互影响被证明在ALI/ARDS 的发生发展、严重程度和预后方面起重要作用[9],但是这2 个系统如何影响ALI/ARDS 患者的肺损伤,尤其是分子机制目前尚不明确。PAI-1 为纤维蛋白溶解和凝血系统的重要成员,与炎症系统共同影响ALI/ARDS的进展。本课题组既往研究[10]发现PAI-1 招募中性粒细胞富集,进而促进LPS 诱导的AEC Ⅱ细胞损伤,提示血浆中的PAI-1 水平升高与ALI/ARDS 的不良预后有关。PAI-1 主要在内皮细胞、肺上皮细胞和成纤维细胞中表达且表达量较低,在缺氧、氧化应激和LPS 诱导的炎症刺激等不同条件下表达量增加[13-14]。本研究中,采用LPS 刺激表达Flag-PAI-1 的HEK293T 细胞,初步证明LPS刺激能促进PAI-1 的表达及释放。进一步探讨PAI-1 在用LPS 诱导的AEC Ⅱ细胞损伤中发挥的作用和分子机制,结果表明,在LPS 刺激下,PAI-1 被激活并分泌到AEC Ⅱ的细胞培养液中,而PAI-039作为PAI-1 抑制剂,能阻断PAI-1 的激活和分泌,减轻LPS 诱导的肺上皮细胞损伤。该结果提示PAI-1是LPS 诱导肺部损伤的重要一环,而抑制PAI-1 可能成为ALI/ARDS 的潜在临床治疗方法。
Kwak 等[14]表明,中性粒细胞暴露于LPS 时被激活,而PAI-1 能通过激活JNK 来增强该效果,提示PAI-1 能招募中性粒细胞并促进其迁移到ALI/ARDS 患者的肺组织中,从而促进LPS 诱导的肺损伤。随后,该课题组进一步发现PAI-1 明显抑制了中性粒细胞的凋亡和胞葬作用[15],与Zmijewski的研究[16]相一致,说明PAI-1 可能作为一个“不要吞噬我”的信号来调控中性粒细胞。本研究中,PAI-1 重组蛋白明显抑制了中性粒细胞的死亡,同时能阻断中性粒细胞的激活和迁移,与上述研究一致。当AEC Ⅱ暴露于LPS 时,更多的中性粒细胞被招募到AEC Ⅱ细胞培养基中,此外,PAI-039 逆转了PAI-1 对LPS 激活中性粒细胞的增强作用,进一步证明PAI-1 是中性粒细胞招募的一个关键因素。对损伤的AEC Ⅱ进行染色发现,PAI-039 抑制了LPS 诱导的AEC Ⅱ细胞死亡。
既往研究[17-18]表明,当肺细胞被LPS 感染时,被招募的中性粒细胞会分泌促炎症因子,增加血管通透性,从而促进肺损伤。本研究在中性粒细胞中加入PAI-1 重组蛋白,ELISA 法检测发现IL-6 升高显著,由此推测IL-6 可能是PAI-1 激活中性粒细胞进而促进LPS 诱导的AEC Ⅱ细胞损伤的关键炎症因子。既往研究[19-21]表明,血清中IL-6 水平升高明显加重肺部炎症和纤维化,并导致ALI/ARDS预后变差。JAK 可以介导STAT3 的激活,从而干扰先天性和适应性免疫反应的启动[22];而且,在LPS 诱导的ALI 肺组织中STAT3 的磷酸化水平升高,与TNF-α、IL-1β、IL-6 等促炎症细胞因子有关[23]。本研究中,由PAI-1 招募的中性粒细胞中JAK 介导的 STAT3 Tyr705 位点(而不是 Ser727 位点)磷酸化增加,从而促进LPS 诱导的AEC Ⅱ细胞损伤;PAI-039 有效抑制了 STAT3 Tyr705 位点磷酸化,并减轻了LPS 诱导的AEC Ⅱ细胞损伤;此外,AZD1480 能抑制STAT3 的Tyr705 和Ser727磷酸化,并减弱了LPS 诱导的AEC Ⅱ细胞损伤,表明STAT3 激活是PAI-1 招募中性粒细胞富集进而促进AEC Ⅱ细胞损伤的关键环节,抑制STAT3的活性能改善PAI-1 募集中性粒细胞促进LPS 诱导的AEC Ⅱ细胞损伤。图6 为PAI-1 通过调控中性粒细胞-IL6-STAT3 轴促进LPS 诱导的AEC Ⅱ损伤的模式图。

图6 PAI-1-中性粒细胞-IL6-STAT3 轴对LPS 诱导的AEC Ⅱ损伤作用模式
综上所述,本研究表明,在LPS 刺激下,PAI-1 被激活并释放到AEC Ⅱ外,促进中性粒细胞募集,后者释放大量的炎症细胞因子IL-6,增加STAT3 的Tyr705 位点磷酸化,进而促进LPS 诱导的AEC Ⅱ细胞损伤;而PAI-039 抑制PAI-1 激活后,中性粒细胞募集减少,IL-6/STAT3 信号通路被抑制,LPS 诱导的AEC Ⅱ细胞损伤获得缓解。因此,PAI-1 是参与LPS 诱导肺损伤的重要分子,目前研究虽然仍处于起步阶段,但为ALI/ARDS 提供了新的视角和理论基础,并可能为临床提供以PAI-1 为靶点的临床干预思路。
利益冲突:所有作者声明不存在利益冲突。
