多环芳烃(萘)与聚苯乙烯微球联合对普通小球藻的急性毒性效应
2022-09-13张潇峮李立杰罗鸣钟
张潇峮 李立杰 彭 梦 柴 毅 张 辉* 罗鸣钟*
(1. 中国水产科学研究院长江水产研究所,农业农村部淡水生物多样性保护重点实验室,武汉 430223;2. 长江大学动物科学学院/农学院,荆州,434020)
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是一类由石油、农药等降解生成的具有生物积累性的持久性有机污染物(Persistent Organic Pollutants,POPs)[1],其在自然环境中广泛存在,因此PAHs在自然环境中的累积和环境效应受到高度关注[2,3]。萘(Naphthalene,Nap)是多环芳烃污染物的主要种类之一,其由2个苯环组成,具有较高水溶解性[4,5]。由于具有较高的辛醇-水分配系数,水体中的Nap多吸附在悬浮颗粒物上,悬浮颗粒物成了Nap的主要载体[6],而其中的Nap极易通过被水生生物吞食进入食物链,并逐级传递最终危害人类健康[7]。Nap已在水环境中被广泛检出,且其含量和占比均较高,是水环境中主要的PAHs污染物之一[8,9]。Meng等[9]于2019年调查了中国14个湖泊中PAHs的种类及含量,结果发现水体中Nap平均含量为6.25 μg/L,远远超过了欧盟2013/39/EU指令对萘的水环境质量标准(2 μg/L)[10]和加拿大保护水生生物的水环境质量指导值(1.1 μg/L)[11],已成为水域生态环境和人体健康的较大威胁。
当前,微塑料(Microplastics,MPs)作为一种新型污染物,其赋存特征已成为全球关注的热点环境问题之一[12—14]。塑料在物理作用、化学作用及光降解等因素下会分解成微塑料,即塑料颗粒<5 mm[15]。在不同自然环境介质中均已检测到MPs,包括大气、土壤、水体和沉积物等,而其分布范围也极为广阔,甚至是极地区域也有MPs存在[16—18]。MPs由于具备粒径小和比表面积大等特点,对水环境中的积累污染物可产生很强的吸附作用,又因其疏水性强且迁移率高,使其成为水环境中重金属[19,20]和有机污染物[21,22],尤其是PAHs和多氯联苯等持久性有机污染物[23—25]的优良载体。MPs与吸附在其表面的污染物形成复合污染,导致其对水生生物的毒性效应更加复杂。
浮游植物作为水生态系统的重要初级生产者,在淡水和海洋食物链中都起着十分重要的作用,易成为食物链中的污染物富集起点,而普通小球藻(Chlorella vulgaris)因其对污染物的敏感性,通常研究测定外源污染物对普通小球藻的生长影响,可以反映整个生态环境的综合效应[26]。而其分布广、繁殖速度快、生长周期短和人工培养条件下可大量繁殖等特点,使其成为水质检测的重要指示生物之一[27]。王琳等[28]研究发现,当MPs浓度达到5000 mg/L时可对小球藻生长产生显著抑制作用;沈国兴等[29]研究发现,Nap对普通小球藻的96h半最大效应浓度(EC50)为98.06 mg/L,对普通小球藻叶绿素含量有较强影响。但关于两者联合胁迫对普通小球藻急性毒性效应的研究尚未见报道。因此,本实验使用普通小球藻,研究了新型污染物MPs与多环芳烃类污染物Nap联合胁迫对普通小球藻的急性毒性效应,以期为评估自然环境条件下微塑料对共存有机污染物的生物累积及毒性效应提供科学依据。
1 材料与方法
1.1 实验材料
藻种: 普通小球藻购自中国科学院水生生物研究所淡水藻种库。
Nap (AR,98%)和二甲基亚砜(AR≥99%)购自上海阿拉丁生化科技股份有限公司。
单分散聚苯乙烯微球,粒径为(5.0±0.3) μm,密度为1.05 g/m3,变异系数≤4.5%,在乙醇中的膨胀率8%,购自无锡瑞格生物科技有限公司。
1.2 藻种扩培
普通小球藻在BG11培养基[30]中培养,并在光照培养箱(GZX-250BSH-Ⅲ,上海新苗医疗器械制造有限公司)中进行扩大培养,培养条件: 温度为(25±1)℃,光暗比为12h∶12h,光强为5000—8000 lx,每天摇动培养瓶3—4次,每隔1—2周转接,使藻类生长进入对数生长期。在整个培养过程,均经过灭菌处理。
1.3 毒性效应实验设置
Nap对普通小球藻的单一毒性效应将Nap溶于二甲基亚砜配置成一定质量浓度的母液。设置Nap对普通小球藻急性毒性试验的质量浓度梯度为50、75、100、125和150 mg/L,用培养基进行稀释,现用现配。选取处于对数生长期的普通小球藻藻液,离心3000 r/min,15min,蒸馏水重悬,再离心,重复3次,去除细胞表面吸附培养基营养盐,藻泥加入300 mL锥形瓶中,再加入培养液稀释已配置的Nap母液到所需质量浓度,培养藻液体积为100 mL,初始藻密度为6×105cells/mL,每组设3个重复,另各设未含Nap培养液的藻液作为空白对照和最高含量助溶剂对照组(助溶剂二甲基亚砜添加量≤0.1%),每天摇动培养瓶3—4次,实验周期为96h。
聚苯乙烯微球对普通小球藻的单一毒性效应聚苯乙烯微球浓度设置为80、160、240、320和400 mg/L,分别加入300 mL锥形瓶中,选取处于对数生长期的普通小球藻藻液,离心3000 r/min,15min,蒸馏水重悬,再离心,重复3次,去除细胞表面吸附培养基营养盐,接种初始藻密度为1×106cells/mL,培养藻液体积为100 mL,每组3个平行,每天摇动培养瓶3—4次,试验周期为96h。
Nap与聚苯乙烯微球对普通小球藻的联合毒性效应以单一毒性试验测得的Nap和聚苯乙烯微球对普通小球藻的96hEC50为基础,0.5×EC50(Nap)×0.5×EC50(MPs)=1 TU,经过预实验,两者的联合毒性实验梯度为0、0.3、0.6、0.9、1.2和1.5 TU,每组3个平行,接种初始藻密度1×106cells/mL,每天摇动培养瓶3—4次,实验周期为96h。经回归分析求得两者混合后对普通小球藻96hEC50。
1.4 生物量测定
通过在显微镜下用血球计数板进行藻细胞计数,以及在波长680 nm (OD680)下测定藻液光密度,建立不同藻细胞浓度和光密度之间的线性关系,实验中以测定的光密度和根据线性方程计算出的藻细胞浓度表示生物量,每24h在OD680检测各处理组和对照组藻培养液的吸光度[31]。
1.5 叶绿素a质量浓度测定
采用热乙醇法测定普通小球藻光合色素叶绿素a(Chl.a)。在2d、4d和6d取10 mL藻液借助抽滤装置通过0.45 μm醋酸纤维膜,真空泵压泵的压力维持在0.05 MPa,膜上多余水分抽干,将滤膜剪碎后放入加有10 mL 90%乙醇溶液的旋口刻度管中,75℃水浴锅中提取5min。对其提取液进行测定,用分光光度计读取其665和750 nm处的吸光读值。再向提取液加入1—2滴l mol/L盐酸,酸化8min后再次读取其665和750 nm处的吸光度值。
1.6 抗氧化酶活性的测定
96h时取50 mL藻液离心3000 r/min,15min,生理盐水重悬离心,重复3次,藻泥加入1 mL生理盐水和0.2 g氧化锆珠(R=0.05 mm),低温条件下在高效组织细胞破碎仪(Tissue Cell-distroyer D1000,湖北新纵科病毒疾病工程技术有限公司)破碎,5000 r/s,30s,间隙10s,重复3次,低温离心上清液为粗酶液。可溶性蛋白含量(TP)、丙二醛(MDA)含量、总超氧化物歧化酶(T-SOD)活性及过氧化氢酶(CAT)活性使用南京建成公司相应的试剂盒进行测定。
1.7 数据处理
生物量计算通过藻密度绘制生长曲线并计算抑制率(I)和比生长速率(K)。
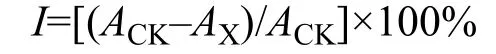
式中,I为抑制率;ACK指对照组的藻密度,AX指实验组的藻密度。
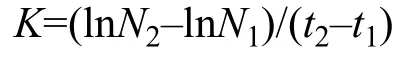
式中,K为比生长速率(/d);t代表生长时间(d);N2为t2的藻密度(cells/mL);N1为t1的藻密度(cells/mL)。
Chl.a含量计算根据下式,计算藻液中Chl.a的含量:
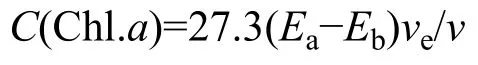
式中,C(Chl.a)为Chl.a的含量(μg/L);Ea为提取液酸化前波长665和750 nm处的光密度之差,Eb为提取液酸化后波长665和750 nm处的光密度之差,ve为乙醇提取液的体积(mL),v为抽滤的水样体积(L)。
联合毒性效应评价采用抑制率I转化为概率单位,以概率单位-浓度对数法,建立各时间段的抑制率和测试毒物间的线性回归关系,并求出EC50。
本试验分别用毒性单位法(TU)、添加指数法(AI)和混合毒性指数法(MTI)对联合毒性进行评价,具体公式如下:
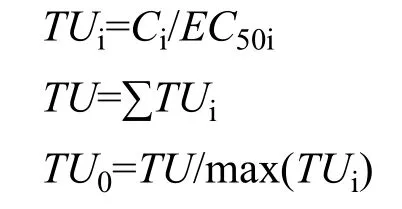
式中,Ci为混合物i的半致死浓度;EC50i为化合物i单独作用时的半致死浓度。
(1)毒性单位法(TU): 若TU=1,化合物之间呈相加作用;若TU>TU0,呈拮抗作用;若TU<1,呈协同作用;若TU=TU0,为独立作用;若TU0>TU>1,呈部分相加作用。
(2)添加指数法(AI): 当TU≤1.0时,AI=>(1/TU)-1;当TU≥1.0时,AI=1-TU,若AI>0,呈大于相加作用,若AI<0,呈小于相加作用,若AI=0,呈等于相加作用。
(3)混合毒性指数法(MTI):MTI=1-lgTU/lgTU0,若MTI<0,呈拮抗作用,若MTI=0,独立作用;若0<MTI<1,部分相加作用;若MTI=1,浓度相加作用;若MTI>1,协同作用。
数据统计分析实验数据为平均值±标准差(n=3),使用OriginPro 9.8和Graphpad Prism 8作图和SPSS 20.0进行方差检验和回归分析,P<0.05为显著性差异,计算出EC50的95%置信区间。
2 结果
2.1 普通小球藻藻密度与其光密度的线性关系
通过血球板计数得到普通小球藻藻密度(y)与其在680 nm下测定的光密度(x)的线性回归方程y=84.893x-0.3361,相关系数R2=1(图1)。
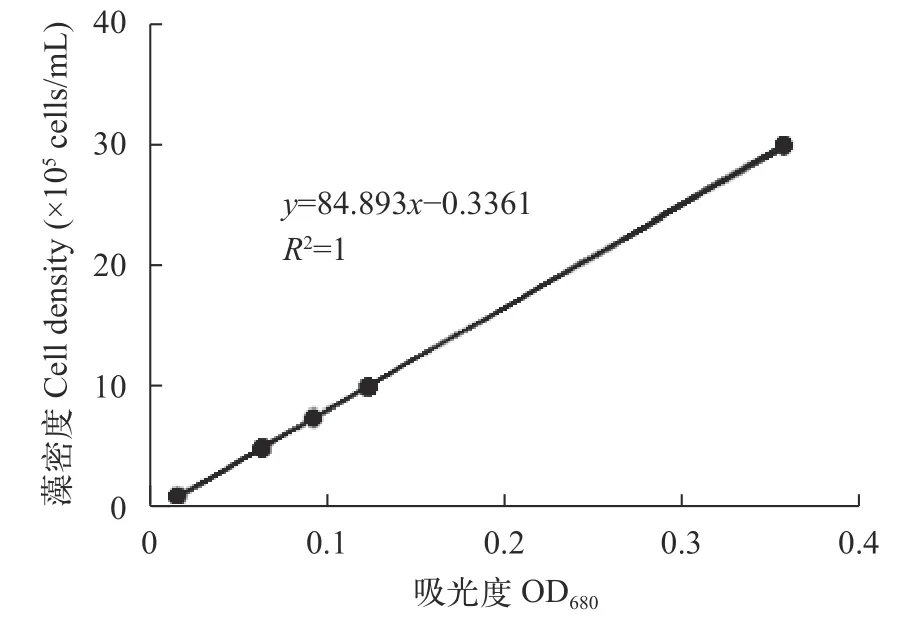
图1 普通小球藻藻密度与光密度关系Fig. 1 Relationship between C. vulgaris density and optical density
2.2 Nap胁迫对普通小球藻生长的影响
在Nap单一胁迫普通小球藻24h后,并未对普通小球藻生长产生显著抑制作用。48h后各浓度组普通小球藻密度显著下降,但50 mg/L浓度组抑制作用显著低于其他浓度组。至96h,50 mg/L浓度组普通小球藻密度显著上升,其抑制率显著低于其他浓度组(17.04%),而150 mg/L浓度组抑制率最高,达到68.26%(图2)。
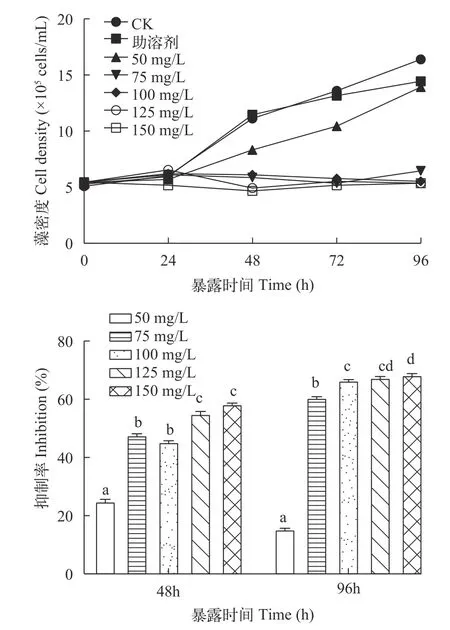
图2 Nap对普通小球藻藻密度变化的影响Fig. 2 Effect of Nap on the density variation of C. vulgaris
在96h实验中,随着Nap浓度的升高,各浓度组Chl.a含量呈现显著下降趋势,其中在100和125 mg/L浓度组之间无显著差异(P>0.05),150 mg/L浓度组抑制作用最强,其Chl.a含量最低(524.51 μg/L;图3)。
2.3 Nap胁迫对普通小球藻抗氧化酶活性的影响
Nap单一胁迫普通小球藻96h后,空白组和各浓度组细胞内TP、MDA、CAT及T-SOD的含量水平(图4)。 与对照组相比,各浓度组TP含量随着萘浓度的升高显著下降;50、75和100 mg/L浓度组对MDA含量并无显著影响,而125和150 mg/L浓度组MDA含量显著升高;各实验组CAT活性随着Nap浓度的升高显著下降;各实验组T-SOD活性随Nap浓度的升高总体呈显著下降趋势,但75和100 mg/L浓度组之间无显著差异。
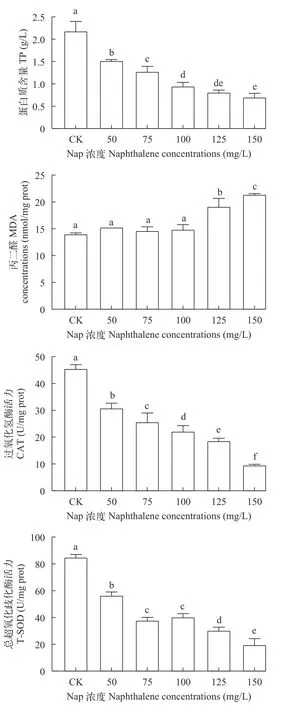
图4 Nap对普通小球藻TP、MDA、CAT及T-SOD的影响Fig. 4 Effect of Nap on TP,MDA,CAT and T-SOD of C.vulgaris
2.4 MPs胁迫对普通小球藻生长的影响
由图5可知,在所测浓度范围的MPs的胁迫下,各浓度组普通小球藻生长均受到抑制作用,并且随着时间的延长,生长抑制越明显。不同浓度组之间抑制率存在显著差异,其中80、160 和240 mg/L浓度组抑制率较低,在96h分别达到13.47%、18.86%和13.78%;320 和400 mg/L浓度组抑制率较高,其中320 mg/L浓度组在24h抑制率达到最高(75.36%),而400 mg/L浓度组在48h抑制率达到最高(78.36%),之后随着时间延长,在96h两组抑制率均有所下降(39.27%和 57.40%)。

图5 MPs对普通小球藻藻密度变化的影响Fig. 5 Effect of MPs on the density variation of C. vulgaris
由图6可知,MPs对普通小球藻Chl.a含量的影响与其对普通小球藻生长的影响呈现相似的变化规律。在96h实验中,随MPs暴露浓度的升高,各浓度组Chl.a含量呈现显著下降趋势,其中80和160 mg/L浓度组之间无显著差异,400 mg/L浓度组对Chl.a含量的抑制作用最强(737.10 μg/L)。

图6 MPs对普通小球藻Chl.a含量变化的影响Fig. 6 Effect of MPs on Chl.a content variation of C. vulgaris
2.5 MPs对普通小球藻抗氧化酶活性的影响
MPs单一胁迫普通小球藻96h后,空白组和各浓度组细胞内TP、MDA、CAT及T-SOD的含量水平(图7)。与对照组相比,各浓度组TP含量随着MPs浓度的升高总体呈显著下降趋势,但160和240 mg/L浓度组之间无显著差异;80、160和240 mg/L浓度组对MDA含量并无显著影响,而320和400 mg/L浓度组促使MDA含量显著升高;80、160和240 mg/L浓度组CAT和T-SOD活性均显著上升,而320和400 mg/L浓度组CAT和T-SOD活性均显著下降。

图7 MPs对普通小球藻TP、MDA、CAT及T-SOD的影响Fig. 7 Effect of MPs on TP,MDA,CAT and T-SOD of C.vulgaris
2.6 联合胁迫对普通小球藻藻密度的影响
在Nap和MPs联合胁迫下,各浓度组普通小球藻生长均受到抑制作用,并且随着时间的延长,生长抑制越明显。不同浓度组之间抑制率随着联合污染物浓度的升高呈显著上升趋势。联合污染物对普通小球藻生长的影响,呈现出明显的毒性-剂量和毒性-时间效应。胁迫96h后,1.5 TU浓度组抑制率最高,达到52.05%(图8)。
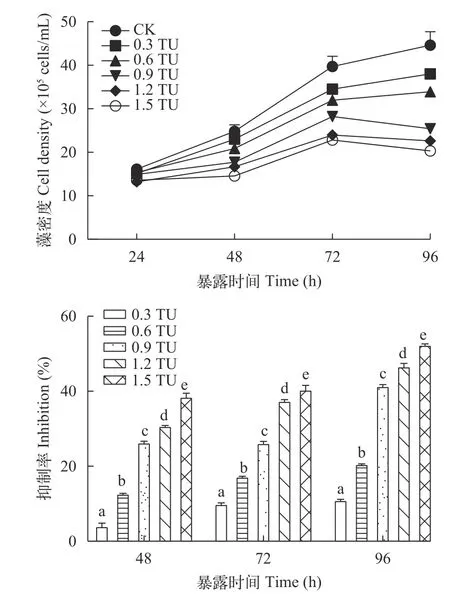
图8 Nap和MPs联合胁迫对普通小球藻藻密度变化的影响Fig. 8 Effects of combined stress of Nap and MPs on the density variation of C. vulgaris
Nap和MPs联合胁迫普通小球藻对Chl.a含量的影响,在96h实验中随着联合污染物浓度的升高,各浓度组Chl.a含量呈现显著下降趋势,其中0.3 TU浓度组未出现显著下降,0.6、0.9、1.2和1.5 TU浓度组Chl.a含量均显著下降,且在1.5 TU浓度组内达到最低(1.645 mg/L),1.2和1.5 TU浓度组间Chl.a含量无显著差异(图9)。
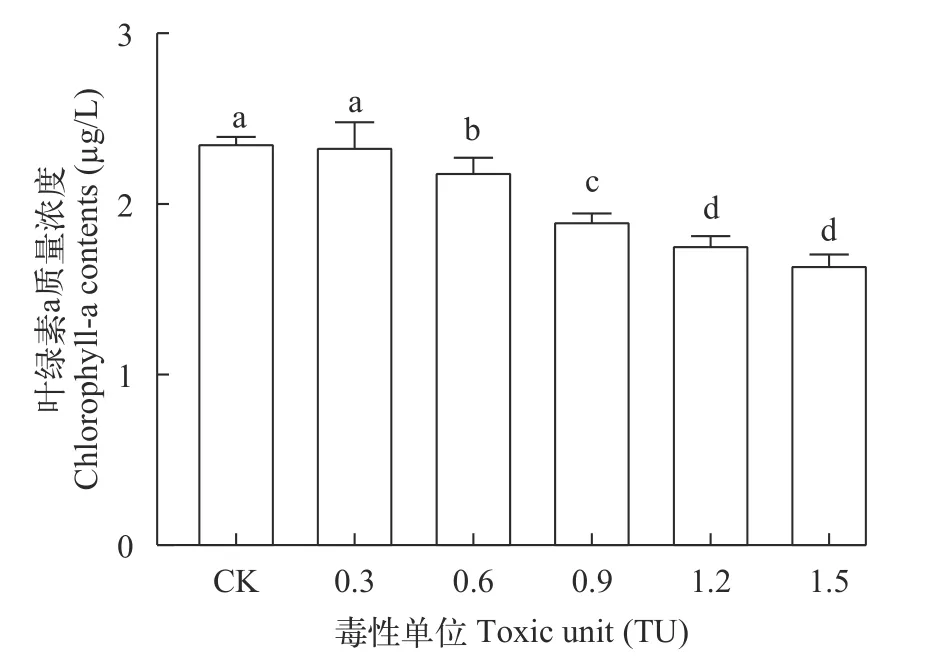
图9 Nap和MPs联合胁迫对普通小球藻Chl.a含量变化的影响Fig. 9 Effects of combined stress of Nap and MPs on Chl.a content variation of C. vulgaris
2.7 联合胁迫对普通小球藻抗氧化酶活性的影响
Nap和MPs联合胁迫普通小球藻96h后,空白组和各浓度组细胞内TP、MDA、CAT及T-SOD的含量水平(图10)。与空白组相比,各实验组TP含量随着联合污染物浓度的升高而显著下降,但0.3和0.6 TU浓度组之间无显著差异;0.3、0.6和0.9 TU浓度组MDA含量呈上升趋势,但差异不显著,而1.2 和1.5 TU浓度组MDA含量显著升高;CAT和T-SOD活性均随着联合污染物浓度的升高而显著上升,且在1.2 TU浓度组中达到最高值,之后随着联合污染物浓度的继续升高,CAT和T-SOD活性均有所下降,但最终CAT和T-SOD活性均显著高于对照组。
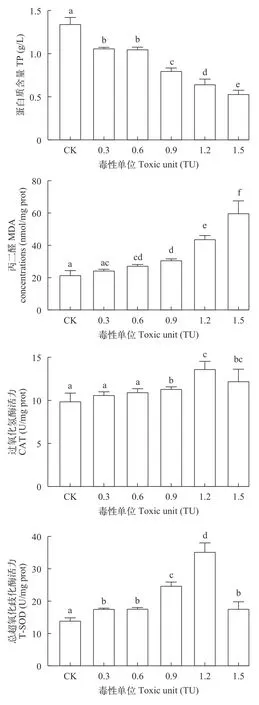
图10 Nap和MPs联合胁迫对普通小球藻TP、MDA、CAT及T-SOD的影响Fig. 10 Effects of combined stress of Nap and MPs on TP,MDA,CAT and T-SOD of C. vulgaris
2.8 毒性效应评价
采用概率单位-浓度对数法,求出Nap和MPs单一胁迫对普通小球藻的EC50-96h分别为81.35和383.3 mg/L,Nap较MPs对普通小球藻的毒性更强;两种污染物联合胁迫对普通小球藻的EC50-96h为1.320 TU。各污染物单一胁迫及联合胁迫的EC50拟合曲线见图11。采用3种联合毒性评价方法评价联合毒性效应,均显示当 Nap与MPs毒性比为1∶1时,两者对普通小球藻的联合毒性作用为拮抗效应(表2)。

图11 Nap和MPs单独及联合胁迫EC50拟合曲线Fig. 11 EC50 fitting curve of single and combined stress of Nap and MPs
3 讨论
3.1 Nap和MPs对普通小球藻的生长抑制
普通小球藻的生物量变化是污染物对普通小球藻生长抑制作用的直观体现,Chl.a是叶绿素中的重要组成部分,Chl.a的含量可以直接反映藻细胞的光合作用效率,并且与藻细胞量呈正相关[32],其含量变化也是污染物抑制作用的佐证。从两种污染物对普通小球藻 96h 生长抑制实验结果可以看出,Nap对普通小球藻生长抑制作用较强,抑制率最高可达68.26%,与对照组相比Chl.a含量下降55.51%;普通小球藻对MPs表现出一定的耐受性,MPs在48h对普通小球藻的抑制率可达到78.36%,而至96h时抑制率下降至57.40%,与对照组相比Chl.a含量下降51.86%;Nap和MPs联合胁迫普通小球藻的生长抑制作用显著降低,抑制率最高仅为52.05%,与对照组相比Chl.a含量仅下降30.08%。姜航等[33]研究了MPs和罗红霉素(Roxithromycin,ROX)对斜生栅藻(Scenedesmus obliquus)的联合毒性效应,发现MPs与ROX共同胁迫使斜生栅藻的藻细胞密度相较于对照组,实验组下降了13.3%,Chl.a含量下降了9.5%,但是与各污染物单独胁迫相比,MPs与ROX共同胁迫对斜生栅藻生长的抑制效果反而有所降低,与本研究结果相似。
3.2 Nap和MPs对普通小球藻的抗氧化酶活性影响
Nap和MPs单独及联合胁迫普通小球藻,TP含量均显著下降,与藻密度抑制现象呈现出较好的一致性。MDA是生物体内脂质过氧化的重要产物,通常用于反映生物体在受到外界刺激后的细胞氧化损伤程度[34,35]。在本研究中,普通小球藻在Nap和MPs单独及联合胁迫下,MDA含量逐渐上升,而在污染物浓度较高时显著增加,说明污染物造成了普通小球藻细胞内活性氧清除系统逐渐失去作用,不能有效地建立活性氧平衡,最终普通小球藻自身抗氧化系统无法清除高浓度污染物产生的活性氧自由基,致使MDA含量急剧上升,藻细胞受到氧化损伤。Jang等[36]研究增塑剂对红藻的影响时也发现了同样的规律。
作为抗氧化酶,SOD和CAT广泛存在于各种水生生物中,SOD通常与CAT联合作用,建立起生物体对活性氧物质的应激防御机制。本实验中Nap单一胁迫时,SOD和CAT含量整体呈显著下降趋势,与对照组相比,96h最高浓度组SOD和CAT含量分别下降76.86%和78.92%;MPs单一胁迫时,表现出“低促高抑”现象,与对照组相比,96h最高浓度组SOD和CAT含量分别下降88.07%和66.69%;两种污染物联合胁迫时,SOD和CAT含量总体呈上升趋势,虽然随着污染物浓度的增加有所下降,但96h最高浓度组SOD和CAT含量分别上升了26.23%和23.46%,表明萘和聚苯乙烯的联合胁迫并未完全破坏普通小球藻的应激防御机制。与本实验类似,马新刚等[37]研究发现,与草甘膦单一胁迫相比,纳塑料与草甘膦联合胁迫铜绿微囊藻(Microcystis aeruginosa)时,铜绿微囊藻细胞内SOD水平和活力均有显著提升。本实验不同污染物胁迫产生的SOD和CAT含量变化,说明Nap对普通小球藻毒性较强,低浓度即可造成普通小球藻的氧化损伤,而MPs对Nap毒性起到明显抑制作用。
3.3 Nap和MPs单独及联合胁迫毒性效应
本研究污染物毒性效应评价结果与生长抑制作用结果相符,毒性强度表现为萘>聚苯乙烯>联合胁迫。Zhu等[38]研究了4种不同类型的MPs和三氯生(TCS)联合胁迫肋骨条藻(Skeletonema costatum)的急性毒性效应,发现MPs的吸附使得TCS的疏水性增加,导致水体中的沉淀量增加,减少了TCS与肋骨条藻细胞之间的接触机会,进而降低了MPs和TCS的毒性;Zhang等[39]研究了氨基修饰的聚苯乙烯纳米粒子(nPS-NH2)和草甘膦联合胁迫对铜绿微囊藻(Microcystis aeruginosa)的急性毒性效应,发现nPS-NH2 对草甘膦的吸附作用显著减轻了草甘膦对铜绿微囊藻的毒性效应,nPS-NH2 与草甘膦联合毒性作用表现为拮抗。与上述研究结果相似,在本研究的联合胁迫实验中,MPs对Nap的吸附聚合作用可能使二者接触普通小球藻藻胞的几率均大幅降低,导致联合毒性效应并没有比单一毒性更加显著,两者对普通小球藻的联合毒性作用也表现为拮抗效应。微塑料的存在虽然可降低有机污染物毒性,在短期内体现出一定的保护作用,但是自然水域环境中,微塑料与多环芳烃类污染物极有可能是长期共存的,而它们对水生生物产生的长期联合效应尚未探究,因此有关微塑料与多环芳烃类污染物对水生生物的慢性毒性效应实验亟待开展。
