委内瑞拉减压渣油的热解特性及其动力学研究
2022-09-13李家州郭子千张玉明熊青安
李家州, 乔 沛, 郭子千, 张玉明, 张 炜, 熊青安
(中国石油大学(北京) 重质油国家重点实验室,北京 102249)
进入新世纪,全球石油资源需求量日益增长,而世界原油重质化和劣质化趋势不断增加,供需之间的矛盾不断加深。全球重油资源量巨大,约占剩余石油资源的70%以上[1]。中国原油品质大多中等偏重,500 ℃以上减压渣油的产率占40%~50%[2],并且中国石油资源消费巨大,2020年中国原油对外依存度已达到约72%。根据《BP世界能源统计年鉴2020》报道,2019年全球石油消费量日均增加90×104bbl,中国石油消费量日均增加68×104bbl(1 bbl=159 L)[3]。原油资源变重,原油加工过程中渣油的产量相应增加[4]。随着市场对轻质油品的需求量日益增加以及环保要求日益严格,如何实现重油的清洁高效利用已成为当前炼油工业面临的重大问题。
劣质重油(包括常压重油、稠油、超稠油以及原油加工过程中产生的减压渣油和油浆等)通常具有高残炭值、高碳/氢比、高黏度和密度、易缩合生焦等特性,这些特性对现有的重油加工技术提出了巨大挑战。重油改质工艺主要分为脱碳和加氢,脱碳工艺主要包括催化裂化、减黏裂化、焦化(延迟焦化、灵活焦化、流化焦化);而加氢工艺则包括加氢裂化、加氢精制、加氢脱硫等。焦化技术由于具有原料适应性强、灵活性好、脱碳率高和投资低等优势,已成为重油预处理技术和研究开发的热点[5]。热解是劣质重油热化学转化过程中的重要环节,研究重油热转化动力学对于理解热解过程、确定脱碳工艺参数具有重要意义,通过热解动力学可以深入了解反应过程及反应机理,预测反应速率、复杂程度和反应难易程度等,可为劣质重油相关工艺的开发和高附加值利用提供依据[6-7]。
常用的动力学分析方法可以分为模型法和无模型法[8]。模型法主要有Coats-Redfern[9]和Dolye等方法,需要先构建动力学模型,若选取不当会造成较大误差。无模型法(又称为等转化率法)主要有Friedman-Reich-Levi(Friedman)[10]、(FWO)[11]、Kissinger-Akahira-Sunose(KAS)[12]等,该方法避免了模型函数的选取,可获得较为准确的动力学参数。许多研究者倾向于利用一级动力学模型描述劣质重油的热转化反应[13-14]。高岱巍等[15]采用热重分析仪考察华北油浆的热转化过程,在温度为300~596 ℃内采用一级反应动力学方程拟合,计算得到的表观活化能约为108 kJ/mol。谌家豪等[16]采用一级反应动力学拟合3种催化油浆净化后的渣浆,其活化能分别为30.40、39.90和32.30 kJ/mol。Che等[17]研究伊朗减压渣油的热解行为及动力学,采用FWO法计算得到的活化能为160.00~217.00 kJ/mol。Zhang等[18]将脱油沥青热解过程分为两阶段,分别采用一阶积分模型计算活化能和指前因子,第一阶段225~425 ℃范围内活化能为37.69~47.91 kJ/mol,第二阶段425~528 ℃范围内活化能为110.00~121.33 kJ/mol。廖泽文等[19]对沥青质的热解动力学进行研究,采用Friedman法计算得到的活化能为159.00~455.00 kJ/mol。等转化率法将劣质重油热解反应视作单一组分反应,对于精确的反应模型和动力学参数分析可能会有一些系统误差。劣质重油是多种化合物的混合物,其热解反应是由多种反应综合构成的复杂过程,因此将其视为单一组分反应不能够准确描述其热解特性[20-22]。分布活化能模型(DAEM)法作为一种高精度的分析方法,其假设有许多具有不同动力学参数的若干一阶或n阶不可逆平行反应同时发生,通过对其若干伪组分动力学参数进行计算,如平均活化能、指前因子等,实现对复杂反应的分析[23]。DAEM法目前已经被应用于生物质[24-25]、煤炭[26-27]、油砂沥青[28-29]等多种复杂热解反应,但是对于减压渣油的相关研究还在探索过程中。高斯型DAEM法动力学参数之间有着很强的补偿效应,通常为了获得较好的拟合效果,需要对指前因子(A)采用试错法进行选择,从而导致表观活化能(E0)呈现出非唯一解的现象,即所谓的动力学补偿效应,因此通常将指前因子A视作常数,从而保证动力学参数的唯一解[30-31]。
笔者采用热重-质谱(TG-MS)联用技术研究减压渣油的热解反应特性以及气体产物释放规律。TG-MS联用技术已在生物质和煤热转化研究和利用中得到广泛的应用[32-38],而在减压渣油热转化中的应用则鲜有报道。基于热重数据,利用Friedman、FWO和KAS 3种等转化率方法对减压渣油的热解反应过程进行动力学分析,求取其热解动力学参数,并比较3种等转化率方法在减压渣油热解过程中的适用性;基于3种无模型动力学方法的结果,进一步使用分布活化能模型DAEM法对升温速率10 ℃/min条件下的热重分析(TG-DTG)数据进行拟合,获得与实验数据拟合程度较高的四组分高斯曲线及动力学参数,并通过计算获得活化能分布曲线,推测得到总活化能分布范围。
1 实验部分
1.1 实验原料
选取委内瑞拉减压渣油作为实验原料,由中国石油石油化工研究院提供,原料性质如表1所示。由表1可知:减压渣油在100 ℃时的运动黏度为19647.23 mm2/s,流动性很差;其康氏残炭值为21.15%,氢/碳原子比较低(1.41),这说明减压渣油的芳香结构含量较高,芳香环系的稠合程度较高,生焦倾向较大。胶质和沥青质含量所占比例较高,分别达到质量分数24.70%和12.41%,两者是渣油热裂解生焦的主要来源。

表1 委内瑞拉减压渣油的基本性质Table 1 Basic properties of Venezuela vacuum residue
1.2 实验装置及方法
采用日本SⅡ TG/DTA 7300型热重分析仪考察委内瑞拉减压渣油的热解特性。实验以N2作为惰性保护气和载气,N2纯度≥99.999%,其体积流量为80 mL/min,设定温度从30 ℃升高至800 ℃,采用的升温速率分别为5、10、15和20 ℃/min。实验中每次称取样品质量为4 mg左右,热天平自动记录样品质量的变化信号。实验开始前进行3次重复实验,保证数据相对误差小于5%,选取3次实验数据的平均值计算动力学参数。同时将热重分析仪和质谱仪(德国ThermoStar GSD 320型)联用,获取实时的气体释放信息。
1.3 减压渣油热解反应动力学分析
委内瑞拉减压渣油热解过程中质量损失反应转化率按照式(1)计算。
(1)
式(1)中:x为转化率;m0、mt和mf分别为样品初始质量、t时刻质量和热解终止质量,mg。
委内瑞拉减压渣油热解过程中反应速率方程按照式(2)计算。
(2)
式(2)中:t为委内瑞拉减压渣油热解时间,min;β为升温速率,℃/min;T为渣油热解温度,℃;k为反应速率常数,min-1;f(x)为反应机理函数。
反应速率常数k遵循Arrhenius定律,为:
(3)
式(3)中:A为指前因子,min-1;E为表观活化能,kJ/mol;R为气体常数,8.314×10-3kJ/(mol·℃)。
通常,动力学机理函数f(x)的积分形式为:
(4)
由式(2)~式(4)可得:
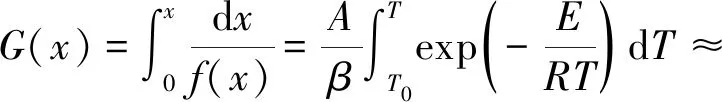
(5)
通过式(2)~式(5)可得以下通用公式[39-40]:
Friedman法:
(6)
FWO法:
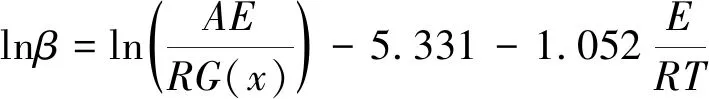
(7)
KAS法:
(8)
根据上述公式,对热重数据进行处理,分别以ln(dx/dt)、lnβ和ln(β/T2)对1/T进行线性拟合,根据斜率计算活化能。笔者将委内瑞拉减压渣油的热解反应机理函数视为一级反应[41],即f(x)=1-x,相应的G(x)=-ln(1-x),再结合拟合曲线截距,可求得指前因子。
一阶反应DAEM模型的方程式[24,42]如式(9)所示。
(9)
其中f(E)为反应活化能分布函数。
此时DAEM模型的待求变量实质上是A和f(E),其中常用的f(E)函数有高斯分布、logistic分布、指数分布和Weibull分布,采用最常用的高斯分布函数,分布函数如式(10)所示。
(10)
式(10)中:σ为正态分布里的标准差;E0为反应的平均活化能,kJ/mol。
为了减少动力学补偿效应的作用,其中指前因子A通常确定为固定值,因此可以得到DAEM的导数方程如式(11)所示。
(11)
式(11)中:T0为初始时刻的绝对温度,℃。
采用模式搜索法进行拟合的过程中,随着迭代次数的增加,当残差值(Residual error,Re)(见式(12))不再明显变化时即认为达到最优值,设定Fit作为评价模型拟合程度的拟合度偏差值(见式(13)),该值越低说明动力学参数的拟合效果越好。
(12)
(13)
式(12)和式(13)中:i为研究的数据点;n为数据点的个数;(dx/dT)max表示实验求出的转化率导数的最大值。
2 结果与讨论
2.1 委内瑞拉减压渣油热重分析
2.1.1 热重曲线分析
委内瑞拉减压渣油在升温速率为10 ℃/min下的TG和DTG曲线如图1所示。从图1可知,委内瑞拉减压渣油的热解反应温度区间较宽。由于减压渣油的沸点较高,因此在低于179 ℃范围较少发生热解,主要为吸附水分和气体的脱附;在179~300 ℃之间的质量损失较小,主要为渣油中的轻质组分裂解为低分子产物;在300~490 ℃之间的质量损失较大,此阶段包含基于自由基反应机理的减压渣油热转化反应,主要包括环烷烃和芳烃的侧链断裂,环烷烃的脱氢和开环,芳香烃的脱氢缩合,烃类中C—C键、C—H键和非烃类中C—杂原子键(如S、N)的断裂等[43]。高于490 ℃范围的TG和DTG曲线变化较为平缓,此阶段为炭化阶段,稠环芳烃脱氢缩合成焦炭,继续升温只有少量气体逸出导致质量损失的发生。减压渣油在升温速率10 ℃/min时热解主要反应温度段为179~490 ℃,总质量损失率为77.54%,DTG中的质量损失峰在446 ℃达到最大,最大质量损失速率为317.38 μg/min。
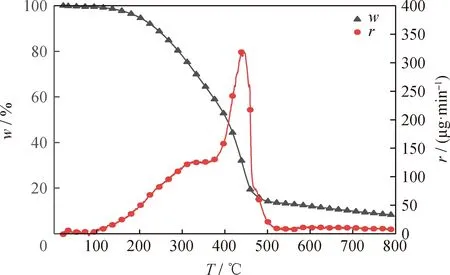
图1 委内瑞拉减压渣油的TG和DTG曲线Fig.1 TG and DTG curves of Venezuela vacuum residueHeating rate (β) 10 ℃/min
2.1.2 气体释放规律分析
当升温速率为10 ℃/min时,委内瑞拉减压渣油的热解气体(CH4、H2O、CO和CO2)释放规律如图2所示。图2(a)为CH4的逸出质谱曲线,从400 ℃起CH4析出量迅速增加,并在462 ℃时达到峰值,在500~800 ℃区间CH4析出量逐步降低。减压渣油中烷烃的断链和芳香烃、环烷烃及非烃类的侧链断裂会生成大分子的烷基自由基,部分烷基自由基与脱氢产生的氢自由基反应会生成大量的CH4[44]。图2(b)为H2O的逸出质谱曲线,从室温到300 ℃温度区间逸出的H2O主要为减压渣油物理吸附的H2O以及C—OH键断裂生成的H2O,其达到峰值的温度为177 ℃。在400~700 ℃温度区间内,出现H2O的第2个析出峰,这是因为C—O键断裂,其达到峰值的温度为463 ℃。由于C—O键的键能大于C—OH键的键能,故需要更高的温度才能断裂。减压渣油C—O键断裂生成H2O的强度明显大于C—OH键断裂生成H2O的强度,故其主要的含氧基团为C—O键[45]。图2(c)为CO的逸出质谱曲线,从热解初始阶段就有大量CO析出。在300~700 ℃温度区间内由于自由基断裂和缩合反应剧烈,出现CO的最大析出峰,其达到峰值的温度为459 ℃,接近DTG曲线的最大质量损失速率温度。图2(d)为CO2的逸出质谱曲线,从400 ℃时CO2析出量逐渐增加,其达到峰值的温度为456 ℃,减压渣油中羧基热稳定性差,高温条件下易发生脱羧反应而生成CO2[46]。
根据上述热解气体的实时释放规律,大部分热解气初始产生温度在400 ℃左右,结合委内瑞拉减压渣油升温速率10 ℃/min时的热重曲线,委内瑞拉减压渣油在400 ℃时的质量损失率为48.13%,其整体热解过程的质量损失主要是由于裂化和缩合作用。
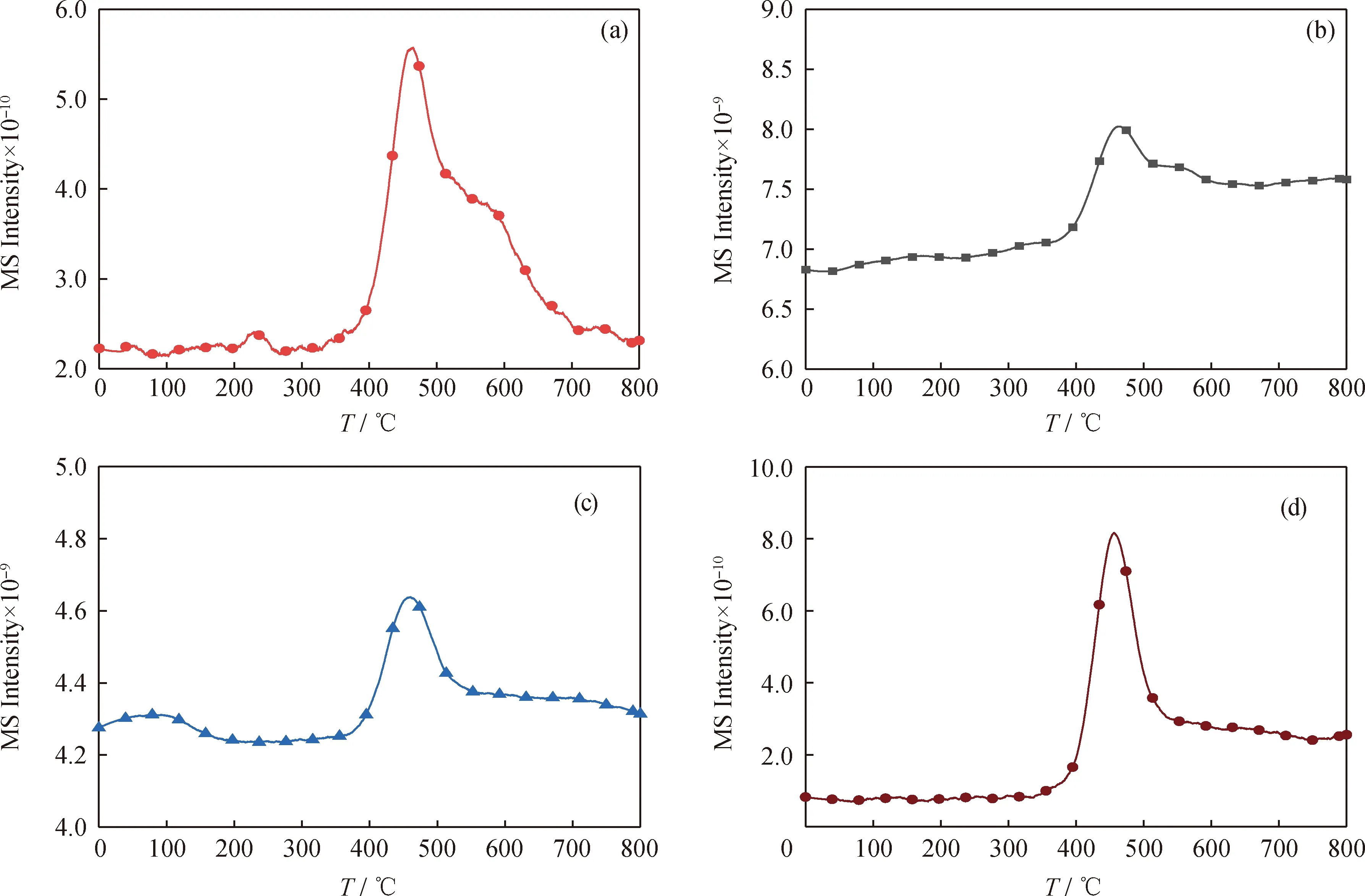
图2 委内瑞拉减压渣油的气体逸出质谱曲线Fig.2 Gas escape mass spectrometry curve of Venezuela vacuum residue(a) CH4; (b) H2O; (c) CO; (d) CO2
2.1.3 升温速率对热重分析结果的影响
委内瑞拉减压渣油在升温速率分别为5、10、15和20 ℃/min下的TG、DTG与温度之间的关系如图3所示。从图3可以看出,升温速率不同,某一时刻的质量损失量有所不同。由于升温速率不同,热量至外向内传递的速度就不同,升温速率较低时,样品受热充分,质量损失量大,重油热解的起始温度和终止温度较低[47]。升温速率越高,达到相同质量损失所对应的热解温度越高,DTG峰向高温方向移动。

图3 不同升温速率(β)下委内瑞拉减压渣油的TG和DTG曲线Fig.3 TG and DTG curves of Venezuela vacuum residue at different heating rates (β)(a) TG; (b) DTG
不同升温速率下对应的最大质量损失速率(Pmax)及其所对应的温度(Tmax)如表2所示。从表2可知,随着升温速率的增加,最大热解质量损失速率所对应的温度升高,产生热滞后现象[48]。另外,升温速率高,样品在特定温度下停留时间较短,完成整个热解过程所需要的时间减少。

表2 不同升温速率(β)下最大质量损失速率(Pmax)及其对应的温度(Tmax)Table 2 Maximum mass loss rate (Pmax) and its correspondingtemperature (Tmax) at different heating rates (β)
2.1.4 转化率与温度的关系
图4为委内瑞拉减压渣油在不同升温速率下热解转化率与温度的关系。从图4可知,相同转化率下,反应温度随升温速率的增加而增高。在相同温度下,升温速率越小,反应转化率越大。
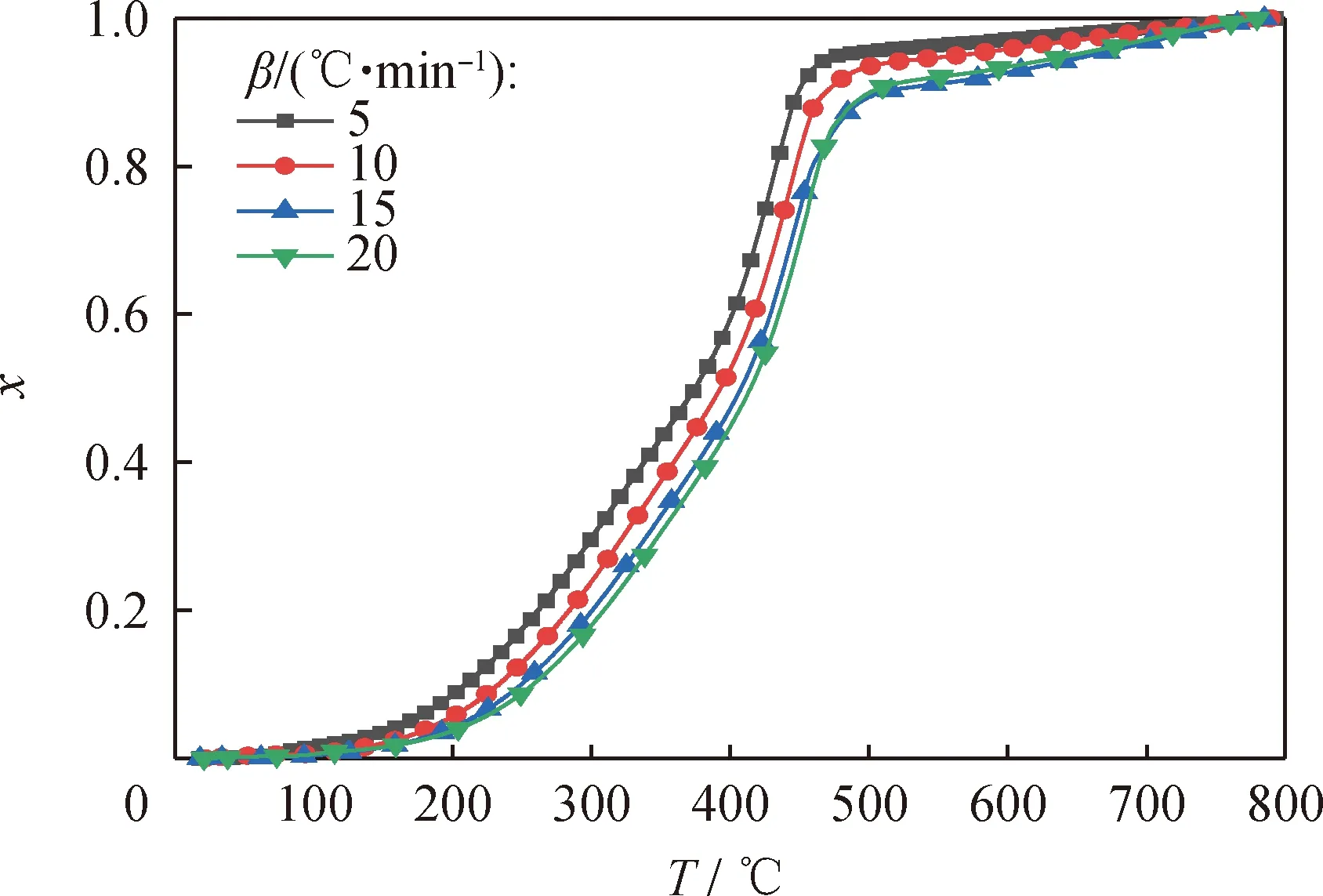
图4 委内瑞拉减压渣油在不同升温速率(β)下热解转化率(x)与温度(T)的关系Fig.4 Relationship between pyrolysis conversion rate (x) and temperature (T) of Venezuela vacuum residue at different heating rates (β)
2.2 委内瑞拉减压渣油热解反应动力学分析
为了获得Friedman、FWO和KAS 3种模型的动力学关键参数,根据图4的实验数据,得到转化率x分别为0.1、0.2、…、0.8时委内瑞拉减压渣油对应的温度(T)、ln(dx/dt)、lnβ和ln(β/T2)值,然后分别以ln(dx/dt)、lnβ和ln(β/T2)对1/T进行拟合,得到不同转化率下的活化能和指前因子,拟合结果如图5所示。KAS法和FWO法对式(5)在0到T温度区间内进行了近似温度积分,这导致随转化率变化的活化能在积分区间内被“平均化”,会产生一定的计算误差。表3列出了通过Friedman法、FWO法和KAS法求得的动力学参数。由于转化率高于0.8时的相关系数较低,因此不作考虑[49-50]。从表3可知,在转化率0.1~0.8范围内,3种模型线性拟合程度均较高,R2都在0.96以上,计算得到的委内瑞拉减压渣油平均活化能分别为131.37(Friedman法)、115.25(FWO法)和110.69 kJ/mol(KAS法)。
委内瑞拉减压渣油通过3种等转化率方法获得的活化能与转化率之间的关系曲线如图6所示。从图6可知,减压渣油的活化能不是恒定值,这是由于重油热解是一个复杂的多步反应过程,不同的反应需要的能量不同[51]。在热解过程中,重油四组分活化能由小到大顺序为饱和分、芳香分、胶质、沥青质[52]。在反应初期,劣质重油分子中不稳定的键(以富含直链烃类的饱和分为主)由于键能较低而首先发生断裂,反应的活化能较小。随着温度的升高,热解程度加深,分子中较强的键开始断裂,生成大量气体产物,反应的表观活化能增大。在相同转化率下,FWO和KAS法计算得到的活化能值相差较小,Friedman法计算得到的活化能值稍微偏大。这是由于FWO和KAS法是一种积分等转化率法,而Friedman法是一种微分等转化率法,而数值微分计算会放大实验噪声,导致Friedman法对实验噪声较为敏感[53]。
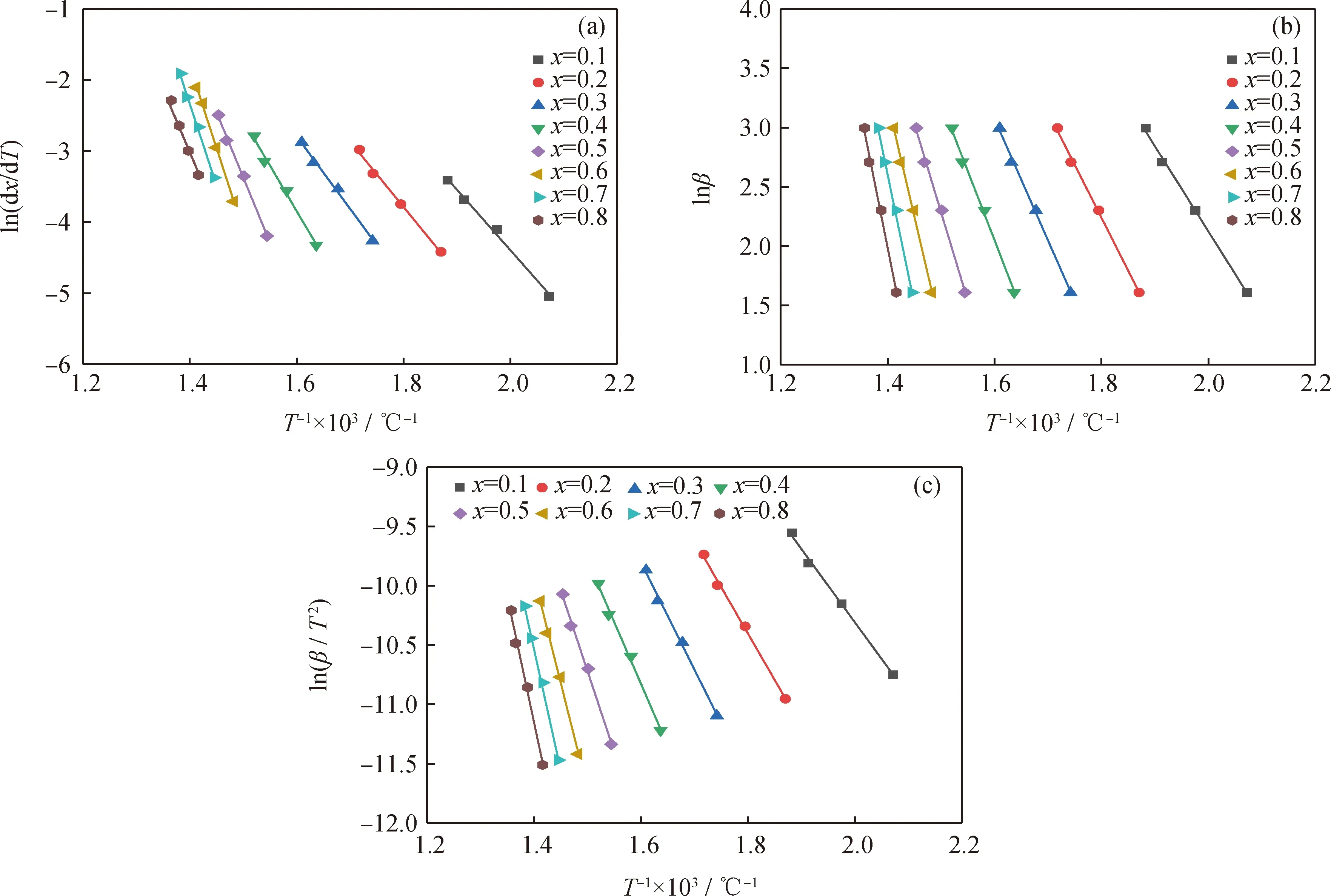
图5 Friedman、FWO和KAS法得到的委内瑞拉减压渣油拟合曲线Fig.5 Fitting curves of Venezuela vacuum residue obtained by Friedman, FWO and KAS methods(a) Friedman; (b) FWO; (c) KAS
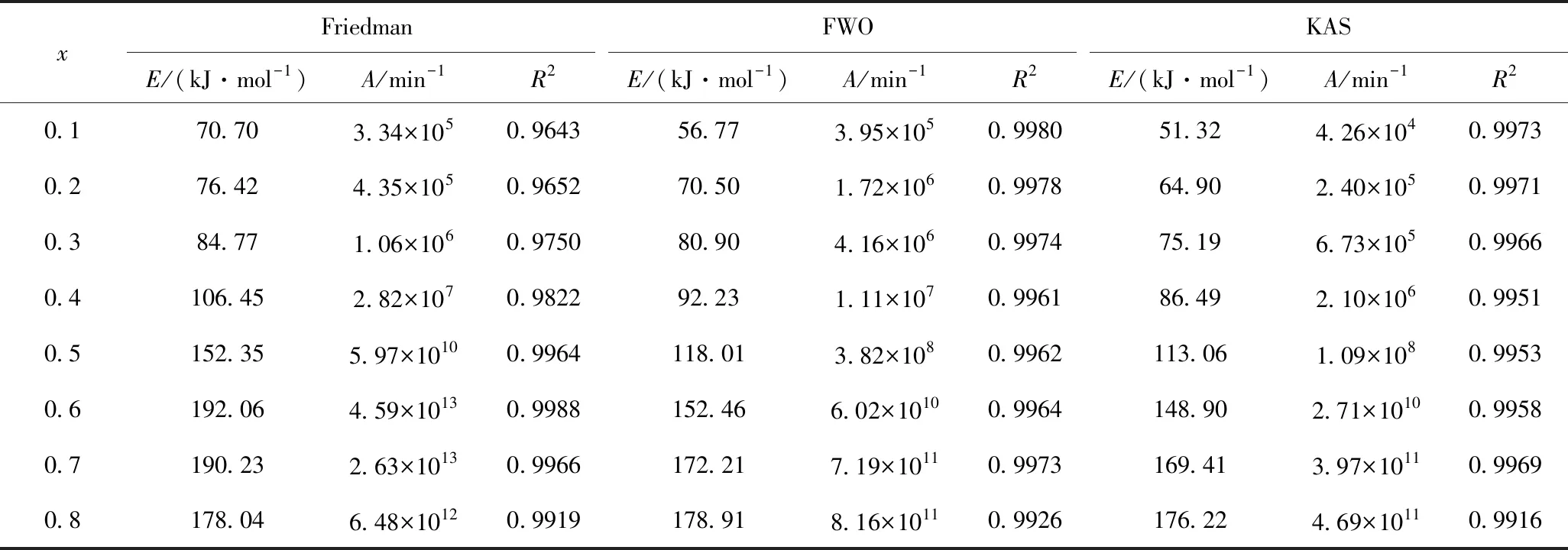
表3 由Friedman、FWO和KAS法得到的活化能(E)、指前因子(A)和相关系数(R2)Table 3 Activation energy (E), pre-exponential factor (A) and correlation coefficient (R2) obtained by Friedman, FWO and KAS methods
委内瑞拉减压渣油通过3种等转化率方法获得的动力学参数的范围见表4。不同方法计算得到的指前因子A和活化能E之间存在一定差距,这是由于动力学补偿效应造成的[54]。为了尽量减少动力学补偿效应带来的误差,应选择指前因子和活化能相差不大的方法。由于FWO和KAS法计算得到的动力学参数相差较小,但FWO法在温度积分时的精确度更高[39],故可采用FWO法求得动力学参数。采用FWO法计算得到减压渣油在转化率为0.1~0.8范围内的活化能为56.77~178.91 kJ/mol。
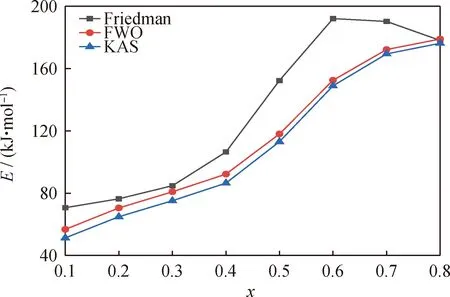
图6 3种等转化率方法获得委内瑞拉减压渣油的活化能(E)与转化率(x)之间的关系Fig.6 Relationship between the activation energy (E) and conversion rate (x) of Venezuela vacuum residue obtained by three iso-conversional methods
减压渣油主要由饱和分、芳香分、胶质和沥青质四组分构成,因此假设减压渣油包含4个未知化学成分,首先采用高斯DAEM模型对减压渣油在升温速率10 ℃/min下的TG-DTG数据进行分峰拟合,4个假定组分分别标注为Gauss-1、Gauss-2、Gauss-3、Gauss-4,分别对应饱和分、芳香分、胶质和沥青质,叠加峰标注为Guass,实验测量值标注为Experiment,各组分分峰结果如图7所示。将实验测量值曲线与4个假定组分叠加曲线进行比较,可以看出二者的拟合程度是非常接近的。
为了减少动力学补偿效应的影响,在拟合过程中预先设定饱和分、芳香分、胶质和沥青质的指前因子分别在1012、109、1015、1024的数量级内,分别对4个假定组分进行拟合。图8为减压渣油四组分DAEM模型动力学参数的计算结果。根据图8中动力学参数可以对4个假定组分各自的计算值曲线(分别标注为Calculation-1、Calculation-2、Calculation-3、Calculation-4)与实验值曲线(分别标注为Experiment-1、Experiment-2、Experiment-3、Experiment-4)作对比,可以看出各假定组分的计算值与实验值的重合度较高,拟合效果较好。

表4 3种等转化率方法获得的动力学参数Table 4 Kinetic parameters obtained by three iso-conversional methods
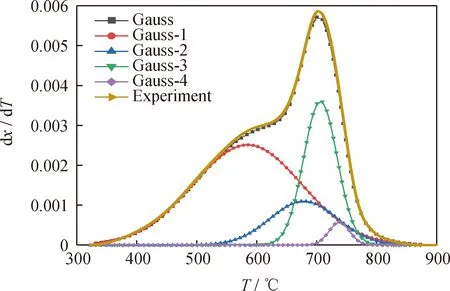
图7 委内瑞拉减压渣油四组分DAEM模型拟合曲线Fig.7 Four-component DAEM fitting curve of Venezuela vacuum residueHeating rate (β) 10 ℃/min
表5为四组分DAEM模型动力学参数及评价指标。从DAEM拟合结果可以看出,Fit值均小于2,能够基本满足拟合要求,且相关系数R2均在0.99以上,这表明DAEM模型对于减压渣油复杂的热解过程有着很高的适用程度。其次对计算得到的各假定组分的平均活化能进行对比后发现,4种假定组分呈现出E4>E3>E1>E2的规律,同时计算得到的各组分峰占比也基本符合委内瑞拉减压渣油4种组分的比例,这也说明了对于采用四组分DAEM模型进行拟合的正确性。
如图9所示,f(E)-1,f(E)-2,f(E)-3,f(E)-4分别对应四种组分的活化能分布曲线,将其叠加后得到委内瑞拉减压渣油整体的f(E)。委内瑞拉减压渣油的活化能主要分布在100~250 kJ/mol之间,并且在100~200 kJ/mol之间的活化能分布概率更高,对4种假定组分各自的活化能进行加权平均求和后,计算得到的委内瑞拉减压渣油的平均活化能为190.11 kJ/mol。相比于采用Friedman、FWO和KAS 3种等转化率法计算转化率为0.1~0.8范围内的活化能,DAEM法可计算重油(转化率0~1范围)的总热解反应活化能,因此DAEM求得的反应活化能更接近减压渣油实际的活化能范围。
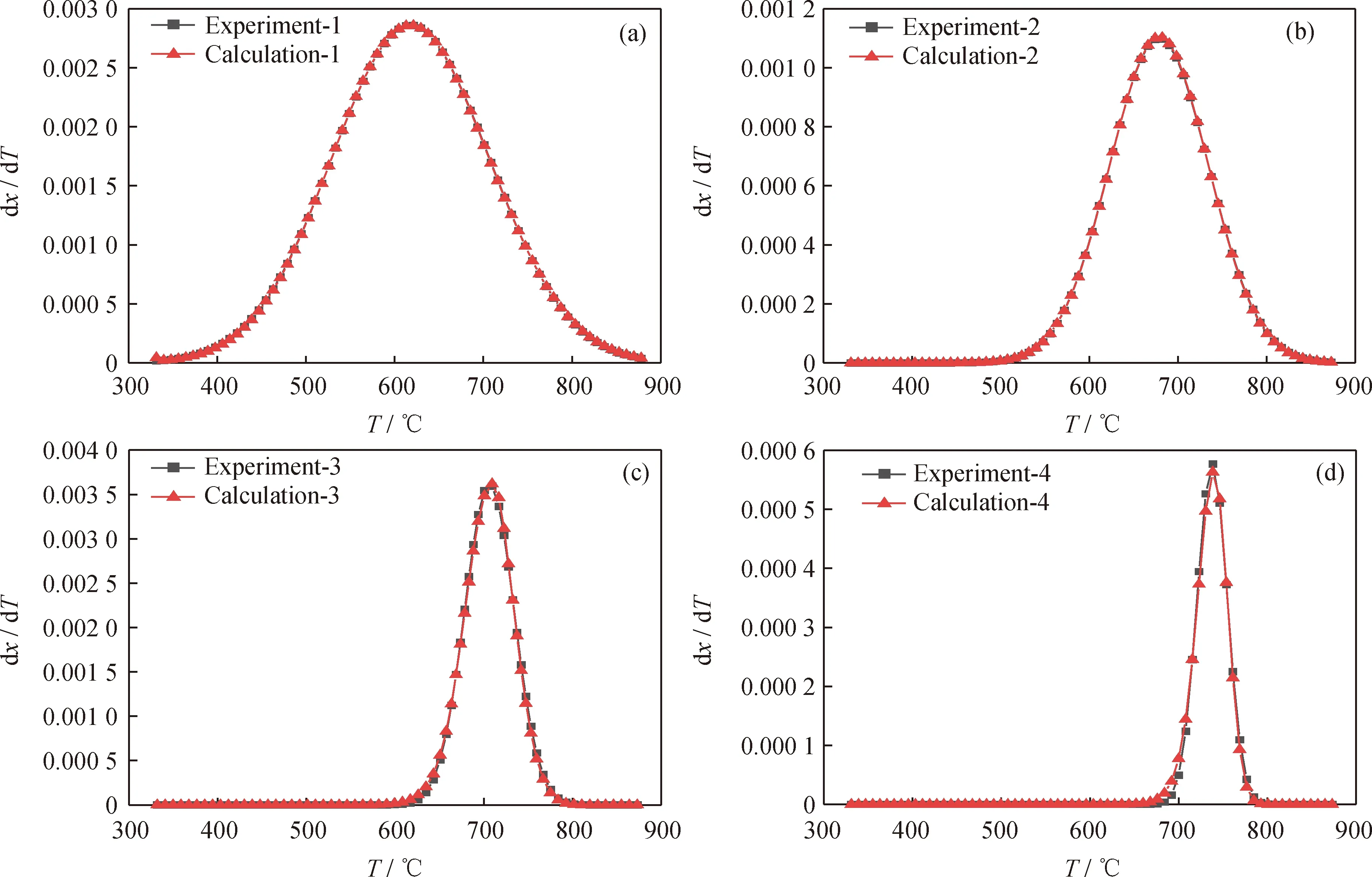
图8 委内瑞拉减压渣油4个假定组分各自的DAEM模型拟合结果与实验值的对比Fig.8 Comparison of DAEM fitting results of 4 hypothetical components of Venezuela vacuum residue with experimental values(a) Saturates; (b) Aromatics; (c)Resins; (d) Asphaltenes
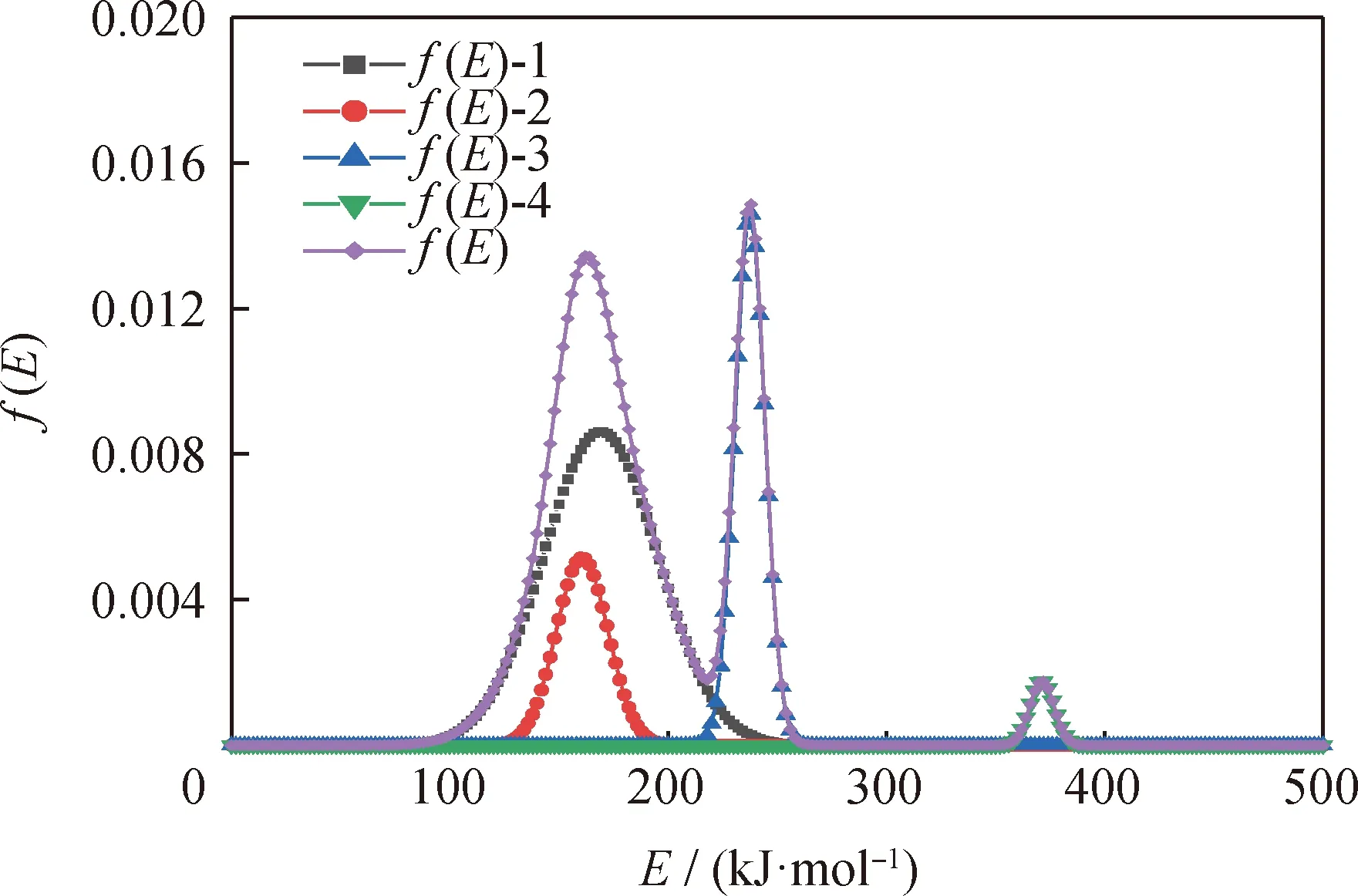
f(E)-1, f(E)-2, f(E)-3, f(E)-4 correspond to the activation energydistribution curves of the four components, respectively. Aftersuperimposing obtain the overall Venezuela vacuum residue oil f(E).图9 委内瑞拉减压渣油的四组分活化能(E)分布Fig.9 Distribution of four-component activation energy (E) of Venezuela vacuum residue
3 结 论
选取委内瑞拉减压渣油作为典型的劣质重油原料,采用TG-MS联用技术研究了不同升温速率下重油热解质量损失变化及气体释放规律;并采用Friedman、FWO和KAS 3种等转化率法和DAEM模型法对反应过程进行了动力学计算,求解了表观活化能及指前因子等动力学参数,所得主要结论如下:
(1)委内瑞拉减压渣油的热解反应阶段为179~490 ℃,总质量损失率为77.54%,质量损失峰在446 ℃达到最大,最大质量损失速率为317.38 μg/min。
(2)相比Friedman和KAS模型,FWO模型能更好地描述委内瑞拉减压渣油热解过程,采用FWO法计算的委内瑞拉减压渣油在转化率为0.1~0.8范围内的热解活化能为56.77~178.91 kJ/mol。
(3)利用DAEM模型法将委内瑞拉减压渣油分为4个假定组分进行分峰拟合,同时求取四组分动力学参数,并据此获得委内瑞拉减压渣油总活化能分布曲线,在升温速率10 ℃/min下活化能主要集中在100~250 kJ/mol范围内,通过加权求和获得平均活化能为190.11 kJ/mol,这与渣油实际热反应活化能更加接近。
