长链非编码RNA FTX通过PPARγ影响肠癌细胞的增殖、迁移和糖酵解
2022-09-13马晶晶杨金兰屈天银喻皇飞
马晶晶 杨金兰 屈天银 喻皇飞
遵义市第一人民医院(遵义医科大学第三附属医院)1检验科,2肿瘤科(贵州遵义 563000)
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤,发病率在我国呈逐年上升趋势,严重威胁人民群众健康[1]。在肿瘤生长过程中,随着瘤体逐渐增大及肿瘤内环境的改变,癌细胞利用葡萄糖供能从有氧糖代谢转向有氧糖酵解,使得其在相对缺氧的状态下适应环境的改变而持续增殖生长,从而产生瓦伯格效应(warburg effect),是实体恶性肿瘤的重大生物学特征之一[2]。所以,从癌细胞糖能量代谢的角度入手深入研究CRC 的发病机制,对健康中国战略下的CRC 防治具有重要意义。
长链非编码RNA(long noncoding RNA,LncRNA)是生物体内长度超过200 bp 的、不具备蛋白质编码功能的一类RNA[3]。研究[4]证实LncRNA 在肿瘤中异常表达,参与肿瘤的发生发展。LncFTX 是由位于X 染色体失活区域(X chromosome inactivation,XCI)的非蛋白质编码基因FTX(five prime to Xist)转录而来,由2 300 bp 组成[5]。FTX 在进化上高度保守,位于人染色体X q13.2 区域,曾一度被认为是“无用的废弃基因”。随着研究的不断深入,发现LncFTX 在恶性胶质瘤[6]、肝癌[7]、胃癌[8]以及肺癌[9]等多种肿瘤中作为促癌因子存在,刺激癌细胞的恶性生物学行为。LncFTX 同样在肠癌组织中异常表达[10],但其与肠癌细胞糖能量代谢之间的关系不是十分清楚。本研究拟探索LncFTX 在肠癌细胞中对葡萄糖代谢和癌细胞增殖迁移行为的影响,为深究其参与肠癌发生发展机制提供一定的实验依据。
1 材料与方法
1.1 细胞系与主要试剂肠癌细胞株HT-29、SW480、HCT116 以及正常肠黏膜上皮细胞株NCM-460细胞购自中国科学院上海细胞库;DMEM培养基、胎牛血清购自GIBCO 公司;转染试剂lipofectamine 2000 购自Invitrogen 公司;PPARγ、PDHA1、Glut4、TNF α、Leptin 兔抗人多克隆抗体均来自ABclonal公司;HRP 标记羊抗兔二抗来自武汉博士德公司,RIPA 裂解液购自上海碧云天生物技术有限公司,pcDNA3.1 PPARγ 过表达质粒及相应空载体购自湖南优宝生物科技有限公司;siRNAs 购自上海吉玛制药技术有限公司;PPARγ 激动剂Pioglitazone购自美国MCE 公司;果糖磷酸激酶(PFK)检测试剂盒、柠檬酸合成酶(CS)检测试剂盒、乳酸脱氢酶(LDH)检测试剂盒均购自南京建成生物科技有限公司。本研究经医院伦理委员会同意并批准。
1.2 细胞培养及转染肠癌HT-29、SW480、HCT 116 细胞株及正常肠黏膜上皮细胞NCM-460 细胞均用含10%胎牛血清的DMEM 完全培养基(含双抗)在37 ℃、5%CO2饱和湿度条件下培养。HT-29细胞转染前一天按2 × 104个/mL 密度种植于六孔板中,待细胞生长到一定密度(60%~70%)时,参照Lipofectamine 2000 试剂说明书的方法进行转染。分别将si-FTX、si-NC 及pcDNA3.1 PPARγ 及相应阴性对照质粒转染至HT-29 细胞中,同时设空白对照组。转染6 h 后换液,继续培养48 h。所用si-LncFTX 干扰序列:Forward 5'-GCUGAAACUUCAGUACUUATT-3',Reverse 5'-UAAGUACUGAAGUUUCAGCTT-3'。
1.3 实时荧光定量PCR取对数生长期细胞,严格按照RNA 抽提试剂盒说明书要求提取总RNA,进行核酸定量,然后按逆转录试剂盒说明书合成cDNA。最后按qRT-PCR 试剂盒说明书进行LncFTX 和PPARγ 检测。用2-△△Ct法计算两者相应mRNA 的表达。引物序列见表1。

表1 所用引物序列Tab.1 Sequence of primers used in the experiment
1.4 CCK-8 实验检测细胞增殖实验按CCK-8试剂盒操作说明进行,具体步骤如下:收集各组细胞,按5 × 103个/孔接种于96 孔板中,各组均设3个复孔,每孔加入90 μL新鲜培养液并加入10 μL CCK-8 溶液,轻微混匀,在37 ℃孵箱内孵育2 h,采用酶标仪测定各孔450 nm 处的吸光度(A450)值。统计分析时,将对照组的OD值标定为100%,根据实验各组与对照组的OD值比值,算出各组的相对增殖速度。以上实验做3 次重复。
1.5 Transwell 实验检测细胞迁移能力取处理好的HT-29 细胞,0.25%胰酶分别消化收集,无血清DMEM 培养基悬浮细胞,调整细胞浓度至3 ×105个/mL 备用。在24 孔板中预先加入800 μL 10%FBS 的DMEM 培养基,并放入Transwell 小室,1 h后在Transwell 上室分别接入200 μL 各组细胞悬液,37 ℃,5% CO2培养箱培养24 h 后取出transwell小室,用PBS 小心清洗小室,用70%冰乙醇溶液固定细胞后以0.5%结晶紫染液在室温条件下染色20 min,PBS 洗涤后用干净的棉球将上室一侧的未迁移的细胞擦干净,置于显微镜下观察拍照。
1.6 蛋白质印迹法(western blot,WB)收集经处理后的细胞,PBS 洗涤后每孔加入80 μL通用型蛋白裂解液提取蛋白,进行蛋白浓度定量。分别配制12%的分离胶、5%的浓缩胶进行SDS-PAGE凝胶电泳分离目标蛋白,PVDF膜转膜后利用5%脱脂奶粉封闭2 h;然后分别加入一抗PPARγ(1∶1 000)、PDHA1(1∶1 000)、Glut4(1∶1 000)、TNF-α(1∶1 000)、Leptin(1∶1 000)4 ℃过夜,用含Tween-20 的Tris-HCl 缓冲盐溶液(TBST)洗膜3 次,每次10 min;按1∶5 000 的比例加入HRP 标记的羊抗兔二抗,在室温下孵育2 h 后,TBST 洗膜3 次,用ECL 显色液显色,Image J 软件对条带进行灰度分析。
1.7 酶联免疫吸附试验(ELISA分析)按照PFK、
LDH、CS 检测试剂盒说明书进行各组细胞中PFK、LDH、CS 含量检测。多功能酶标仪测各组OD值,每组设三个复孔。受测样本OD=(测定OD-对照OD)/(标准OD-空白OD)。
1.8 统计学方法采用SPSS 20.0 软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,两组间比较采用独立样本t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 LncFTX 促进肠癌细胞的增殖和迁移利用
RT-qPCR 检测LncFTX 在正常肠黏膜上皮NCM-460 细胞和肠癌HT-29、HCT116 和SW480 三种不同瘤株细胞中本底表达,发现其在三种肠癌细胞中的表达均明显高于正常肠粘膜细胞。相比而言,LncFTX 在HT29 细胞中的本底表达水平最高(图1A)。故此选择在HT-29 细胞中利用siRNA 干扰LncFTX的表达(图1B),发现下调LncFTX表达后的HT29细胞的增殖(图1C)和迁移能力(图1D-1E)均受到了明显抑制。结果提示LncFTX 不仅在肠癌细胞中高表达,还参与了HT-29 细胞的增殖和迁移行为。
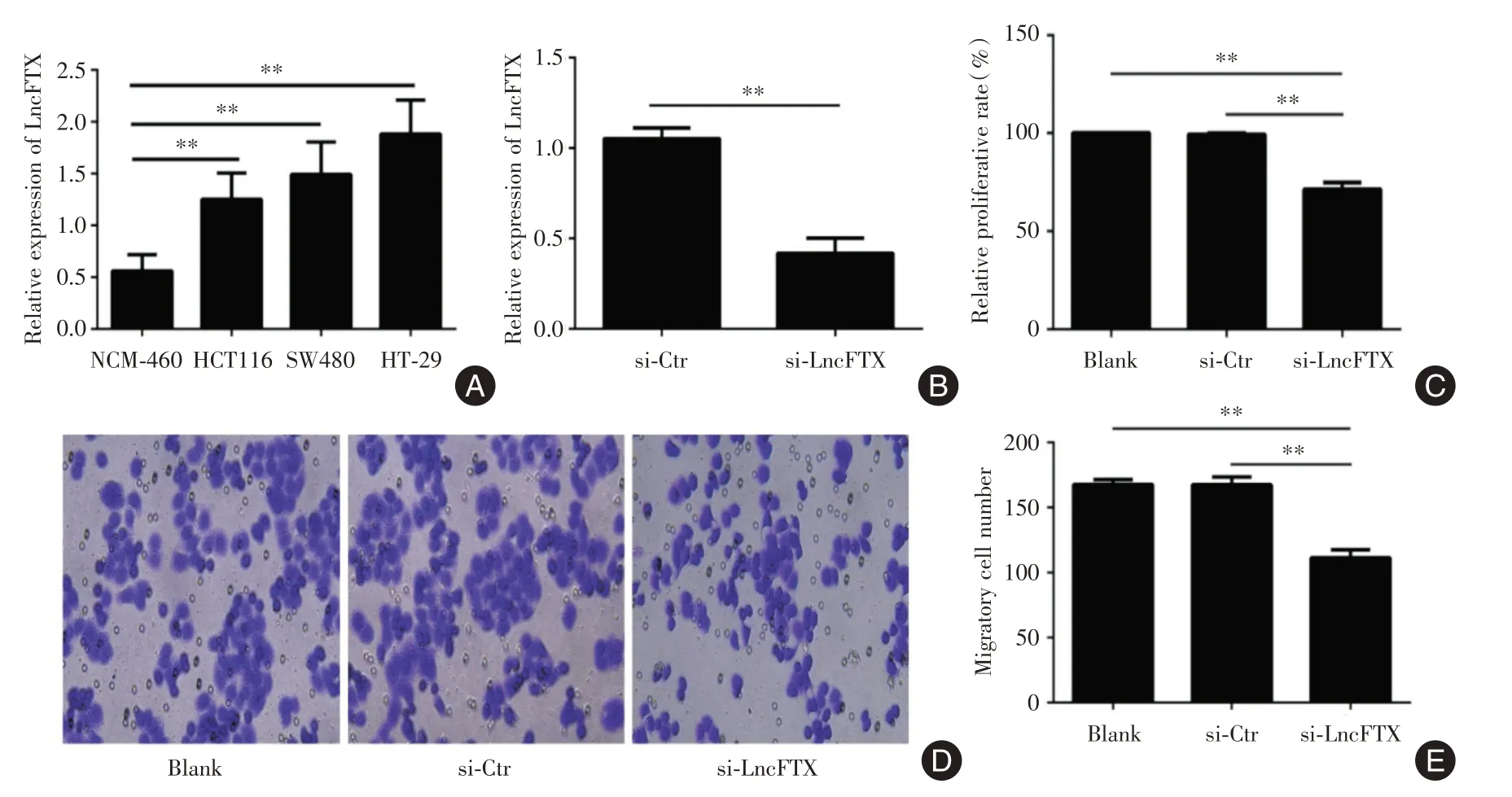
图1 LncFTX 促进肠癌细胞的增殖和迁移Fig.1 LncFTX promotes the proliferation and migration of colorectal cancer cells
2.2 LncFTX 促进肠癌细胞有氧糖酵解过程为进一步验证LncFTX 对HT-29 肠癌细胞糖能量代谢过程的影响,利用siRNA 下调LncFTX 表达后发现HT-29 细胞中Glut4 表达明显减少(图2A),但PDHA1 却明显升高。同时ELISA 检测细胞内PFK和LDH 的含量分别为(0.14 ± 0.02)U/mg 和(72.03± 14.64)U/L,均明显低于空白组和干扰对照组(P<0.05)。而CS 的含量则明显升高,从对照组的(4.22±0.20)U/mg升至(8.07±0.50)U/mg(P<0.05,图2B-D)。提示下调LncFTX 可能使得HT-29 细胞的葡萄糖摄入下降,细胞内乳酸生成减少,同时让细胞内的葡萄糖进入三羧酸循环代谢。

图2 LncFTX 促进肠癌细胞有氧糖酵解过程Fig.2 LncFTX promotes aerobic glycolysis of colorectal cancer cells
2.3 LncFTX调节PPARγ及其下游基因的表达通过生物信息学分析预测LncFTX 可能与PPARγ关联,提示LncFTX 对HT-29 细胞的糖能量代谢与其对PPARγ 的调控有关。进一步的实验发现下调HT-29 细胞中LncFTX 表达 后,PPARγ 无论是在mRNA 水平(图3A)还是在蛋白水平均较空白和对照组明显下降。而Leptin、TNFα 作为下游蛋白,受到PPARγ 的负调控,在LncFTX 被抑制后两者的表达则明显升高(图3B)。

图3 LncFTX 调节PPARγ 及其下游基因的表达Fig.3 LncFTX regulates the expression of PPARγ and its downstream genes
2.4 PPARγ 介导了LncFTX 对肠癌细胞的糖酵解干扰LncFTX 后的HT-29 细胞,经10 μmol/L Pioglitazone(PPARγ 特异性激动剂)处理后发现细胞内CS 的含量则由(7.11±0.54)U/mg 变为(4.21±0.27)U/mg,较si-LncFTX 组明显下降(P<0.05);而下降的PFK 及LDH 含量均得以有效逆转,分别从(0.10±0.01)U/mg、(61.37 ± 6.70)U/L 升至(0.14 ±0.02)U/mg、(100.83 ± 9.66)U/L,较si-LncFTX 组显著升高(均P<0.05,图4A)。为进一步验证PPARγ在糖代谢调节中的作用,利用过表达PPARγ 载体转染HT-29 细胞,结果发现PPARγ 能够明显激活PFK和LDH的活性,单纯PPARγ过表达组HT-29细胞内的PFK 和LDH 活性分别为(0.29 ± 0.02)U/mg和(170.43 ± 11.83)U/L,明显高于si-Ctr 组(0.16 ±0.01)U/mg、(109.07 ± 6.70)U/L 和si-LncFTX 组;CS的活性则明显受到抑制[(1.75 ± 0.35)U/mg],显著低于si-Ctr 组和si-LncFTX 组。但同时转染si-LncFTX 和PPARγ 组细胞中的PFK 和LDH 含量较单纯PPARγ 过表达组仍有所下降,其含量分别是(0.20 ± 0.01)U/mg 和(132.36 ± 11.24)U/L,而CS 含量却有升高[(3.07±0.08)U/mg,图4B]。
WB 实验也发现,通过过表达质粒转染或利用PPARγ 特异性激动剂Pioglitazone 上调HT-29 细胞中PPARγ 表达后明显可逆转LncFTX 对PPARγ 的影响,但其下游蛋白Leptin、TNFα 则出现与PPARγ相反的升高现象。Glut4的表达与细胞中PPARγ表达变化一致,但PDHA1 则在HT-29 细胞si-LncFTX时最高,PPARγ过表达及Pioglitazone 处理后有一定程度的下降(图4C)。这些结果均提示PPARγ 除对下游Leptin、TNFα 有明显影响外,还可调节代谢关键酶的表达参与肠癌细胞的糖耐量代谢过程。
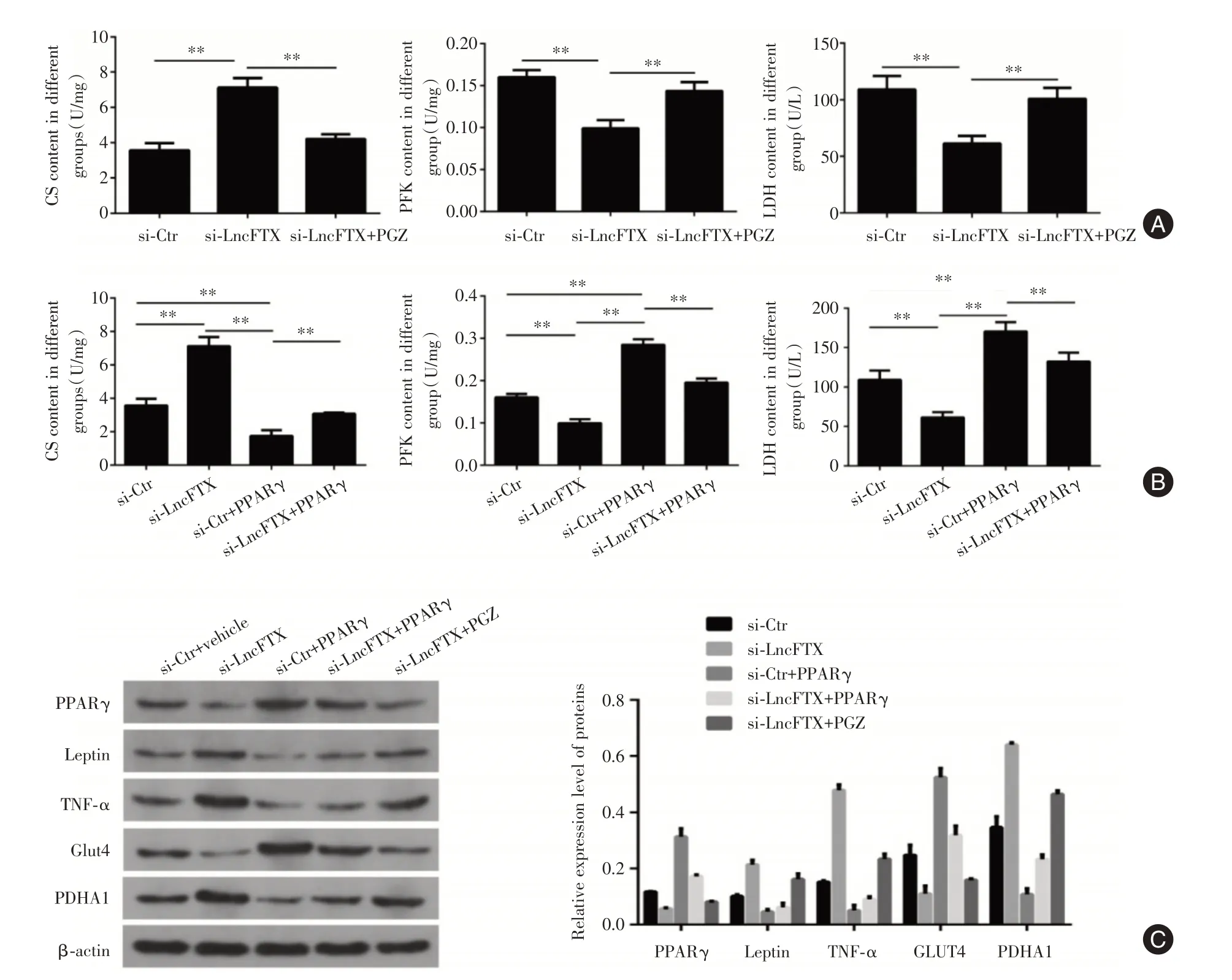
图4 PPARγ 参与LncFTX 对肠癌细胞的糖酵解Fig.4 PPARγ participates in the glycolysis of colon cancer cells induced by LncFTX
3 讨论
LncFTX 作为XCI 区域的非编码RNA 及重要的表观遗传调控因子,参与多种恶性肿瘤的发生进展[11]。本实验的研究结果也显示LncFTX 可作为肠癌的促癌因素而存在,除了促进肠癌细胞的增殖迁移外,还可调节癌细胞的糖酵解过程,改变肿瘤的能量供给,进而调控肿瘤的生长。
PPARγ 作为过氧化物酶体增殖物激活受体家族重要成员之一,PPARγ 还可以通过调控代谢途径促进肿瘤进程,被视为肿瘤治疗的潜在靶点[12]。TEW 等[13]发现,前列腺癌中抑制PPARγ 后,会降低其下游脂肪酸合成酶(fatty acid synthase,FASN)的表达,减缓前列腺癌的发展。在肝癌细胞中,PPARγ的激活能够增加糖酵解水平,最终促进肝癌的发生[14]。本研究结果显示,在肠癌细胞中PPARγ可作为LncFTX 的下游蛋白并受之调控,这与LI等[14]在肝癌中的研究相似,说明LncFTX 能够通过PPARγ 调控不同癌细胞的生长。利用siRNA 下调HT29 细胞中LncFTX 后,除PPARγ 受抑制外,介导葡萄糖转运的Glut4 表达下降,但PDHA1 的表达却明显升高。Glut4 是细胞葡萄糖摄取的重要转运蛋白,其表达异常可致使胃癌糖酵解发生和肿瘤进展[15],而PDHA1 作为丙酮酸脱氢酶复合体的关键亚基,活性的下降有利于细胞内有氧糖酵解(即Warburg 效应)[16],而其表达上调则可逆转癌细胞的Warburg 效应[17]。从随后对细胞内CS 及PFK、LDH 的活性和含量分析来看,LncFTX 通过PPARγ调节肠癌细胞的有氧糖酵解过程在过表达PPARγ或利用PPARγ 激动剂后得到部分逆转,也证实了PPARγ 在介导LncFTX 对肠癌糖酵解过程中的重要作用。
Leptin 作为PPARγ 下游的脂性因子,可反映细胞对胰岛素抵抗的敏感性,而TNFα 则在脂肪因子诱导的细胞炎性反应中起重要作用,两者均受PPARγ 的负调控[18]。在本实验中,HT-29 细胞中的LncFTX 表达被下调后,作为下游的Leptin 和TNFα 随着PPARγ 的抑制而升高,该现象在过表达PPARγ 后即被有效逆转,提示LncFTX 还有可能通过PPARγ 影响癌细胞的脂肪代谢过程。
LncFTX 对癌细胞生物学行为的调节多是通过海绵吸附不同miRNA 调控细胞内靶基因的表达而得以实现[7-9],本研究中LncFTX 对PPARγ 调控的分子机制是否涉及miRNA 的参与尚不清楚。本研究通过核苷酸序列比对分析发现LncFTX 与PPARγ 之间存在一定的互补结合序列的结果来看,LncFTX还有可能直接与mRNA 结合影响PPARγ的翻译过程。但LncFTX 对PPARγ 的影响究竟是直接与其mRNA 作用还是通过某些miRNAs 实现的,有待后续进一步的研究证实。
