仑伐替尼联合PD-1抑制剂治疗晚期肝癌的疗效及安全性
2022-09-13王璐孙小虎白静慧
王璐 孙小虎 白静慧
原发性肝癌起病隐蔽,患者初诊时多已处于中晚期,针对肝癌晚期患者根治性治疗切除手术往往难以开展[1-3]。晚期肝癌主要通过全身系统性治疗:包括化疗、分子靶向治疗及免疫治疗等[4-5]。既往研究表明,肝癌细胞对化疗具有较强耐药性,故目前的研究重点主要集中于分子靶向和免疫治疗[6]。研究证实,分子靶向药物仑伐替尼在发挥免疫抑制的同时可抑制肿瘤微环境的血管形成,治疗晚期肝癌成效显著[7]。此外,免疫治疗药物也已崭露头角[8-10]。其中,PD-1抑制剂通过阻断PD-1与PD-L1的细胞信号传导,导致肿瘤细胞的免疫监视逃避能力消失,免疫系统重新恢复对肝癌细胞的识别杀伤能力,从而达到肝癌治疗效果[11]。然而,临床研究显示,仅使用二者任一药物对患者的病情缓解效果不佳,由此科研人员将目光聚焦于靶向治疗联合免疫治疗[11]。本研究观察仑伐替尼联合帕博丽珠单抗对晚期肝癌患者的治疗效果及联合治疗的安全性,为临床研究提供更多数据。
资料与方法
一、研究对象
收集自 2019 年 1 月至 2021 年 1 月在中国医科大学肿瘤医院接受仑伐替尼联合帕博丽珠单抗治疗的晚期原发性肝癌患者。收集患者治疗期间相关临床数据,包括患者年龄、性别、Child-Pugh分级、是否有门静脉癌栓、是否有远处转移、HBV感染情况和治疗情况。
纳入标准:①年龄≥18 周岁;②明确诊断为原发性肝癌;③以RECIST1.1为标准,患者肝部有一个及以上可测量病灶;④以巴塞罗那分期(BCLC)为标准,患者符合C期表现;⑤以ECOG PS为标准,患者评分0~2分;⑥肝功能Child-Pugh A或B级(≤7 分)。排除标准:①有相关药物使用禁忌;②有器官移植或骨髓抑制史;③有心、脑和肺等重要器官严重的功能障碍;④伴有严重并发症。
二、治疗方法
给予仑伐替尼(Lenvatinib,卫材药业有限公司),体质量<60 kg的患者,口服8 mg/d;体质量≥60 kg的患者,口服12 mg/d。每周期(3周)首日静脉滴注200 mg帕博丽珠单抗 [MSD Ireland (Carlow), 注册证号S20180019]。
三、疗效评估
患者治疗期间,每2个月复查腹部磁共振增强扫描和胸部CT增强扫描,以评估肿瘤生长及转移情况。使用mRECIST标准评估肝内肿瘤[12],治疗效果以磁共振检查增强显影的病灶大小为评估依据。以RECIST1.1标准评估肝外转移病灶,淋巴结病灶短径≥1.5 cm,肺部转移病灶直径≥1.0 cm时符合可评估病灶。客观缓解率 (ORR) = [完全缓解 (CR) + 部分缓解 (PR)]/总病例数。局部控制率 (DCR) = [CR + PR + 疾病稳定 (SD)]/总病例数。以原发性肝癌相关死亡为研究终点,记录患者的中位无疾病进展时间 (mPFS) 及总生存期 (OS),分析患者预后主要影响因素。联合治疗期间,以CTCAEV4.03标准评估患者的不良反应。
四、随访
每周对患者进行一次电话或门诊随访,询问并记录患者血压和体质量变化,是否出现皮疹、疲劳和恶心呕吐等不良反应,收集患者的血尿常规、游离甲状腺素,肝肾功能检查的化验结果。随访至患者死亡或截止至2021年1月1日。
五、伦理学审查
此项研究通过了本院伦理委员会的审批,参与此项研究的所有患者均明确知情,自愿签署知情同意书,同意参与此项研究。
六、统计分析
采用SPSS 20.0软件分析数据。计数资料采用χ2检验,用Kaplan-Meier法绘制生存曲线,log-rank检验进行生存分析。
结 果
一、一般资料
48例患者中,男女比例为3.8:1,其中男性患者38例,女性患者10例;患者年龄20~76岁,平均 (56.1 ± 11.2) 岁,33例(68.75%)患者年龄超过50岁。35例 (72.92%) 患者合并肝硬化;39例 (81.25%) 患者合并乙型肝炎病毒 (HBV)感染,3例 (6.25%) 患者合并丙型肝炎病毒 (HCV) 感染;36例 (75%) 患者肝功能分级为Child-Pugh A级,12例 (25%) 患者为Child-Pugh B级。所有患者分期均为BCLC C期;28例 (58.3%) 患者AFP水平< 200 ng/mL,20例 (41.7%) 患者AFP水平> 200 ng/mL;15例 (31.25%) 患者存在Ⅱ型门静脉癌栓,8例 (16.7%) 患者存在Ⅲ型门静脉癌栓,6例 (12.5%) 患者存在Ⅳ型门静脉癌栓;25例 (52.08%) 患者有淋巴结转移,10例 (20.8%) 患者有腹腔转移,6例 (12.5%) 患者有肺转移;14例 (29.17%) 患者在此项治疗前接受过TACE或手术治疗。
二、近期临床疗效
根据RECIST疗效评价标准,并未有患者达到CR,22例 (45.83%) 患者肿瘤直径明显缩小,达到PR标准,14例 (29.17%)患者肿瘤维持稳定,可评为病情稳定 (SD),12例(25%)患者有疾病进展(PD)情况。ORR为22例 (45.8%),DCR为36例 (75.0%)。
三、远期临床疗效
mPFS为7.39个月 (95%CI: 5.88~8.92,见图1)。
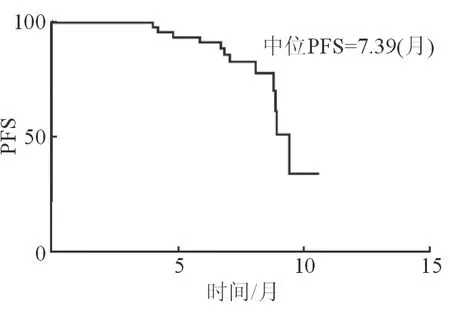
图1 远期临床疗效的中位无进展生存期情况
Kaplan-Meier生存分析显示,中位无进展生存期与患者年龄、血管侵犯类型、癌细胞是否远处转移、肿瘤是否多发、感染病毒的种类、患者是否存在肝硬化及患者AFP水平均无明显相关性 (P>0.05)。直至随访结束,有14例患者死亡,中位OS为14.39个月 (95%CI: 11.20~17.61,见 图2)。
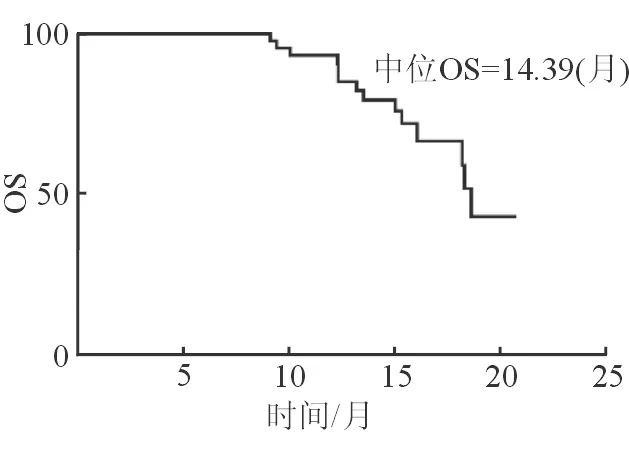
图2 远期临床疗效的中位总生存期情况
四、不良反应
52.08%的患者出现不同程度的不良反应。皮疹及疲乏是最常见的不良反应 (31.25%),其次为高血压 (27.08%)、腹泻 (12.50%)、尿蛋白 (12.50%)、食欲下降 (10.42%) 及甲状腺功能减退 (10.42%)。22例患者发生3级不良反应,其中6例患者有尿蛋白 (12.50%),4例患者发生3度高血压,2例患者疲乏明显。以上不良反应均给予相应治疗处理。所有患者未发生4级及以上不良反应 (表1)。

表1 联合治疗患者的不良反应情况
讨 论
近年来针对肝癌的药物研究发展迅速,其中靶向药物和PD-1抑制剂均给肝癌患者带来了一定的生存获益。靶向药以索拉非尼、仑伐替尼为代表,其中索拉非尼是一种多酪氨酸激酶抑制剂,主要靶点为VEGFR 1-3 、PDGFR、c-KIT和STAT3[13]。据文献报道,索拉非尼治疗晚期肝癌患者的中位OS为10.7个月, mPFS为5.5个月,不良反应高达80%,ORR仅2%[14-16]。同样作为多酪氨酸激酶抑制剂,仑伐替尼的主要靶点为VEGFR1-3、FGFR 1-4、PDGFRa、RET和KIT。有研究表明,仑伐替尼治疗肝癌患者的中位OS不劣于索拉非尼,且mPFS及ORR均优于索拉非尼[7]。与此同时,以纳武利尤单抗和帕博丽珠单抗为代表的PD-1抑制剂在晚期肝细胞癌治疗中的价值逐渐显现。纳武利尤单抗是PD-1抑制剂中第一款被批准用于肝细胞癌治疗的二线方案。据报道,单独使用纳武利尤单抗的患者ORR为20%,DCR为64%,中位缓解持续时间为9.9月,mPFS为 4.0个月[17]。作为另一PD-1抑制剂,帕博丽珠单抗是由FDA批准的第二个治疗肝癌的二线方案。有研究表明,帕博丽珠单抗治疗肝癌患者的ORR为17%,DCR为64%,mPFS为4.9个月,中位OS为12.9个月[18]。
尽管PD-1抑制剂在部分肝癌患者中有效,且不良事件可控,但其ORR仅20%,未达到统计学意义的生存获益。据文献报道,与分子靶向药物或PD-1抑制剂单药相比,仑伐替尼与PD-1抑制剂联合使用具有更好的抗肿瘤活性,不良反应均可耐受,是一种较为安全的治疗方式[19-20]。但相关研究数据较少且证据相对不足,后续临床研究意义重大。
本研究结果显示,仑伐替尼与PD-1抑制剂联合治疗的患者ORR为7.39个月,中位OS为14.39个月,与单用分子靶向药物或PD-1抑制剂相比能明显延长患者生存时间。联合治疗后患者皮疹的发生率较高,但给予皮炎平外涂且保持患者皮肤清洁和干燥,可显著缓解,所有患者无不可控的不良反应,安全性较好。因仑伐替尼联合PD-1抑制剂治疗应用于临床的时间较短,本研究纳入样本有限,无法进行统计学比较,因此,我们期待未来利用更多病例进行一线和二线治疗的生存差异分析。
