微针在雄激素性脱发治疗中的研究进展
2022-09-13张凡杨一诺
张凡,杨一诺
(1.北京积水潭医院毛发医学研究中心 皮肤性病科,北京,100035;2.北京大学医学部,临床医学院,北京,100191)
1 介 绍
雄激素性脱发(AGA)是雄激素介导的以进行性毛囊微小化、毛发生长期缩短为特点的脱发,是男性最常见的脱发类型。循环中包括二氢睾酮(DHT)在内的雄激素通过真皮毛乳头的毛细血管进入毛囊,与毛乳头细胞内的雄激素受体结合,抑制Wnt、Stat3和Shh,上调Dickkopf相关蛋白1和BMP41。Dkk-1是Wnt通路的有效抑制剂[2]。BMP4蛋白通过激活DKK通路抑制毛囊生长[3]。
目前研究最广泛的治疗措施是局部应用米诺地尔和口服非那雄胺,尽管部分患者毛发再生的效果显著,但仍有部分患者仅仅是减缓了脱发进程[4]。微针作为一种微创设备,可破坏皮肤的角质层,造成暂时性、含水的空洞,促进药物分子进入表皮[5]。许多研究表明,微针可促进毛发生长,增强局部疗法的渗透性,是雄激素性脱发的一项安全有效的辅助疗法[1,6-20]。
2 微针的作用机制
2.1 调节毛发生长周期
毛囊周期分为3个阶段:生长期、退行期和休止期;生长期即毛囊的生长阶段;退行期以毛囊的退行及退化为特点;休止期是毛囊的静息阶段,这一阶段会形成杵状发并最终脱落[21](见图1)。

图1 (改编自文献[21])毛囊的发育及周期
毛发生长的可能机制有二,一是调节毛发周期,二是形成新生毛囊[22]。微针治疗不足以造成全层厚度的伤口,有研究认为其通过微创伤刺激Wnt/β-catenin通路来促进毛发生长[15,23]。Kim等人24发现反复微针刺激可诱导小鼠模型的毛发生长,诱导Wnt3a、β-catenin、VEGF、Wnt10b的mRNA和蛋白质表达增加,而Wnt/β-catenin信号通路和VEGF均可诱导生长期,因此,微针治疗中的毛发生长更可能是调节毛发周期的作用而非新生毛囊再生所致。
大量分子信号作用于正常毛发周期的各个阶段。休止期毛囊向生长期的转变与 Wnt/β-catenin/Lef1、Sonic Hedgehog (Shh) 和STAT3通路的激活以及骨形态发生蛋白 (BMP) 信号传导的下调有关[1,3,25,26]。多项研究发现β-catenin在毛囊生长期高度表达,此阶段为毛囊形成和生长的起始[21,27-31]。
毛囊在休止期的维持有赖于静息毛囊干细胞的BMP信号增高[32,33]。毛发周期从休止期进入再生阶段需要逆转BMP介导的静息状态并通过Wnt信号激活上皮分化程序[3,33-36]。由于在休止期晚期真皮毛乳头表达BMP抑制剂(Noggin、Bambi、TGFβ2、Sostdc1),毛发基质内的BMP信号缺失[35-38]。一旦解除BMP的抑制作用,通过持续与真皮毛乳头接触可稳定核β-catenin,从而激活毛发基质细胞,促使其转变为增殖的短暂扩增细胞[35,39-43]。
SHH参与毛囊的形态发生和晚期分化,在胚胎毛发发育以及成人毛囊正常周期中发挥重要作用,并提示生长期的诱导[44]。隆突区的毛囊干细胞可感知毛发基质来源的SHH,从而完成自我更新并形成外毛根鞘[45,46]。SHH也指导真皮毛乳头通过分泌FGF7和10来促进毛发基质的增生和分化[35,45]。
Wnt通路被认为是毛囊形态发生过程中的主要调节因子,其通过EDA/EDAR/NF-κB信号传导,NF-κB调节Wnt通路,并通过上调SHH配体的表达发挥信号介质的作用[15,47]。Notch信号决定干细胞命运,可抑制TGF-β,激活Kit配体,若Notch信号缺失,则隆突区的干细胞子代可分化为毛囊,但无法维持,有研究发现隆突区的干细胞需要Notch通路阻止其迁移并分化为毛囊间表皮[48]。真皮Wnt 通路促进表皮 Notch表达的上调。这些通路的失调会导致某些异常,在某些情况下甚至会导致肿瘤生长[47]。
真皮毛乳头(DP)是各种毛发生长相关基因的表达位点,也是雄激素介导事件的主要目标1。各种研究已经证明了Wnt蛋白和伤口生长因子在刺激真皮毛乳头相关干细胞方面的潜在重要性[49]。不同类型的Wnt在毛囊形态发生和再生中起不同作用[50](见图2)。
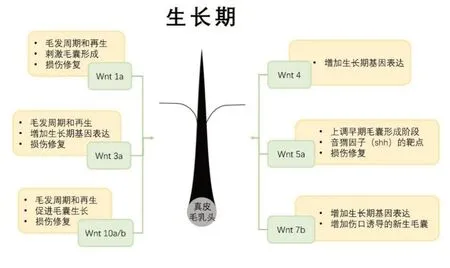
图2 (改编自文献[50])不同类型Wnt 在毛囊形态发生和再生中的不同作用
STAT3通过调节包括Sca-1、c-myc、β-catenin及多个EMT相关基因在内的多个基因,促进毛发隆突区角质形成细胞干细胞的成熟及迁移,在维持角质形成干/祖细胞稳态中起重要作用[51]。
2.2 伤口愈合反应
有研究发现微针通过释放生长因子和真皮乳头相关干细胞来发挥作用,微针物理微创伤可激活伤口再生机制,形成胶原蛋白,并形成孔道增强局部渗透[52]。
在经皮胶原诱导中,组织反应极度依赖于穿孔的深度和密度,不同的微针刺入方式也会引发不同的皮肤生理反应,微针促进持续的表皮增厚,基底层核极性正常化,减少日光性弹力组织变性,增加I型、Ⅲ型和Ⅳ型胶原(基底膜的组分)[53]。
针头刺入皮肤在成的损伤会造成小血管破裂,导致局部损伤和轻微出血。当数以千计的细针相邻放置时,情况则不同。多数作者认为皮肤针刺诱导的正常伤口愈合分为三个阶段[54,55](见图3):
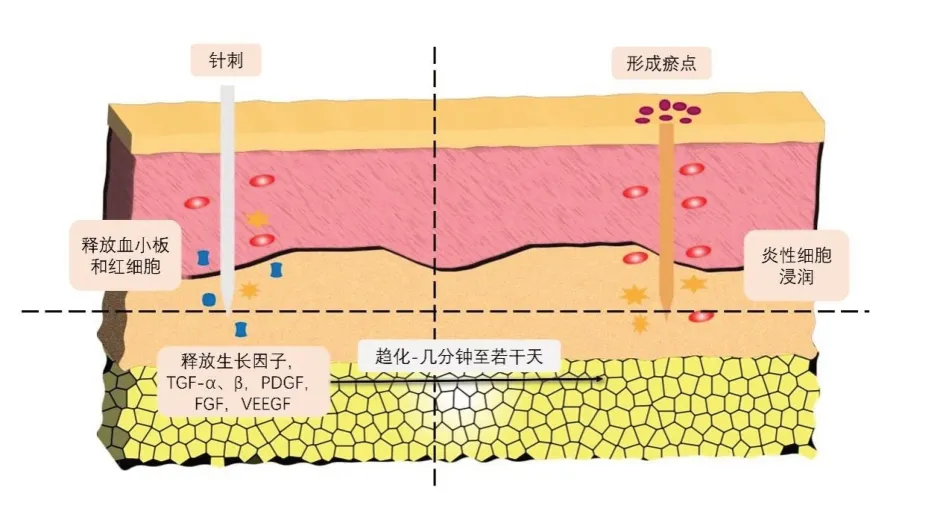
图3 (改编自文献[58])微针形成微小穿孔,其深度足以引发炎症反应
第一阶段:炎症阶段,在受伤后不久开始;血小板释放趋化因子,诱导其他血小板、中性粒细胞和成纤维细胞的浸润。
第二阶段:增殖阶段,巨噬细胞取代中性粒细胞并释放包括PDGF、FGF、TGFα、TGFβ在内的多种生长因子刺激成纤维细胞迁移和增殖。随后角质形成细胞迁移以覆盖基底膜中的间隙,它们可使用层粘连蛋白和Ⅳ型、Ⅶ型胶原蛋白来生产用于重建基底膜的组分。经皮胶原诱导后1~2天,角质形成细胞开始增生并释放生长因子,促进成纤维细胞的胶原沉积。
第三阶段:组织重塑阶段,在受伤后持续数月,主要依靠成纤维细胞作用:Ⅲ型胶原沉积在真皮浅层,并在1年或更长的时间内逐渐被I型胶原替代。基质金属蛋白酶1-3是转化过程中的必要条件。
针刺还可破坏陈旧的硬化瘢痕线并使其重新血管化,成纤维细胞的迁移和增殖可诱导新血管和新胶原的形成[56]。
Liebl等人[57]推测微针的作用机制可能与细胞膜电位相关:他认为微针治疗只破坏毛细血管,出血很少,仅产生轻微的炎症反应,可能是肥大细胞释放组胺和缓激肽的结果;在软组织损伤后,其附近细胞的Na+-K+泵激活,细胞内外电位改变;而微针每单位的皮肤可有约200个针刺,针孔附近的细胞将反复针刺感知为新的重复的诱导伤口的刺激,从而维持在持续活跃状态,导致细胞间电解质产生极化的电磁场,刺激周围细胞DNA表达,这种表观遗传的DNA信息增强了伤口区域表皮和内皮细胞的活动性,也增强了促进愈合的生长因子的基因表达。因此,微针治疗并非造成了真正的创伤,而是“欺骗”细胞使其相信伤害已发生[56]。
2.3 透皮给药途径
微针可促进药物的传递,并增加皮肤对不同化合物的吸收。局部用药的主要局限性就是经皮吸收差,角质层对大于500分子量的分子起到了物理屏障作用,且其富含脂质和神经酰胺,限制了亲水性药物的渗透性[59]。微针治疗可诱导角质屏障的机械性变化,在皮肤中形成微米级的通道,从而输送包括蛋白质在内的多种分子[60-62],其提高大分子的吸收率最高可达80%58。这些微通道在10分钟后会自发关闭,使表皮屏障保持完整,因此不会发生术后感染[63]。微针还可去除毛囊漏斗部的鳞屑和皮脂残留物,使脂质产品更有效地渗入[63]。
3 结论
综上,微针诱导毛发再生的机制包括:
1、诱导毛发生长相关基因(如VEGF、β-catenin、Wnt3a、Wnt10b)过表达[24],调节毛发周期,刺激真皮毛乳头,促进毛发生长[6,58,64]。
2、皮肤屏障完整度遭到破坏,释放细胞因子(IL-1α、IL-8、IL-6、TNF-α、GM-CSF),且有新生血管扩张、角质形成细胞迁移[6]。伤口愈合反应[54,55]:微针治疗后会释放血小板衍生生长因子,通过血小板活化和皮肤伤口再生机制增加表皮生长因子水平,促进毛发生长;微针治疗后形成的伤口愈合的微环境,激活了毛囊区域的干细胞;受伤背景下有新生血管形成,有利于毛发生长[1]。
3、透皮给药途径,促进药物的渗透和吸收[63,65]。
