免疫检查点抑制剂抗肿瘤作用的影响因素研究进展
2022-09-13曾峥罗丹玲钟明利谭亲友高义李江桂林医学院附属医院药学部广西桂林5400桂林医学院药学院广西桂林54000
曾峥,罗丹玲,钟明利,谭亲友,高义,李江*(.桂林医学院附属医院药学部,广西 桂林 5400;.桂林医学院药学院,广西 桂林 54000)
免疫检查点是免疫细胞上表达的一系列调节免疫激活水平的分子,在维持免疫系统的稳定中发挥重要作用[1],通常用于缓解抗原激活后的免疫应答。肿瘤细胞因基因突变导致不同新生抗原的表达,从而逃避免疫系统的攻击。细胞程序性死亡受体-1/细胞程序性死亡配体-1(PD-1/PDL1)相互作用后,可通过抑制T细胞增殖、促进T细胞凋亡、促进调节性T细胞(regulatory T cells,Tregs)分化增殖而下调T细胞活性,还可通过CTLA-4与CD80/CD86细胞上的B7分子结合下调T细胞活性和上调Tregs活性发挥免疫抑制作用,免疫检查点抑制剂(ICIs)通过阻断它们的结合重新识别肿瘤细胞从而抵抗肿瘤,目前应用最广泛的ICIs是针对PD-1/PD-L1的单克隆抗体[2-3]。
研究发现,多种因素可以影响免疫疗效。其中,糖皮质激素可通过多种机制影响免疫细胞的分化、凋亡,负性调控免疫系统[4-5];抗菌药物会导致患者体内菌群失调,进而引起免疫反应紊乱,最终削弱ICIs的疗效[6-7];抗血管生成药可改善肿瘤的微环境,使血管正常化,与ICIs具有协同抗肿瘤作用[8-9]。以上药物作用均可能会影响患者应用ICIs的疗效,本文就此进行系统综述。
1 糖皮质激素与免疫治疗
1.1 糖皮质激素影响免疫治疗的机制
糖皮质激素具有免疫抑制效应,目前认为糖皮质激素可能会降低免疫治疗的效果[10],指南中也指出同时使用糖皮质激素作为相对禁忌证疗法[11]。糖皮质激素可通过多种途径抑制T细胞,如诱导T细胞凋亡、抑制其增殖活化、增加Tregs的数量以及促进细胞毒性T淋巴细胞相关抗原-4(CTLA-4)、PD-1表达等,因此,理论上糖皮质激素可能会抑制ICIs的治疗效果[12-13]。
肿瘤患者在启动ICIs治疗前后都有可能使用糖皮质激素,有研究提示在ICIs治疗早期使用糖皮质激素会出现明显的抑制作用[14-15];而另有研究发现,糖皮质激素用于处理免疫相关不良事件(irAEs)并没有显著影响患者的总生存期(overall survive,OS)和无进展生存期(progression-free survival,PFS)[16-17]。提示糖皮质激素对OS和PFS的影响可能因患者的使用时间以及使用原因不同而存在差异。
1.2 治疗早期使用糖皮质激素对ICIs疗效的影响
有研究表明,在接受PD-1/PD-L1单抗单药或联合CTLA-4单抗治疗的晚期非小细胞肺癌(non small cell lung cancer,NSCLC)患者中,开始免疫治疗后28 d内接受≥10 mg泼尼松当量的糖皮质激素的患者较对照组患者(剂量<10 mg)的疗效降低,其疾病控制率(DCR)、中位无进展生存期(mPFS)和中位生存期(mOS)均明显下降[15],Scott等[18]的报告也显示出相似的结果,在接受纳武利尤单抗治疗的晚期NSCLC患者中,在免疫治疗前30 d内使用糖皮质激素的患者OS降低;Arbour等[14]进行的一项回顾性研究也证实了在晚期NSCLC患者中,开始PD-1/PD-L1单抗治疗时使用糖皮质激素的患者较未使用的患者临床获益减少,深入分析发现,ICIs开始治疗前30 d内接受糖皮质激素给药明显与患者预后更差相关;同样,一项小样本量回顾性研究也显示,在晚期黑色素瘤(melanoma,MEL)治疗中,与未接受糖皮质激素治疗的患者相比,早期应用糖皮质激素治疗的患者mOS显著降低[19]。
1.3 使用糖皮质激素的治疗目的不同,对ICIs的疗效有不同的影响
应用ICIs的患者因不同的治疗目的和肿瘤分期,可能有多种指征使用糖皮质激素,如有恶心、疲劳、疼痛、呼吸困难以及ICIs引起irAEs的肿瘤患者通常给予糖皮质激素作为缓解症状的主要方法,而使用糖皮质激素的治疗目的不同,免疫疗效可能受到影响。
一项回顾性分析显示,基于糖皮质激素使用的原因不同,患者的临床获益不同,应用糖皮质激素缓解肿瘤相关症状(如呼吸困难、疼痛、脑转移症状)的患者预后明显更差,而用于治疗肿瘤无关症状(如慢性阻塞性肺病、肺炎)的患者对预后没有影响[17]。
Ricciuti等[20]报告显示,应用PD-1/PD-L1单抗单药或联合CTLA-4单抗治疗的晚期NSCLC患者中,治疗开始时接受糖皮质激素治疗的患者OS明显缩短,根据糖皮质激素使用原因进行亚组分析显示,用于治疗肿瘤相关症状的患者较肿瘤无关症状患者生存期也显著降低。
进一步分析使用糖皮质激素缓解irAEs对患者OS的影响,Skribek等[16]进行的一项回顾性研究表明,在接受PD-1/PD-L1抑制剂治疗的晚期NSCLC患者中,根据使用糖皮质激素的原因进行亚组分析,结果显示因irAEs接受糖皮质激素治疗的患者对预后没有影响,且该亚组的患者呈现出较好的PFS和OS,而因缓解肿瘤相关症状而接受糖皮质激素的患者在所有亚组中OS最短;在黑色素瘤和其他类型肿瘤中也得到类似的结果,多项研究表明,在应用ICIs治疗的黑色瘤患者中,接受糖皮质激素以缓解irAEs的患者对预后没有影响,且显示出更好的OS[21-23]。此外,一项大型系统回顾和荟萃分析也证实了在ICIs治疗期间,因发生irAEs使用糖皮质激素治疗的患者,其生存期没有受到影响[24]。
1.4 化疗前预处理使用糖皮质激素对ICIs疗效的影响
化疗药物常会引起恶心、呕吐等不良反应,通常需要使用糖皮质激素进行预处理,有研究表明,在免疫联合化疗前使用糖皮质激素进行预处理,糖皮质激素并未明显影响疗效[25]。另外,一项在转移性NSCLC患者中接受PD-L1单抗联合化疗和靶向治疗时使用糖皮质激素进行预处理的研究也表明,糖皮质激素并未降低疗效[26];KEYNOTE407[27]和KEYNOTE-189[28]研究证实了糖皮质激素用于免疫联合化疗前预处理,并未观察到糖皮质激素降低疗效。
1.5 小结
目前,关于使用糖皮质激素对ICIs疗效影响的荟萃分析或汇总的文献较少,特别是关于糖皮质激素类型对免疫疗效影响的研究十分有限,Okoye等[29]研究表明,地塞米松抑制T细胞功能的作用显著,而ICIs无法克服这种抑制作用,其疗效会受到影响;王汉萍等[30]研究表明,为避免糖皮质激素相关毒副作用,同时尽量减少其对肾上腺垂体轴的生理抑制,一般多选择中效糖皮质激素,如泼尼松龙或甲基强的松。虽然长效糖皮质激素抗炎作用更加强大,但是生物半衰期长,长期使用不仅会损害T细胞功能,而且发生糖皮质激素相关不良反应增加。
本文纳入的研究中(见表1),在ICIs治疗期间,应用糖皮质激素可能会使患者临床获益减少,特别是在早期(ICIs治疗前后30 d内)使用糖皮质激素,患者预后明显更差;且进一步分析显示,糖皮质激素用于治疗有肿瘤相关症状(如疲劳、疼痛、脑转移和呼吸困难)的患者,结局最差;而因发生irAEs的糖皮质激素给药不会损害患者预后。因此,在临床工作中,应尽量避免或使用最低有效剂量的糖皮质激素缓解肿瘤相关症状;而在出现严重irAEs时,应积极使用糖皮质激素治疗,待患者症状好转后逐渐减少糖皮质激素的剂量,以免发生糖皮质激素相关不良反应。

表1 纳入关于糖皮质激素影响ICIs疗效研究的基本特征Tab 1 Basic features included in the study on the effect of glucocorticoid on the efficacy of ICIs
2 抗菌药物与免疫治疗
2.1 抗菌药物影响免疫治疗的机制
肠道微生物群对人体免疫系统的影响是非常大的,从稳定局部屏障到调节全身免疫、代谢、炎症等功能,同时参与恶性肿瘤的发生、发展和转移;多项研究表明,肠道中益生菌能增加肿瘤微环境中T细胞的数量[31-34];增强树突状细胞(dendritic cell,DC)的功能和Th1细胞反应,从而使肿瘤组织及肠道 CD8+T细胞增殖、活化;下调CD4+Tregs细胞的数量,因此,肠道菌群的变化会影响ICIs的抗肿瘤作用,而抗菌药物可使肠道菌群失调,可能会降低ICIs的有效性。
2.2 抗菌药物暴露时间窗口对ICIs的影响
恶性肿瘤患者常伴有炎症和感染,通常需要使用抗菌药物治疗,而抗菌药物引起的肠道菌群紊乱在其停用后1~3个月才能恢复到基线水平,有些细菌可能需数年才能完全恢复[35-37]。
目前大多研究认为在ICIs治疗期间使用抗菌药物会影响其疗效。Chalabi等[38]研究的POPLAR和OAK两项临床试验,均为NSCLC患者,阿替利珠组患者使用抗菌药物的mOS与未使用抗菌药物组比较显著缩短;进一步分析提示,在均使用抗菌药物的前提下,多西他赛组与阿替利珠组的mOS无显著差异,而在未使用抗菌药物的前提下,多西他赛组较阿替利珠组的mOS显著降低。Derosa等[39]研究显示,在纳入的晚期肾细胞癌(RCC)和NSCLC患者中使用PD-1/PD-L1单抗单药或联合CTLA-4单抗治疗前30 d内接受抗菌药物治疗,mPFS和mOS显著降低,也检测到在开始ICIs治疗前60 d内使用抗菌药物的患者,生存期缩短;Routy等[40]研究发现,在开始接受PD-1/PD-LI单抗治疗前2个月内或治疗后1个月内暴露于抗菌药物的患者,预后更差;Zhao等[41]也证实了在ICIs治疗前后30 d内,应用抗菌药物的NSCLC患者疾病进展风险增加,生存期缩短;同样也观察到,在ICIs治疗前2个月或1个月内使用抗菌药物的RCC患者生存期降低[42],随后,Lurienne等[43]进行的一项系统回顾和荟萃分析结果也证实了在ICIs治疗前后30 d、60 d、90 d内应用抗菌药物的患者,免疫疗效受到损害,尤其是在ICIs治疗前后30日内疗效降低更明显。
2.3 抗菌药物的类型对ICIs的影响
广谱抗菌药物可使肠道菌群失调,破坏肠道生态系统的功能,不仅使参与刺激免疫应答的微生物数量减少,也会增加免疫抑制因子的数量,从而降低ICIs的有效性[44]。
有研究表明,在首次ICIs治疗前后2周内使用抗菌药物的患者较未使用抗菌药物的患者,其免疫应答率(RR)、mPFS更低,该研究根据抗菌药物使用类型,将患者分为广谱抗菌药物治疗组和窄谱抗菌药物治疗组,结果表明,窄谱抗菌药物组(仅覆盖革兰氏阳性菌的抗菌药物,如万古霉素、利奈唑胺等)并未影响患者RR,而广谱抗菌药物组(覆盖革兰氏阳性菌和阴性菌或厌氧菌的抗菌药物,如第三、四代头孢菌素,美罗培南等)RR更低,且应答时间也更长[45];Mohiuddin等[46]研究也显示,在首次输注ICIs前使用抗菌药物的黑色素瘤患者生存期降低,且抗菌药物暴露患者中需要静脉注射糖皮质激素的免疫介导性结肠炎的1年累积发病率显著高于抗菌药物未暴露患者,亚组分析显示,广谱抗菌药物会损害生存率,而窄谱抗菌药物与生存率下降无关。Elkrief等[47]的研究也证实了广谱抗菌药物显著损害ICIs的疗效。
2.4 小结
在本文纳入的所有研究中(见表2),患者几乎都是接受ICIs单药治疗,结果表明,开始ICIs治疗前后有限时间窗内(开始治疗前后90 d内的抗菌药物暴露)使用抗菌药物会扰乱肠道菌群的组成,破坏肠道菌群平衡,进而降低ICIs的疗效,特别是在ICIs治疗前后30 d内影响更为显著,且抗菌药物暴露患者免疫介导性结肠炎、疾病进展风险增加;此外,应用广谱抗菌药物对ICIs疗效损害更大;故应尽量避免在ICI治疗前后30 d内应用抗菌药物,且要选用相对窄谱的抗菌药物类型。
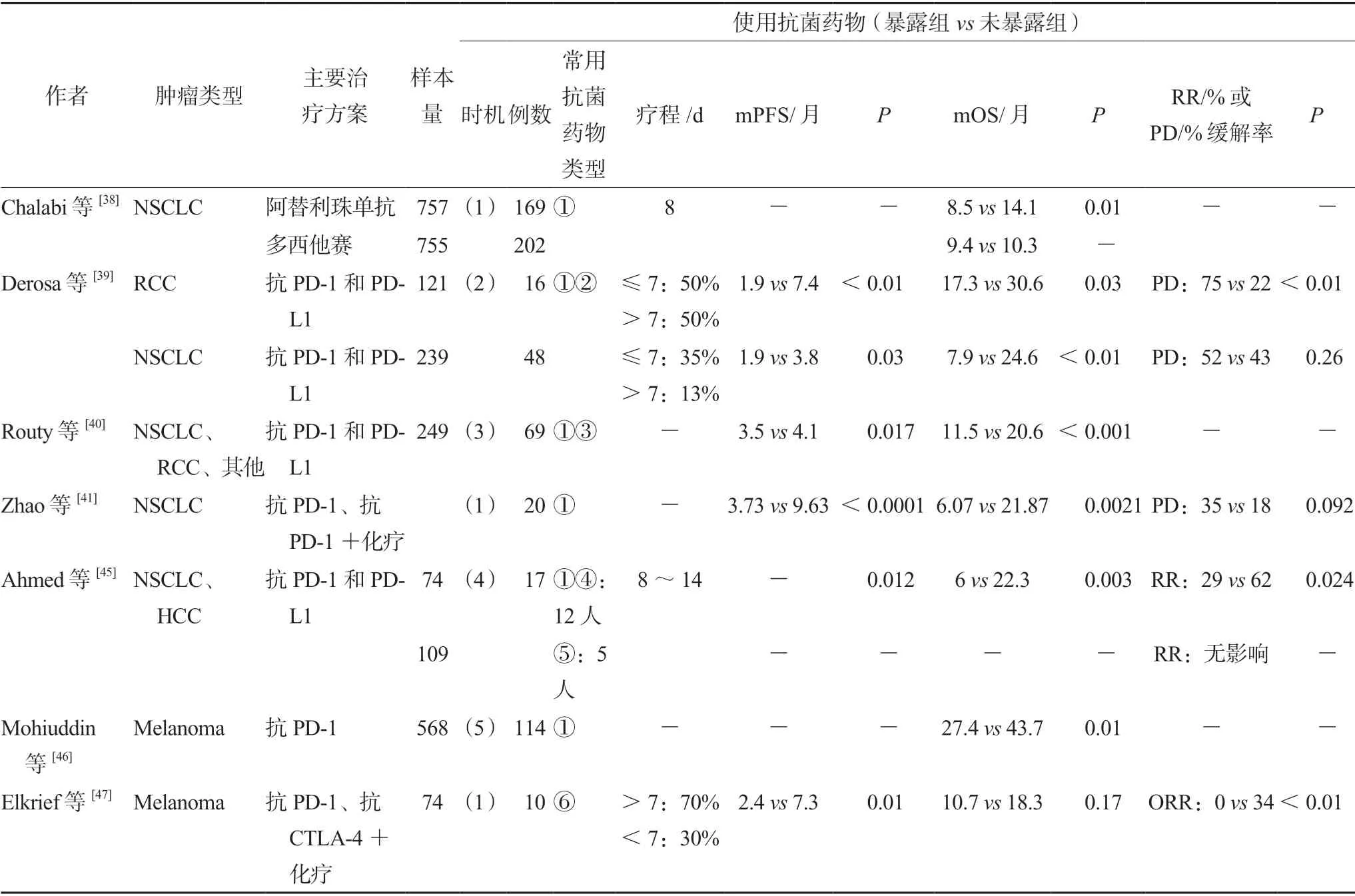
表2 纳入关于抗菌药物影响ICIs疗效研究的基本特征Tab 2 Basic features included in the study regarding the effect of ATB on the efficacy of ICIs
然而,最近有研究表明,应用化疗联合免疫疗法治疗NSCLC患者,抗菌药物暴露并不会影响患者的ORR和生存期,因为与单一ICIs疗法相比,化学免疫疗法的疗效可能较少依赖于肠道细菌组成,并且抗菌药物的有害影响可能通过ICIs和细胞毒性化疗之间的协同作用得到补偿,化疗诱导的肿瘤细胞裂解实际上可以通过促进暴露和呈递先前无法获得的肿瘤抗原来增加肿瘤的抗原性,而局部和全身释放损伤相关的分子模式在增强适应性免疫以及免疫检查点分子(如PDL1)阻断方面具有重要的辅助作用[48];且Galluzzi等[49]也表明,化疗能诱导免疫检查点分子的上调,化疗免疫疗法可增加肿瘤患者的临床获益。因此,在化学联合免疫治疗的情况下,不应延迟在伴有感染的患者中应用抗菌药物。
3 抗血管生成药与免疫治疗
3.1 抗血管生成药影响免疫治疗的机制
在临床实践中,选择ICIs的一个主要考虑因素是应答率低,目前对ICIs单药治疗的频繁耐药性尚未完全解决,但近期有研究表明,联合抗血管生成药治疗可减轻ICIs的耐药性。
血管生成发生于许多生理病理过程中(如伤口愈合、糖尿病相关性视网膜病变等),主要是指从现有血管再生成新的血管[50],在肿瘤的增殖过程中需要营养物质和氧气等,均需要血管生成提供,并且要比正常血管的通透性更强,才能满足肿瘤的快速分裂和转移的需要[51]。血管内皮生长因 子(vascular endothelial growth factor,VEGF)是血管生成的主要调节因子,是免疫抑制微环境的关键介质[52],可通过阻断T细胞向肿瘤浸润、阻止T细胞向肿瘤转运、抑制免疫细胞亚群的诱导和增殖、抑制DC成熟等机制,使肿瘤细胞发生免疫逃逸,减弱抗肿瘤反应[53-54]。抗血管生成药可使血管正常化,正常的肿瘤血管网可直接缓解缺氧,增加免疫细胞的浸润和活化,使肿瘤微环境由免疫抑制转变为免疫支持[8-9,55]。
3.2 抗血管生成药对免疫疗效的影响
3.2.1 临床前研究 抗血管生成药可刺激免疫反应,早就有研究发现,多靶点酪氨酸激酶抑制剂(TKI)舒尼替尼可以抑制晚期荷瘤小鼠中PD-L1的表达,并显著增加CD8+和CD4+T细胞浸润肿瘤细胞,减少Tregs的数量[53,56],这能增强免疫疗效;随后,Wu等[57]验证了抗PD-L1联合舒尼替尼能有效延长肾肿瘤小鼠的生存期。Voron等[58]也报道了VEGF可以通过激活细胞膜上受体信号通路来上调PD-1、CTLA-4等免疫检查点的表达,因此抗PD-1联合抗VEGF治疗能有效阻断PD-1/PD-L1轴,协同抑制肿瘤生长,特别是对于VEGF分泌过多的肿瘤,如结肠癌、肾癌、乳腺癌、肺癌等;Yasuda等[59]研究显示,在结肠腺癌小鼠中观察到抗 PD-1和抗血管内皮生长因子受体2(VEGFR2)双重阻断诱导的协同作用,显著抑制了肿瘤的生长,且没有增加明显的毒性。
3.2.2 临床研究 目前已有多项临床研究表明,抗血管生成药联合ICIs具有协同抗肿瘤作用(见表3)。Checkmate012研究结果显示,接受纳武利尤单抗+贝伐单抗治疗的晚期NSCLC患者较纳武利尤单抗单药治疗患者的PFS和OS延长,且安全可耐受,出现≥3级irAEs的频率较低[60]。IMpower150研究也表明了,接受阿替利珠单抗联合贝伐珠单抗联合化疗的NSCLC患者与接受贝伐珠单抗联合化疗的患者相比,PFS和OS延长,临床获益增加,两组不良反应无明显差别[26]。在TASUKI-52研究中也验证了ICI联合抗血管生成药的协同作用,即接受纳武利尤单抗联合贝伐珠单抗和化疗的晚期非鳞NSCLC患者较安慰剂联合贝伐珠单抗和化疗患者PFS显著获益,OS有延长趋势,两组不良反应发生率相似[62]。
3.3 小结
抗血管生成通过增加抗肿瘤免疫细胞比例,降低免疫检查点表达,阻断负性免疫信号,促进血管正常化等机制与ICIs联合可协同促进抗肿瘤治疗并恢复免疫支持微环境。两者联用并未明显增加不良反应,且有协同作用,相关研究见表3。目前免疫治疗联合抗血管生成联合化疗作为一线方案写入NSCLC指南,而在一些肿瘤的后线治疗无标准方案时ICIs联合抗血管生成也有良好的效果[62]。

表3 关于纳入ICIs联合抗血管生成药研究的基本特征Tab 3 Basic characteristics of incorporation into ICIs combined with antiangiogenic drug study
4 结论
随着免疫疗法广泛成为各种晚期癌症的治疗标准,联合用药可能会改变其抗肿瘤作用,如在免疫治疗早期应用糖皮质激素会损害免疫疗效,且糖皮质激素使用原因不同,疗效有差异,当糖皮质激素用于处理irAEs时对免疫疗效影响不明显,但当糖皮质激素用以缓解肿瘤相关症状时与较差的临床结果相关;恶性肿瘤患者常伴有感染,通常需使用抗菌药物治疗,这可能导致患者肠道菌群失调,因其恢复需要较长时间继而影响免疫疗效;而抗血管生成药与ICIs联用能相互促进,克服ICIs治疗后的耐药性和改善患者预后,提高抗肿瘤效果,因此,在临床工作中,要充分权衡ICIs联合用药的利弊,尽可能使免疫疗效获益最大化。
