基于染色法和HPLC法测定龙葵不同部位中多酚含量
2022-09-13孟莹王晓红刘晓利张琪卢甜甜程忠哲潍坊医学院药学院山东潍坊6053淄博市疾病预防控制中心山东淄博55000
孟莹,王晓红,刘晓利,张琪,卢甜甜,程忠哲*(.潍坊医学院 药学院,山东 潍坊 6053;.淄博市疾病预防控制中心,山东 淄博 55000)
龙葵为茄科茄属植物龙葵(Solanum nigrum
L.)的全草部分,是一种药食两用的植物,作为传统的中药材,常用于治疗疔疮、痈肿、丹毒、跌打扭伤等疾病。天然药物化学研究表明从龙葵中分离鉴定出的化学成分有生物碱、酚酸、黄酮等。其中酚酸类具有抑菌、抗病毒、抗氧化、降血压等作用;黄酮类具有抗炎、抗病毒、抗自由基、抗脂质过氧化、拮抗血小板活化因子、血管舒张、抗急性胰腺炎等作用。研究表明,绿原酸具有抗病毒、抗氧化、抗肿瘤等活性。咖啡酸具有抗炎、抗氧化等活性。没食子酸可以抗糖尿病、抗肝纤维化、抗肿瘤等。(E
)-阿魏酸能够降血脂、抗血栓、抗氧化。原儿茶酸可以发挥调节肝糖异生、抗炎、抗病毒等作用。芦丁具有抗病毒、抗自由基等活性。目前龙葵中各成分的定量研究多集中于生物碱和皂苷类化合物,针对其酚酸成分的含量研究尚未见报道,采用染色法测定龙葵中总酚酸及HPLC 法同时定量龙葵全草各部位(熟果、青果、茎、叶)中多种酚酸类化合物和黄酮类化合物的相关文献均未见报道。故本实验首先采用三氯化铁-铁氰化钾染色法研究龙葵不同部位(熟果、青果、茎、叶)中总酚酸含量的分布。然后,采用HPLC 分段波长法同时定量龙葵不同部位潜在的5 种酚酸类指标成分[绿原酸、咖啡酸、没食子酸、(E
)-阿魏酸、原儿茶酸]及1 种黄酮类(芦丁)成分,为龙葵的质量控制及进一步开发提供参考。1 仪器与试药
LC-20A 高效液相色谱仪,配有紫外检测器(SPD-20A)、UV-2700 紫外分光光度计(日本岛津公司),KQ3200DE 型数控超声波清洗器(昆山市超声仪器有限公司),AR153CN 电子天平[奥豪斯仪器(上海)有限公司],200T 多功能粉碎机(永康市铂欧五金制品有限公司)。芦丁对照品(批号:100080-200707,纯度:90.5%,中国食品药品检定研究院),没食子酸(批号:C12211832)、(E
)-阿魏酸(批号:C12085953)对照品(纯度≥99%,上海麦克林生化科技有限公司),绿原酸对照品(批号:PS000627,纯度>98.0%,成都普思生物科技股份有限公司),原儿茶酸对照品(批号:W09A11B111046,纯度≥97%,上海源叶生物科技有限公司),咖啡酸对照品(批号:BQZ406,纯度:99.65%,上海毕得医药科技股份有限公司),十二烷基硫酸钠、铁氰化钾(上海麦克林生化科技有限公司),无水三氯化铁(国药集团化学试剂有限公司),浓盐酸(烟台远东精细化工有限公司),水为娃哈哈纯净水,色谱甲醇(MeOH)、色谱乙腈(ACN)(Sigma-Aldrich),其他试剂均为分析纯。龙葵全草,2020年9月采于山西省运城市垣曲县,经潍坊医学院药学院王晓红(讲师)鉴定为茄科属植物龙葵Solanum nigrum
L.的全草。2 三氯化铁-铁氰化钾染色法定量分析
2.1 溶液的配制
2.1.1 显色剂 ① 0.3%十二烷基硫酸钠(SDS):精密称取SDS 0.300 g,加水100 mL 溶解,制得0.3%SDS 溶液。② 0.1 mol·L盐酸:精密量取浓盐酸4.1 mL,加超纯水至500 mL,制得0.1 mol·L的稀盐酸溶液。③ 0.9% K[Fe(CN)]试液:精密称取K[Fe(CN)]粉末0.450 g,加超纯水至50 mL,得0.9%K[Fe(CN)]溶液。④ 0.6% FeCl试液:精密称取FeCl固体0.300 g,加超纯水至50 mL,制得0.6%FeCl溶液。
2.1.2 供试品溶液 称取过五号筛的样品粉末0.1 g,加入2 mL 50%甲醇水溶液,称重,超声20 min,补足失重,12 000 r·min离心10 min,取出上清液,待用。
2.1.3 没食子酸对照品溶液 精密称定没食子酸对照品5 mg 于25 mL 量瓶中,用甲醇定容,配制成质量浓度为200 μg·mL的对照品储备液,再稀释10 倍得工作溶液,4℃保存,待用。
2.2 方法学考察
2.2.1 线性关系考察 分别精密量取“2.1.3”项下没食子酸对照品溶液0、0.2、0.4、0.6、0.8、1.2、1.6、2 mL 于25 mL 量瓶中,加入2 mL 0.3% SDS溶液, 再加入1 mL 0.9% K[Fe(CN)]与0.6%FeCl的等比混合溶液,摇匀,暗处静置5 min 后以0.1 mol·L盐酸定容。暗处静置20 min,在400 ~800 nm 内进行光谱扫描,结果显示没食子酸在720 nm 波长处吸光度值最大,结果如图1 所示。以没食子酸质量浓度为横坐标,吸光度值为纵坐标作线性回归,得到y
=0.5749x
+0.1151,r
=0.9985,线性范围0.16 ~1.6 μg·mL。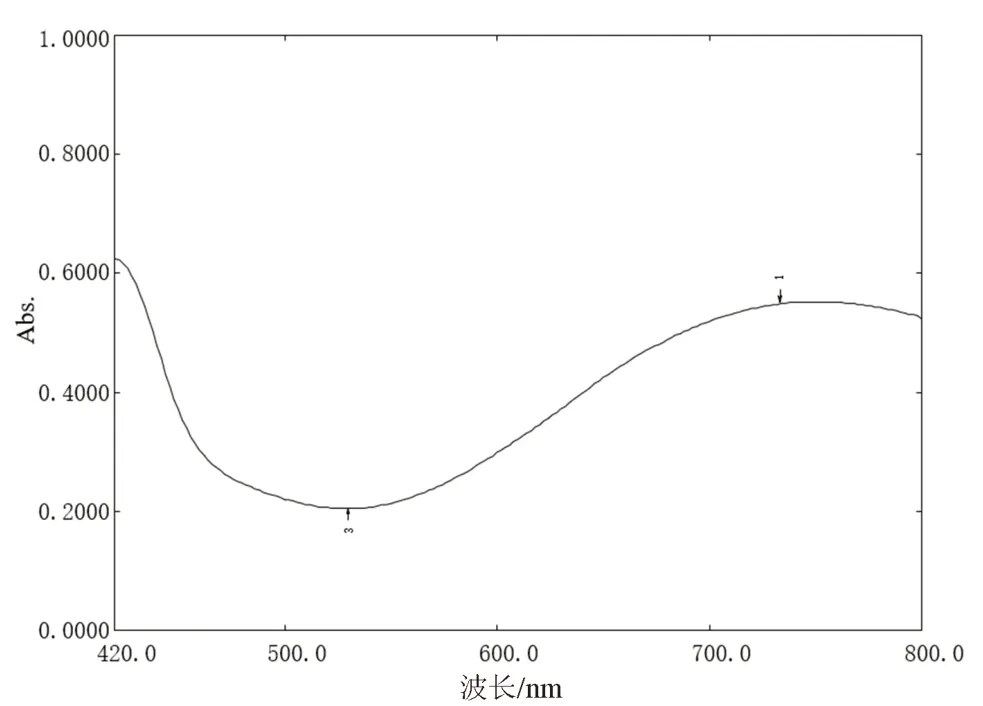
图1 没食子酸显色后紫外-可见吸收光谱Fig 1 UV-vis absorption spectra of gallic acid after the coloration
2.2.2 精密度试验 将0.6 mL 含有20 μg·mL没食子酸的对照品溶液显色后连续测定6 次,计算得含量RSD
为0.24%,表明本法精密度良好。2.2.3 稳定性试验 提取液置于室温下分别于0、1、2、4、6、8、12、24 h 后显色处理,测定吸光度值,计算含量RSD
为4.0%。表明供试品溶液室温条件下24 h 内稳定性良好。2.2.4 重复性试验 分别吸取6 份100 μL 供试品溶液于25 mL 量瓶中,显色,测定吸光度值,计算6 份供试品溶液含量的RSD
为4.1%,表明重复性良好。2.2.5 加样回收试验 分别吸取100 μL 供试品液6份,按1∶1水平精密加入没食子酸对照品溶液适量,显色,测定吸光度值,计算加样回收率,结果总酚酸的平均加样回收率为103.70%,RSD
为2.7%。2.3 样品含量测定
按“2.1.2”项下方法配制龙葵不同部位供试品溶液,精密吸取100 μL 于25 mL 量瓶中,显色,测定吸光度值,计算不同部位总酚酸含量。熟果、叶、青果、茎中总酚酸含量依次为(7040±195)μg·g、(4430±120)μg·g、(2720±97)μg·g、(810±9)μg·g,占比分别为0.70%、0.44%、0.27%、0.008%。
3 HPLC 定量分析
3.1 色谱条件
Kromasil 100-5C(150 mm×4.6 mm,5 μm)色谱柱;流动相分别为0.1%甲酸水溶液(A)和甲醇(B);梯度洗脱(0.01 ~11 min,5%B;11 ~20 min,5%→20%B;20 ~30 min,20%→30%B;30 ~40 min,30%→45%B;40 ~45 min,45%→70%B;45 ~48 min,70%→90%B;48 ~53 min,90%→90%B;53 ~53.1 min,90%→5%B;53.1 ~58.1 min,5%→5%B);流速1 mL·min;柱温30℃;进样量20 μL;检测波长274 nm(没食子酸)、258 nm(原儿茶酸)、320 nm[绿原酸、咖啡酸、(E
)-阿魏酸、芦丁]。3.2 溶液配制
3.2.1 供试品溶液 称取过五号筛的样品粉末0.1 g,加入2 mL 50%甲醇溶液,称重,超声20 min,补足失重,12 000 r·min离心10 min,取上清液,旋蒸至干,加入50%甲醇溶液500 μL涡旋复溶,过0.22 μm 滤膜备用。
3.2.2 混合对照品溶液 精密称定对照品没食子酸、原儿茶酸、绿原酸、咖啡酸、(E
)-阿魏酸和芦丁适量,加50%甲醇溶液溶解,配制成质量浓度分别为25、100、300、15、30 和250 μg·mL的混合对照品溶液,4℃保存。3.3 方法学考察
3.3.1 专属性试验 取“3.2.2”项下混合对照品溶液和由茎、叶、青果、熟果粉末按“3.2.1”项下方法配制的供试品溶液分别进样分析。没食子酸、原儿茶酸、绿原酸、咖啡酸、(E
)-阿魏酸和芦丁的保留时间分别为7.00、15.49、25.19、27.00、35.39、40.83 min,各化合物分离度良好且无明显干扰,如图2 所示。
图2 对照品和供试品代表性HPLC 色谱图Fig 2 Typical HPLC chromatograms of reference and samples
3.3.2 线性关系考察 精密量取“3.2.2”项下混合对照品溶液适量,稀释为6 个质量浓度梯度的混合对照品工作溶液,进样测定,以峰面积为纵坐标,质量浓度为横坐标进行线性回归,各组分在其线性范围内与峰面积线性关系良好。以信噪比S/N
≥3 时的浓度为检测限(LOD),信噪比S/N
≥10 时的浓度为定量限(LOQ),结果如表1所示。表1 6 种成分线性关系
Tab 1 Linear relationships of 6 components
成分回归方程r线性范围/(ng·mL-1)LOD/(ng·mL-1) LOQ/(ng·mL-1)没食子酸y =74.733x +7200.20.99932.5×102 ~2.5×104 48160原儿茶酸y =85.665x-150860.99981.0×103 ~1.0×105156520绿原酸y =66.128x +328140.99983.0×103 ~3.0×105 25 50咖啡酸y =123.94x-3584.90.99971.5×102 ~1.5×104 9 30(E)-阿魏酸y =116.95x +502280.99953.0×102 ~3.0×104 6 20芦丁y =31.641x-250300.99982.5×103 ~2.5×105 85170
3.3.3 精密度试验 将“3.2.2”项下的混合对照品溶液稀释1 倍,连续进样6 次,分别测得没食子酸、原儿茶酸、绿原酸、咖啡酸、(E
)-阿魏酸、芦丁含量的RSD
分别为2.1%、1.8%、1.9%、2.0%、1.8%、2.0%,表明仪器精密度良好,将上述溶液连续3 d 进样,测得这6 种成分含量RSD
分别为1.7%、2.1%、1.8%、2.8%、2.3%、2.7%,表明仪器日间精密度良好。3.3.4 稳定性试 按“3.2.1”项下方法配制龙葵全草供试品溶液,置室温下分别于0、1、2、4、8、12、24 h 后进样分析,测得没食子酸、原儿茶酸、绿原酸、咖啡酸、(E
)-阿魏酸、芦丁含量RSD
分别为4.9%、3.9%、4.1%、4.8%、5.1%、2.2%。表明供试品溶液室温条件下24 h 稳定性良好。3.3.5 重复性试验 取按“3.2.1”项下方法平行配制的6 份龙葵全草供试品溶液进样分析,测得没食子酸、原儿茶酸、绿原酸、咖啡酸、(E
)-阿魏酸、芦丁含量RSD
分别为3.0%、3.2%、1.7%、0.80%、3.5%、2.3%,说明本法重复性良好。3.3.6 加样回收试验 称取龙葵熟果0.05 g,平行3 份,按“3.2.1”项下方法制备供试品溶液,分别按照50%、100%、150%水平精密加入混合对照品溶液,进样测定,计算加样回收率,结果6 种成分的平均加样回收率均在95.58%~108.41%,RSD
在0.34%~4.5%。3.4 样品含量测定
按“3.2.1”项下方法配制不同部位供试品溶液,进样分析,结果见表2,含量热图如图3 所示。
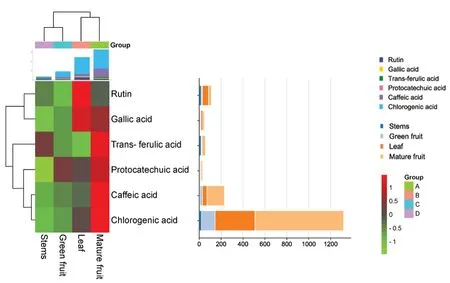
图3 成分含量热图Fig 3 Heatmap of component content
表2 龙葵各部位中各组分含量测定结果(μg·g, =3)
Tab 2 Content of 6 components in L.(μg·g, =3)
部位没食子酸原儿茶酸绿原酸咖啡酸(E)-阿魏酸芦丁青果熟果9.39±0.59 14.67±0.83 9.04±0.26 11.27±0.19 123.25±0.84 890.27±9.20 25.47±0.27 159.35±1.60茎3.54±0.19 3.60±0.02 6.50±0.07 30.75±0.27 18.00±0.28叶7.26±0.58 17.59±0.42 8.72±0.75 21.13±0.24 364.95±3.36 42.17±0.42 1.56±0.08 9.65±0.30 27.65±0.24 19.15±0.38 56.65±0.97
3.5 样品数据统计分析
样品中5 种酚酸成分含量的差异采用方差分析进行研究。由于茎中5 种酚酸类成分含量无较大差异,因此选择熟果、叶和青果中5 种酚酸类成分含量采用IBM SPSS Statistics 24.0 软件进行无重复数据的两因素方差分析,结果如表3 所示,表3 中成分的显著性P
=0.044 证明了在置信区间95%范围内熟果、叶和青果各部位酚酸的含量差异具有统计学意义(P
<0.05)。表3 方差分析结果
Tab 3 Analysis of variance
注:a. =0.708(调整后 =0.489)。
Note:[a. =0.708(adjusted =0.708)]
源Ⅲ类平方和 自由度均方F显著性修正模型548 447.248a6 91 407.875 3.234 0.064截距196 070.2341196 070.234 6.936 0.030部位 92 588.2542 46 294.127 1.638 0.253成分455 858.9934113 964.748 4.031 0.044误差226 149.5178 28 268.690总计970 666.99815修正后总计 774 596.76514
4 讨论
研究表明,龙葵中含有酚酸和黄酮等活性成分,但其含量研究尚未见报道。龙葵通常为全草入药,不同部位中酚酸类化合物的含量可能存在差异。
酚酸类化合物在抗氧化、抗肿瘤、抑菌、护肝、提高免疫力等方面表现出生物活性,因此多种药用植物采用酚酸类化合物作为质量控制指标。如《中国药典》(2020年版)中冬葵果以总酚酸作为质量控制指标。本实验对龙葵中总酚酸含量进行测定,结果表明龙葵不同部位均含有总酚酸。其中熟果的含量最高,其次为叶,青果,茎中最低。药典规定冬葵果总酚酸不低于0.15%,提示总酚酸可以作为龙葵质量控制的指标之一。
进一步采用HPLC 分段波长法同时定量研究龙葵不同部位6 个多酚含量。分段波长法在提高检测灵敏度的同时,又使分析物附近干扰峰减少,有利于提高分离度。本实验选取多酚类化合物中活性较高的绿原酸、咖啡酸、没食子酸、(E
)-阿魏酸、原儿茶酸及芦丁进行含量研究。结果显示,6 种活性成分在不同部位中均有检出。所有部位中绿原酸含量最高,其次为咖啡酸、芦丁、(E
)-阿魏酸、没食子酸,原儿茶酸最低。不同部位中6种成分总和熟果含量最高,其次为叶、青果,茎中最低(见图3 左上)。绿原酸在熟果中含量最高(0.089%),其次为叶(0.036%),青果(0.012%),茎中最低(0.002%),药典规定杜仲叶、忍冬藤绿原酸含量分别不低于0.08%、0.10%,提示绿原酸可以作为龙葵质量控制的指标之一;咖啡酸在熟果中含量最高(0.016%),其次为叶(0.004%),青果(0.003%),茎中最低(0.0004%),药典规定蒲公英咖啡酸含量分别不低于0.02%,熟果中含量接近,提示其可以作为龙葵质量控制的指标之一。绿原酸和咖啡酸在龙葵中含量与《中国药典》规定较高或相近,可以作为主要质量控制指标,其他4 个酚酸类成分[(E
)-阿魏酸、没食子酸、原儿茶酸及芦丁]可以作为次要质量控制指标。本实验采用三氯化铁-铁氰化钾染色法测定了不同部位的总酚酸,结果各部位均含有总酚酸。其中熟果、叶和青果总酚酸含量高于《中国药典》对冬葵果总酚酸含量的规定。进一步采用HPLC分段波长法同时定量龙葵不同部位中5 种酚酸类化合物和1 种黄酮类化合物的含量,发现绿原酸和咖啡酸与《中国药典》中的规定较高或接近,因此,绿原酸、咖啡酸可以作为龙葵潜在的主要质量控制指标。(E
)-阿魏酸、没食子酸,原儿茶酸及芦丁可以作为龙葵潜在的次要质量控制指标。为龙葵的质量控制研究及进一步开发提供参考。