金银花提取物增强抗CD19 CAR-T细胞肿瘤杀伤活性
2022-09-13单贺珍董石李晓瑞董宇曦刘秀盈何宇王建勋北京中医药大学生命科学学院北京02488深圳北京中医药大学研究院广东深圳5872中国农业大学生物学院北京009
单贺珍,董石,李晓瑞,董宇曦,刘秀盈,何宇,王建勋,2*(.北京中医药大学生命科学学院,北京 02488;2.深圳北京中医药大学研究院,广东 深圳 5872;.中国农业大学生物学院,北京 009)
嵌合抗原受体(chimeric antigen receptor,CAR)T细胞免疫疗法是抗肿瘤领域的一种新型细胞疗法。近年来,多款抗CD19 CAR-T细胞产品陆续获批上市,它对B细胞恶性淋巴瘤的疗效显著,特别是弥漫性大B细胞淋巴瘤,完全有效率可达54%。然而,抗CD19 CAR-T细胞疗法的不良反应不可忽视,比如神经毒性和细胞因子综合征(cytokine release syndrome,CRS),严重者甚至会危及患者的生命。
中药金银花(Lonicera japonica,LJ)具有清热解毒、抗炎消肿的功效,临床上广泛用于发热、扁桃体炎、肺炎、鼻炎及皮疹等。有体外实验表明,金银花提取物可以阻碍脂多糖诱导神经小胶质细胞与免疫巨噬细胞分泌炎症因子,抑制补体活性。这提示金银花可能有助于缓解抗CD19 CAR-T细胞导致的CRS。
因此,本实验将金银花水煎剂与抗CD19 CAR-T细胞联合处理表达CD19的Burkitt’s淋巴瘤细胞(Raji细胞),以探究金银花对抗CD19 CAR-T细胞肿瘤杀伤能力,细胞因子释放以及程序性死亡蛋白(programmed death-1,PD-1)表达的影响,以期为恶性B细胞淋巴瘤患者提供新的治疗方案。
1 材料
1.1 仪器
流式细胞分析仪(LSRFortessa SORP,BD);酶标仪(Epoch 2TC,BioTek);细胞自动计数仪(Invitrogen Countess II FL,ThermoFisher)。
1.2 试药
RPMI 1640培养基、AIMV培养基、胎牛血清(FBS)(Gibco公司);CD3-APC抗体、PD-1-PE抗体、c-Myc-PE抗体、Human CD8/NK Panel检测试剂盒、CFSE荧光染料(Bio-Legend公司);细胞凋亡检测试剂盒(北京金普来生物科技有限公司);Bright-LumiⅡ萤火虫荧光素酶报告基因检测试剂盒(碧云天生物技术公司);金银花中药饮片[中国北京同仁堂(集团)有限公司]。
1.3 细胞系
Burkitt’s淋巴瘤细胞(Raji细胞,美国 ATCC细胞库);Raji-荧光素酶标记细胞(Raji-Luc,北京维通达公司);外周血单个核细胞(Peripheral blood mononuclear cell,PBMC,为健康志愿者提供)。本研究获得北京中医药大学医学与实验动物伦理委员会审理与批准,审批号为2022 BZYLL0102。
2 方法
2.1 金银花提取物的制备[7]
称取金银花30 g,以8倍量去离子水浸泡30 min,加热煮沸2 h,以三层纱布过滤。最后水浴浓缩至300 mL,即获得质量浓度为100 mg·mL的金银花水煎剂,0.22 μm滤膜过滤。
2.2 抗CD19 CAR-T细胞的构建与转导率测定[8]
采用Ficoll 密度梯度离心法分离人外周血中的PBMC,以含有10%FBS的AIMV 培养基培养。T细胞激活则通过CD3 单克隆抗体与白介素-2(IL-2)刺激处理,继续培养48 h后,转导抗CD19 CAR反转录病毒(实验室前期制备并保存)得到抗CD19 CAR-T细胞。48 h后通过c-Myc-PE染色与流式细胞术检测c-Myc 阳性细胞,即获得CD19 CAR的转导效率。
2.3 荧光素酶检测法测定靶细胞活率
将抗CD19 CAR-T细胞或T细胞依照1∶8效靶比与4×10个Raji-Luc细胞置于96孔培养皿100 μL体系中,给药组分别给予5、10、20 mg·mL金银花水煎剂干预。37℃共同培养12 h后,每孔加入100 μL荧光素酶底物,孵育3 min后使用酶标仪的化学发光模式检测。根据下列公式计算不同组别的细胞杀伤效率:细胞杀伤效率(%)=(靶细胞组检测值-实验组检测值)/靶细胞组检测值×100%。
2.4 Annexin V染色法检测靶细胞凋亡
将抗CD19 CAR-T细胞依照1∶2、1∶4、1∶8、1∶16效靶比与2.4×10个Raji细胞共同培养12 h后,以CD3-APC抗体标记T细胞,Annexin-FITC标记早期凋亡细胞后,通过流式细胞术测定Raji细胞的凋亡比例。根据下列公式计算不同组别的细胞杀伤效率:细胞杀伤效率(%)=(实验组FITC阳性率-靶细胞组FITC阳性率)/(1-靶细胞组FITC阳性率)×100%。
2.5 CFSE染色法测定效应细胞增殖
将抗CD19 CAR-T细胞与3 μmol·L羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)孵育染色30 min,流式细胞术检测0 h的FITC通道荧光强度;之后抗CD19 CAR-T细胞按照1∶8效靶比与2.4×10个Raji细胞共同培养12 h,以CD3-APC抗体标记T细胞,检测12 h的FITC通道荧光强度。
2.6 CBA多因子流式细胞术检测细胞因子释放水平
将抗CD19 CAR-T按照1∶8效靶比与2.4×10个Raji细胞共同培养12 h后,收取培养基上清液,按照Human CD8/NK Panel检测试剂盒说明书操作并检测。
2.7 流式细胞术检测PD-1的表达水平
将抗CD19 CAR-T按照1∶8效靶比与2.4×10个Raji细胞共同培养12 h后,以CD3-APC抗体标记T细胞,PD-1-PE抗体标记PD-1蛋白,抗体孵育1 h后采用流式细胞术检测。
2.8 数据统计与分析
采用Graphpad Prism 9软件进行统计学分析,两组之间采用t
检验,P
<0.05则表明差异有统计学意义。3 结果
3.1 抗CD19 CAR-T细胞的成功制备
抗CD19 CAR-T细胞的构建是通过基因重组技术将载有CD19 CAR的反转录病毒转导至T细胞,使其可以识别肿瘤细胞表面的CD19从而特异性杀伤肿瘤,其中CD19 CAR的分子结构主要包括CD19的单链可变片段(scFv)、CD8铰链区、CD28共刺激域以及CD3ζ
结构域(见图1A)。转染48 h后采用c-Myc抗体标记CD19 CAR分子以评估病毒的转导效率,结果发现T细胞中CD19 CAR分子的表达率为65.7%(见图1B)。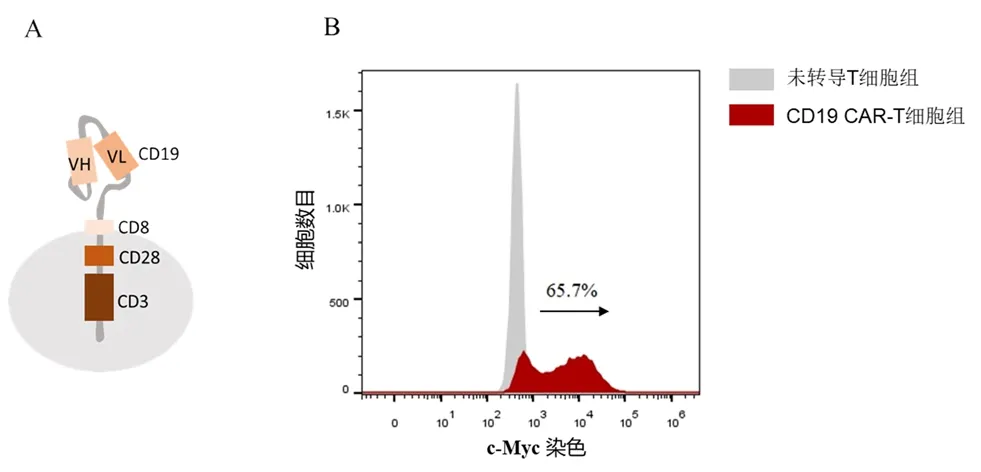
图1 靶向CD19的嵌合抗原受体(CAR)的分子结构(A)及其表达率(B)Fig 1 Structure(A)and transduction efficiency(B)of anti-CD19 chimeric antigen receptor(CAR)
3.2 金银花提取物提高抗CD19 CAR-T细胞肿瘤杀伤活性
为了探究金银花提取物是否会影响抗CD19 CAR-T细胞的体外细胞毒性,将效应细胞与Raji-Luc共培养,给药组给予金银花提取物干预12 h,通过荧光素酶检测法测定Raji-Luc的存活率。浓度摸索实验发现,10 mg·mL的金银花提取物可以促进抗CD19 CAR-T细胞杀伤肿瘤,优于5 mg·mL和20 mg·mL两个质量浓度组(见图2A)。于是将10 mg·mL作为后续实验中金银花提取物的最佳干预浓度。此外,还发现金银花与抗CD19 CAR-T细胞联合杀伤Raji-Luc的效果显著优于两者的单独应用,即两者具有叠加效应,也强于未转导T细胞与金银花联用组以及未转导T细胞组(见图2B)。

图2 荧光素酶检测法测定抗CD19 CAR-T对Raji-Luc的杀伤效率(n=3)Fig 2 Killing efficienc of anti-CD19 CAR-T cells against Raji-Luc measured by luciferase assay(n=3)
进一步通过流式细胞术的方法检测了不同效靶比条件下,10 mg·mL的金银花提取物是否均会影响抗CD19 CAR-T细胞对Raji细胞的促凋亡作用,结果显示,1∶2、1∶4、1∶8与1∶16效靶比水平下,金银花与抗CD19 CAR-T细胞联合应用组的肿瘤杀伤活性均显著高于抗CD19 CAR-T细胞组(见图3)。

图3 细胞凋亡检测法测定抗CD19 CAR-T对Raji细胞的杀伤效率(n=3)Fig 3 Killing efficiency of anti-CD19 CAR-T cells against Raji cells measured by cell apoptosis assay(n=3)
3.3 金银花提取物促进抗CD19 CAR-T细胞的增殖
CAR-T细胞增殖能力同体内抗肿瘤的持久性密切相关,于是通过CFSE染色法测定了经10 mg·mL金银花提取物处理的抗CD19 CAR-T细胞,结果显示,与靶细胞共培养12 h后,同抗CD19 CAR-T细胞组相比,金银花联合应用组的CFSE荧光峰图向左偏移(见图4),即金银花提取物提高了抗CD19 CAR-T细胞的增殖能力。
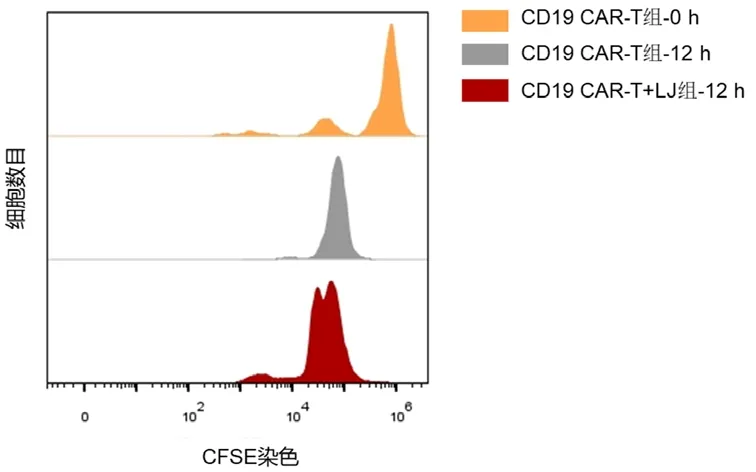
图4 CFSE染色测定抗CD19 CAR-T细胞的增殖能力Fig 4 Proliferation ability of anti-CD19 CAR-T cell measured by CFSE staining
3.4 金银花提取物双向调控细胞因子的分泌
细胞因子的释放水平是指征CAR-T细胞功能的标志之一,于是对抗CD19 CAR-T细胞与Raji细胞共培养体系中白介素-2(IL-2)、白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子α
(TNF-α
)、干扰素γ
(IFN-γ
)以及颗粒酶B(Granzyme B)的水平进行检测。结果发现经10 mg·mL金银花提取物处理后,Granzyme B显著上调,IL-2与TNF-α
有表达升高的趋势;同时IFN-γ
与IL-10显著下调,IL-6表达有降低的趋势(见图5)。
图5 金银花提取物特异性调控细胞因子的分泌水平(n=3)Fig 5 Expression level of cytokines regulated by Lonicera japonica extract(n=3)
3.5 金银花提取物下调PD-1蛋白的表达
为了进一步阐明金银花提取物增强抗CD19 CAR-T细胞肿瘤杀伤能力的可能原因,对抗CD19 CAR-T细胞活性相关的免疫检查点PD-1蛋白进行检测,结果发现,同对照组相比,经10 mg·mL金银花处理的抗CD19 CAR-T细胞的PD-1阳性率发生降低(见图6)。

图6 流式细胞术检测PD-1蛋白表达的阳性率Fig 6 Expression of PD-1 detected by flow cytometry
4 讨论
CD19是B细胞的生物标志物,属于免疫球蛋白超家族,并在多数慢性淋巴细胞白血病、急性淋巴细胞白血病以及B细胞淋巴瘤病例中高水平,且为血液肿瘤治疗的潜在靶点。针对CD19靶标设计的抗CD19 CAR-T细胞可以特异性识别高表达CD19的B细胞淋巴瘤并激活自身T细胞的功能,进而精准清除癌变细胞。Raji细胞是取自Burkitt’s淋巴瘤患者的癌变B细胞,可作为评估靶向CD19 CAR-T细胞效力的靶细胞。基于成功制备的抗CD19 CAR-T细胞与Raji细胞共培养体系,实验发现10 mg·mL金银花提取物有助于提高抗CD19 CAR-T细胞的细胞毒性,改善抗CD19 CAR-T细胞的增殖,提示金银花提取物与抗CD19 CAR-T细胞的联合疗法具有良好的抗肿瘤疗效,有可能进一步提高B细胞淋巴瘤的临床治愈率。
此外,在体内杀伤靶细胞过程中,抗CD19 CAR-T细胞与自免疫T细胞的激活会导致血清中免疫刺激细胞因子的增加,如Granzyme B、IL-6、IL-10、TNF-α
、IFN-γ
、IFN-β
等,介导对肿瘤的杀伤作用。而这些细胞因子过度的级联释放会导致受试者发生细胞因子风暴,是CAR-T细胞疗法的不良反应之一。研究表明金银花提取物对细胞因子的调控是双向的,它促进Granzyme B的分泌,而抑制IFN-γ
与IL-10的释放,对IL-2、TNF-α
与IL-6的表达无显著影响。Granzyme B是丝氨酸蛋白酶家族成员之一,常在效应T细胞中表达并介导对靶细胞的促凋亡作用,而金银花提取物的处理促进了抗CD19 CAR-T细胞释放Granzyme B,进一步揭示了金银花与抗CD19 CAR-T细胞的联合应用具有最佳肿瘤杀伤能力的原因;有研究表明干扰素IFN-γ
水平的高低对CAR-T细胞的疗效无显著影响,并且抑制 IFN-γ
不仅可以减轻细胞因子相关的毒性,还能够通过减少免疫检查点蛋白的表达来增强T细胞增殖,金银花提取物的干预明显抑制了抗CD19 CAR-T细胞分泌IFN-γ
,说明金银花可能会在不影响杀伤效果的同时减轻抗CD19 CAR-T细胞疗法引发的CRS症状,也解释了经金银花处理的抗CD19 CAR-T细胞自我更新能力得到提高的原因。PD-1是重要的免疫检查点之一,当抗CD19 CAR-T细胞暴露于肿瘤细胞环境时,会诱导自身PD-1蛋白的表达上调,PD-1信号通路的激活则会降低抗CD19 CAR-T细胞对肿瘤细胞的杀伤活性以及细胞增殖能力,导致肿瘤免疫逃逸的发生。而10 mg·mL金银花提取物处理可以下调由Raji细胞刺激诱发的抗CD19 CAR-T细胞中PD-1的表达,这说明金银花提取物有可能通过下调PD-1蛋白的表达从而增强抗CD19 CAR-T细胞肿瘤杀伤活性以及细胞增殖能力。
综上,本项研究证实了金银花提取物可以提高抗CD19 CAR-T细胞体外杀伤肿瘤的效力,且特异性调控细胞因子的释放水平并下调免疫检查点PD-1的表达。这一发现将有助于改善抗CD19 CAR-T细胞疗法的效果与降低不良反应的发生率,也拓展了中药金银花的临床应用范围。然而,金银花调控抗CD19 CAR-T细胞功能的有效成分与内在分子机制尚不清晰,有待中药物质基础学研究与生物信息学分析加以阐释,为金银花与抗CD19 CAR-T细胞联合疗法的临床转化提供更夯实的证据。
