R-CHOP方案序贯自体造血干细胞移植在中高危弥漫大B细胞淋巴瘤中的应用:单中心回顾性分析
2022-09-13贤晓敏蓝晓凤刘玄勇陈丽萍刘志淑谢晶王月乔王强郭智武汉科技大学医学院武汉430065国家癌症中心国家肿瘤临床医学研究中心中国医学科学院北京协和医学院肿瘤医院深圳医院广东深圳586
贤晓敏,蓝晓凤,刘玄勇,陈丽萍,刘志淑,谢晶,王月乔,王强,郭智*(.武汉科技大学医学院,武汉 430065;.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院,广东 深圳 586)
弥漫性大B细胞淋巴瘤(DLBCL)是一组异质性很强的肿瘤,为最常见的非霍奇金淋巴瘤类型,约占成人非霍奇金淋巴瘤病理类型的 30%。R-CHOP方案(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、强的松)为初治DLBCL患者的一线化疗方案,5年生存率为50%~70%;尽管R-CHOP方案极大地提高了DLBCL患者的生存率,但仍有20%的患者最终会难治,30%的患者会复发。目前自体造血干细胞移植(Auto-HSCT)已广泛应用于DLBCL的巩固治疗,无论是在DLBCL的一线巩固治疗,还是在复发难治淋巴瘤的挽救治疗,均占据了重要地位,能延长患者的无进展生存 期(progression-free survival,PFS)及总生存期(overall survival,OS)。临床上亦已开展了Auto-HSCT作为巩固治疗应用于一线化疗达到完全缓解(CR)的淋巴瘤患者的相关试验,结果表明可改善患者生存及预后。2018版造血干细胞移植治疗淋巴瘤中国专家共识指出,对于治疗后达到CR的年轻高危DLBCL患者,推荐Auto-HSCT作为一线巩固治疗方案。但到目前为止,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南尚未推荐Auto-HSCT作为治疗后达到CR的DLBCL患者的一线巩固治疗方案。因此,针对化疗后达到CR的DLBCL患者,是否采用序贯Auto-HSCT巩固治疗尚处于探索阶段,未形成标准巩固治疗方案。本中心于2018年1月已开展把Auto-HSCT作为一线巩固治疗应用于经R-CHOP方案化疗达到CR的初治中高危DLBCL患者的工作,现把25例序贯Auto-HSCT巩固治疗的患者临床资料进行分析,旨在探讨Auto-HSCT对初治中高危DLBCL患者巩固治疗的疗效。
1 资料与方法
1.1 一般资料
对2018年1月至2021年1月在中国医学科学院肿瘤医院深圳医院血液肿瘤科既往经过R-CHOP方案化疗后达到CR的初治中高危(IPI评分≥3分)DLBCL患者资料进行回顾性分析。依据是否序贯Auto-HSCT巩固治疗分为移植组和对照组。所有患者经本院病理科病理组织活检及免疫组织化学染色确诊为DLBCL,并对肿瘤组织中的MYC、Bcl-2、Bcl-6进行检测(双表达淋巴瘤是指MYC和Bcl-2/Bcl-6蛋白过表达,本研究中双表达淋巴瘤的截断值定义为:MYC≥40%,Bcl-2≥50%,Bcl-6≥ 30%)。所有患者均行骨髓穿刺及骨髓活检检查明确骨髓是否受累。所有患者初诊时均进行Ann Arbor分期、ECOG评分,依据国际预后指数(international prognostic index,IPI)进行危险度分层。所有患者均无重要脏器功能不全,治疗过程中均定期采用增强CT或PET-CT检查评价患者的疗效。本研究排除中枢侵犯患者、“双打击”或“三打击”患者(即经荧光原位杂交提示MYC和Bcl-2/Bcl-6重排阳性)及拒绝随访患者。
1.2 Auto-HSCT动员前治疗方案
R-CHOP方案化疗后序贯Auto-HSCT巩固治疗的即为移植组;化疗后不序贯Auto-HSCT巩固治疗的即为对照组。移植组所有患者移植前总的化疗周期数为163个,中位化疗周期数为6个(范围:6~7个);对照组所有患者总的化疗周期数为345个,中位化疗周期数为7个(范围:6~8个),两组患者的化疗周期数比较差异无统计学意义(P
=0.121)。4个周期R-CHOP方案化疗后行外周血干细胞采集术。R-CHOP方案为:利妥昔单抗 375 mg·m,第0日;环磷酰胺(CTX)750 mg·m,阿霉素(ADM)50 mg·m或阿霉素脂质体 30 mg·m,长春新碱(VCR)1.4 mg·m,第1日;泼尼松(PDN)60 mg·m,第1~5日。治疗期间定期监测血常规、肝肾功能、电解质、心肌酶、心电图等检验检查指标。患者每两周期化疗后均进行疗效评估。1.3 Auto-HSCT的动员
所有移植组患者移植前经影像学检查评估均达到CR状态。动员前移植组所有患者造血功能及心肺肝肾功能均恢复正常。动员方案采用化疗药物联合粒细胞集落刺激因子(granulocytecolony stimulating factor,G-CSF),其中有15例采用单药环磷酰胺化疗;10例采用EAC方案(依托泊苷+环磷酰胺+阿糖胞苷)化疗。皮下注射G-CSF的最佳时机为待外周血白细胞降低至最低值时,剂量为5~10 μg/(kg·d),连续用药3~5 d至外周血白细胞超过5.0×10·L时进行造血干细胞采集。采用外周血细胞分离机进行外周造血干细胞分离。本研究对每位移植组患者进行外周血干细胞采集1~3次。造血干细胞采集结束后放置于-80℃的环境保存。
1.4 预处理方案
预处理方案为BUCY方案或者BEAM方案。其中采用BUCY方案15例,采用BEAM方案10例。具体方案如下:
①BUCY方案:白消安 3.2 mg/(kg·d)-6 d~-4 d,环磷酰胺 35 mg/(kg·d)-3 d~-2 d;②BEAM方案:卡莫司汀 300 mg/(m·d)-8 d,依托泊苷 100~150 mg/(m·d)-7 d~-4 d,阿糖胞苷 200~400 mg/(m·d)-7 d~-4 d,马法兰 140 mg/(m·d)-2 d。
1.5 造血干细胞回输及支持治疗
预处理结束后24 h回输自体造血干细胞,回输后加强支持治疗。所有移植组患者均预防性使用药物预防常见的感染:左氧氟沙星预防消化道感染,更昔洛韦预防巨细胞病毒感染,氟康唑预防真菌感染,复发磺胺甲噁唑预防卡氏肺孢子菌病。每日密切监测患者体温、血尿常规指标、生化指标等。血红蛋白<60 g·L时予输注红细胞治疗,血小板<20×10·L时予输注血小板治疗。
1.6 疗效评估及随访
通过增强CT或PET-CT等影像学检查结果,根据2014年Lugano修订版淋巴瘤疗效评价标准判断治疗效果,分为CR、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。采用美国国立癌症研究所常见毒性分级标准CTCAE 4.0评价药物不良反应,分为Ⅰ~Ⅳ级。通过查阅住院病历、门诊病历或电话等方式进行随访,随访截止时间为2021年12月31日。第1~2年每3~6个月复查增强CT或PET-CT,第3~5年每6个月复查增强CT或每12个月复查PET-CT。主要研究终点为无复发生存期(relapse-free survival,RFS):疾病缓解至初次复发的时间。次要研究终点为OS:从随机化开始至(因任何原因)死亡的时间。
1.7 统计学方法
使用SPSS 25.0软件进行统计学处理,计量资料的组间比较采用两独立样本的t
检验或秩和检验;计数资料比较采用χ
检验;生存分析采用Kaplan-Meier法绘制生存曲线,分析RFS及OS。P
<0.05为差异有统计学意义。2 结果
2.1 患者临床特征
本研究共筛选出78例接受化疗后达到CR的初治中高危DLBCL患者,其中1例患者继发中枢神经系统肿瘤,2例患者拒绝随访,因此经纳入排除标准共排除3例患者,最终75例患者纳入研究分析。75例患者中,25例患者化疗后序贯Auto-HSCT巩固治疗,即移植组(n
=25),50例患者化疗后不序贯Auto-HSCT巩固治疗,即对照组(n
=50)。在移植组中,男性15例(60%),女性10例(40%),中位年龄50岁(34.5~60.5岁),≥60岁7例;在对照组中,男性21例(42%),女性29例(58%),中位年龄54岁(43.75~65.25岁),≥60岁有22例。两组在年龄、性别、细胞起源、B症状、IPI评分、Ann Arbor分期、淋巴结及淋巴结外侵犯、骨髓侵犯、Ki-67、肿瘤大小、是否双表达等分布上差异均无统计学意义(P
>0.05),见表1。表1 移植组与对照组患者的一般资料[(%)]
Tab 1 General information of patients in the transplant group and the control group [(%)]
项目 特征 移植组(n=25)对照组(n=50)P年龄/岁 ≥60 7(28) 22(44) 0.180<60 18(72) 28(56)性别 男 15(60) 21(42) 0.141女10(40) 29(58)细胞起源 non-GCB 20(80) 39(78) 0.842 GCB 5(20) 11(22)B症状 有 17(68) 43(86) 0.066无8(32) 7(14)IPI评分/分 3 19(76) 44(88) 0.181≥4 6(24) 6(12)Ann Arbor分期Ⅰ~Ⅱ 8(32) 23(46) 0.246Ⅲ~Ⅳ 17(68) 27(54)侵犯部位 淋巴结 10(40) 29(58) 0.141淋巴结外侵犯 15(60) 21(42)骨髓侵犯 有 6(24) 13(26) 0.857无19(76) 37(74)Ki-67 ≥70% 17(68) 32(64) 0.731<70% 8(32) 18(36)肿瘤大小/cm≥7.5 5(20) 6(12) 0.356<7.5 20(80) 44(88)双表达 有 9(36) 16(32) 0.729无16(64) 34(68)
2.2 造血干细胞的造血重建
25例移植组患者最终输注的CD34细胞中位 数 为7.43×10·kg(1.91×10~21.16×10·kg),单核细胞中位数为7.58×10·kg(1.37×10~15.75×10·kg)。所有移植患者在移植期间均未发生严重并发症,均获得造血重建。中性粒细胞>0.5×10·L的中位时间为12 d(5~19 d),血小板≥20×10·L的中位时间为15.4 d(10~22 d)。
2.3 两组治疗效果比较及生存分析
随访截至2021年12月31日,移植组的中位随访时间为26个月(13~34个月),4例患者在随访过程中出现疾病复发,复发率为16%;其中2例患者因疾病进展死亡,病死率为8%。其余21例移植患者在截至随访终点时均为无复发生存。对照组的中位随访时间为24.5个月(17~35个月),截至随访终点,有21例患者在观察随访期间出现疾病复发进展,复发率为42%;复发患者均选用后线治疗方案继续治疗,其中6例患者死于肿瘤复发进展导致的多器官衰竭,病死率为12%。其余29例移植患者在截至随访终点时均为无复发生存。移植组的2年RFS率显著高于对照组(79.1%vs
54.7%,P
=0.039),见图1;而移植组和对照组2年OS率差异无统计学意义(92%vs
89.9%,P
=0.722),见图2。进一步对年龄、性别、细胞起源、骨髓侵犯、B症状、IPI评分、Ann Arbor分期、淋巴结及淋巴结外侵犯、Ki-67、肿瘤大小、是否双表达等单因素进行亚组分析,结果见表2。两组在不同年龄、性别、骨髓侵犯、B症状、IPI评分、Ann Arbor分期、淋巴结及淋巴结外侵犯、Ki-67、肿瘤大小、是否双表达的2年RFS率差异无统计学意义(均P
>0.05)。亚组分析显示,在non-GCB型患者中,移植组2年RFS率高于对照组(81.8%vs
51.7%,P
=0.021),见图3。另外,将25例移植组患者根据不同的预处理方案分为两个亚组,采用BEAM方案的为移植组1(n
=10),采用BUCY方案的为移植组2(n
=15),两亚组间进行RFS、OS分析,结果提示移植组1与移植组2的2年RFS率、OS率差异均无统计学意义(67.5%vs
83%,P
=0.656,90%vs
93.3%,P
=0.792),分别见图4、图5。表2 移植组与对照组患者2年RFS率的比较(%)
Tab 2 2-year RFS rates between transplant group and control group (%)
项目 特征 移植组(n=25)对照组(n=50)P年龄/岁 ≥60 85.7 38.5 0.222<60 79.7 67.7 0.228性别 男 74.3 53.60.262女85.7 55.4 0.061细胞起源 non-GCB 81.8 51.7 0.021 GCB 50.0 81.8 0.840 B症状 有 87.5 42.9 0.128无72.6 61.7 0.138 IPI评分/分 3 79.2 58.7 0.081≥4 83.3 33.3 0.294 Ann Arbor分期Ⅰ~Ⅱ 80.0 59.8 0.161Ⅲ~Ⅳ 79.4 50.8 0.125侵犯部位 淋巴结 83.3 59.7 0.119淋巴结外侵犯 74.3 46.8 0.131骨髓侵犯 有 66.7 23.1 0.258无82.1 66.9 0.121 Ki-67 ≥70% 66.2 47.9 0.163<70% 98.0 65.7 0.080肿瘤大小/cm ≥7.5 80.0 16.7 0.124<7.5 78.9 61.5 0.099双表达 有 51.9 12.5 0.695无81.8 77.1 0.054
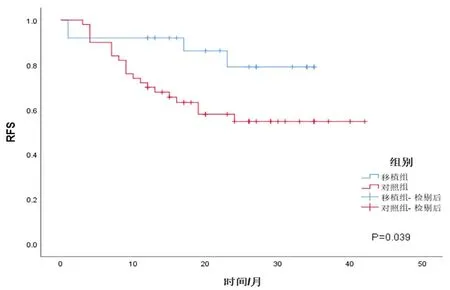
图1 移植组与对照组患者的无复发生存曲线Fig 1 Relapse-free survival curves of patients in both groups

图2 移植组与对照组患者的总生存曲线Fig 2 Overall survival curves of patients in both groups

图3 移植组与对照组non-GCB型患者的无复发生存曲线Fig 3 Relapse-free survival curves of non-GCB patients in both groups

图4 移植组1与移植组2患者的无复发生存曲线Fig 4 Relapse-free survival curves of patients in the transplantation group 1 and group 2

图5 移植组1与移植组2患者的总生存曲线Fig 5 Overall survival curves of patients in the transplantation group 1 and transplantation group 2
2.4 不良反应
25例移植组患者均未发生移植相关死亡事件,所有患者在移植后均出现血液系统不良反应,其中粒细胞缺乏伴发热20例(80%),肺部感染6例(24%),败血症2例(8%),上述不良反应经抗菌药物治疗后感染得到控制;其他不良反应包括低钾血症8例(32%),恶心呕吐8例(32%),腹泻4例(16%),口腔溃疡2例(8%),周围神经炎2例(8%),Ⅰ~Ⅱ度肝功能损伤2例(8%),肛周感染1例(4%),心功能不全1例(4%);予对症治疗后均痊愈。对照组在化疗过程中出现粒细胞缺乏伴发热14例(28%),恶心呕吐26例(52%),肺部感染8例(16%),Ⅰ~Ⅱ度肝功能损伤8例(16%),皮疹4例(8%),胃肠道感染3例(6%);上述不良反应经对症治疗后均痊愈。
3 讨论
DLBCL患者经标准一线R-CHOP方案化疗后存在部分复发难治,虽有挽救治疗方案,如后线化疗方案、靶向药物联合化疗、程序性死亡受体-1(programmed death-1,PD-1)抑制剂等,但效果均不太理想。基于DLBCL存在着高异质性、易复发进展等特点,为进一步减少肿瘤复发进展,可选用非细胞毒性药物方案对化疗后达到CR的DLBCL患者进行巩固治疗。但真实世界的研究结果却不尽如人意,多项研究证实应用利妥昔单抗、来那度胺或靶向药物对DLBCL患者进行巩固治疗并不能明显改善患者的预后;亦有研究表明应用PD-1抑制剂对DLBCL患者进行巩固治疗仅在中高危、non-GCB型DLBCL患者时表现出潜在的优势,但不能改善患者的OS;且目前PD-1抑制剂应用于DLBCL巩固治疗尚处于初始阶段,无标准治疗方案。目前急需为化疗后获得CR的DLBCL患者寻找有效的巩固治疗方案,以提高患者的生存及预后。
Auto-HSCT为在疾病缓解期采集自身的造血干细胞,经预处理后回输入患者体内的一种治疗方法,其能重建患者的免疫功能及造血功能,进一步杀死肿瘤细胞,提高疾病的治疗效果。因Auto-HSCT具有快速恢复免疫功能及造血功能、移植并发症少、安全有效、经济等特点,近年来Auto-HSCT已被广泛应用于DLBCL的治疗,尤其是Auto-HSCT在DLBCL患者巩固治疗已成为研究的热点。有研究证实Auto-HSCT无论在DLBCL患者巩固治疗,还是挽救复发治疗,均获得了较好的疗效。Kim等分析了Auto-HSCT应用于高危DLBCL患者的疗效,将高危DLBCL患者分为移植组(n
=81)及非移植组(n
=138),分析结果提示移植组的PFS率与OS率均显著优于非移植组(76.6%vs
63.3 %,P
=0.007;85%vs
75.8%,P
=0.038),进一步肯定了Auto-HSCT治疗DLBCL的疗效。Yoon等的随机对照研究显示,把58例中高危、一线R-CHOP方案化疗6周期达到CR的DLBCL患者随机分为两组,治疗组接受Auto-HSCT巩固治疗,对照组不接受Auto-HSCT巩固治疗,结果提示治疗组的PFS率明显较对照组延长(66%vs
39%,P
=0.004)。周佳思等回顾性分析了40例初治中高危DLBCL患者的临床资料,所有患者接受6周期R-CHOP方案化疗均达到SD,把序贯Auto-HSCT治疗的为移植组(n
=24),不序贯Auto-HSCT治疗的为对照组(n
=16),结果显示移植组预计3年的PFS率与OS率均高于对照组(78.8%vs
38%,85.7%vs
50%,均P
<0.05)。本研究回顾性分析既往经过R-CHOP方案化疗后达到CR的初治中高危DLBCL患者,结果显示移植组2年RFS率优于对照组(79.1%vs
54.7%,P
=0.039),移植组获益。虽然上述研究及本研究均提示对于初治中高危DLBCL的患者经过R-CHOP方案化疗后序贯Auto-HSCT巩固治疗能使PFS或OS获益,但均为小样本回顾性分析报告。然而,一项来自Schmitz等的前瞻性临床研究,随机把年轻、中高危的侵袭性B细胞非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)患者分为R-CHOEP-14组及R-MegaCHOEP序贯Auto-HSCT组,比较两组的临床疗效,结果提示两组3年的PFS率差异无统计学意义(61.4%vs
69.5%,P
=0.14)。此研究对Auto-HSCT作为侵袭性B细胞NHL患者巩固治疗提出了质疑,因此,未来需更多的大规模前瞻性研究评估Auto-HSCT在中高危DLBCL患者巩固治疗中的地位。本研究亚组分析显示,对于存在non-GCB型预后不良因素的DLBCL患者,化疗后序贯Auto-HSCT巩固治疗更能改善2年的RFS(81.8%vs
51.7%,P
=0.021)。考虑可能原因为non-GCB型患者肿瘤细胞内信息传导通路被抑制,导致肿瘤细胞的凋亡受阻,不利于病情的转归。进一步表明non-GCB型是患者独立的预后不良因素。廖已函等对80例DLBCL患者进行回顾性分析,单因素分析结果亦显示non-GCB型患者为影响预后的独立危险因素。因此认为,伴有non-GCB型预后不良因素的DLBCL患者较GCB型患者更容易出现复发难治,也可能是序贯Auto-HSCT巩固治疗更容易获益的人群。另外,Kim等分析了预处理方案采用BEAM方案或BUCY方案的65例接受Auto-HSCT的非霍奇金淋巴瘤患者,结果表明BEAM方案与BUCY方案的生存结果相似。本研究对预处理方案分别采用BEAM方案或BUCY方案的25例移植组患者进行RFS、OS分析,结果提示2年RFS率、OS率差异均无统计意义,提示两种预处理方案无明显差别,疗效相当。与上述的研究结果亦相符。Auto-HSCT治疗DLBCL患者的疗效确切,安全性相对较好。多项研究提示Auto-HSCT的主要不良反应为Ⅲ~Ⅳ级骨髓抑制、胃肠道反应、肝功能损伤等,予对症治疗后均好转。本研究所有移植患者均未发现移植相关死亡,主要不良反应为粒细胞缺乏伴发热,部分出现了肺部感染、败血症、胃肠道反应及其他Ⅰ~Ⅱ级比较轻微的反应,经对症治疗后均痊愈。安全数据与上述研究安全数据相符,进一步提示序贯Auto-HSCT巩固治疗为安全可控的。本研究总体不良反应发生率较低、程度较轻,考虑与样本量偏少有关。
本研究存在的局限性:①MYC、Bcl-2和/或Bcl-6重排为影响预后的不良因素,本研究未能把此类DLBCL患者纳入分析,而这个预后不良因素可能会影响RFS、OS的分析结果;②单因素分析提示两组的non-GCB型患者2年的RFS对比差异有统计学意义,但未能进一步运用COX比例风险回归模型校正混杂因素,而这因素亦可能会影响RFS、OS的分析结果;③ 本研究为小样本单中心回顾性分析,虽两组患者的基线水平相当,但因样本量小,随访时间过短,最终分析的OS无明显差异。后续需开展更多的大样本、多中心前瞻性研究以进一步探讨该方案的疗效及安全性。
