多花黄精须根营养成分及抗氧化活性研究
2022-09-13高海燕余欢迎金传山许凤清刘军玲柳春风李雷安徽中医药大学药学院合肥230012中药饮片制造新技术安徽省重点实验室合肥230012安徽省食品药品检验研究院合肥23001金寨润元生物科技有限公司安徽六安237300金寨森沣农业科技开发有限公司安徽六安237000
高海燕,余欢迎,金传山*,许凤清,刘军玲,柳春风,李雷(1.安徽中医药大学药学院,合肥 230012;2.中药饮片制造新技术安徽省重点实验室,合肥 230012;3.安徽省食品药品检验研究院,合肥 23001;.金寨润元生物科技有限公司,安徽 六安 237300;.金寨森沣农业科技开发有限公司,安徽 六安 237000)
《中国药典》2020年版规定黄精为百合科黄精属黄精(Polygonatum
sibiricum
)、滇黄精(Polygonatum kingianum
)和多花黄精(Polygonatum cyrtonema
)的干燥根茎,味甘、性平,归脾、肺、肾经,具有补气养阴、健脾、润肺、益肾的功效,用于脾胃气虚、体倦乏力、肺虚燥咳、精血不足、须发早白等。研究表明,黄精的主要化学成分为甾体皂苷类、多糖类、黄酮类、生物碱、木脂素以及多种对人体有用的氨基酸等化合物,药理作用包括抗肿瘤、抗氧化、抗衰老、抗疲劳等。其中氨基酸是黄精补益强壮作用和增强免疫功能的物质基础之一,可作为疾病防治过程中减轻药物毒副作用的补充替代品。目前,多花黄精以根茎入药,其研究也集中于根茎的炮制加工、活性成分提取及药理药效等方面,而须根在采收产地加工过程中常作为杂质除去。据统计,多花黄精须根约占根茎总重量的10%,有研究表明黄精须根和根茎中的成分基本相同,含多糖、氨基酸、微量元素等,所以有望作为新资源进行开发和利用。王天梅等测定多花黄精根、茎、叶、花和嫩芽5 个部位提取液的DPPH 自由基、羟基自由基以及亚硝酸盐的清除率,结果表明,提取物的抗氧化能力为叶>嫩芽>花>根。周东月等采用水提醇沉法提取黄精中的多糖类化合物,并探讨黄精多糖的抗氧化活性,结果表明,黄精多糖具有较好的还原能力以及清除DPPH 自由基、超氧阴离子自由基、羟基自由基的能力。本实验以多花黄精须根为研究对象,测定其浸出物、多糖和氨基酸含量,且采用同一提取方式对多花黄精须根的醇溶性成分进行提取,对其不同极性部位的体外抗氧化活性进行测定分析,为合理利用须根资源提供了理论依据。1 材料
L-8800 全自动氨基酸分析仪(日本日立公司);FD240 电热恒温干燥箱(德国Binder 公司);UV-2700 紫外可见分光光度计(日本岛津公司);Multiskan spectrum 全波长酶标仪(美国赛默飞世尔科技有限公司);ML204 万分之一分析天平(瑞士Mettle-Toledo 公司);XMTE-205数显恒温水浴锅(常州国宇仪器制造有限公司);Simplicity-185 超纯水仪(美国默克密理博公司)。
多花黄精由安徽金寨润元生物科技有限公司提供,9 批分别采集于金寨县乡村:张冲乡(XG1)、油坊店乡(XG2)、花石乡大湾村(XG3)、花石乡花石村(XG4)、长岭乡(XG5)、槐树湾乡(XG6)、桃岭乡桃岭村(XG7)、桃岭乡牌坊村(XG8)、沙河乡(XG9),由安徽中医药大学药学院刘守金教授鉴定为百合科植物多花黄精的带须根茎,除去泥土,洗净,蒸至透心,干燥,收集黄精根茎以及须根。氨基酸混合标准溶液(日本日立公司),DPPH、ABTS 和抗坏血酸(阿拉丁试剂有限公司);D
-无水葡萄糖(纯度:98%,上海源叶生物科技有限公司);水为超纯水,其他试剂为分析纯。2 方法
2.1 浸出物含量测定
按照2020年版《中国药典》中醇溶性浸出物法(通则2201)项下的热浸法测定,重复实验3次,取平均值。
2.2 多糖含量测定
2.2.1 对照品溶液的制备 取D
-无水葡萄糖对照品适量,置100 mL 量瓶中,加水溶解并稀释至刻度,摇匀,即得每1 mL 中含无水葡萄糖0.3316 mg 的对照品溶液。2.2.2 标准曲线的绘制 精密量取对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL,分别置于10 mL 具塞刻度试管中,各加水至2.0 mL,摇匀,在冰浴中缓慢滴加0.2%蒽酮-硫酸溶液至刻度,混匀,放冷后置水浴中保温10 min,取出,立即置冰水浴中冷却10 min,取出,以相应试剂为空白。照紫外-可见分光度法(通则0401),在582 nm 波长处测定吸光度。以吸光度为纵坐标,质量浓度为横坐标,绘制标准曲线,Y
=3.360X
+0.2165,R
=0.9994,线性范围为0.0332 ~0.1990 mg·mL。2.3 氨基酸含量测定
2.3.1 对照品溶液的制备 分别精密移取17 种氨基酸对照品适量,用0.02 mol·L盐酸溶解至一定浓度(胱氨酸为1.25µmol·mL,其他氨基酸均为2.50
µmol·mL)作为母液备用。取适量母液,按一定梯度比例稀释,采用自动在线衍生化方法进行衍生化检测。
2.3.2 供试品溶液的制备 取须根样品粉末0.1 g,精密称定,置10 mL 顶空瓶中,精密加入浓盐酸和水各2 mL,封口,将顶空瓶放入150℃恒温干燥箱中,水解1 h,冷却,移入蒸发皿中,蒸干,残渣加0.02 mol·L盐酸溶液定容至50 mL 量瓶中,摇匀,过0.22 µm 水相微孔滤膜,即得。
2.3.3 氨基酸自动分析仪分析条件 色谱柱:INCH 离子交换柱(4.6 mm×60 mm); 柱温57 ℃;衍生反应器温度135℃;检测波长:脯氨酸440 nm,其他氨基酸570 nm;进样量20 µL;缓冲液流速0.400 mL·min;缓冲液泵压0 ~30 MPa;茚三酮流速0.350 mL·min;茚三酮泵压0 ~3.5 MPa;缓冲液改变次数6 次;分析时间53 min,取混合氨基酸对照品溶液和样品溶液各20 µL 注入氨基酸自动分析仪,记录各氨基酸的峰面积,按照外标法计算含量。
2.4 体外抗氧化活性
2.4.1 样品的制备 醇提物制备:参照文献并稍作改动。称取须根粉末200 g,加10 倍量50%乙醇水浸泡1 h 后,加热回流提取3 次,每次2 h,过滤,滤液减压浓缩至干,冷冻干燥。不同极性萃取部位的制备:取醇提物,加入100 mL 温水溶解,依次用等体积的乙酸乙酯、正丁醇溶液分别萃取3 次,减压回收溶剂,得到各萃取部位,称重。分别精密称取须根的乙酸乙酯萃取部位、正丁醇萃取部位、剩余水部位以及醇提物,加蒸馏水溶解,制得1.0 mg·mL的样品溶液;将阳性对照品维生素C 配制成1.0 mg·mL的溶液,避光冷藏。依次将样品和维生素C 对照品稀释成0、0.2、0.4、0.6、0.8、1.0 mg·mL6 个质量浓度。
2.4.2 DPPH 自由基清除率测定 参照文献的方法,并作适当改动。取不同浓度的样品溶液1.0 mL 与2.0 mL 0.2 mmol·L的DPPH 溶液混合,充分振荡,室温暗处反应30 min,在517 nm波长下测定吸光度,记为A
,平行重复3 次。以蒸馏水代替样品作为空白对照(A
),以蒸馏水代替反应液记为A
,以维生素C 作为阳性对照,计算公式(1)如下: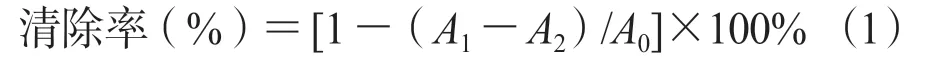
2.4.3 ABTS自由基清除能力的测定将7 mmol·LABTS 溶液与2.45 mmol·L过硫酸铵混合避光氧化12 h,用PBS 稀释ABTS 混合液,在734 nm 波长下测定吸光度值为(0.80±0.02)。取不同部位的样品溶液及维生素C 对照品1 mL 与2 mL ABTS 混合液混合,室温放置6 min,在734 nm 波长下测吸光度值,重复3 次。按公式(1)计算清除率。
2.5 统计学处理方法
实验数据采用GraphPad Prism 9.0 绘图和SPSS 25.0 软件进行处理,均为3 次重复测定结果的平均值。
3 结果与分析
3.1 多花黄精须根成分含量
多花黄精须根的浸出物、多糖含量见表1。须根浸出物含量在42.48%~ 55.76%,平均值为49.26%,约为文献报道中黄精浸出物的66.7%。黄精药用价值和营养保健主要集中在多糖含量上,而须根的多糖含量为7.12%~9.36%,与文献报道的黄精多糖含量相近。
表1 多花黄精须根含量分析结果(%)
Tab 1 Content of fibrous root ofHua (%)
样品浸出物多糖XG145.069.36 XG242.488.43 XG345.467.12 XG455.768.16 XG549.358.42 XG652.198.63 XG754.088.67 XG849.858.90 XG949.088.34均值49.268.45
3.2 氨基酸组成分析
从多花黄精须根中鉴定出17 种氨基酸成分,结果见表2。须根氨基酸总量(TAA)为6.09%~10.43%,平均值为8.08%。其中,谷氨酸含量最高,为1.49%~2.44%,平均含量为1.86%;其次为精氨酸、门冬氨酸,平均含量分别为1.04%、0.80%。
表2 多花黄精须根中氨基酸组成和含量(%)
Tab 2 Amino acid in fibrous root of Hua (%)
注:为必需氨基酸。
Note: means essential amino acid.
种类产地门冬氨酸(Asp)苏氨酸*(Thr)丝氨酸(Ser)谷氨酸(Glu)甘氨酸(Gly)丙氨酸(Ala)胱氨酸(Cys)缬氨酸*(Val)甲硫氨酸*(Met)异亮氨酸*(Ile)亮氨酸*(Leu)酪氨酸(Tyr)苯丙氨酸*(Phe)赖氨酸*(Lys)组氨酸(His)精氨酸(Arg)脯氨酸(Pro)TAA EAA NAAEAA/TAA XG1 0.92 0.34 0.55 2.11 0.39 0.52 1.02 0.40 0.08 0.29 0.55 0.33 0.32 0.61 0.24 1.23 0.52 10.43 2.59 7.83 24.86 XG2 1.01 0.36 0.59 2.10 0.40 0.53 0.65 0.39 0.08 0.28 0.55 0.34 0.32 0.59 0.24 1.10 0.54 10.07 2.57 7.50 25.52 XG3 0.91 0.31 0.49 1.79 0.34 0.46 0.57 0.24 0.08 0.15 0.4 0.25 0.29 0.45 0.19 1.01 0.45 8.38 1.92 6.46 22.91 XG4 0.94 0.34 0.55 2.44 0.33 0.46 0.64 0.29 0.07 0.20 0.44 0.29 0.27 0.50 0.20 1.36 0.44 9.76 2.11 7.65 21.62 XG5 0.82 0.36 0.44 1.98 0.29 0.42 0.56 0.21 0.05 0.12 0.34 0.25 0.28 0.36 0.15 1.11 0.36 8.10 1.72 6.38 21.23 XG6 0.70 0.44 0.35 1.82 0.26 0.37 0.44 0.16 0.04 0.08 0.24 0.20 0.29 0.27 0.12 0.98 0.24 7.00 1.52 5.48 21.71 XG7 0.64 0.31 0.30 1.49 0.25 0.34 0.52 0.15 0.04 0.08 0.24 0.19 0.28 0.26 0.11 0.93 0.25 6.38 1.36 5.02 21.32 XG8 0.68 0.33 0.32 1.50 0.26 0.37 0.47 0.16 0.04 0.08 0.25 0.23 0.30 0.27 0.11 0.88 0.27 6.52 1.43 5.09 21.93 XG9 0.60 0.12 0.29 1.55 0.25 0.36 0.62 0.16 0.04 0.08 0.23 0.17 0.27 0.25 0.09 0.78 0.24 6.09 1.15 4.95 18.85均值 0.80 0.32 0.43 1.86 0.31 0.43 0.61 0.24 0.06 0.15 0.36 0.25 0.29 0.40 0.16 1.04 0.37 8.08 1.82 6.26 22.52
相对于植物,人类和动物均需要通过食物蛋白来摄取某些氨基酸,这些人体中无法合成的氨基酸称为必需氨基酸(EAA),多花黄精须根中检测出EAA 7 个,非必需氨基酸(NAA)10 个。须根EAA 质量分数在1.15%~2.59%,平均值为1.82%,其中XG9 中EAA 质量分数最小,XG1 质量分数最高。根据世界卫生组织/联合国粮农组织(WHO/FAO)颁布的理想蛋白质必需氨基酸模式谱,EAA/TAA 的标准比值为40%,须根中EAA/TAA 的比值范围为18.85%~25.52%,与WHO/FAO 氨基酸标准值40%有一定差距。
3.3 自由基清除能力
3.3.1 DPPH 自由基的清除能力 结果显示多花黄精须根各极性萃取部位能良好地清除DPPH 自由基,且存在量效关系。须根各极性萃取相清除能力由大到小依次为乙酸乙酯相>醇提物>水相>正丁醇相(见表3 及图1)。
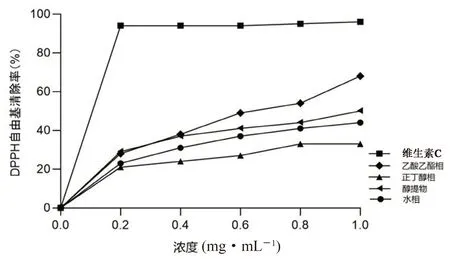
图1 多花黄精须根不同极性部位对DPPH 自由基清除能力Fig 1 In vitro antioxidant activities of Polygonatum cyrtonema Hua’s different polar extracts evaluated by the DPPH radicals scavenging abilities
3.3.2 ABTS自由基的清除能力 结果显示,须根各极性萃取相清除能力由大到小依次为乙酸乙酯相>水相>醇提物>正丁醇相。在质量浓度为1.0 mg·mL时,不同极性萃取部位中乙酸乙酯相清除能力最强,清除率达到97.86%,其IC
值为0.59 mg·mL(见表3 及图2)。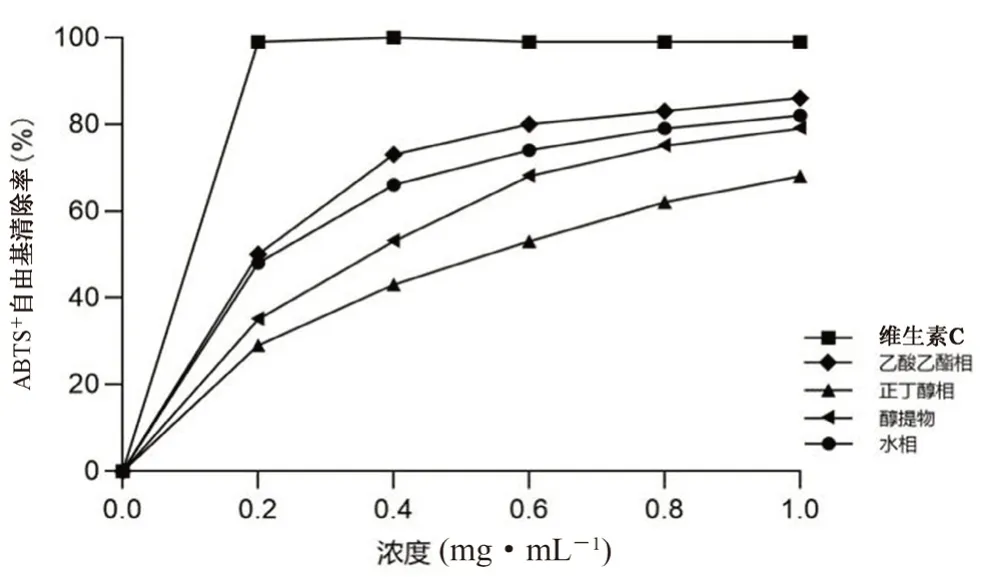
图2 多花黄精须根不同极性部位对ABTS 阳离子自由基清除能力Fig 2 In vitro antioxidant activities of Polygonatum cyrtonema Hua’s different polar extracts evaluated by the ABTS radicals scavenging abilities
表3 不同极性萃取部位抗氧化活性
Tab 3 Antioxidant activity of extracts with different polarity
部位DPPH 自由基/(mg·mL-1)ABTS+自由基/(mg·mL-1)乙酸乙酯相0.780.59正丁醇相0.920.75水相0.860.62醇提物0.820.68
3.3.3 醇提物抗氧化活性与多糖含量的相关性 采用SPSS 25.0 软件对醇提物中多糖含量与DPPH 自由基清除率和ABTS自由基清除率进行相关性分析,结果表明,多糖含量与DPPH 自由基清除率显著相关(P
=0.005);多糖含量与ABTS自由基清除率显著相关(P
=0.002)。4 讨论与结论
多花黄精须根中含有丰富的多糖、氨基酸等,其中浸出物含量为42.48%~55.76%;多糖含量为7.12%~9.36%;须根中鉴定出17 种氨基酸,总氨基酸含量为6.09%~10.43%,而谷氨酸含量最高,为1.49%~2.44%,该结果与王曙东等研究黄精根茎及须根的氨基酸分析结果一致。虽然须根中EAA/TAA 的比值范围为18.85%~25.52%,与WHO/FAO 氨基酸标准值40%有一定差距,但是WHO/FAO 规定的标准并非针对植物蛋白,目前研究表明完全符合此标准的植物蛋白并不多,如木芙蓉花为22.33%~37.51%,蝶豆花为34.91%,重楼为26.12%~41.08%。黄精多糖具有调节免疫力、抗氧化等重要功能,夏晓凯等探讨黄精多糖的体内外抗氧化作用,发现黄精多糖的体外能抑制自发的和诱导的脂质过氧化产物的含量,王爱梅等的研究表明黄精一方面可以抑制大脑里氧自由基的生成,另一方面可以强化大脑对氧自由基清除的力度,发挥抗氧化作用。氨基酸是黄精补益作用的物质基础,谷氨酸作为一种功能性氨基酸,不仅参与蛋白质的合成和氧化功能,而且具有改善肠道完整性、增强肠道屏障功能和抗氧化能力。缬氨酸治疗肾功能衰竭、败血症及加快外科创伤愈合;亮氨酸可降低血糖,缓解肥胖、代谢综合征,调节机体免疫等。本研究表明须根具有较强的抗氧化活性,与须根多糖含量明显相关。不同极性萃取相在抗氧化检测中均表现出不同程度的抗氧化活性,且存在一定的量效关系。乙酸乙酯相清除DPPH自由基能力和ABTS自由基能力最强,IC
值分别为0.78 mg·mL和0.59 mg·mL,不同极性萃取部位抗氧化能力趋势一致,但是结果差别较大,表明多花黄精须根不同极性部位的抗氧化活性存在差异,其原因可能与不同极性部位中主要活性成分的含量不同有关。目前使用的中药材往往取自植物的某一部分,其余非药用部分常作为废料而丢弃,这不仅不利于中药资源的综合利用,还造成了资源浪费和环境污染。有研究表明,药用植物的非药用部位具有与传统药用部位相同或相近的化学成分及作用,尤其是抗氧化活性。本研究发现,多花黄精须根的提取物具有一定的抗氧化活性,且抗氧化能力与浓度有关,因此,后续可从优化提取活性成分的角度,将多花黄精须根作为试样,进行进一步提取工艺考察,可为多花黄精须根资源再利用提供理论依据。
