四川省西南地区汉族人群CYP2C19基因多态性对PPIs治疗幽门螺杆菌疗效的影响
2022-09-10张富东余敏灵朱敏凤杨璐胡利群陈丽陈曦乔石易辉赵静刘粤张婷
张富东,余敏灵,朱敏凤,杨璐,胡利群,陈丽,陈曦,乔石,易辉,赵静,刘粤,张婷
(1. 四川省乐山职业技术学院,四川 乐山 614000;2. 四川省乐山市食品药品检验检测中心,四川 乐山 614000;3. 四川省乐山市市中区市场监督管理局,四川 乐山 614000;4. 乐山职业技术学院附属医院,四川 乐山 614000;5. 四川省食品药品审查评价及安全监测中心,四川 成都 610017)
幽门螺杆菌(Hp)是一种螺旋形、微厌氧、对生长条件要求十分苛刻的细菌,是慢性活动性胃炎、严重胃十二指肠溃疡最常见的病因,1983年首次从慢性活动性胃炎患者的胃黏膜活检组织中分离成功,是迄今为止发现能够在人胃中生存的唯一微生物种类。近年来,相关研究报道表明无铋剂的三联疗法和含铋剂的四联疗法Hp根除率均逐年下降[1],随着研究的深入发现可能与细胞色素P450酶(cytochrome P450,CYP)基因多态性有关,而CYP2C19是质子泵抑制剂(PPIs)最主要的代谢酶之一,其基因多态性能影响PPIs在患者体内的血药浓度,从而影响药物疗效和Hp根除率[2]。本课题组主要研究四川西南地区汉族人群CYP2C19基因多态性和PPIs(奥美拉唑、艾普拉唑)在含铋剂的四联疗法中Hp根除率的影响,从而为本地区Hp感染阳性患者开展精细化药学服务。
1 资料与方法
1.1 一般资料 研究对象为四川省乐山市、雅安市、眉山市和泸州市的4家三级医疗机构医院管理信息系统随机抽取2021年1月—2021年12月住院治疗的162例Hp阳性患者,均为汉族。患者的年龄在25~65岁,其中男性患者为88例,女性患者为74例。本次研究的病例纳入标准为[2]:14C-尿素呼气试验阳性,开展检查前患者已停用PPIs 2周以上或抗菌药物4周以上[3],且无青霉素、四环素过敏史;本次研究的病例排除标准为:开展检查前患者2周内用过PPIs或4周内用过抗菌药物,近期有影响 CYP2C19酶活性药物(如异烟肼、卡马西平等)用药史,以及有青霉素、四环素过敏史的患者。
1.2 基因型分析 4家医疗机构的荧光检测仪和检测试剂均购自相同厂家,分别为西安天隆科技有限公司和北京华夏时代基因科技发展有限公司。基因检测分析步骤,主要参考仪器设备厂家提供的操作指南以及侯文洁等[4]研究报道。根据基因检测结果,将符合纳入标准的162例Hp阳性患者划分为4种代谢类型:慢代谢型(PM,*2/*2,*2/*3,*3/*3)、中间代谢型(IM,*1/*2,*1/*3,*17/*2,*17/*3)、快代谢型(EM,*1/*1)以及超快代谢型(UM,*1/*17,*17/*17)[5-6]。
1.3 方法及分组 162例Hp阳性患者晨起空腹抽取静脉血5 mL,根据相关研究表明Hp对四环素 (95%~100%)、呋喃唑酮 (99%~100%)和阿莫西林 (95%~100%)3种抗菌药物的敏感性依然保持在较高水平[7-10],而Hp对克拉霉素、甲硝唑和左氧氟沙星3种抗菌药物的敏感性却在逐年下降。同时,在铋剂的研究中,尚未发现Hp对铋剂耐药[11],且证实铋剂短期应用于抗Hp治疗安全性高[12]。因此,本研究选择了PPIs (奥美拉唑、艾普拉唑)+铋剂(枸橼酸铋钾)+阿莫西林+四环素[13-15]的四联治疗方案,为2周疗程。疗程结束后,停用奥美拉唑、艾普拉唑2周及阿莫西林、四环素4周以上,再次进行14C-尿素呼气试验,结果显示阴性表明Hp根除,并计算各组根除率,同时分别对治疗前和疗程结束后的患者C-反应蛋白(C-reactive protein,CRP) 、白介素-10(interleukin-10,IL-10)进行检测。具体分组情况和给药剂量:组1、组2、组4和组5为UM、EM代谢型患者随机平均分配,各组为总病例数的1/4;组3和组6为IM、PM代谢型患者随机平均分配,各组为总病例数的1/2。见表1。
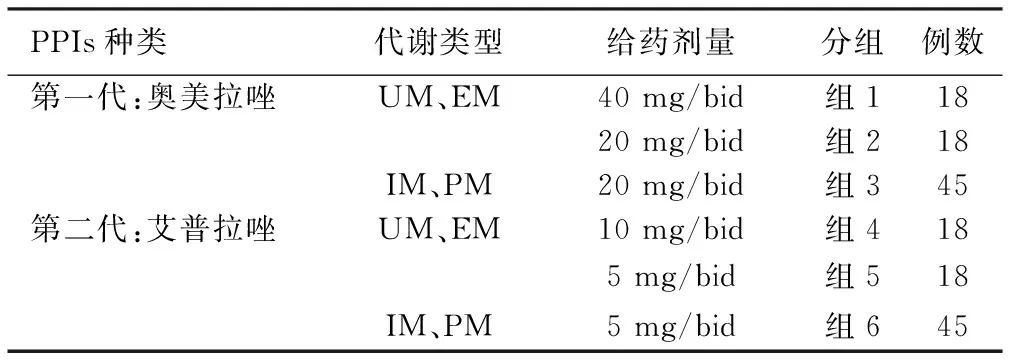
表1 分组情况和给药剂量

2 结果
2.1 CYP2C19基因型分布 162例研究对象基因型分布频率见表2,各基因型分布均符合Hardy-Weinberg平衡(P>0.05),说明该样本具有良好的人群代表性。
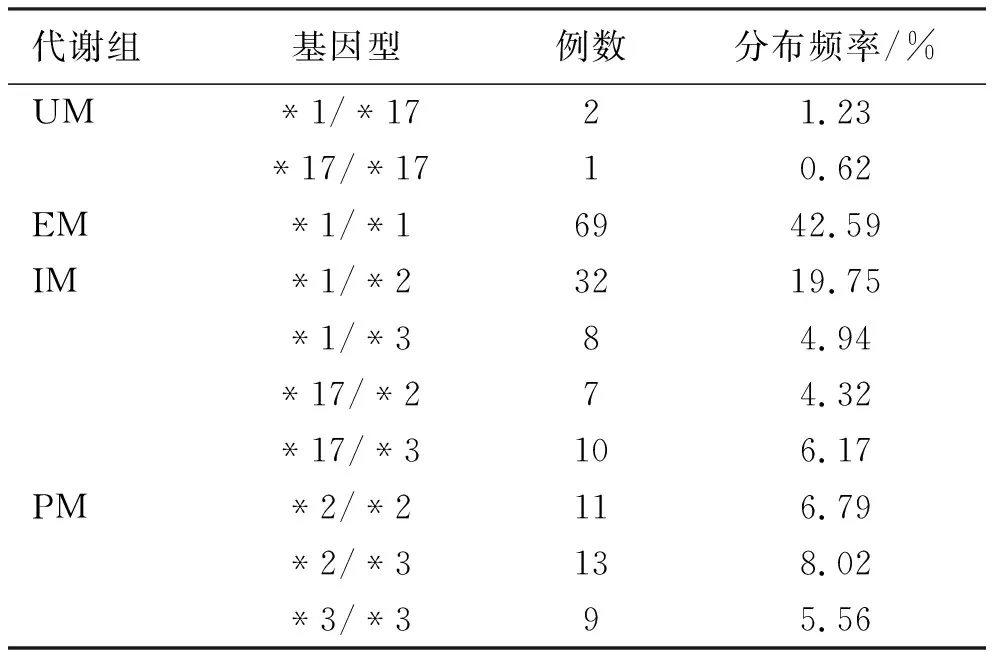
表2 CYP2C19基因型分布频率
2.2 不同代谢组对Hp根除率的影响 各代谢组间性别、年龄和体质量差异无统计学意义(P>0.05),提示具有可比性,见表3。分别统计奥美拉唑20 mg/bid、艾普拉唑5 mg/bid时不同代谢组患者的Hp根除率。组2根除率(44.44%)明显低于于组3根除率(82.22%),差异有统计学意义(P<0.05),组5根除率(88.89%)和组6根除率(91.11%),差异无统计学意义(P>0.05),见表4。
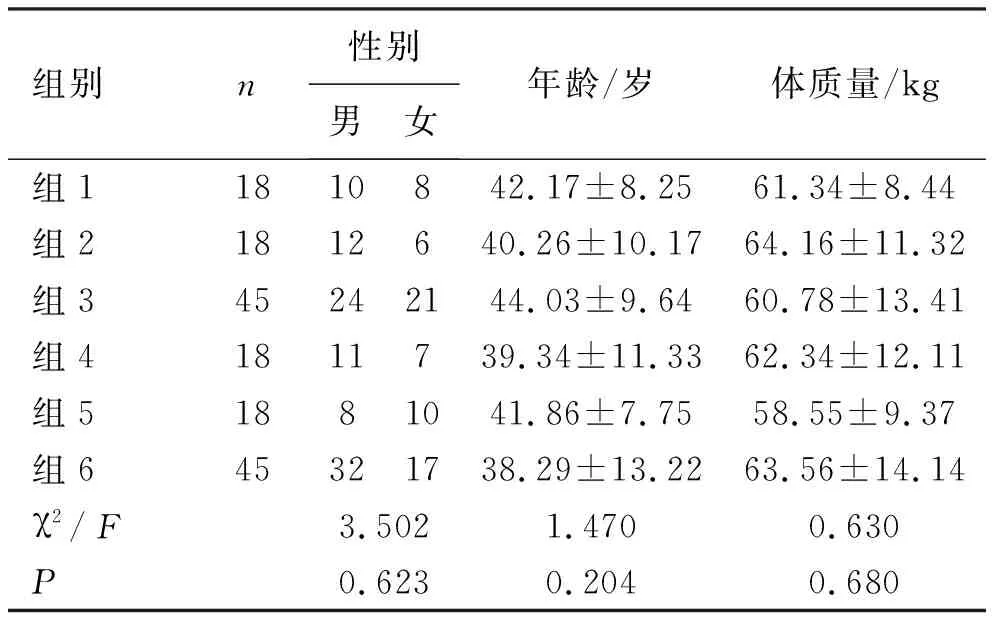
表3 各代谢组间性别、年龄和体质量统计结果
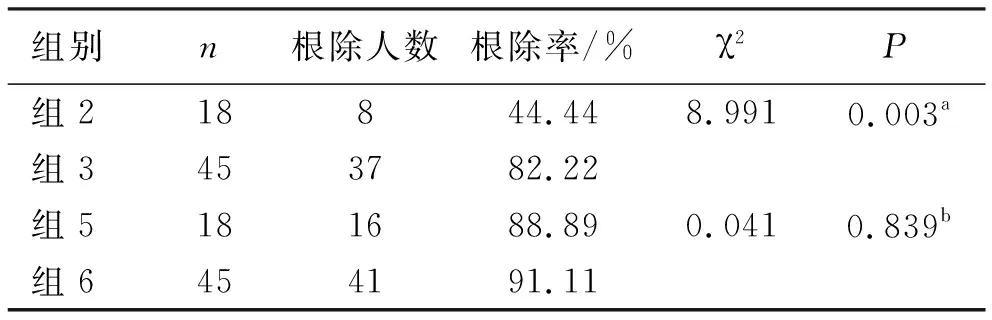
表4 不同代谢组对根除率的影响
2.3 UM、EM型患者中不同剂量对Hp根除率的影响 统计UM、EM型患者中奥美拉唑高剂量组40 mg/bid(组1)和常规剂量组20 mg/bid(组2)患者的Hp根除率,以及艾普拉唑高剂量组10 mg/bid(组4)和常规剂量组5 mg/bid(组5)患者的Hp根除率。奥美拉唑高剂量组(组1)根除率(88.89%)明显高于常规剂量组(组2)根除率(44.44%)(P<0.05),艾普拉唑高剂量组(组4)根除率(94.44%)与常规剂量组(组5)根除率(88.89%)差异无统计学意义(P>0.05),见表5。
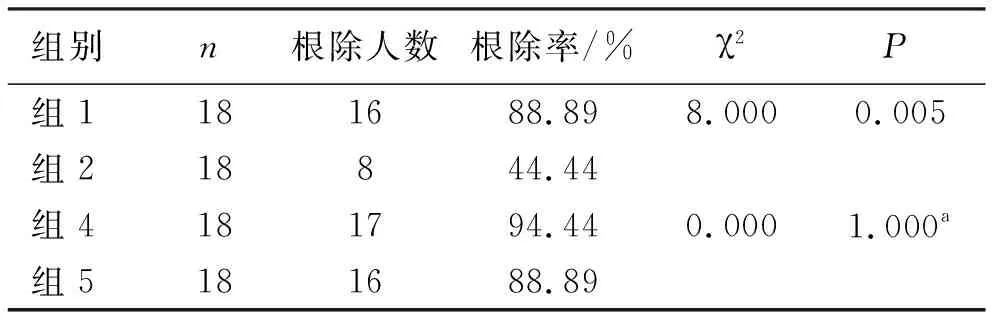
表5 不同剂量对根除率的影响
2.4 不同代谢组对患者治疗前后血清中炎性因子水平的影响 用t检验比较,统计结果显示3组治疗后患者的血清CRP 与IL-10含量均低于治疗前,根除率高的代谢组抑制血清中的炎性因子水平效果更确切,且具有统计学意义(P<0.05),见表6。
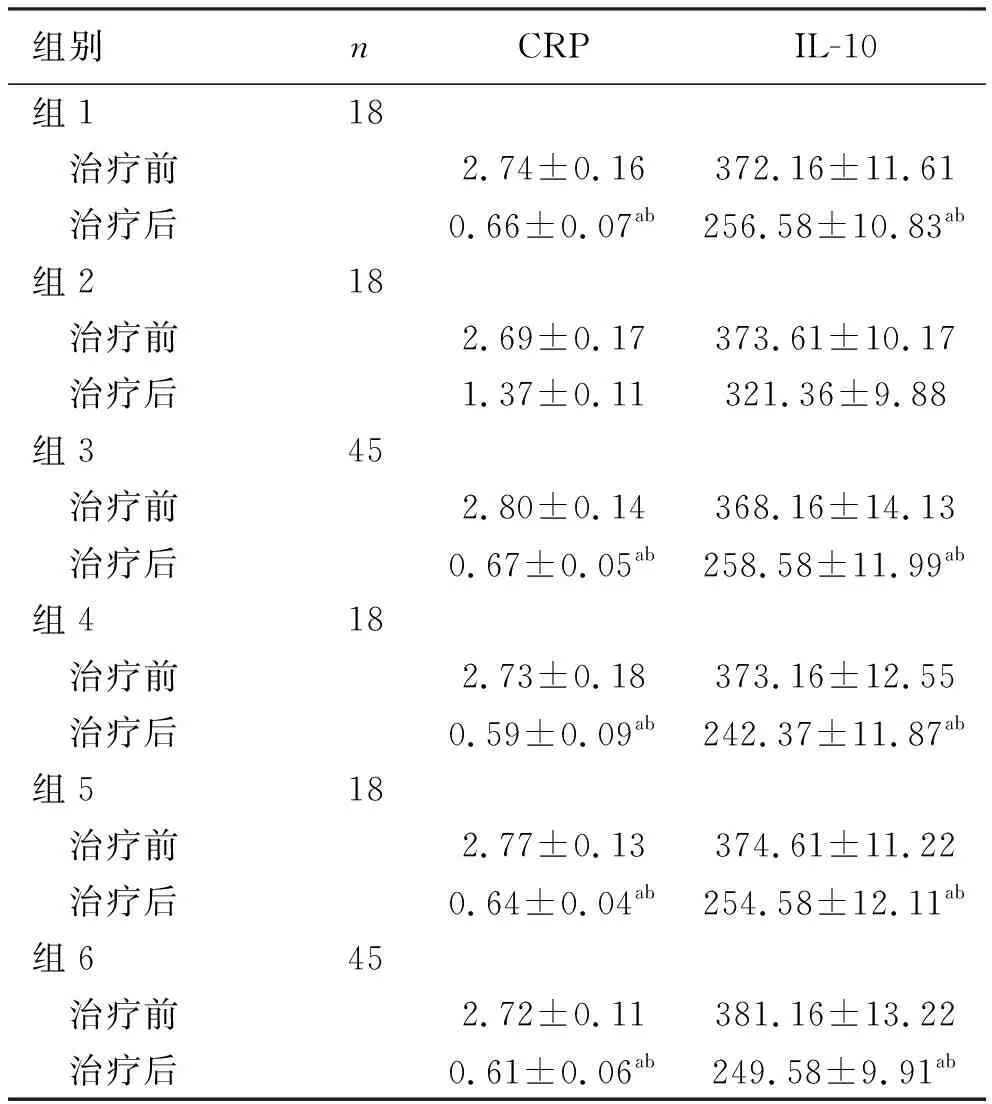
表6 不同代谢组对患者治疗前后血清中炎性因子水平的影响 单位:mg/L
3 讨论
目前研究表明,CYP2C19和CYP3A4是影响PPIs代谢的两大主要关键酶[16]。其中,奥美拉唑作为第一代 PPIs代表药物,CYP2C19可影响其90%的代谢,因此,CYP2C19的活性高低与奥美拉唑疗效强弱密切关联[17];而艾普拉唑作为第二代 PPIs代表药物,周银平等[18-19]研究表明,CYP2C19基因多态性对艾普拉唑的代谢并无影响,这与本研究结果基本吻合。
目前,研究者已发现30多种CYP2C19等位基因[20-21],其中CYP2C19*2、CYP2C19*3两种突变型基因最为常见,主要作用机制为破坏转录蛋白的活性使酶活性降低;而CYP2C19*17基因型则是近年来最新发现,主要作用机制为促使转录活性增强使代谢更快。据相关研究报道,CYP2C19基因型在不同人种中的分布特频率有显著差异,其中亚洲人群的分布特点为CYP2C19*17约占4%,CYP2C19*3占5%~13%,CYP2C19*2占20%~30%,CYP2C19*1约占65%[22]。本次研究所得四川省西南地区汉族人群CYP2C19基因型分布频率与文献报道中的亚洲人群CYP2C19基因型分布特点一致,人群代表性良好[23]。同时,近年来研究还发现血清炎性因子与Hp 相关性溃疡的发病有关[24]。本研究也通过统计学分析表明,各组患者治疗后CRP和IL-10水平均得到明显降低,且根除率高的代谢组抑制血清中的炎性因子水平效果更确切,并验证了Hp阳性患者的CRP、IL-10水平只与不同代谢组患者治疗前后的Hp阳性情况有关。
通过本次研究发现,在剂量相同的条件下,使用奥美拉唑的UM、EM组的Hp根除率明显低于IM、PM组;使用艾普拉唑则不受患者代谢类型和CYP2C19基因多态性影响。对于使用奥美拉唑的UM、EM组患者,40 mg/bid组的Hp根除率明显高于20 mg/bid组;使用艾普拉唑的UM、EM组患者则不受剂量影响。研究成果对于四川省西南地区汉族人群的抗Hp个体化治疗具有重要的指导意义;特别对于本地区Hp根除失败的患者,更应首先考虑检测CYP2C19基因型,并及时调整PPIs给药剂量,或换用不受CYP2C19基因多态性影响的PPIs制剂,以提高精细化药学服务质量。
