高氏盆炎方三号对慢性盆腔炎大鼠炎症介质和生殖功能的影响
2022-09-09郝艳红刘玉兰
郝艳红 高 慧 刘玉兰
(承德医学院附属医院,承德,067000)
盆腔炎性疾病(Pelvic Inflammatory Disease,PID)是指女性上生殖道的一组感染性疾病,包括子宫内膜炎,子宫体炎,输卵管炎,卵巢炎和盆腔腹膜炎等[1]。PID是我国常见的一种妇科疾患,是不孕症的常见病因之一。当患者急性盆腔炎症未彻底治愈或劳累体虚或因病原体对药物不敏感以致病情迁延可导致盆腔炎性疾病后遗症(Sequelae of Pelvic Inflammatory Disease,SPID)即慢性盆腔炎(Chronic Pelvic Inflammatory Disease,CPID),而长期慢性炎症存在或盆腔炎性疾病反复发作累及输卵管,导致输卵管性不孕。有研究报道,PID致输卵管阻塞引起的不孕占20%~40%,且不孕症的发生与患者PID的发作次数有明显相关性,发作次数增加,不孕发生率随之上升;病程越长,不孕发生率越高,严重影响育龄期女性的生殖健康[2-3]。中医无“盆腔炎”之病名,可归属于“不孕”“带下病”“妇人腹痛”“癥瘕”等疾病范畴。临床上高氏盆炎方三号治疗CPID及炎性不孕取得了较好的效果,本研究通过苯酚凝胶联合机械损伤制备大鼠CPID模型,观察高氏盆炎方三号对CPID大鼠子宫组织病理及炎症介质的影响,并进一步观察其对盆腔炎大鼠生殖功能的影响。
1 材料与方法
1.1 材料
1.1.1 动物 健康雌性SD大鼠70只,体质量220~250 g,无特定病原体(Specific Pathogen Free,SPF)清洁级,大鼠及饲料由河北医科大学动物实验室提供,动物饲养于自然光照条件好,室温在21~23 ℃的环境中。许可证号:SCXK(冀)2013-1003,批号:1801215。本研究获承德医学院附属医院医学伦理委员会批准,严格遵守实验动物福利和伦理原则。
1.1.2 药物 人胎盘组织液2 mL/支×6支/盒(湖南一格制药有限公司,生产批号:201705014);蒲苓盆炎康颗粒(翔宇药业股份有限公司,生产批号:170724)。高氏盆炎方三号中药组成:皂角刺30 g、当归12 g、红花10 g、蒲公英30 g、穿山甲3 g、柴胡6 g、白芍10 g、香附10 g、山药10 g、青皮10 g、陈皮10 g、路路通10 g、通草10 g。中药饮片由石家庄市中医院中药房提供,浓缩成生药浓度为3.4 g/mL的中药液。
1.1.3 试剂与仪器 GM-CSF试剂盒(上海森雄科技事业有限公司,批号:SXR006)、IL-4试剂盒(上海森雄科技事业有限公司,批号:SXR030);核因子κB antibody(北京博奥生物,批号:bs-0465R);ABC Kit(Vector公司,美国,批号:PK-4002);DAB Kit(北京中杉金桥,批号:zlI-9610)。显微镜(Olympus Corporation,日本,型号:DP73);离心机(上海安亭,型号:TDL-5-A);酶标仪(雷勃公司,芬兰,型号:MK3);恒温振荡器(常州国华,型号:SHA-B);显微图像分析系统(武汉同济医科大学,型号:HMIAS-2000);实时荧光定量PCR仪(美国ABI,7500fast);基因扩增仪(PE公司,美国,型号:PE~9600)。
1.2 方法
1.2.1 分组与模型制备 SD大鼠适应性饲养5 d,连续进行阴道脱落细胞学涂片,光镜下观察,筛选动情周期正常的雌性大鼠125只进入正式实验。机械损伤联合化学烧伤造模[4]。除空白组(17只大鼠)外,其余大鼠进行造模,术前禁食水12 h,称重,10%的水合氯醛以大鼠体质量300 g/mL腹腔注射麻醉,麻药起效后,固定、备皮、消毒,于大鼠下腹正中作1 cm左右大小的切口,寻找并暴露子宫。用1 mL注射器取25%的苯酚胶浆剂,自药效组大鼠左侧子宫进针,向输卵管—卵巢方向缓慢注入苯酚胶浆0.06 mL。生殖组大鼠自双侧子宫分别进针,向双侧输卵管—卵巢方向缓慢注入苯酚胶浆各0.06 mL,造模过程中用注射器针头轻轻划伤大鼠宫内膜,夹闭针孔防止溶液流出,切口缝合、消毒,抬高大鼠臀部防止胶浆流出,待大鼠苏醒。造模过程中随机选取6只大鼠,取子宫组织,苏木精-伊红(Hematoxylin Eosin,HE)染色,造模第10天,光镜下观察大鼠出现子宫腔壁增厚,组织结构紊乱,腺体紊乱萎缩变形,可见大量炎细胞浸润,内膜充血水肿等病理改变情况,以确定造模成功。按照随机数字表法进行分组,分为模型组、高氏盆炎方三号高、中、低剂量组(中药高、中、低剂量组)、蒲苓组、胎盘组;药效组每组10只,生殖组每组7只(共119只大鼠)。
1.2.2 给药方法 空白组(自由食水)模型组给与生理盐水1 mL/100 g,高氏盆炎方三号高、中、低剂量组每天分别给予34 g/kg、17 g/kg、8.5 g/kg高氏盆炎方三号药液(以生药计,根据每千克体质量用药量的人鼠比例换算);蒲苓组给予3 g/kg蒲苓盆炎康颗粒,胎盘组肌内注射人胎盘组织液1 mL/kg,连续用药20 d。
1.2.3 合笼方法 给药20 d后,观察大鼠动情周期,按照雌雄比7﹕2进行合笼,即每7只雌性大鼠随机与2只健康同周龄雄鼠关在同一笼子里交配[5]。由于大鼠性周期为4~5 d,其孕期19~23 d,平均21 d,以同笼饲养试受孕时间60 d为限(即大鼠12个动情周期)。每天上午8:00开始进行阴道涂片观察及阴栓检查,并描述、记录观察内容。观察各组大鼠受孕情况,受孕成功的雌鼠单独喂养,而雄鼠仍可与其余雌鼠交配。
1.2.4 检测指标与方法
1.2.4.1 药效组 1)在末次给药治疗24 h后,麻醉大鼠(10%水合氯醛),腹主动脉取血后离心10 min(3 000 r/min,r=10 cm),取上层血清;分离大鼠双子宫称重,后取左侧部分组织置于多聚甲醛中固定保存,一部分装到EP管中,-80 ℃留存待测。2)取大鼠双侧子宫组织,称湿质量,计算子宫肿胀度(子宫肿胀度=左侧子宫质量-右侧子宫质量;抑制率模型组子宫平均肿胀度-给药组子宫平均肿胀度/模型组子宫平均肿胀度×100%。将左侧子宫组织标本固定、包埋、切片,染色,光镜下观察病理改变[6-7]。3)酶联免疫吸附试验法法检测血清粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage Colony StimulatingFactor,GM-CSF)、白细胞介素(Interleukin,IL)-4水平。严格按试剂盒说明书逐步操作进行检测。4)免疫组织化学法和实时定量PCR测定核因子κB蛋白和基因表达。5)核因子κB蛋白表达:将石蜡切片脱蜡水化,磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)溶液洗3次(5 min),于3% H2O2溶液(室温中)静置15 min后PBS洗3次(5 min);非免疫血清封闭40 min;加已稀释I抗(4 ℃过夜)→复温→PBS洗3次(5 min);加已稀释Ⅱ抗,37 ℃孵育20 min,PBS洗3次(5 min);加SP,37 ℃孵育15 min,PBS洗3次(5 min);加入显色剂(DAB)显色(5 min)后自来水冲洗,苏木精复染、脱水、透明、中性树胶封片,显微镜观察,拍照,用HMIAS-2000高清晰度彩色医学图文分析系统计算平均光密度值(IOD),阳性表达则可见棕黄色或棕褐色颗粒染色部位。6)核因子κB mRNA表达水平:取-80 ℃留存大鼠子宫组织粉碎摇匀添加RNA提取试剂,提取总RNA,测RNA浓度后,取总RNA 2 μg,先在含寡dT纤维素引物、脱氧核苷三磷酸的混合液中65 ℃ 5 min使模板RNA变性后,冰上迅速冷却。添加反转录反应液(包括PrimeScript II Buffer,PrimeScript II RTase,Rnase Inhibitor等),用焦碳酸二乙酯水将反应液容积增至20 μL,缓慢摇匀后离心,置于PCR仪中,42 ℃静置45 min合成cDNA,95 ℃置5 min使酶失活,冷却后于-20 ℃保存备用。使用两步法反应程序,95 ℃,10 min预变性;而后40个循环反应:95 ℃ 15 s。进行RT-PCR结果分析,扩增完毕后,得到核因子κB基因及内参基因GAPDH的Ct值,△Ct=核因子κB基因的Ct值-内参基因GAPDH的Ct值,得出核因子κB基因的Q值及Q均值(Q=2-△Ct),最后求得所需的RQ值(即核因子κB基因表达的相对定量值,RQ=Q值/Q均值),将RQ统计分析。
1.2.4.2 生殖组 观察60 d(约大鼠12个动情周期)内各组大鼠一般情况,受孕率,产仔数等变化。

表1 引物序列
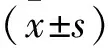
2 结果
2.1 药效学实验结果
2.1.1 各组大鼠子宫组织病理学表现 空白组:子宫壁结构清晰完整,腺体完整,子宫内膜无充血及水肿,未见炎症细胞。模型组:子宫腔壁增厚,组织结构紊乱,腺体紊乱萎缩变形,可见大量炎症细胞浸润,内膜充血水肿明显。中药高剂量组:炎症细胞浸润较少,余同空白组。中药中剂量组:部分腔壁稍增厚,内见少量炎症细胞轻度浸润,稍有内膜充血、水肿。中药低剂量组及蒲苓组:腔壁轻度增厚,结构杂乱,内膜充血、水肿,全层可见炎症细胞浸润。胎盘组:部分可见少量炎症细胞浸润。
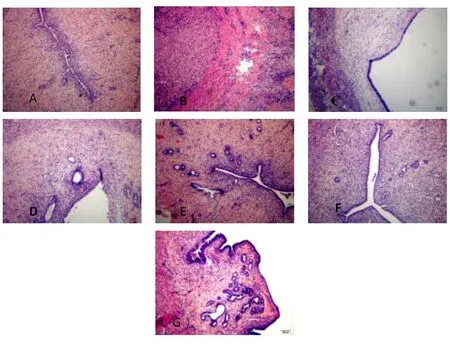
图1 光镜下各组大鼠子宫形态学变化(HE染色,×400)
2.1.2 各组大鼠血清GM-CSF、IL-4的水平比较 与模型组比较,其余各组大鼠血清GM-CSF水平均明显降低,IL-4水平升高,差异均有统计学意义(P<0.05);中药高剂量组血清GM-CSF及IL-4水平与空白组比较,差异无统计学意义(P>0.05);中药中、低剂量组大鼠与空白组大鼠比较,血清GM-CSF水平升高,血清IL-4水平降低,差异均有统计学意义(均P<0.05);中药高剂量组与蒲苓组及胎盘组比较,GM-CSF表达降低,IL-4水平明显升高,差异均有统计学意义(均P<0.05);中药中、低剂量组大鼠血清GM-CSF及IL-4水平与蒲苓组及胎盘组比较,差异均无统计学意义(均P>0.05)。见表2。
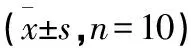
表2 各组大鼠血清GM-CSF、IL-4的水平比较
2.1.3 各组大鼠子宫组织核因子κB蛋白及mRNA表达水平比较 与模型组比较,其余各组大鼠子宫组织核因子κB蛋白及核因子κB mRNA表达明显降低,差异均有统计学意义(均P<0.05);与空白组比较,中药低剂量组大鼠子宫核因子κB蛋白及核因子κB mRNA表达明显上升,差异均有统计学意义(均P<0.05);空白组大鼠子宫组织核因子κB蛋白及核因子κB mRNA表达水平与中药高、中剂量组比较,差异无统计学意义(P>0.05);中药高、中、低剂量组大鼠子宫组织核因子κB蛋白及核因子κB mRNA表达水平与胎盘组比较,差异无统计学意义(P>0.05);中药高剂量组大鼠子宫组织核因子κB蛋白及核因子κB mRNA表达水平降低,与蒲苓组比较差异均有统计学意义(P<0.05);蒲苓组大鼠子宫组织核因子κB蛋白及核因子κB mRNA表达水平与高氏盆炎方三号中、低剂量组比较,差异无统计学意义(P>0.05)。见表3及图2。
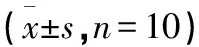
表3 各组大鼠子宫组织核因子κB蛋白及基因表达水平
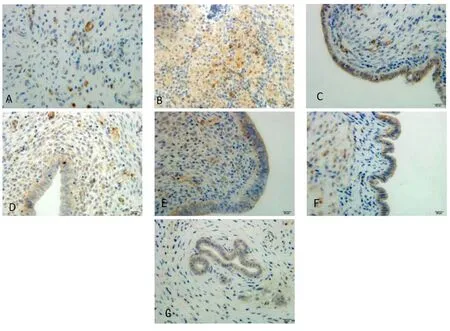
图2 各组核因子κB蛋白表达(免疫组织化学染色,×400)
2.2 生殖组实验结果
2.2.1 第1~10天受孕率 观察雌雄合笼第1~10天(即大鼠2个性周期)受孕情况,空白组受孕率为100%,模型组受孕率为0,2组比较差异有统计学意义(P<0.05)。与模型组比较,中药高、中低剂量组及胎盘组第1~10天受孕率明显升高,差异有统计学意义(P<0.05);中药高、中、低剂量组第1~10天受孕率与对照组、胎盘组比较,差异无统计学意义(P>0.05);与其他各给药组比较,蒲苓组第1~10天受孕率低于中药各剂量组,且较空白组及中药组受孕时间后延。
2.2.2 总妊娠率 试受孕60 d后,模型组7只雌鼠仍未受孕,与模型组比较,各给药组60 d的总体妊娠率明显升高,差异均有统计学意义(均P<0.05);中药高、中、低剂量组及胎盘组大鼠60 d内全部受孕,妊娠率达到100%,蒲苓组仅有1只未孕,总妊娠率达到85.7%(1只受孕中期死亡,但总妊娠率仍明显高于模型组)。见表4。
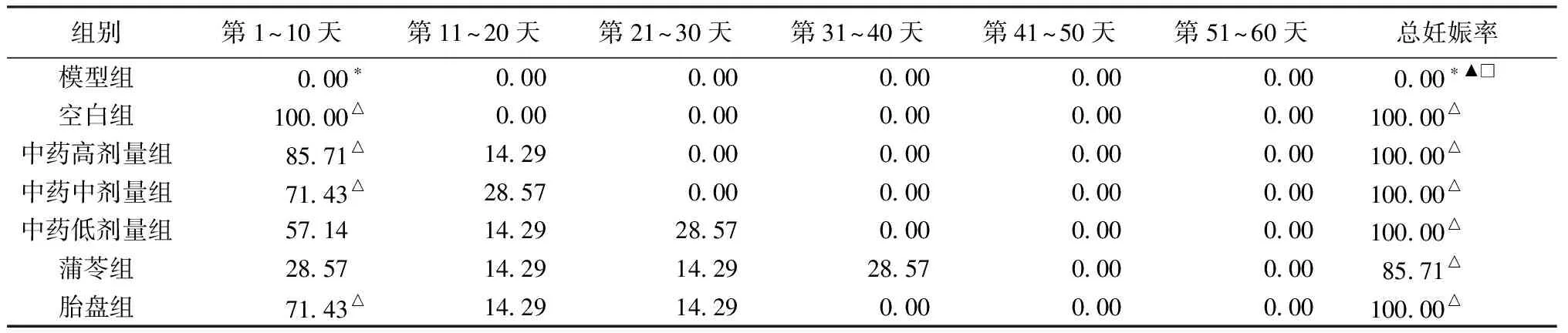
表4 生殖组各组大鼠受孕率情况(%,n=7)
2.2.3 子鼠情况 模型组受孕率为0,产子数为0。空白组、中药高剂量组产仔数、平均产仔数较多,各组子鼠存活率较高(93.1~98.7%)。各组平均产仔数与模型组比较,差异均有统计学意义(均P<0.05);中药中、低剂量组平均产仔数低于空白组,差异均有统计学意义(均P<0.05),空白组平均产仔数与中药高剂量组比较,差异无统计学意义(P>0.05)。见表5。
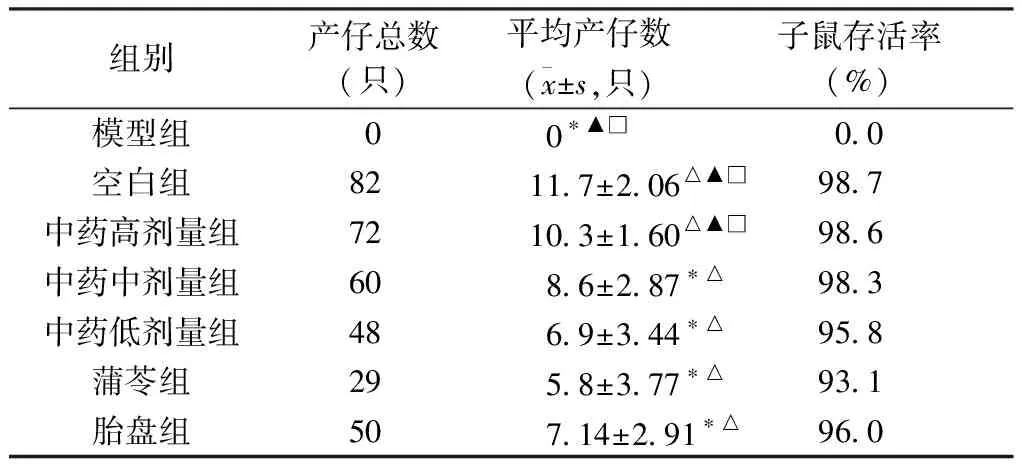
表5 生殖组各组大鼠子数情况(n=7)
3 讨论
近年CPID发病率逐年上升,为妇科常见及多发病。而不孕症是指男女双方同居1年以上,有正常的性生活且未采取任何避孕措施,女性仍未受孕,或曾有过妊娠,之后未避孕1年以上而未再妊娠。不孕症是妇科常见、多发且难治性疾病。不孕症的病因复杂多样,近年来随着人工流产术等宫腔操作次数的增加、工作节奏的加快、急性盆腔炎未能得到及时有效治疗以及性传播疾病的增加,导致盆腔炎性不孕的发病率也随之上升,其中PID是导致输卵管性不孕的主要原因。西医治疗PID在急性期以抗生素治疗为主,后期常采用手术或辅助生殖技术治疗,西医手术治疗可缩短治疗时间,但对机体损害相对较大,输卵管疏通后仍有再次粘连或堵塞的风险。中医多靶点治疗可促进患者整体恢复、预防术后并发症,提高受孕率。在治疗盆腔炎及盆腔炎性不孕有其独特优势。
中医认为本病关键是“瘀”,“瘀”既是疾病的病理产物,又是致病因素,病机为邪(寒热湿毒)阻冲任气机,气滞血瘀,胞脉瘀阻不通。高氏盆炎方三号重用活血化瘀、软坚散结,消癥通络的皂角刺、穿山甲、当归、红花、路路通起到抗粘连作用。叶天士曾云“女子以肝为先天”,方中柴胡、白芍、香附、青皮行气疏肝,调情志,主要针对女性生理特点,且因肝脉过阴器,又有“经脉所过,主治所及”,选用入肝经中药,引药入位,可治疗盆腔疾病,疏通输卵管治疗不孕。现代药理研究表明,理气药能够对抗渗出和增生性炎症,增强机体的免疫力,又具明显镇痛作用[8]。方中山药、陈皮能调和脾胃以祛湿,一则健脾扶正,正气强则邪气消,提高机体免疫力,防止慢性炎症急性发作;二则脾胃强则能受纳药物(防止活血化瘀、软坚散结药损伤脾胃)。另外加入具有清热解毒之功的蒲公英、通草,起到抗炎作用,避免慢性炎症急性发作导致疾病进展。研究表明,清热解毒类中药有多种抗炎成分,它们通过多种途径发挥抗炎作用[9]。高氏盆炎方三号切中病机,临床中除用来治疗CPID外,在治疗CPID合并输卵管阻塞和输卵管阻塞性不孕症等方面具有优势。
CPID存在不同程度的炎症损伤,前期以组织充血、肿胀、渗出等病理改变为主,后期会呈现不同程度增生、粘连及瘢痕的表现,不仅容易造成盆腔粘连,还容易造成输卵管粘连阻塞,最终导致不孕发生。高慧教授[10]根据其病理特点将前者定义为“湿性炎症”,如盆腔积液,输卵管积液、积脓,后者则称为“干性炎症”,如盆腔粘连、输卵管不通,输卵管阻塞等。本实验中,药效实验结果显示,各给药组较模型组大鼠子宫肿胀度减轻,光镜下观察模型组可见明显炎细胞浸润,内膜充血水肿,子宫腔壁增厚,组织结构紊乱,腺体紊乱萎缩变形,提示造模成功,各给药组大鼠的病理表现有不同程度的改善。
在CPID细胞因子网络中,核因子κB的活化是一中心环节,核因子κB是介导机体炎症反应的信号通路,受到物理创伤、细胞因子刺激后被激活,从而启动和调控炎症细胞、黏附分子等参与炎症反应过程(其中包括炎症介质GM-CSF),进一步扩大炎症反应,并通过炎症反应加重组织损伤[11-14]。有研究指出核因子кB参与组织纤维化(肺、肝等),与宫腔粘连密切相关[15]。GM-CSF是在炎症反应过程中由损伤内皮细胞释放出的一种炎症反应的敏感性标志物,与CPID密切相关[16]。核因子κB的活化可上调GM-CSF的表达,通过核因子κB失活抑制了GM-CSF生成[17-18]。IL-4主要由Th2细胞产生的免疫抗炎因子,在炎症反应中,随着IL-4水平的逐渐升高,其抑炎作用增强,炎症介质被抑制,恢复体内自身的免疫动态平衡[19]。既往已有研究表明,IL-4能够负调控核因子κB通路抑制炎症反应[20-23]。本研究结果表明,与模型组比较,高氏盆炎方三号各剂量组大鼠血清GM-CSF水平均降低;IL-4水平均升高,子宫组织核因子κB蛋白及基因表达下调,说明了中药发挥免疫抗炎作用,通过升高IL-4的水平,提高了机体免疫力,抑制核因子ΚB活性,阻断炎症信号通路传导,从而下调GM-CSF水平,抑制了炎症介质激活释放,最终降低炎症反应,从而修复大鼠子宫组织结构、病理损伤,预防和抗粘连,改善盆腔炎症结局。
本研究通过观察生殖观察组不孕大鼠模型,结果表明,模型组60 d(大鼠以5 d为一个性周期,12个周期为60 d)总体妊娠率为0,而药物观察组均受孕产子,其受孕率、产仔数、平均产仔数、存活率较高。主要考虑以下3方面因素影响受孕:1)因炎症改变盆腔内环境;2)炎症导致输卵管炎症及输卵管阻塞;3)炎症经输卵管蔓延至卵巢(大鼠动情周期改变),影响卵巢功能;其中任何一个环节出现问题均可能导致不孕发生。本研究模型组雌鼠均未受孕也再次证明了盆腔炎模型制备成功(无论是子宫体炎、输卵管炎、输卵管炎性阻塞、卵巢炎均属于盆腔炎)。经高氏盆炎方三号治疗后大鼠受孕率明显升高,且产仔只数较模型组明显增多,治疗效果理想,提示高氏盆炎方三号可有效改善盆腔炎大鼠的生殖功能,一方面因盆腔炎的治愈,控制了输卵管炎和卵巢炎,疏通输卵管炎性阻塞,而最终起到治疗炎性不孕的效果,达到他病愈则自能成孕。另一方面通过抗炎,抑制CPID症进一步扩散,起到预防损伤进一步进展,提高了妊娠率和治疗效果。运用倒查机制,以受孕成功说明炎症粘连恢复,盆腔内环境恢复。
综上所述,高氏盆炎方三号对CPID及炎性不孕大鼠有良好的治疗作用,其作用机制可能是通过促进抗炎细胞因子IL-4分泌水平,提高机体免疫力,恢复体内自身的免疫动态平衡,抑制核因子κB通路的激活,进而降低炎症介质GM-CSF释放,减轻子宫炎症反应,减少CPID的损害,预防粘连发生,改善大鼠子宫组织病理形态,提示高氏盆炎方三号能够有效治疗CPID。同时通过治疗盆腔炎症(包括治疗输卵管炎和卵巢炎;疏通输卵管炎性阻塞,恢复卵巢排卵功能),抑制盆腔炎症进一步进展,恢复盆腔内环境,修复因炎症造成的盆腔生殖功能的损伤,提高CPID大鼠受孕率及妊娠率,为临床应用高氏盆炎方三号治疗CPID及炎性不孕提供了更多的理论依据。
