正交试验优选羽扇豆醇提取工艺及液相色谱法-质谱法联用(LC-MS)与气相色谱法-质谱法联用检测比较
2022-09-09任天和潘年松
任天和 潘年松 罗 俊
(1 贵州医科大学基础医学院,贵阳,550004;2 遵义医药高等专科学校,遵义,563006)
马棘(Indigofera Pseudotinctoria)是豆科,木蓝属小灌木。主要分布于云南、贵州、四川、湖南、湖北等地,也是优质的青饲料[1]。有研究发现在马棘提取物石油醚层鉴定出羽扇烯酮,在同豆科的截叶铁扫帚中,测得羽扇烯酮和羽扇豆醇含量均为主要成分[2-3]。羽扇豆醇属于五环羽扇豆烷型三萜类化合物,广泛存在于无花果、葡萄、大豆等多种水果蔬菜中,具有抗肿瘤、抗氧化、降糖、抗炎、护肝等药理活性[4-5]。
气相色谱法-质谱法联用(Liquid Chromatograph-mass Spectrographyr,LC-MS)和气相色谱法-质谱法联用(Gas Chromatography-mass Spectrography,GC-MS)均有很高的灵敏度与专属性,结合质谱对不同离子的响应,可以快速定性分离化合物成分信息。在众多领域有广泛的应用,在代谢组学中更是互为补充[6]。
1 材料
1.1 样品及标准品 马棘种子(遵义绿普森农业科技开发有限公司);羽扇豆醇标准品(成都普思生物科技股份有限公司,生产批号:PS020067)。
1.2 仪器 液质联用仪(AB,美国,型号:SCIEX 4000Q trap LC-MS/MS);LC色谱柱(AcclaimTM,美国,型号:120 C18 4.6 mm×150 mm 5 μm);气质联用仪(Thermo ScientificTM,美国,型号:ISQTM7000单四极杆GC-MS);GC色谱柱(Thermo,美国,型号:TG-5MS 30 m×0.25 mm×0.25 μm)。
2 方法
2.1 单因素试验
根据现有文献[7-11]报道,选取溶剂与时间2个因素,进行马棘种子提取单因素试验,烘干溶剂得浸膏。通过LC-MS检测计算羽扇豆醇含量。
2.1.1 LC-MS含量检测 标准品及样品制备:精密称取4.0 mg样品,溶解于1 mL甲醇中,超声溶解,过0.22 μm滤膜,4 ℃保存备用。精密称取1.0 mg标准品,溶解于1 mL甲醇中,配成1 mg/mL浓度,过0.22 μm滤膜。并依次稀释至320 μg/mL、32 μg/mL、16 μg/mL、8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL,4 ℃保存备用。
2.1.2 LC-MS条件 流动相:0.1%甲酸甲醇(0.1%甲酸水=90∶10),进样量:1 μL,流速:0.8 mL/min。羽扇豆醇的准确分子质量:426.4,母离子:453.2,子离子:435.4,DP:102,CE:32。
2.2 正交试验
以单因素试验为基础,设计三因素三水平正交试验。烘干样品后通过GC-MS检测分析羽扇豆醇最佳提取方案及影响因素。见表1。

表1 羽扇豆醇浸提工艺因素水平
2.2.1 GC-MS成分检测 标准品及样品制备:精密称取各样品20 mg,溶于1 mL乙醚中,震荡溶解后过0.45 μm滤膜,4 ℃保存备用。精密称取1.0 mg标准品,溶解于1 mL乙醚中,过0.45 μm滤膜,4 ℃保存备用。
GC-MS条件:根据唐超等[3]试验方法稍作调整,初始温度40 ℃,保持1 min,以30 ℃/min升温至260 ℃,保持1 min,再以15 ℃/min升温至280 ℃,保持10 min;气化室温度250 ℃;离子源温度300 ℃;进样口温度280 ℃;载气为高纯度氦气;体积流量:1.0 mL/min;离子化模式:EI;电子能量:70 eV;溶剂延迟:12 min。质谱扫描范围:m/z 40~500。
2.2.2 羽扇豆醇定性及半定量分析 通过LC-MS检测,对相同工艺提取的GC-MS检测结果峰面积进行等量代换,并对LC-MS检测的其他峰面积进行推导计算含量(M:浸膏总重;Y:称取重量)。
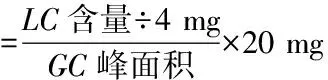
3 结果
3.1 LC-MS检测单因素分析 LC-MS检测结果计算含量显示,羽扇豆醇在10倍液料比情况下比较溶剂与浸提时间2个因素。石油醚、浸提5 d、10倍液料比情况下羽扇豆醇含量最高。见表2。
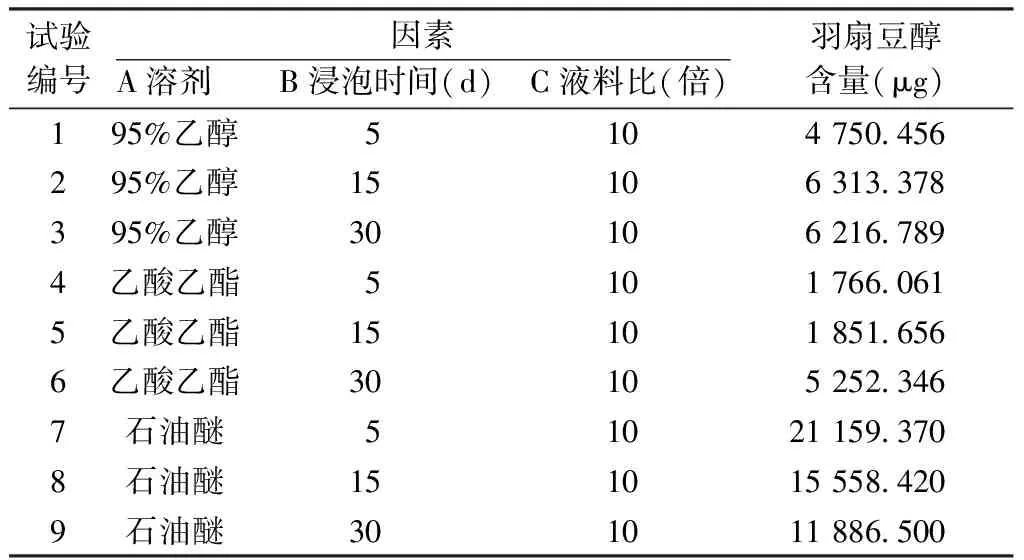
表2 单因素实验结果
3.2 GC-MS检测正交试验分析
3.2.1 定性分析 如图1所示羽扇豆醇标准品A(18.37)与样品B的保留时间大致相同,向样品中加入标准品后出峰时间C(18.29)稍有提前。
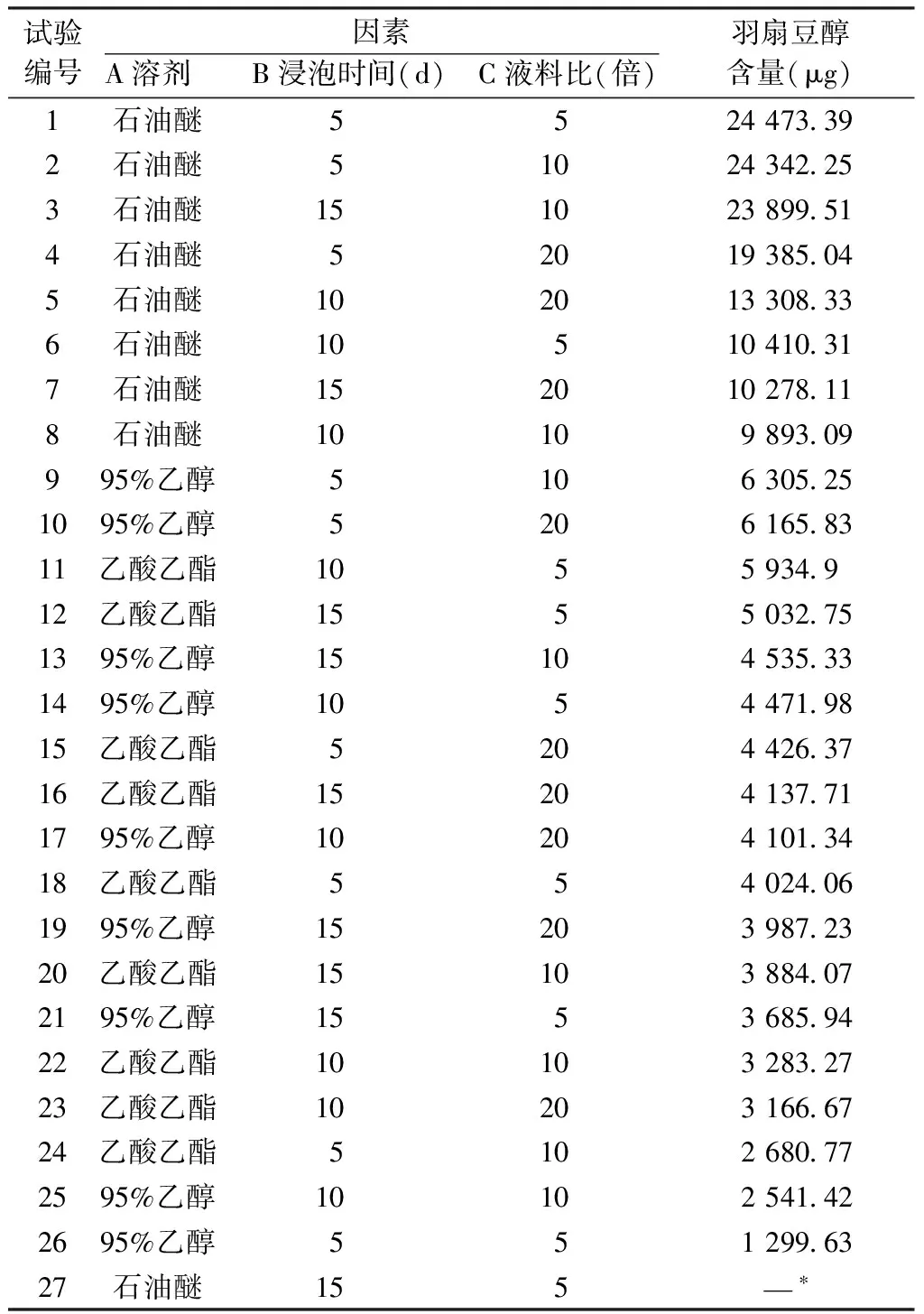
表3 GC-MS半定量推导含量
采用中位数检验,正交实验排除第27号工艺后,对剩下26份数据按照羽扇豆醇含量降序排列,若数据为偶数,则中位数选取最中间2个数据(即第13号和第14号),求得其平均值,即中位数值为4 503.66 μg;工艺分别为95%乙醇、15 d、10倍液料比和95%乙醇、10 d、5倍液料比。根据降序排列可以看出最大提取含量工艺为石油醚,5 d、5倍液料比,最小值为95%乙醇、5 d、5倍液料比。且羽扇豆醇含量前25%基本均为石油醚作为溶剂所提取的工艺。
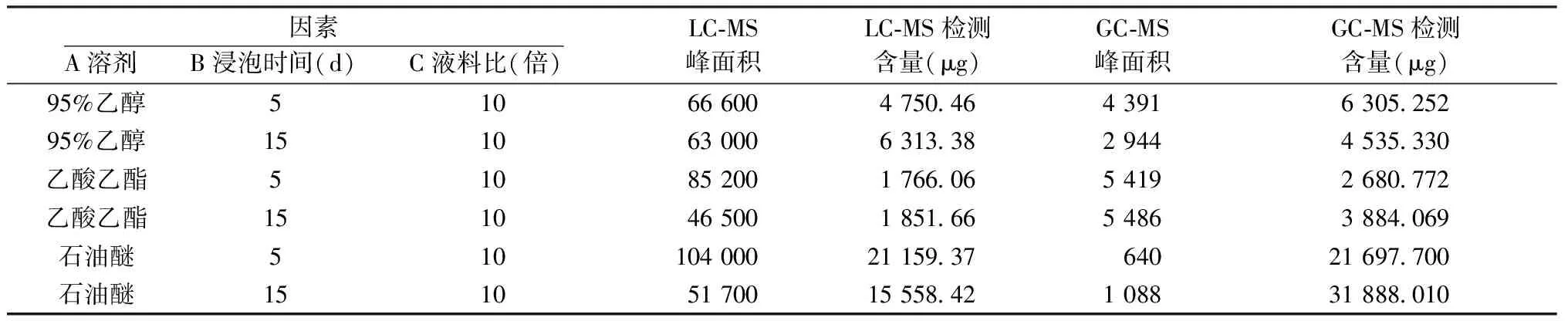
表4 LC-MS与GC-MS相同工艺下羽扇豆醇峰面积及含量

表5 LC-MS与GC-MS相同工艺检测结果Wilcoxon符号秩和检验结果
4 讨论
采用提取方法包括水浴、热回流、超声、超临界萃取等[12-16],溶剂包括乙醇、甲醇、氯仿等浸膏中均检测出羽扇豆醇[14-15,17]。但在高婷[14]的研究提到对山楂采用超声提取羽扇豆醇,并对溶剂(氯仿、甲醇、80%乙醇)及用量与超声时间进行单因素考察发现,在40 mL氯仿中超声45 min时提取效果最佳;并在枸骨叶中提取羽扇豆醇也通过单因素考察了溶剂(氯仿、乙酸乙酯、甲醇)及用量与提取方法[18],最后发现用20 mL甲醇在40 ℃水浴16 h后超声30 min时提取率最佳。本实验设计三因素三水平正交实验,对马棘种子提取羽扇豆醇的工艺进行研究,采用了溶剂(95%乙醇、乙酸乙酯、石油醚)、时间(5 d、10 d、15 d)、液料比(5倍、10倍、20倍)3种因素对马棘种子进行提取率考察。以提取羽扇豆醇含量从大到小排序发现,其中含量前25%均为石油醚作为溶剂提取,但第27号样品因石油醚提取,导致油脂含量过高,羽扇豆醇无法准确被检测。初步确定最佳工艺为石油醚、5倍液料比浸提5 d。但石油醚具有毒性,且难以回收,考虑对环境污染,及工业化大生产,不作为优选考虑的溶剂。排除石油醚对应的组别后,乙醇与乙酸乙酯相互交替,未见明显区别。根据单因素实验中采用95%乙醇提取,基本比乙酸乙酯作为溶剂提取率更高,且乙醇易回收,因此选取95%乙醇作为溶剂,在比较正交实验中,也同时与单因素实验结果相联系。综合上述考虑后得出马棘提取羽扇豆醇工艺为95%乙醇、15 d、10倍液料比。
此外,对于LC-MS与GC-MS检测结果的比较,在对肝脏及血清样本的分析中,GC-MS比LC-MS多分离鉴定出50%的化合物[19]。且在检测生物检材中甲基异柳磷在LC-MS对样品的处理比GC-MS检测更为烦琐[20]。对丙烯酰胺的含量检测中发现GC-MS/MS和LC-MS/MS 2种方法都具有定量限低、精密度好的特点[21]。但在相关文献中并没有对2种检测方法结果的比较。而本实验采用了在相同工艺下的样品,用LC-MS所测的含量与GC-MS峰面积进行比较,推导其GC-MS所测羽扇豆醇的含量计算公式,以计算正交实验中羽扇豆醇含量的方法。本实验首次尝试了对LC-MS与GC-MS所测实验结果进行比较及推导的方法,所计算结果没有统计学意义(P>0.05),但不同溶剂间对应的比值有所差异。GC-MS一般是定性某成分的有无,不作为定量依据,其优点是一次检测可以获得很多种物质的信息,其缺点是定量不准确。LC-MS值一般是作为定量依据,其优点是定量准确,其缺点是1次只能检测1个成分的含量。从本实验看,GC-MS的峰面积值似可以与LC-MS进行大体含量推导。这为初步判断GC-MS峰面积值提供了一个便捷方法,值得进一步积累数据,找出规律。
