镉通过诱导自噬促进肾小管上皮细胞铁死亡的研究
2022-09-09刘亚轩皮会丰
李 敏,杨 前,刘亚轩, 3,皮会丰,刁 波
430000 湖北 武汉,中部战区总医院基础医学实验室1;430000 湖北 武汉,中枢神经系统肿瘤发生与干预湖北省重点实验室2;510515 广东 广州,南方医科大学,广州3;4000384 重庆,陆军军医大学军事预防医学系军队劳动卫生学教研室4;4000384 重庆,电磁辐射医学防护教育部重点实验室5
重金属元素镉(Cadmium, Cd)是一种毒性非常大的工业和环境污染物。由于其在工业中的广泛应用,致使含镉粉尘、废水、废渣对环境造成严重污染,再经空气、饮水和食品等途径进入人体,危害身体健康。研究表明,肾脏是Cd积累和滞留的主要器官。由于Cd在肾脏中的半衰期长达30年,肾功能不全可能是Cd引起毒性损害甚至死亡的最大危险因素。研究表明,肾小管上皮细胞是镉毒性的主要靶点。各种形式的细胞死亡,包括由氧化应激介导的细胞凋亡、坏死和坏死性凋亡,都与镉诱导的肾小管损伤有关。然而,其他类型的氧化性细胞死亡是否参与镉诱导的肾小管损伤尚不清楚。
铁死亡是一种以铁离子依赖为特征的非凋亡性细胞死亡,其本质是细胞内脂质氧化物的代谢障碍,进而在铁离子的催化下异常代谢,产生大量脂质ROS,攻击生物大分子,触发细胞死亡。抗氧化系统功能抑制和线粒体功能损伤是铁死亡脂质过氧化发生的重要原因。谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)和长链脂酰CoA合成酶(Acyl-CoA Synthetase Long chain family member 4, ACSL4)是铁死亡的关键调节因子,也是其标记物。铁死亡受铁代谢的严格调控。储铁蛋白(Ferritin)是细胞内主要的铁储存蛋白复合物,由铁蛋白轻链1(ferritin light polypeptide 1, FLT)和铁蛋白重链 1 (ferritin heavy polypeptide 1, FTH) 组成。铁死亡与许多疾病有关,包括组织损伤、癌症、感染和阿尔茨海默病。然而,铁死亡在Cd诱导的肾小管上皮细胞死亡中的作用尚不清楚。
自噬是一种依赖溶酶体的降解途径,通过吞噬和降解清除受损的细胞内成分,参与Cd诱导的细胞毒性和细胞死亡。自噬关键因子如ATG5、ATG7和ATG16L1的敲除可抑制癌细胞中的铁死亡。自噬的另一个核心效应分子BECN,可直接与SLC7A11结合来诱导GSH 耗竭和铁死亡。据报道,某些形式的自噬通过影响铁积累、脂质过氧化和抗氧化蛋白质的降解来促进铁死亡。特别是铁自噬(ferritinophagy),一种选择性自噬,可通过溶酶体降解储铁蛋白,增加细胞内铁离子水平促进铁死亡。该过程由核受体共激活因子4(nuclear receptor coactivator 4, NCOA4)介导,NCOA4 选择性地结合自噬小体中的 FTH1并将其递送到溶酶体中,从而导致铁释放。抑制自噬调节蛋白如ATG7或铁自噬特异性受体 NCOA4 的表达,可抑制铁死亡;而过表达NCOA4则可促进细胞铁死亡。然而,在Cd诱导的肾小管损伤中,铁自噬介导的铁死亡是否发挥重要作用仍然未知。基于以上分析,本研究采用HK-2细胞构建镉暴露模型,研究铁自噬诱导的铁死亡在Cd暴露致肾小管上皮细胞毒性中的作用。
1 材料与方法
1.1 细胞培养和处理
HK-2细胞购买自武汉大学细胞库,用含10%胎牛血清(PAN公司)的MEM培养基(hyclone公司)进行培养。氯化镉及其他抑制剂购自Sigma-Aldrich公司。为了证实铁死亡的作用,细胞用4 μmol/L脂质过氧化作用抑制剂ferrastatin-1(Fer-1)或12.5 μmol/L铁离子螯合剂去铁胺(deferroamine, DFO)预处理2 h。为了研究自噬-溶酶体途径对Cd引起的铁死亡的作用,用1 mmol/L自噬抑制剂3-甲基腺嘌呤(3-Methyladenine, 3-MA)或5 μmol/L溶酶体抑制剂氯喹(Chloroquine, CQ)预处理细胞2 h。对照细胞用溶剂处理。对于所有实验,在指定的预处理后再添加24 μmol/L Cd处理24 h。
1.2 细胞活力检测
细胞于染毒结束后,用CCK8试剂(购自东京同仁公司)检测其细胞活力以评价镉暴露对HK-2细胞的毒性。简单地说,用不同浓度的镉(0、12、24和36 μmol/L)处理细胞24 h。对于其他处理,按照上述方法处理细胞,并根据制造商的说明在24 μmol/L Cd处理24 h后进行评估。
1.3 细胞内铁离子的检测
细胞内 Fe的积累可通过比色法使用铁离子含量试剂盒(Abcam公司)监测。HK-2细胞(1×10细胞)在6倍细胞体积的铁测定缓冲液中快速均质化,并在16 000×g
下4 ℃离心10 min去除不溶性物质。将50 μL样品加入96孔板中,后用分析缓冲液将体积增加至100 μL。然后分别添加5 μL铁测定缓冲液或铁还原剂,分别用于Fe或总铁的测量。混合后,在25 ℃避光孵育30 min后,向每个孔中加入100 μL铁探针,并在25 ℃避光孵育。最后,在593 nm处测量吸光度,并使用标准曲线计算铁浓度。1.4 脂质过氧化水平
脂质过氧化水平可通过检测氧化应激标记物丙二醛(Malondialdehyde, MDA)水平量化。HK-2细胞(1×10细胞)在冰上用 300 μL含有3 μL BHT的MDA裂解缓冲液匀浆,并以13 000×g
离心10 min以去除不溶性物质。然后根据制造商的说明(碧云天公司)使用脂质过氧化(MDA)测定试剂盒测量MDA含量。1.5 免疫印迹分析
常规提取细胞蛋白并进行免疫印迹分析,通过10%或12% SDS-PAGE分离样品后转印到PVDF膜上。封闭后与一抗,包括FTH(1∶2 000,NOVUS公司)、GPX4(1∶1 000,三鹰生物公司)、ACTB(1∶5 000,Sigma-Aldrich公司)、LC3B-Ⅱ(1∶1 000,Sigma-Aldrich公司)、NCOA4(ARA70,1∶1,赛默飞公司)和ACSL4(1∶1 000,赛默飞公司)4 ℃过夜孵育,将膜在TBST中洗涤后与二抗(1∶1000;碧云天公司)在室温下再孵育1 h。蛋白条带用BeyoECL Star (碧云天公司) 显影。使用Image J软件对条带进行密度分析。所有数据代表至少3个独立实验。
1.6 透射电镜
HK-2细胞收集离心后,用2.5%戊二醛在4 ℃下固定2 h,然后用 0.01 mol/L磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤3次。然后,将细胞用1%锇酸固定2 h,并用PBS洗涤3次。随后,将细胞用1%四氧化锇固定并通过酒精梯度脱水后嵌入树脂中。再用乙酸铀和柠檬酸铅双重染色后,使用透射电子显微镜(HT7800,日立)检测样品。
1.7 siRNA转染
根据厂家的说明书,细胞使用Opti-MEM® I无血清培养基(gibco公司)与Lipofectamine2000 转染试剂(赛默飞公司)转染si RNA以干扰相应的分子。简单来说,分别将siRNA和5 μL Lipofectamine2000用250 μL Opti-MEM稀释后室温孵育5 min。随后将两种溶液混合后再室温孵育20 min后加入培养板中,并用不含抗生素的培养基加至2 mL。孵育7 h后,更换培养基后孵育16~24 h后用于实验。
1.8 统计分析
所有实验数据采用SPSS 19.0软件进行统计分析,实验数据均表示。组间比较采用方差分析,两两比较采用post-hoc Tukey检验。零假设在0.05水平拒绝。
2 结果
2.1 Cd以剂量依赖性方式诱导肾小管上皮细胞铁死亡
不同浓度Cd暴露后,24 μmol/LCd 在 24 h诱导细胞死亡,而36 μmol/LCd导致几乎一半的细胞死亡(图 1A),差异有显著统计学意义(P
<0.01)。相应的,Cd处理导致 HK-2 细胞中 MDA 含量以剂量依赖性方式增加(图 1B),差异有显著统计学意义(P
<0.01)。免疫印迹结果显示,与对照组相比,Cd 处理下调 GPX4蛋白水平,上调 ACSL4 蛋白水平(图 1C),差异有显著统计学意义(P
<0.01)。这些结果提示Cd诱导肾小管上皮细胞铁死亡。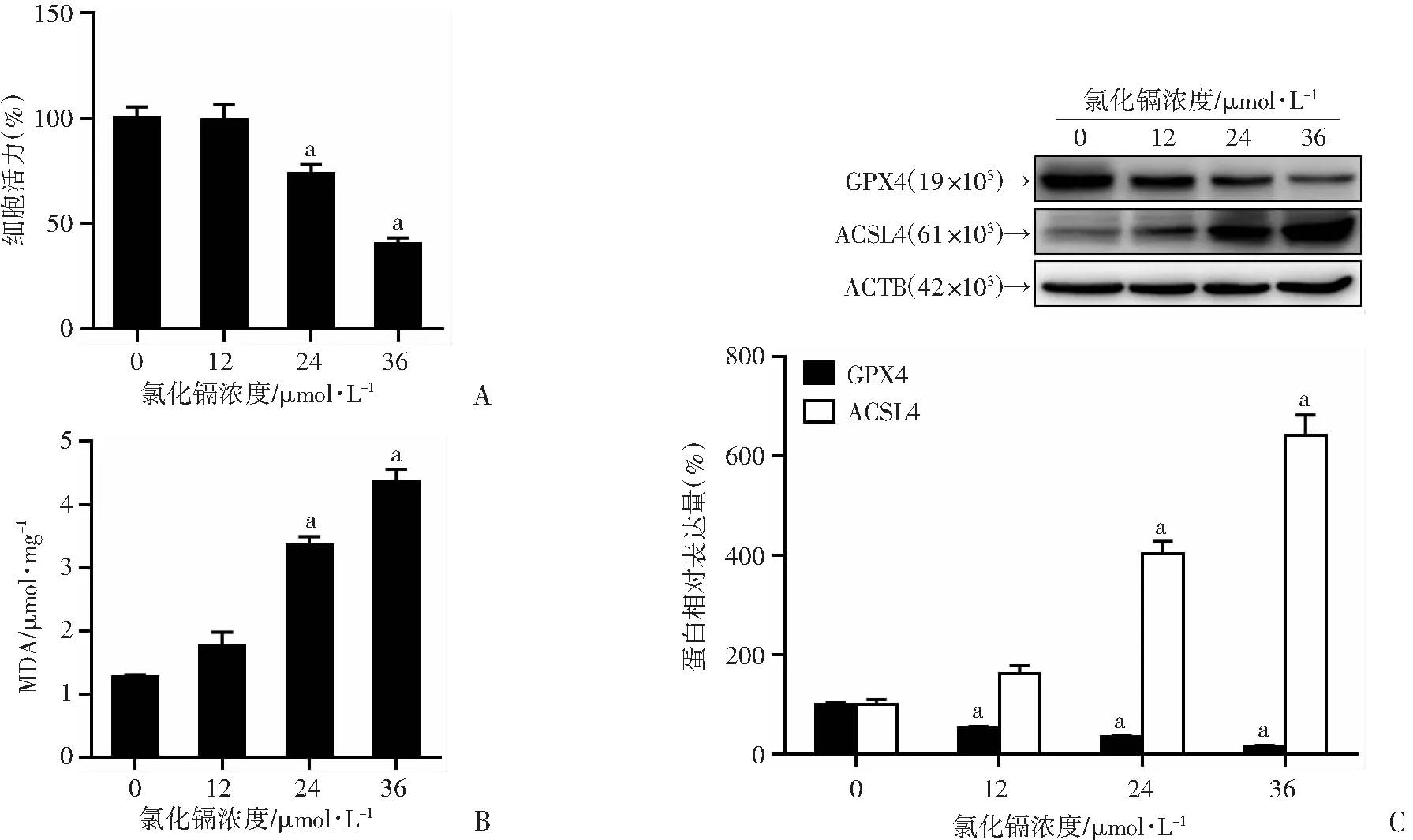
a:P<0.01,与0 μmol/L比较
2.2 抑制铁死亡可减轻Cd诱导的肾小管上皮细胞死亡
为了进一步验证铁死亡在镉诱导的细胞死亡中的作用,我们研究了抑制铁死亡是否可以预防Cd诱导的肾小管上皮细胞死亡。与Cd组相比,Fer-1和DFO均可抑制Cd处理的HK-2细胞中MDA的升高(图2A, B);显著减轻了Cd诱导的HK-2 细胞死亡(图2C, 2D),差异具有统计学意义(P
<0.05)。表明铁死亡是Cd诱导的HK-2 细胞死亡的一种重要形式。2.3 Cd诱导肾小管上皮细胞自噬
TEM 结果表明,Cd处理增加了 HK-2 中自噬小体的数量(图 3A)。免疫印迹分析结果表明, Cd暴露上调自噬标志物LC3B-Ⅱ的蛋白质水平(图 3B),与对照组相比,差异有统计学意义(P
<0.01)。由于LC3B-Ⅱ的积累可能表明自噬激活或溶酶体降解受损,我们进行了基于自噬性降解的自噬流评价,即在有和没有自噬抑制剂的情况下检测 LC3B-Ⅱ 蛋白水平。与Cd组相比,免疫印迹分析结果显示,CQ预处理进一步增加了Cd处理的 HK-2 细胞中的 LC3B-Ⅱ 蛋白水平(图 3C),差异有显著统计学意义(P
<0.01),表明Cd暴露激活了肾小管上皮细胞中的自噬。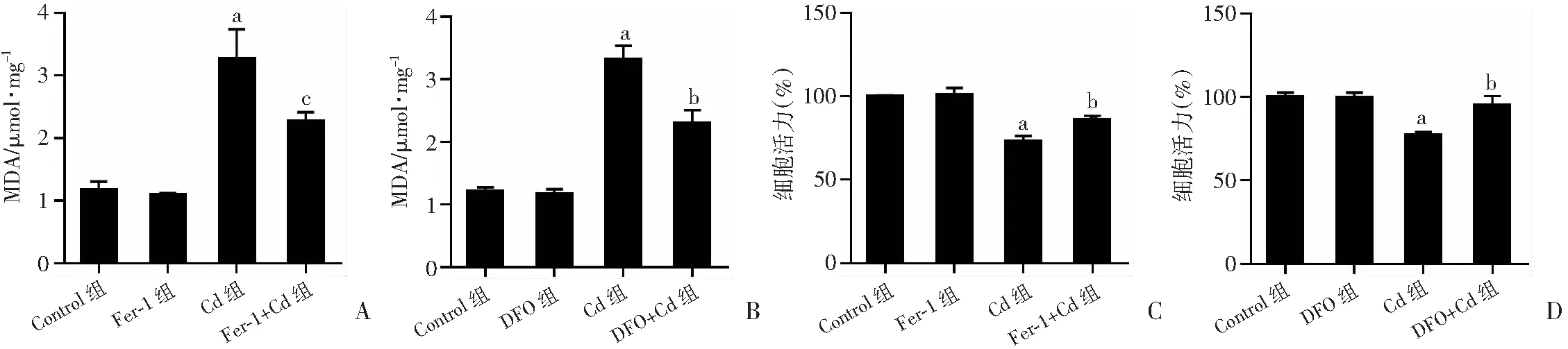
a:P<0.01,与Control组比较;b:P<0.05,与Cd组比较;c:P<0.01,与Cd组比较
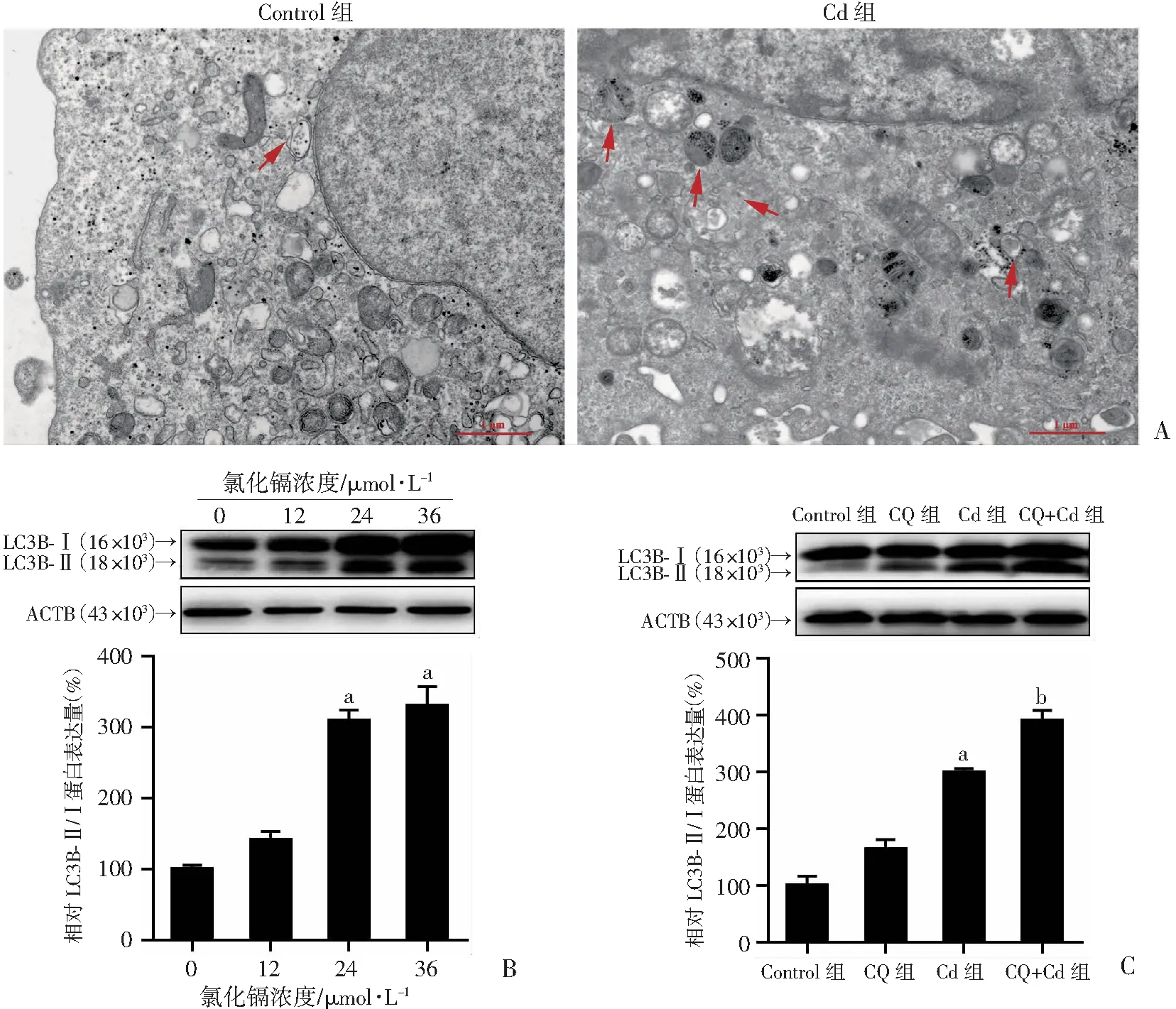
A:代表性透射电镜图,红色箭头表示自噬小体,比例尺:1 μm;B , C:代表性免疫印迹条带及半定量分析 a:P<0.01,与Control比较; b:P<0.01,与Cd组比较
2.4 Cd诱导的肾小管上皮细胞铁死亡需要自噬激活
为了阐明自噬与 Cd 诱导的铁死亡之间的关系,应用自噬药理抑制剂 3-MA 抑制 HK-2中的自噬。与Cd组相比,3-MA 预处理显著减轻了 Cd 诱导的铁过载(图 4A)(P
<0.01),抑制 Cd 暴露诱导的MDA(图 4B)升高(P
<0.01),以及减少Cd 诱导的细胞死亡(图 4C)(P
<0.05),差异具有统计学意义。此外,与Cd组相比, ATG7敲除减轻HK-2 细胞中Cd 诱导的铁过载(图 4D )和 MDA 积累(图 4E),差异具有统计学意义(P
<0.01)。此外,CCK-8 分析显示ATG7 敲除显著减弱了 Cd 诱导的 HK-2 细胞死亡(图 4F )(P
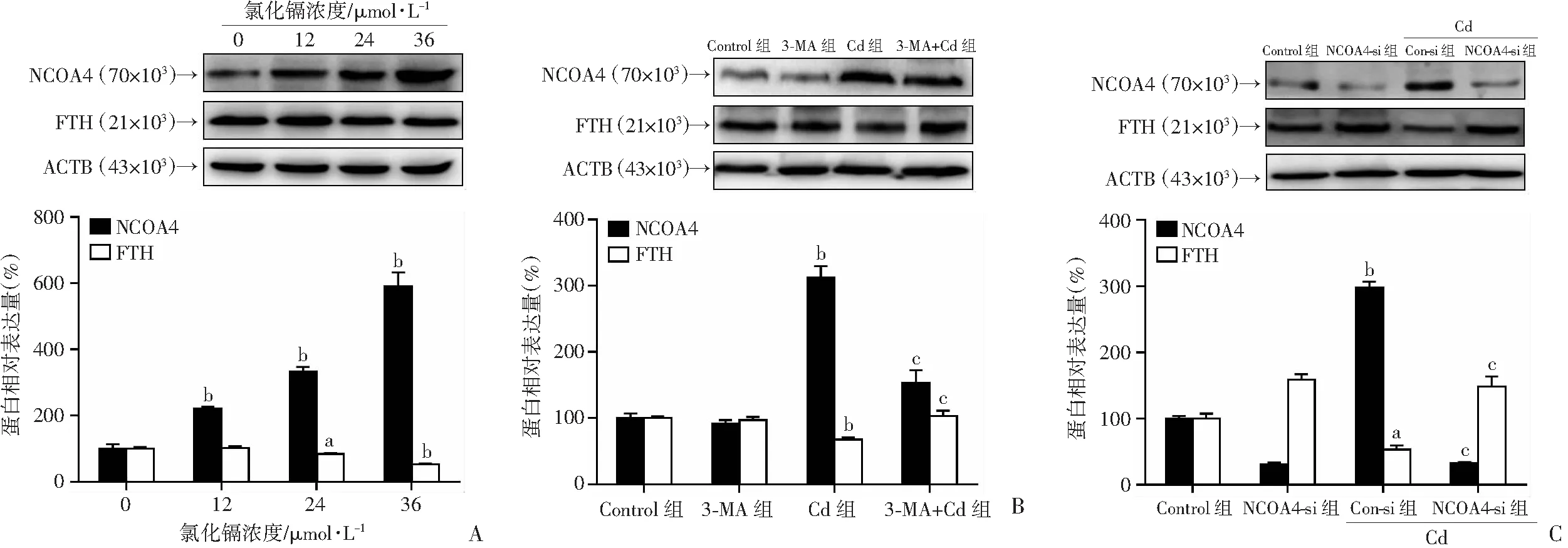
<0.05)。这些数据表明,Cd 诱导的肾小管上皮细胞铁死亡需要自噬激活。2.5 NCOA4 介导的储铁蛋白降解对于 Cd 诱导的肾小管上皮细胞铁死亡至关重要
已经证明,储铁蛋白的自噬降解(即铁自噬)可以促进铁死亡,而 NCOA4 是一种选择性的货物受体,可介导溶酶体中的储铁蛋白降解。因此,我们研究了 NCOA4 介导的储铁蛋白降解是否与 Cd 诱导的上皮细胞铁死亡有关。免疫印迹分析结果显示,与对照组相比,Cd 暴露导致HK-2 细胞中NCOA4 的表达显著升高(P
<0.01),FTH表达显著下降(P
<0.05)(图5A)。与Cd组相比,3-MA抑制自噬显著降低了NCOA4 的表达水平,增加了 FTH的表达水平(图 5B),差异具有统计学意义(P
<0.01)。此外,与Cd组相比,NCOA4 敲除显著抑制了 Cd 诱导的 HK-2细胞中的储铁蛋白降解(图 5C)(P
<0.01),减轻 Cd 诱导的 MDA 上调(图 4E)(P
<0.01)和细胞死亡(图 4F)(P
<0.05)。总之,这些结果表明NCOA4介导的储铁蛋白自噬依赖性降解,这对于 Cd 诱导的肾小管上皮细胞铁死亡至关重要。3 讨论
随着工农业的快速发展,镉暴露严重威胁人类健康。肾功能衰竭是镉引起的最重要疾病之一,肾小管细胞被认为是镉致肾损伤的主要部位。研究表明,低至2.5 mg/kg和2.5 μmol/L的Cd可分别在体内和体外诱导肾损伤。鉴于多种类型的细胞死亡与Cd 诱导的毒性有关,研究 Cd 诱导的肾小管细胞的细胞死亡机制可以帮助我们了解 Cd 诱导的肾脏疾病的发病机制,并为其防治提供潜在的策略。
在这里,我们发现铁死亡是Cd诱导的肾小管上皮细胞毒性的一种新机制,并发现铁自噬介导的储铁蛋白降解促进镉诱导的铁死亡。铁死亡是新近发现的以铁依赖性脂质过氧化为特征的细胞死亡,与许多疾病过程有关。之前的研究表明,砷暴露通过破坏胰腺功能和神经细胞的铁稳态而导致铁死亡。氧化锌纳米颗粒诱导的血管内皮细胞死亡也与铁死亡有关,这表明铁死亡在毒性损伤中的重要作用。越来越多的证据表明,镉暴露会扰乱脂质代谢,促进ROS的过度产生,增加脂质过氧化,并扰乱铁稳态。我们的研究结果表明,镉暴露以剂量依赖的方式诱导铁死亡,Fer-1抑制脂质过氧化减轻了镉诱导的细胞死亡。这一观察结果支持铁依赖性脂质过氧化或铁死亡在镉诱导的肾小管上皮细胞毒性中的重要作用。
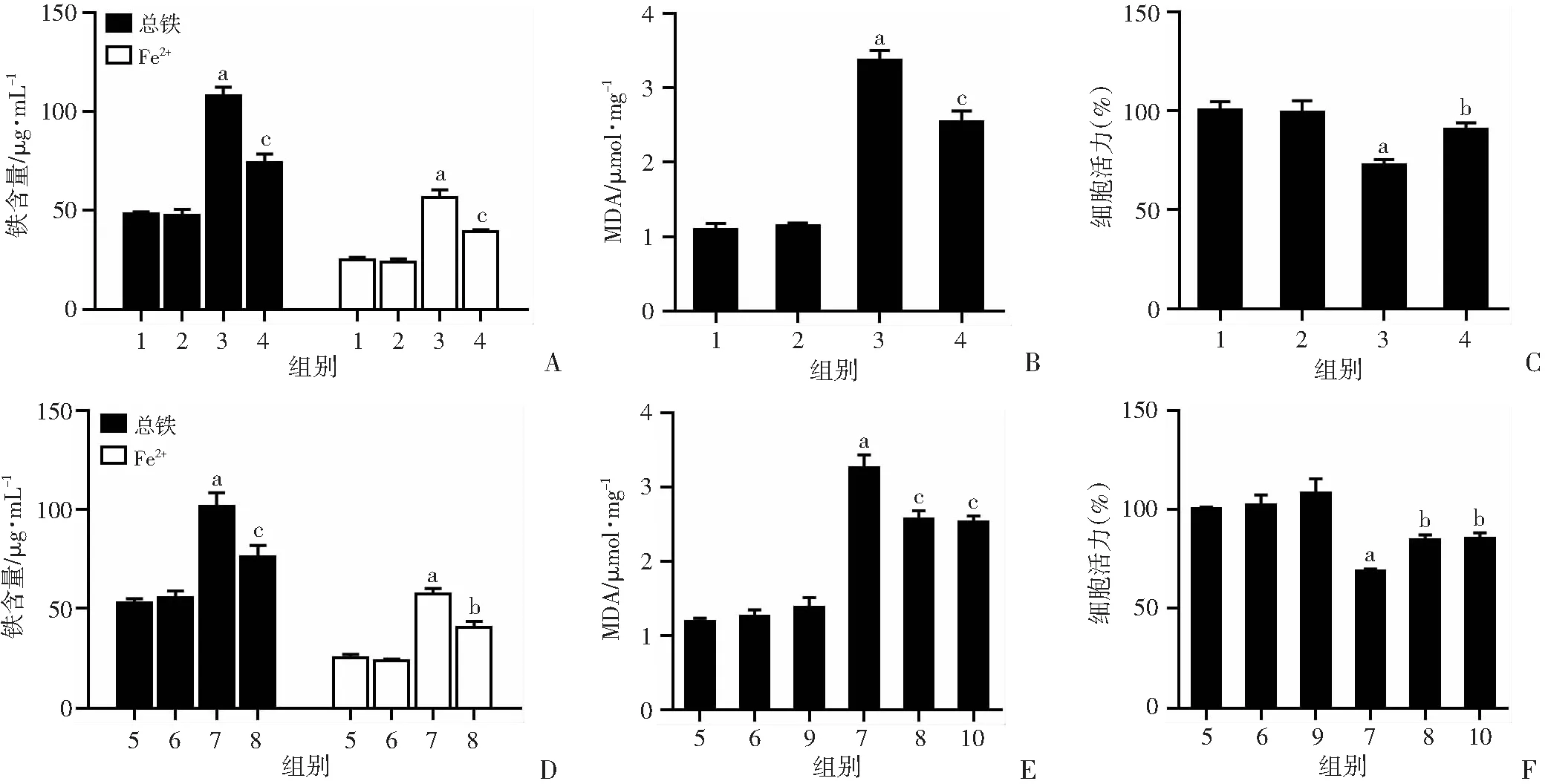
1:Control组;2:3-MA组;3:Cd组;4:3-MA+Cd组;5:Con-si组;6:ATG7-si组;7:Con-si+Cd组;8:ATG7-si+Cd组;9:NCOA4-si组;10:NCOA4-si+Cd组;a:P<0.01,与Control组比较;b:P<0.05,与Cd组比较;c:P<0.01,与Cd组比较
a:P<0.05,b:P<0.01,与Control组比较;c:P<0.01,与Cd组比较
最近的研究表明自噬与铁死亡调节有关。我们的结果表明,Cd诱导自噬激活,以及铁死亡是自噬细胞死亡的一种形式,因为3-MA或敲除ATG7抑制自噬,均导致Cd暴露后细胞游离铁、脂质过氧化和细胞死亡降低。我们还证明Cd诱导的HK-2铁死亡需要储铁蛋白,因为NCOA4敲除表现出与3-MA处理和ATG7敲除相似的作用。尽管NCOA4介导的铁自噬在2014年首次被报道,但铁自噬在各种病理生理过程中的许多作用都得到了阐明。例如,铁自噬是红细胞生成和铁死亡介导的肝纤维化所必需的,并促进肿瘤细胞铁死亡。我们的研究扩展了铁自噬的作用范围,以参与重金属Cd诱导的肾小管上皮细胞功能障碍。
总之,我们报道了Cd暴露以剂量依赖性方式诱导肾小管上皮细胞铁死亡,这与自噬激活密切相关,并且自噬在细胞死亡过程中发挥了促死亡作用。最重要的是,镉暴露导致储铁蛋白的自噬降解,即铁自噬,导致铁过载、脂质过氧化,并最终导致铁死亡。Cd暴露诱导的坏死、细胞凋亡和自噬已被认为是控制细胞命运的毒理机制。我们的研究扩展了这一概念,并提出铁自噬介导的铁死亡是一种由Cd诱导的新型细胞死亡形式,为进一步开发镉肾脏毒性防治药物提供理论支持。
