HL-5抑制HCT116细胞增殖作用及作用机制*
2022-09-08邹丽娟
邹丽娟,郑 莉,万 丹,甘 萍△
(1.中国人民解放军西部战区总医院,四川 成都610083;2.四川大学生物治疗国家重点实验室,四川 成都610041)
目前,大多数基于“单靶点单药物”模型的药物,在治疗复杂、异质、多基因的疾病如肿瘤方面正变得越来越无效。虽然药物组合疗法被用作实现疗效的替代方法,但其优势往往被不利的药物-药物相互作用、不可预测的药代动力学和安全性及患者服药依从性差所抵消。近年来,更倾向于研发“多靶点药物”,以解决许多单靶点或联合疗法的有限疗效和耐药性或毒性。磷脂酰肌醇3-羟基激酶(PI3K)和组蛋白去乙酰化酶(HDAC)是目前临床应用较广泛的抑瘤靶点,但PI3K和HDAC抑制剂都受到疗效不足和耐药突变的限制。有证据表明,同时抑制PI3K和HDAC,可协同抑制肿瘤生长,并通过提高疗效、限制耐药性和提供比单一抑制剂更好的治疗窗口来克服这些限制[1]。特异性HDAC和PI3K异构体的选择性抑制剂可能具有更好的低毒性特征,治疗窗更宽。治疗弥漫大B细胞淋巴瘤的双重抑制剂CUDC-907可通过协同效应抑制肿瘤细胞增殖和生存补偿途径,表现出HDAC和PI3K双向抑制作用,获得更好的治疗效益[2]。临床迫切需要新的具有高效力和选择性的双重抑制剂[3-4]。为此,本研究中以半数抑制率(IC50)评价HL-5与阳性药物辛二酰苯胺异羟肟酸(SAHA,HDAC靶点抑制剂)和4-羟基-2,6-二甲基苯甲腈(GDC-0941,PI3K靶点抑制剂)对肿瘤细胞增殖的抑制效果,同时通过细胞克隆实验、流式细胞仪和蛋白免疫印迹(Western blotting)法,探讨HL-5抑制肿瘤细胞增殖的作用机制。现报道如下。
1 材料与方法
1.1 仪器与试药
仪器:Multiskan Spectrum-15型全波长酶标仪,SORVALLST 16型常温离心机,FASC420型流式细胞仪,均购自赛默飞世尔科技有限公司;CKX31型倒置显微镜(日本Olympus公司);CCL-170B-8型CO2细胞培养箱(新加坡ESCO公司)。
试药:HL-5由课题组自主设计、合成,化学结构见图1。SAHA(批号为J01764A),GDC-0941(Pictilisib,批号为J0315A),均购自大连美仑生物技术有限公司;四甲基偶氮唑蓝(MTT,美国Sigma公司,批号为EZ7890D354);p-H3(批号为17AV0305),cdc25c(批号为E1616),P21(批号为F036118),p-cdc2(批号为K012443),均购自Abcam公司。
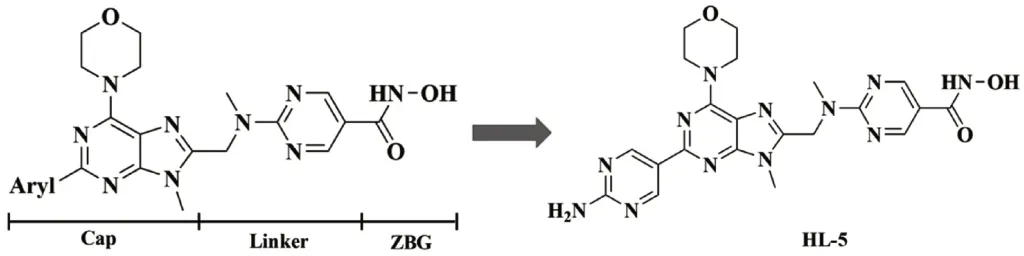
图1 HL-5的设计、合成与化学结构Fig.1 Design,synthesis and chemical structure of HL-5
1.2 方法
IC
50测定:选取对数生长期细胞,按(3~5)×104个/孔铺于96孔板,培养过夜。依次按浓度梯度加入HL-5(1 000,500,250,125,62.5,31.25 nmol/L),GDC-0941(20 000,10 000,5 000,2 500,1 250,625,312.5 nmol/L),SAHA(20 000,10 000,5 000,2 500,1 250,625,312.5 nmol/L),72 h后测定IC50[5]。
细胞克隆形成实验:细胞接种于6孔板(1×105个/孔),24 h后用不同终浓度的HL-5(0,25,50,100,200,400 nmol/L)干预48 h;更换新的6孔板,完成干预后的细胞重接种(500个/孔),行单克隆集落培养12 d;将细胞用甲醇固定15 min,0.1%结晶紫染液染色10 min,晾晒,次日拍照[6-7]。
细胞周期的流式检测:选用6孔板接种人结肠癌细胞系HCT116细胞(1×105个/孔),24 h后用不同终浓度的HL-5(0,40,200,1 000 nmol/L),SAHA(1 000 nmol/L),GDC-0941(1 000 nmol/L)干预细胞24 h;收集细胞,依次行清洗、固定、碘化丙啶(PI)染色和流式细胞仪检测分析[8-9]。
Western blotting实验:采用9 cm培养皿接种人结肠癌细胞系HCT116细胞,24 h后用不同终浓度的HL-5(0,40,200,1 000 nmol/L),SAHA(1 000 nmol/L),GDC-0941(1 000 nmol/L)干预细胞24 h;分别提取总蛋白,行电泳、转膜、封闭、抗体孵育、显影和拍照。
1.3 统计学处理
采用SPSS 19.0统计学软件分析。计量资料以±s表示,行方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 抗肿瘤细胞增殖活性
选取部分实体瘤细胞株进行考察,结果见表1。
表1 HL-5,SAHA,GDC-0941抗肿瘤细胞增殖活性比较(±s,μmol/L)Tab.1 Comparison of anti-proliferation effect of HL-5,SAHA and GDC-0941 on the tumor cells(±s,μmol/L)
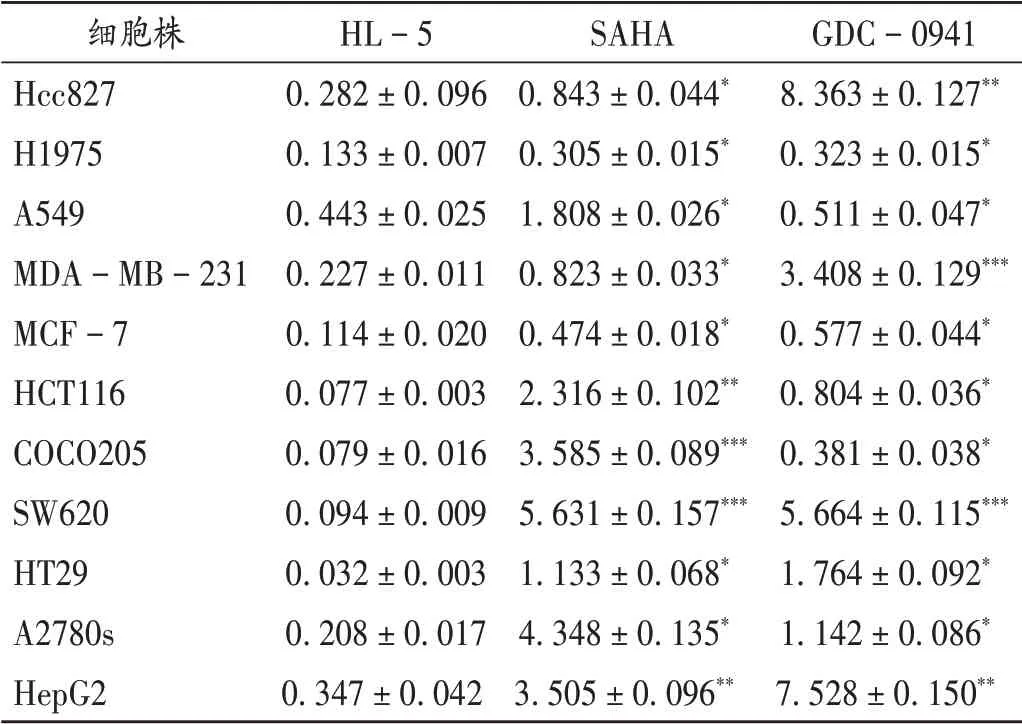
表1 HL-5,SAHA,GDC-0941抗肿瘤细胞增殖活性比较(±s,μmol/L)Tab.1 Comparison of anti-proliferation effect of HL-5,SAHA and GDC-0941 on the tumor cells(±s,μmol/L)
注:与HL-5比较,*P<0.05,**P<0.01,***P<0.001。Note:Compared with those of HL-5,*P<0.05,**P<0.01,***P<0.001.
细胞株Hcc827 H1975 A549 MDA-MB-231 MCF-7 HCT116 COCO205 SW620 HT29 A2780s HepG2 HL-5 0.282±0.096 0.133±0.007 0.443±0.025 0.227±0.011 0.114±0.020 0.077±0.003 0.079±0.016 0.094±0.009 0.032±0.003 0.208±0.017 0.347±0.042 SAHA 0.843±0.044*0.305±0.015*1.808±0.026*0.823±0.033*0.474±0.018*2.316±0.102**3.585±0.089***5.631±0.157***1.133±0.068*4.348±0.135*3.505±0.096**GDC-0941 8.363±0.127**0.323±0.015*0.511±0.047*3.408±0.129***0.577±0.044*0.804±0.036*0.381±0.038*5.664±0.115***1.764±0.092*1.142±0.086*7.528±0.150**
2.2 对HCT116细胞克隆形成的影响
细胞克隆集落形成情况见图2 A,HCT 116细胞计数统计结果见图2 B,可见,HL-5从25 nmol/L浓度开始,与二甲基亚砜比较差异有统计学意义(P<0.01)。结果表明,HL-5对肿瘤细胞具有持久杀伤能力。
2.3 对细胞周期的影响
HDAC抑制剂SAHA与PI3K抑 制剂GDC0941对细胞周期的作用效果不同,SAHA将细胞阻滞在G2/M期,而GDC-0941将细胞阻滞在G1期[8]。通过PI染色考察HL-5对细胞周期的影响,结果见图3。可见,HL-5处理HCT116细胞24 h后,G2/M期细胞比值随浓度增加而增加,且到达一定比值后不再增加,其阻滞细胞周期的结果与SAHA类似而不同于GDC-0941。
2.4 对细胞周期阻滞标志分子的影响
由图4可知,蛋白水平的结果与细胞流式仪分析结果相似,HL-5对各标志蛋白的影响类似于SAHA而不同于GDC-0941。经HL-5处理后,p-H3和P21水平升高;同时,细胞从G2期至M期转化的关键催化因子p-cdc2(161)和cdc25c水平降低。

图4 HL-5对细胞周期相关蛋白表达水平的影响Fig.4 Effect of HL-5 on the expression level of cell cycleassociated proteins
3 讨论
HDAC抑制剂作为抗肿瘤药物的效用在肿瘤学中越来越受到重视,临床不断涌现不同HDAC靶点的药物,治疗效果明显。但其适应证大多局限于血液学肿瘤,对实体瘤疾病的治疗作用不佳。同时,单靶点药物更易出现耐药性。多靶点药物有效剂量更低,疗效更好,相比单靶点药物不易产生耐药性,能对多种不同肿瘤细胞产生抑制作用,给药物开发设计及临床患者带来诸多益处[10-12]。由表1可知,作为HDAC/PI3K双靶点抑制剂,HL-5在非小细胞肺癌、乳腺癌、结肠癌、肝癌、黑色素瘤、卵巢癌等细胞株中均显示出良好的肿瘤抑制效果,且均优于对应的单靶点药物SAHA和GDC-0941,表明双靶点药物起效剂量更低,同时单一HDAC或PI3K靶点抑制剂的适用范围更大。与以往的单靶点药物联用增敏剂的研究[13]相仿,如在头颈鳞状细胞癌(HNSCC)模型中,HDAC的泛抑制剂LBH589与PI3K泛抑制剂BKM120联合使用,在体外和体内均有协同抗肿瘤作用。作为首个报道的HDAC和PI3K的双靶点抑制剂[14],CUDC-907已有5个项目处于临床评价阶段。在后期研究中,将选择CUDC-907作为阳性对照,对比HL-5与其体内外抗肿瘤疗效的差异。
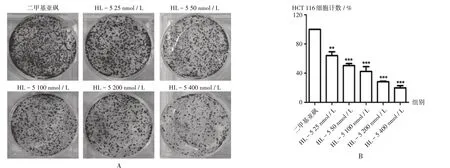
A.克隆染色B.HCT116细胞计数统计注:与二甲基亚砜比较,**P<0.01,***P<0.001。图2 HL-5对HCT116细胞克隆形成的影响A.Clone staining B.Statistics of HCT116 cell countNote:Compared with that of dimethyl sulfoxide,**P<0.01,***P<0.001.Fig.2 Effect of HL-5 on the clone formation of HCT116 cells
细胞克隆形成实验可考察化合物对肿瘤细胞的持久、不可逆的影响,检测经过化合物处理后的细胞在移除药物后能否继续保持增殖活性的能力。由图2可知,HL-5对HCT116细胞克隆形成有很好的抑制效果,且呈现一定的剂量依赖关系。由图3可知,上述结果可能与HL-5能将细胞周期阻滞在G2/M期有关。PI3K信号通路激活导致c-Myc和细胞周期蛋白D1的表达增加,细胞周期检查点蛋白质P21和P27的活性降低,促进细胞周期进程和存活[15];HDAC是细胞周期进程的关键调节剂,能促使肿瘤抑制基因P21和P27的表达增加。因此,同时抑制PI3K和HDAC可协同降低细胞周期蛋白D1的转录,并增加c-Myc的降解。针对CUDC-907的研究发现,其对c-Myc有很强的抑制作用,用于Myc依赖的弥漫大B细胞淋巴瘤和BRD-NUT融合阳性NUT中线癌均有很好的效果[16]。周期分析结果提示,双靶点抑制剂HL-5对细胞周期阻滞标志分子p-H3,cdc25c,P21,p-cdc2(161)的表达均有影响,其对细胞周期的抑制作用更倾向于HDAC抑制剂SAHA,且有一定的量效关系,而非同时具备2个靶点对周期阻滞的特点,与已有单靶点抑制剂作用机制类似[17]。后期研究将进一步考察HL-5对p27,c-Myc,caspase等相关信号通路靶标的影响。
综上所述,与HDAC或PI3K抑制剂相比,双靶点抑制剂HL-5可较好地扩展药物的适用范围,起效剂量更低,值得进一步开发利用。后期研究将选择HCT116,H1975,COCO205,MCF-7细胞株建立荷瘤小鼠模型,以考察HL-5在体内的抗肿瘤作用和作用机制,以及可能的毒性靶器官[18-20]。
