卵巢-附件影像报告和数据系统(O-RADS)磁共振成像风险分层指南介绍和解读
2022-09-08孙梦雅胡笑笑张繁关键
孙梦雅 胡笑笑 张繁 关键
2022 年美国放射学会(American College of Radiology,ACR)正式发布了卵巢-附件影像报告和数据系统(Ovarian-Adnexal Reporting and Data System,O-RADS)MRI 风险分层系统的指南[1]。该指南是ACR 磁共振工作小组在2013 年发表的ADNEX MR 评分系统[2]基础上推出的。作为卵巢-附件肿块恶性概率评估系统,O-RADS MRI 基于病变的类型、组成和实性成分增强模式等MRI特征对评估卵巢-附件病变进行评估。该指南将卵巢-附件磁共振所见的风险分为6 类(ORADS MRI 0~5 分),评分大于等于4 分的卵巢-附件病变需要限期手术,而2~3 分的病变可接受微创或保守手术或择期手术,1 分的病变无需处理[3,4]。O-RADS MRI 涵盖了从生理性到高度恶性的肿物,弱化了卵巢-附件病变的具体组织学诊断(如上皮源性或生殖源性)。O-RADS MRI 的主要目标是在标准化影像数据基础上,改善放射科医生和临床医生之间的沟通,促进卵巢-附件病变的治疗。
对于典型良性特征的卵巢-附件病变,超声具有很高的诊断敏感性和特异性,恶性肿瘤的阳性预测值接近0[5-7]。但当卵巢-附件病变的超声表现不典型时,恶性肿瘤的阳性预测值降至7%~50%[8,9],而MRI 能将此类病变的阳性预测值增加到71%,同时阴性预测值为98%[3]。因此,MRI 能为超声不明确的病变提供更具体诊断,从而有助于改善恶性病变的预后并减少良性病变的手术率[10-12]。
MRI对卵巢-附件病变的诊断优势
MRI 用于卵巢-附件病变诊断的优势如下:(1)排除恶性肿瘤特异性更高,可减少超声误诊率,避免良性或交界性病变患者接受不必要或过度手术治疗,有助于保留年轻女性的生育能力,并保证具有潜在恶性病变的患者得到及时临床评估和手术治疗[13-17]。(2)软组织分辨率高,有利于分辨不同液体或实性成分,如出血、脂肪、纤维成分等,从而更准确地判断病变性质[18]。(3)多平面成像可全方位、多角度观察病变,有助于评估病灶中的小乳头状突起、软组织结节及巨大卵巢-附件病变,而超声对于此类病变的诊断在一定程度上受限[18-20]。(4)评估巨大肿块的起源准确性高。有文献统计10%盆腔病变被超声误判为卵巢-附件起源,而MRI 判断起源的准确率达97%[3,18]。MRI 在确定适应证和诊疗计划上优于超声。(5)现有条件下,在评估超声诊断不明确的卵巢-附件病变方面,MRI 是除了手术之外的金标准[13-15]。
O-RADS MRI 的成像技术要求
MRI 数据采集可以使用1.5 T 或3.0 T 磁共振扫描仪。采集序列应包括矢状位非脂肪抑制T2WI(层厚≤4 mm)、轴位非脂肪抑制T2WI(层厚≤3 mm)、轴位T1WI 同反相位(层厚≤4 mm)、轴位DWI(定位同T2WI;层厚≤4 mm;高b 值≥1000 s/mm2),及轴位脂肪抑制T1WI 动态增强(dynamic contrast enhanced,DCE)成像(层厚≤3 mm;时间分辨率≤15 s)。DCE MRI 应在推注对比剂前30 s 开始扫描以获取平均图像用于减影,推注对比剂后应进行无间断扫描获取DCE 图像(时间间隔0 s;总时间4 min)。
O-RADS MRI 风险分层系统中,卵巢-附件病变内的实性组织是决定评分的主要因素,无实性组织的病变恶性风险近乎为0[2,10,11,16,17,21-28]。因此为充分评估病变内所有实性组织,ACR 磁共振工作小组推荐采用DCE MRI 扫描。常规应采集轴位DCE 图像,若病变非常大,则可在保证时间分辨率的情况下采集矢状位或冠状位DCE 图像,以全面覆盖病变。如果无条件进行15 s 时间分辨率的DCE MRI 扫描,也可以进行普通增强扫描,要求推注对比剂30~40 s 后采集三维超快梯度回波T1WI(层厚≤3 mm)。
O-RADS MRI 成像技术对磁共振设备的场强要求不高,1.5 T 磁共振扫描仪即能满足b 值为1000 s/mm2的DWI 数据采集,也没有特别要求采用高分辨率扫描方案,因此有利于在基层医院开展和推广。
O-RADS MRI 词典
O-RADS MRI 的标准化术语、定义即O-RADS MRI 词典见表1[29]。病变类型包括囊性病变(单房囊性、多房囊性)、含实性成分的病变以及实性病变。实性病变由至少80%的增强实性组织组成。实性组织被定义为增强后强化且符合以下形态之一的成分:乳头状突起、壁结节、不规则分隔或壁、肿块(图1)。囊内容物成分包括单纯性囊液、非单纯性囊液和非实性组织。非单纯性囊液包括出血性、子宫内膜异位性、蛋白性(黏液、脓液和胶体)或脂性物质。非实性组织包括光滑分隔或壁(不论厚薄)、血凝块、碎屑或纤维蛋白、脂肪、毛发、钙化灶和Rokitansky 结节(卵巢囊性畸胎瘤内壁上凸起的结节,可含皮脂、脂肪、钙化、牙齿或骨骼等)。实性组织的增强模式,即DCE 时间-信号强度曲线(time-intensity curve,TIC)类型,分为低风险、中风险和高风险三种(图2)。在绘制TIC 曲线时,兴趣区(region of Interest,ROI)应选在病变实性组织中最早开始强化的部分,子宫肌层的ROI 选择应避开子宫肌层的血管或病变(如子宫平滑肌瘤或子宫腺肌症)。

图1 不同实性组织的示意图、T2WI和DCE 图像的特点

图2 DCE 时间-信号强度曲线示意图。低风险曲线(Type Ⅰ):曲线缓慢上升(比子宫肌层慢),且没有明确的肩部和平台;中风险曲线(Type Ⅱ):曲线适度上升,初始斜率小于或等于子宫肌层曲线,且伴有肩部和平台;高风险曲线(Type Ⅲ):曲线急剧上升,初始斜率大于子宫肌层曲线,且伴有肩部和平台。M:子宫肌层曲线

表1 O-RADS MRI 的术语及定义

续表1
应用O-RADS MRI 风险分层系统时要特别注意区分实性组织(尤其是不规则分隔)和非实性组织(如输卵管内褶皱、Rokitansky 结节),这是病变O-RADS MRI 评分的重要因素。
O-RADS MRI 评分(表2)

表2 O-RADS MRI 风险分层评分
O-RADS MRI 0 分:评价不完全。这种情况包括病变没扫全,或MRI 检查技术不完善,如成像序列不全、图像存在大量伪影等。
O-RADS MRI 1 分:正常卵巢。包括绝经前女性卵巢生理性表现,如小于等于3 cm 的卵泡、出血性囊肿、黄体囊肿,生理性表现可随月经周期发生改变。而O-RADS MRI 2~5 分均属于病理性改变。虽然卵泡也被ACR 磁共振工作小组定义为单纯性囊肿,但是为了使其与2 分中单纯性囊肿区分,实际工作中可以在MRI 报告中将其描述为卵泡。
O-RADS MRI 2 分:几乎可以肯定的良性病变(恶性风险<0.5%)。包括(1)单纯性囊肿,无论囊壁是否增强。(2)无囊壁增强的单房囊肿,包括蛋白性囊肿、出血性囊肿。(3)子宫内膜异位性囊肿(单房/多房、囊壁强化/不强化)。(4)无实性组织的含脂肪病变,如成熟畸胎瘤或皮样囊肿。此外,含少量实性组织(如Rokitansky 结节)的皮样囊肿也被评为2 分。(5)实性组织T2WI、高b 值DWI 都呈均匀一致低信号的病变(简称“双低”病变)。(6)输卵管积液(含单纯性囊液,可有薄且光滑的强化壁/褶皱)。尤其要注意的是,输卵管积液时不要将可强化的输卵管内褶皱误认为乳头状突起。(7)卵巢旁囊肿(含任何囊液),可有薄且光滑的强化囊壁。总而言之,用规范化MRI 术语描述的各种典型良性囊肿(包括单纯性囊肿、无壁强化的单房囊肿、子宫内膜异位性囊肿、成熟畸胎瘤或皮样囊肿、输卵管积液、卵巢旁囊肿)和“双低”病变均被判断为O-RADS MRI 2 分。
O-RADS MRI 3 分:恶性低风险病变(恶性风险0.5%~5%)。包括(1)蛋白性(如黏液)、出血性单房囊肿,有光滑增强的囊壁。其与O-RADS MRI 2 分中的蛋白性、出血性囊肿的区别点在于囊壁是否增强,若囊壁无强化则评为2 分,反之则评为3 分。(2)多房囊肿,有强化的光滑分隔和囊壁(图3)。需要注意是,有些含脂肪病变、子宫内膜异位性囊肿也可呈多房囊性表现,此时应评为2分而不是3 分。(3)含实性组织的病变(“双低”病变除外),实性部分曲线类型为低风险。(4)输卵管积液(含非单纯性囊液伴有薄的壁/褶皱,或含单纯性囊液伴有厚且光滑的壁/皱褶),包括积液(水)、积脓或积血等。这里指的输卵管积液与O-RADS MRI 2 分中输卵管积液的区别点在于壁的厚度,若壁厚大于等于3 mm 则被评为3 分,反之则被评为2 分。
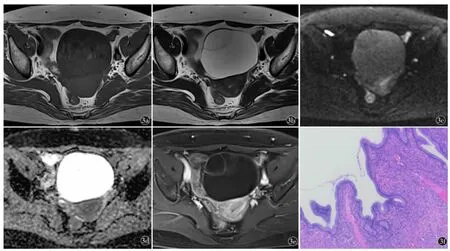
图3 O-RADS MRI 3 分。女,53 岁,左卵巢黏液性囊腺瘤。a)~e)盆腔多房囊性肿物,囊壁和分隔光滑,囊内容物T2WI 高信号,T1WI 低信号,高b 值DWI 高信号,ADC 高信号,增强囊壁和分隔强化;f)术后病理HE 染色图像(HE×40)
O-RADS MRI 4 分:恶性中风险病变(恶性风险5%~50%)(图4)。包括(1)含实性组织的病变(“双低”病变除外),实性部分曲线类型为中风险。(2)如果没有做DCE MRI 扫描,也可以在普通增强序列上评估,即病变内实性组织的强化程度低于或等于子宫肌层,则被评为4 分。由于不能进行曲线类型分析,普通增强不能进一步区分3 分和4 分的病变。(3)含脂肪病变同时有大量强化的实性组织,直接被定为4 分。实际工作中应留意含脂肪病变内实性组织的量或比例。

图4 O-RADS MRI 4 分和1 分。女,31 岁,左卵巢子宫内膜样腺癌(箭),右卵巢黄体囊肿伴出血(箭头)。a)~f)左卵巢实性肿块(箭),实性组织T2WI 中等信号,高b 值DWI 高信号,ADC 低信号,增强减影图示肿块不均匀强化,DCE 曲线呈中风险型(下方实线为病灶曲线,上方虚线为子宫肌层曲线)。右卵巢单房囊性肿物(箭头),囊内容物T2WI 高信号,高b 值DWI 高信号,ADC 高信号,增强减影图示肿物无强化
O-RADS MRI 5 分:恶性高风险病变(恶性风险≥50%)(图5)。(1)含实性组织的病变(“双低”病变除外),实性部分曲线类型为高风险。(2)普通增强时病变的实性组织强化程度高于子宫肌层。(3)腹膜、肠系膜或网膜结节或不规则增厚,伴或不伴腹腔积液——即出现转移特征时,直接评为5 分,无需曲线分析。如果扫描范围内无子宫(如子宫切除、先天性无子宫),因缺乏子宫肌层曲线的对照,而中、高风险TIC 形态又相似,此时难以区分4 分和5 分的病变。

图5 O-RADS MRI 5 分。女,14 岁,双卵巢B 细胞淋巴母细胞性淋巴瘤。a)~e)双卵巢增大,内多发实性结节,实性组织T2WI 压脂中等信号,高b 值DWI 明显高信号,ADC 明显低信号,增强轻度均匀强化,增强曲线呈中风险型(下方为病灶曲线,上方为子宫肌层曲线)。腹膜弥漫性增厚,右髂腰肌、臀中肌、双侧竖脊肌、脊柱及椎管、部分肠管受累;f)穿刺病理HE 染色图像(HE×40)
评分时需注意以下要点:(1)囊性病变或输卵管积液评分最高为3 分,而含实性组织的病变或实性病变评分的起点分为3 分。(2)由于病变内实性组织的TIC 类型直接决定被评为3 分、4 分还是5 分,所以绘制TIC 时ROI 的选取至关重要。(3)由于“双低”病变无需曲线分析即被评为2 分,对含实性组织的病变或实性病变需除外“双低”表现后再行曲线分析。(4)高b 值DWI 的作用主要体现在诊断或排除“双低”病变上,对恶性程度的判断暂时并没有纳入O-RADS 系统。
应用O-RADS MRI 的注意事项
ACR 委员会指出O-RADS MRI 风险分层指南在具体临床实践中有一些应注意的问题,主要涉及以下内容:(1)仅用于评估无急诊症状的卵巢-附件病变患者,而不适用于非卵巢-附件病变的评估。如急性盆腔炎合并输卵管积脓、阔韧带与宫肌瘤等不应进行评分。(2)对于多发或双侧病变,每个病变均需单独评估,且以O-RADS 评分最高的病变指导治疗。例如左卵巢子宫内膜样腺癌合并右黄体囊肿伴出血,2 个病变术前分别被评为O-RADS MRI 4 分和1 分(图4),并以4 分病变来指导治疗,即患者应进行限期手术治疗。(3)皮样囊肿(可含少量实性组织,如Rokitansky 结节)、成熟畸胎瘤被评为O-RADS MRI 2 分,因为这些病变几乎为良性。由于皮样囊肿中可能存在未成熟成分或发生恶变(如恶变为鳞状细胞癌),所以具有大量实性组织的含脂肪病变应被评为O-RADS MRI 4 分。在实际工作中,应重点评判含脂肪病变内是否存在实性组织并确定其含量,这是判断2 分或4 分的关键区分点。(4)O-RADS MRI 除了进行风险评分外,如能通过典型影像特征诊断到具体疾病(如无性细胞瘤、颗粒细胞瘤、淋巴瘤、浆液性乳头状肿瘤、腹膜假性囊肿等),那么评分与具体疾病诊断可同时在报告中呈现(叠加使用)。例如对于卵巢淋巴瘤,可对其直接评为O-RADS MRI 5 分,同时给出卵巢淋巴瘤的诊断(图5)。(5)由于DCE 图像可以对病变内实性组织进行曲线分析,所以DCE MRI 用于卵巢-附件病变的评估要优于普通增强MRI。(6)检查技术不充分时,应被评为0 分,切勿强行评分。
展望和小结
ACR O-RADS MRI 委员会指出未来的研究应侧重于影像数据匮乏的领域,如普通增强MRI用于卵巢-附件病变评估时,如何确定O-RADS MRI 4 分及5 分恶性肿瘤的诊断。此外,为避免放射科医生主观判定,需要对皮样囊肿内的实性组织进行定量分析。再者,需要前瞻性队列研究来评估O-RADS MRI 评分系统在临床实践中的应用价值。
总之,O-RADS MRI 风险分层系统提供了一种以MRI 特征(病变类型、组成和实性组织增强模式)来判断卵巢-附件病变恶性概率的方法,其广泛实施可改善放射科医生和临床医生之间的沟通,以优化卵巢-附件病变的治疗,改善卵巢-附件病变患者预后。
