菜籽多肽结构鉴定及其包封β-胡萝卜素的机制
2022-09-07罗发莉蓝妙传付余马良戴宏杰冯鑫张宇昊
罗发莉,蓝妙传,付余,马良,2,戴宏杰,冯鑫,张宇昊,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学 前沿交叉学科研究院,生物学研究中心,重庆,400715)
β-胡萝卜素是最重要的类胡萝卜素之一,具有抗氧化、抗肿瘤和增强免疫力等生物活性。然而,由于β-胡萝卜素水溶性差、生物利用率较低以及对氧气、光和温度极其敏感而发生降解等缺点,在食品、医药和化妆品等领域的应用受到了限制[1]。近年研究表明,食品蛋白质来源的多肽具有两亲性、生物相容性、生物降解性、生物活性和环境友好性等优势,现已经被广泛应用于对生物活性物质的包封[2]。JIAO等[3]以玉米醇溶蛋白肽作载体对水溶性差、不稳定和生物利用度低的叶黄素进行包封,结果表明多肽可有效提高叶黄素的溶解度、稳定性和生物利用度。DU等[4]通过酶促水解α-乳清蛋白制备了α-乳清蛋白胶束,将其用于β-胡萝卜素的自组装包封,结果表明与游离的β-胡萝卜素相比,经α-乳清蛋白胶束包封的β-胡萝卜素在60 ℃加热或紫外光照射下的水溶性和稳定性显著提高。JIAO等[5]研究发现,聚-L-赖氨酸修饰的纳米脂质体可用于叶黄素的新型递送系统,与未被聚-L-赖氨酸修饰的纳米脂质体递送叶黄素相比,聚-L-赖氨酸可以保护纳米脂质体中的叶黄素不被降解,并促进胃肠液条件下纳米脂质体中叶黄素的释放进而提高其生物利用度。综上,多肽可作为疏水性生物活性物质的载体,具有提高其稳定性、水溶性和生物利用度的潜力。然而,当前研究侧重于多肽包封生物活性物质的理化性质[粒径、多分散指数、zeta电位、包封率(encapsulation efficiency,EE)、负载量(loading amount,LA)和体外稳定等],并没有从分子水平上阐明两者的相互作用机制。因此,研究多肽包封生物活性物质的相互作用机制具有十分重要的意义。
本课题组先前发现以菜籽粕为原料,经酶解得到的菜籽多肽(rapeseed peptides,RPs)可自组装包封疏水性生物活性物质β-胡萝卜素,以不同水解时间、包封时间以及β-胡萝卜素与菜籽多肽质量比为自组装包封β-胡萝卜素的影响因素进行条件优化后,测得包封率为80.03%,负载量为0.48 mg/mg[6]。此外,菜籽多肽经超滤(1~3 kDa)和乙腈先后处理,将其用于β-胡萝卜素的包封,包封率显著提高到95.79%,负载量提高到0.57 mg/mg。由此说明,菜籽多肽的分子质量和极性差异会影响与β-胡萝卜素相互作用的位点进而导致包封出现差异[7]。因此,为进一步探究菜籽多肽与β-胡萝卜素的相互作用机制,本研究以经超滤(1~3 kDa)和乙腈先后处理的菜籽多肽为研究对象,首先利用液质联用对菜籽多肽的氨基酸序列进行鉴定,然后,以多肽的分子质量、亲疏水性和氨基酸组成等影响包封效果的因素为依据,筛选多肽进行分子对接研究。最后,基于分子对接结果和亲疏水氨基酸组成,从中筛选多肽固相合成后验证包封实验。本研究为阐明菜籽多肽包封β-胡萝卜素相互作用机制提供理论依据。
1 材料与方法
1.1 材料与试剂
菜籽粕(蛋白质含量41.20%),西南大学农学与生物科技学院;β-胡萝卜素(纯度98%),北京索莱宝生物科技有限公司;碱性蛋白酶Alcalase 2.4 L,诺维信公司;多肽,生工生物工程(上海)股份有限公司;乙腈、甲酸(均为色谱纯),成都科隆化学品有限公司;氢氧化钠、正己烷,成都科隆化学品有限公司试剂厂;其余试剂均为分析纯。
1.2 仪器与设备
Easy-nLC 1200液相色谱仪、Orbitrap Fusion Lumos质谱仪和Heraeus Multifuge X3R,美国赛默飞世尔科技公司;BNGM2097有机膜分离实验机,济南博纳生物技术有限公司;JA3003B电子天平,上海精天电子仪器有限公司;CJ-78-1磁力搅拌器,上海将任实验设备有限公司;HH-4数显恒温搅拌水浴锅,上海新诺仪器设备有限公司;PE20实验室pH计,上海梅特勒-托利多仪器有限公司。
1.3 实验方法
1.3.1 菜籽多肽的制备
将菜籽粕粉均匀分散在纯水中,料液比为1∶25(g∶mL),酶底物比为1∶100(mL∶g),并在碱性蛋白酶Alcalase 2.4 L的最适条件(温度55 ℃、pH 8.5)下水解60 min以制备菜籽多肽,使用0.5 mol/L的NaOH溶液维持pH 8.5恒定。水解结束后,立即置于沸水中15 min灭酶。待冷却至室温后离心(5 000 r/min,10 min),取上清液分别通过1 kDa和3 kDa分子质量超滤膜制备分子质量为1~3 kDa的多肽溶液,再通过180 Da纳滤膜除盐以避免多肽液中可能存有的少量盐类对色谱柱造成损害。然后在磁力搅拌下加入乙腈溶液(肽溶液与乙腈溶液体积比为1∶3),并在 4 ℃的冰箱中放置使其充分混合后离心(10 000 r/min,10 min),取上清液旋转蒸发去除乙腈,收集多肽溶液冷冻干燥后备用。
1.3.2 菜籽多肽的质谱测序与多肽的筛选
菜籽多肽的氨基酸序列通过液质联用鉴定。
液相色谱条件参考FENG等[8]的方法并作适当的修改。色谱仪:Easy-nLC 1200系统;色谱柱:C18(3 μm,100 Å,75 μm×15 cm),流动相A为0.1%甲酸溶液,流动相B为含甲酸0.1%(体积分数)的乙腈水溶液(体积分数80%)。所应用的色谱梯度为:0~4 min(95%A,5%B);4~40 min(90%A,10%B);40~47 min(72%A,28%B);47~48 min(62%A,38%B);48~60 min(0%A,100%B)。进样量:5 μL,流速:0.3 mL/min,柱温:30 ℃。
质谱条件参考ZHANG等[9]的方法并作适当的修改。具体参数如下:喷雾电压2.0 kV,毛细管温度320 ℃,分辨率设置为1级120 000(m/z200),2级30 000(m/z200),离子扫描范围m/z350~1 550,MS1自动增益控制(AGC)4e5,离子注入时间50 ms,MS2自动增益控制(AGC)1e5,离子注入时间50 ms,离子筛选窗口1.6m/z,动态排除时间为60 s(质量范围±1 Da)。
对于所获得的液质联用数据使用PEAKS Studio X plus进行处理分析,利用菜籽蛋白数据库Brassicanapus(Rape)匹配结果以鉴定肽序列[10]。进一步根据液质联用所获得的菜籽多肽鉴定结果,结合不同多肽序列的分子质量大小、亲疏水氨基酸组成、含量来源等影响多肽自组装包封的因素。同时参考ProtParam数据库(https://web.expasy.org/protparam/)计算多肽的亲水性总平均值(grand average of hydropathicity,GRAVY),负值越大表示亲水性越好,正值越大表示疏水性越强,接近0的时候表明其两亲性较好[11],从中筛选具有良好包封潜力的多肽进行分子对接。
1.3.3 分子对接
小分子物质的准备:从Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取能量最低、最稳定的β-胡萝卜素结构,下载文件格式为.Mol2,以保证后续分子对接实验顺利进行。
靶标多肽结构的准备:首先利用在线网站(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)对多肽结构进行预测,并遵循能量最低最稳定的原则选择多肽结构。再利用SYBYL-X 2.1.1软件中Surflex-Dock(SFIC)标准模式对多肽进行结构处理,把原配体分子从受体的口袋中分离,除去水分子和其他小分子,并对其末端进行修复,对多肽加氢原子、加电荷,以配体为中心5Å的距离内设定对接口袋,由此生成靶标多肽的对接文件[12]。
分子对接:根据分子对接的步骤设定相关参数,采用一致性打分函数Concensus Score(C-Score)和总得分函数Total-Score(T-Score)相结合的方式来对分子对接结果进行评价[13]。C-Score通过构象预测函数、结合自由能函数、共同评价函数等多个方面一起综合得到的评价对接结果可靠性进行打分的函数,主要根据D-SCORE、PMF-SCORE、G-SCORE、CHEM-SCORE这4个值的计算得到。总得分函数T-Score是SYBYL-X 2.1.1 软件自带的打分函数,主要由Crash(碰撞打分,越趋近于0越好)和Polar(极性打分,分值越小越好)组成。基于以上评判标准筛选出最佳结合构象,对获得的最佳结合构象初步探讨肽段与β-胡萝卜素相互作用情况;进一步利用LigPlus软件对最佳结合构象的相互作用力可视化,研究分析菜籽多肽与β-胡萝卜素相互作用机制。根据分子对接结果和亲疏水氨基酸组成选取多肽固相合成用于包封实验验证。
1.3.4 包封率及负载量的测定
参考LIU等[14]的方法稍作修改,对包封率和负载量进行测定。将合成多肽配制成5 mg/mL的溶液,调节pH为7,以多肽与β-胡萝卜素质量比为3∶5加入β-胡萝卜素粉末并在25 ℃下连续搅拌3 h后即得到包封溶液。将包封后的多肽溶液每次加入10 mL的正己烷,涡旋振荡3 min,重复数次直至正己烷层变为无色使游离的未被包封的β-胡萝卜素分离出来,进一步测定正己烷中未被包封的β-胡萝卜素的含量(β-胡萝卜素的标准曲线为y=0.843 5x-0.000 2,R2=0.998 7)。包封率和负载量计算如公式(1)和公式(2)所示:
(1)
(2)
式中:β-c(free)为游离β-胡萝卜素的含量,mg;β-c(total)为添加的β-胡萝卜素的总含量,mg;m(RPs)为添加的菜籽多肽的质量,mg。
1.4 数据统计分析
每个实验重复3次,结果用平均值±标准差表示,使用SPSS Statistics 21.0对数据进行分析,并使用Origin 8.0软件作图。
2 结果与分析
2.1 质谱测序及筛选结果的分析
2.1.1 质谱测序
菜籽多肽液的质谱测序总离子色谱图如图1所示。从菜籽多肽液中共鉴定出2 086条多肽序列。将得到的多肽测序结果与Uniprot数据库(https://www.uniprot.org/)中菜籽蛋白的序列进行BLAST同源性比对,发现水解液中多肽大多来源于P33525、P33522、P24565等几种油菜籽中主要的储藏蛋白Cruciferin和Napin,也有部分多肽来源于菜籽蛋白中的P29111、C3S7F1等油料蛋白Oleosins[15]。
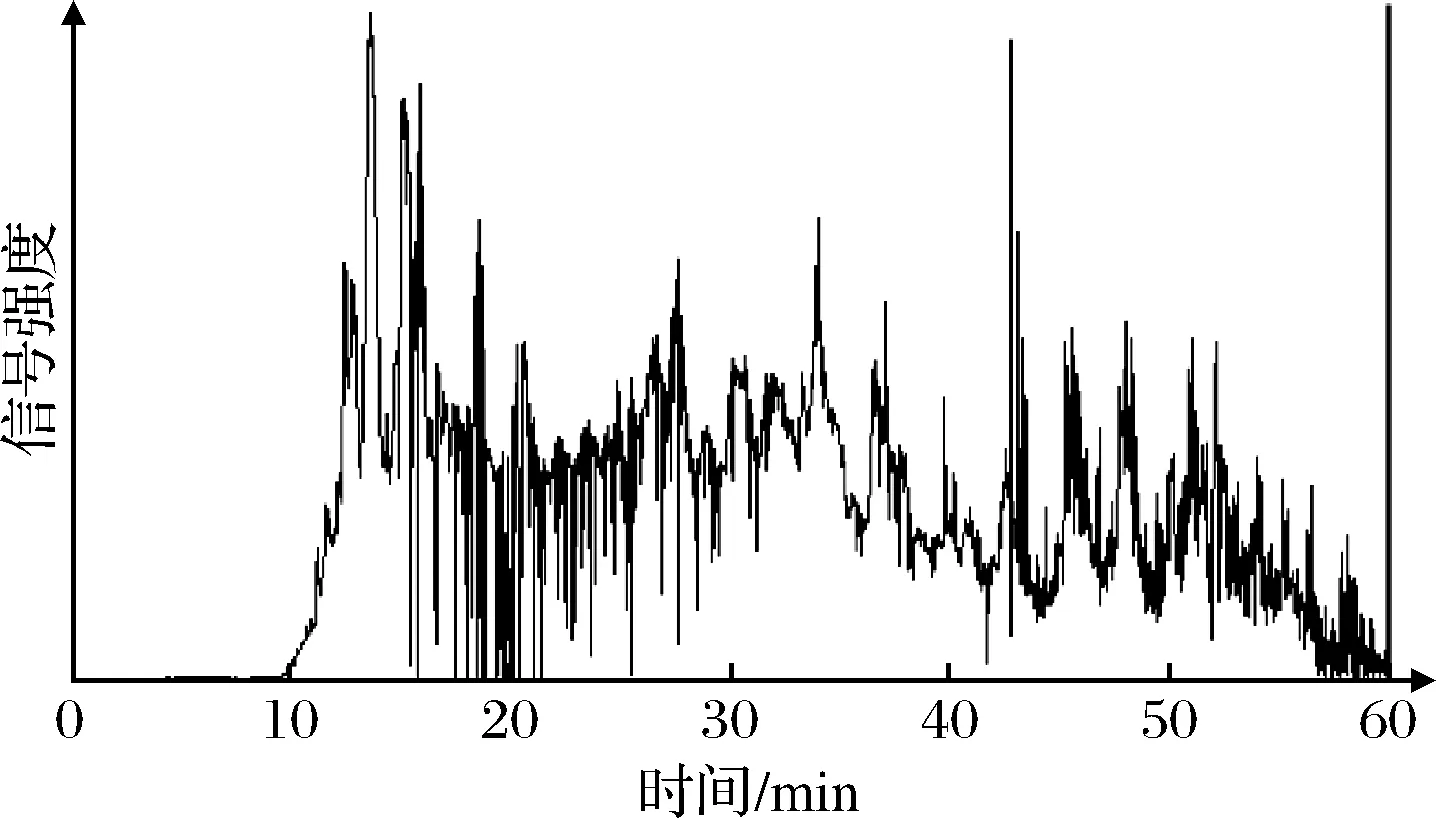
图1 菜籽蛋白肽的总离子色谱图Fig.1 Total ionic chromatogram on rapeseed peptides
2.1.2 多肽的筛选
多肽的分子质量大小、亲疏水性氨基酸分布和含量丰度等因素会影响包封效果[16-17]。本课题组先前研究证明,与小于1 kDa以及3~5 kDa的多肽组分相比,1~3 kDa的多肽具有最优的包封效果。此外,HAN等[18]研究表明,亲疏水氨基酸规律性交替分布或者各分布在多肽链的1端的多肽可能更有利于多肽的自组装,进而可提高其包封效果。此外,参考GRAVY值选择接近于0的两亲性多肽[19]。再者,从多肽含量和原料来源的独特性考虑,选择酶解液中含量丰富且来源为菜籽蛋白中最主要蛋白的多肽。因此,筛选得到了5条多肽(GFRDMHQKVE、NSYDLPILRVL、GTCPFIAIPF、KGQQGQSQGQQ、NTGDQPLVII,表1)用于后续分子对接。由表1可知,这5条多肽均来源于最主要的菜籽蛋白且含量丰富,分子质量均为1 000~1 300 Da,并且这5条多肽按照亲疏水性氨基酸规律性交替(RPs-1)和亲疏水性氨基酸各在多肽链的一端(RPs-2~RPs-5)的特征分布。同时,这5条多肽的GRAVY值均接近于0,可能具有良好的两亲性有利于多肽自组装包封,值得进一步通过分子对接实验进行研究。
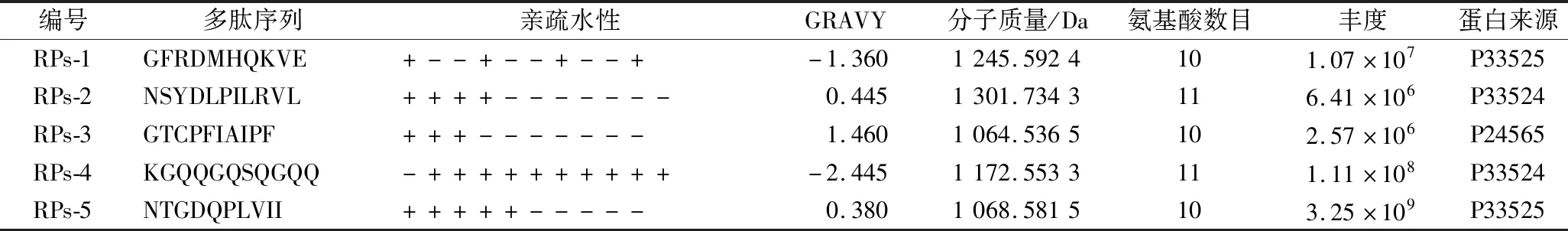
表1 所筛选菜籽多肽的基本信息Table 1 Basic information on the rapeseed peptides
2.2 分子对接结果分析
5条菜籽多肽的3D结构图如图2所示。不同多肽展现出不同构象,弯曲折叠形成了一定的空间结构。5条菜籽多肽分别与β-胡萝卜素的分子对接模型如图3所示。蓝色的整片区域是多肽的“对接口袋”,线形形状的小分子物质即为β-胡萝卜素。由图3可知,没有出现β-胡萝卜素分子远离多肽的现象,说明多肽能够与β-胡萝卜素形成稳定的包封复合物。β-胡萝卜素端链上的2,6,6-三甲基环己烯基与多肽的“对接口袋”可能产生了相互作用,但具体相互作用力后续将利用LigPlus软件进一步分析。分子对接结果的打分评价结果如表2所示。从T-Score数据来看,上述几种多肽的T-Score值都较低,说明菜籽多肽与β-胡萝卜素的相互作用效果不太理想,但还需结合一致性打分函数C-Score的结果来进一步判断。C-Score是应用最为广泛的评价指标,所筛选的5种多肽的C-Score≥4,表示对接成功,说明对接结果与实验的相似度较高,具有可靠性[20]。
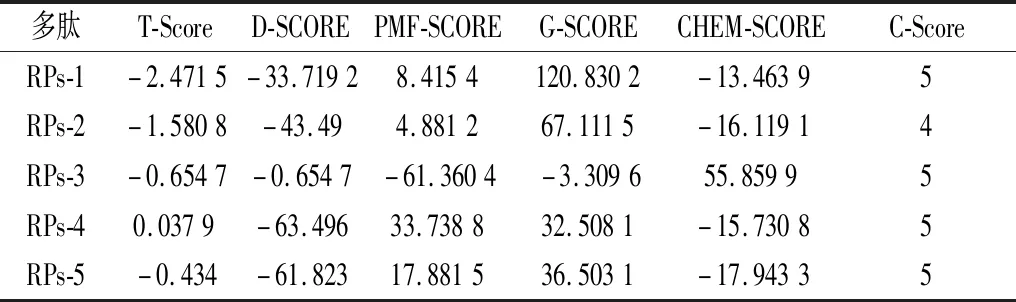
表2 分子对接结果的打分结果Table 2 Scoring results of molecular docking

A-RPs-1;B-RPs-2;C-RPs-3;D-RPs-4;E-RPs-5图2 所筛选菜籽多肽的3D结构图Fig.2 Three dimensional structure diagram on the selected rapeseed peptides

A-RPs-1;B-RPs-2;C-RPs-3;D-RPs-4;E-RPs-5图3 所筛选菜籽多肽与β-胡萝卜素的分子对接模型Fig.3 The molecular docking model on the selected rapeseed peptides and β-carotene
5条多肽与β-胡萝卜素2D相互作用力可视化结果如图4所示。图中“睫毛状”标识表示所发生疏水相互作用的氨基酸,标识的数目也反映了疏水相互作用力的强弱。由图4可知菜籽多肽与β-胡萝卜素的非共价相互作用力主要为疏水相互作用,且参与疏水相互作用的氨基酸大多在多肽“C端”。这与ALLAHDAD等[21-22]利用分子对接揭示β-胡萝卜素分别与酪蛋白和乳清蛋白主要通过疏水相互作用结合的结论类似。本课题组前期借助傅里叶变换红外光谱的研究表明菜籽多肽与β-胡萝卜素在包封过程中没有氢键的形成,因此更可能是疏水相互作用的结果[6]。根据疏水相互作用标识的数目可知,RPs-1的2个氨基酸(谷氨酰胺和缬氨酸)分别与β-胡萝卜素的2,6,6-三甲基环己烯基发生疏水相互作用,而RPs-2~RPs-5均只有1个氨基酸与β-胡萝卜素产生疏水相互作用。与RPs-2~RPs-5相比,RPs-1与β-胡萝卜素产生的疏水相互作用更强,可能具有更优的包封效果。此外,通过进一步归纳多肽与β-胡萝卜素相互作用的氨基酸种类可知,缬氨酸和谷氨酰胺与β-胡萝卜素的2,6,6-三甲基环己烯基产生的疏水相互作用可能在包封中发挥了重要的作用。因此,基于分子对接结果和亲疏水氨基酸的组成,通过化学合成RPs-1和RPs-5,用于验证包封实验。

A-RPs-1;B-RPs-2;C-RPs-3;D-RPs-4;E-RPs-5图4 2D相互作用可视化结果图Fig.4 The image of 2D interaction visualization results
2.3 相互作用包封的结果分析
合成多肽RPs-1和RPs-5的包封率和负载量如图5所示。RPs-1和RPs-5的包封率和负载量分别达到93.17%和0.56 mg/mg,95.70%和0.57 mg/mg。与利用食源性蛋白对类胡萝卜素包封的类似研究对比,乳清分离蛋白对番茄红素进行包封制备纳米颗粒的包封率仅为64.7%[23]。以玉米醇溶蛋白作载体,对叶黄素进行包封制备纳米颗粒,测得包封率为85.18%[24]。综上,合成的2条菜籽多肽对β-胡萝卜素的包封均表现出良好的效果,并且RPs-5较RPs-1具有更优的包封效果。这与分子对接结果略有差异,可能的原因是分子对接时所使用的是多肽与小分子物质(β-胡萝卜素)是一对一的相互作用,但在实际体系中往往是多个菜籽多肽分子与多个β-胡萝卜素分子之间的相互作用[25]。
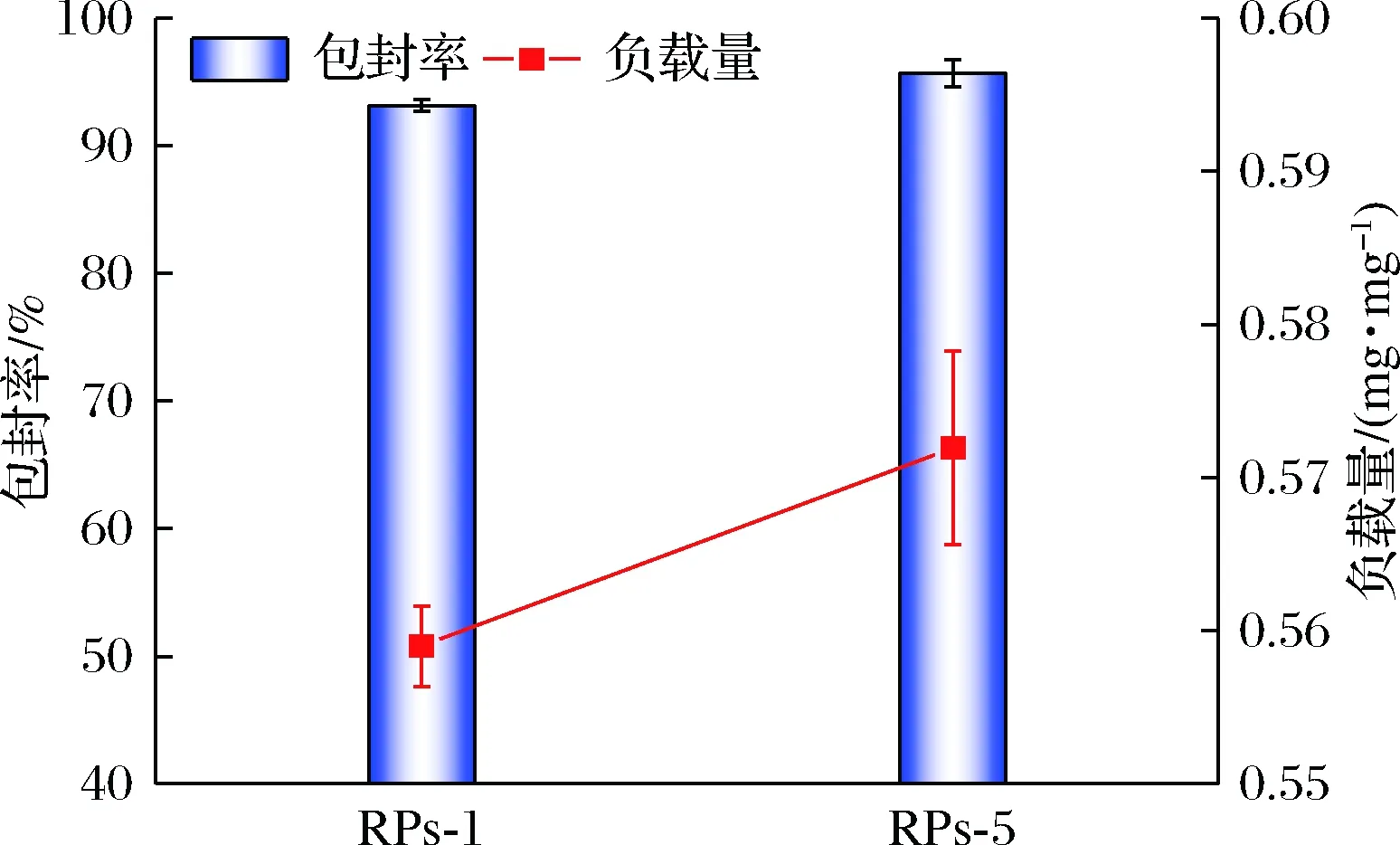
图5 RPs-1和RPs-5的包封率和负载量Fig.5 The encapsulation efficiency and loading amount on RPs-1 and RPs-5
3 结论
菜籽蛋白水解液中的多肽大部分来源于菜籽蛋白的储藏蛋白Cruciferin和Napin,少部分来源于油料蛋白Oleosins。菜籽多肽与β-胡萝卜素的相互作用力主要是疏水相互作用。此外,菜籽多肽中参与疏水相互作用的氨基酸主要为谷氨酰胺、缬氨酸、脯氨酸和异亮氨酸,并且大多在多肽链的“C端”。进一步筛选合成的2条多肽链(GFRDMHQKVE、NTGDQPLVII)均具有良好的包封效果。因此,本研究可为菜籽多肽包封β-胡萝卜素等疏水性生物活性物质提供一定的理论参考。
