经导管主动脉瓣置换术后心脏传导阻滞发生与影响因素分析
2022-09-07李春莉李子琪舒陈林张远飞庞明杰
刘 罗,张 艳,李春莉,李子琪,张 琳,舒陈林,张远飞,庞明杰
(1.昆明理工大学 医学院,云南 昆明 650500;2.昆明理工大学 附属医院,云南 昆明 650032;3.云南省第一人民医院 磁共振影像科,云南 昆明 650032;4.文山州人民医院 心内科,云南 文山 663000;5.楚雄州人民医院 心内三科,云南 楚雄 675000;6.云南省第一人民医院 心内科,云南 昆明 650032)
0 引 言
2010年,国内葛均波院士首次尝试TAVI手术成功,随着近10年技术的进步和已有的临床研究证据表明,经导管主动脉瓣膜置换术 (TAVI) 是治疗具有高手术风险或有症状的严重主动脉瓣狭窄患者的新选择,并逐渐在外科中、低危患者中开展.国外一项纳入358例无法行外科手术的重度主动脉瓣膜狭窄患者结果显示,与内科保守治疗相比,TAVI组全因死亡率、心源性死亡率,再住院率明显降低[1].然而,TAVI手术的各种并发症依然常见,尤其是术后新发心脏传导阻滞,其中高度房室阻滞会导致TAVI术后患者心功能恶化及死亡风险增加.尽管目前有新一代的经导管心脏瓣膜(THVs),但在 TAVI术后 30 d,平均永久性起搏器 (PPM) 率仍保持在10%左右或更高[2-3].目前有研究报道,预先存在的右束支传导阻滞,围手术期房室传导阻滞,PR间期延长等术前心电图异常可作为术后永久性起搏器植入的预测因素[4],但患者自身临床特征如合并脑卒中,陈旧性心梗等因素与术后新发心脏传导阻滞的相关性尚无定论.本研究对TAVI术后新发心脏传导阻滞患者可能的临床因素进行分析及随访术后心功能,为更好地防治TAVI术后新发心脏传导阻滞具有重要意义.
1 资料与方法
1.1 研究对象
回顾性收集2019年1月至2021年10月在云南省第一人民医院因重度主动脉狭窄行经导管主动脉瓣置换术的患者45例.纳入标准:1)术前超声心动图示重度主动脉钙化狭窄,即跨主动脉瓣压力差≥ 40 mmHg 或主动脉瓣口面积<0.8 cm2;2)患者有症状,如心悸、胸痛、晕厥,NYHA心功能分级Ⅱ级以上;3)外科手术高危或禁忌;4)解剖上适合TAVI;5)纠治AS后预期寿命超过12个月.排除标准:1)活动性消化性溃疡或 3个月内曾发生上消化道大出血;2)合并中重度二尖瓣或三尖瓣狭窄或反流;3)患者已存在完全性房室传导阻滞或已行起搏器植入;4)术前严重左心室功能不全,即左心室射血分数<20%,或主动脉根部解剖形态不适合TAVI患者.
1.2 术前评估
严格按照纳入标准,结合患者临床特征及影像学特征进行手术可行性及风险评估.首先对入选的患者进行心脏超声检查,以此整体评估患者的心脏结构、功能及主动脉瓣膜的功能和解剖.然后通过多排计算机断层扫描(MSCT)三维重建,采用3-Mensio软件进行更加精准的参数测量,包括主动脉根部所占体积、瓣环的周长和面积、瓣膜厚度及钙化程度,以此判断术中使用的球囊及瓣膜型号及瓣周漏的风险.在完整采集患者的基础资料后,行心胸外科风险评分(STS评分),由心血管介入、心脏外科、影像学、麻醉等组成的多学科团队经术前讨论,评估患者是否需要进行TAVI手术,制定手术方案.
1.3 手术过程
入室后采用全身麻醉,气管插管并行机械通气,穿刺颈静脉,植入临时起搏器,导丝植入右室心尖,并预备体外循环.TAVI选用经股动脉和经心尖两种途径,经股动脉途径具体手术步骤参照Grube等[5]所述方法.经心尖途径准备同经股动脉途径,具体手术步骤参照张振华等[6]所述方法.手术过程中,应注意观察球囊充分扩张时冠状动脉开口有无阻塞、反流、“腰征”.瓣膜置入前,行主动脉根部造影时,注意控制支撑导丝和瓣膜的深度,避免置入瓣膜过深或过浅.瓣膜置入及球囊扩张时,都应在临时起搏器快速起搏下进行,起搏频率在200次/min左右.再次造影观察瓣膜置入后有无反流及瓣周漏,同时通过食管超声心动图评估压差、跨瓣流速,判断是否需要球囊后扩.
1.4 观察指标
收集TAVI术前患者的基线资料,包括性别、年龄、BMI、血生化、超声心动图、心电图、有无其他合并疾病等,同时记录患者植入瓣膜型号,术后并发症情况.根据患者是否发生心脏传导阻滞分为两组,随访患者术后心脏功能情况.
1.5 统计学方法
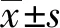
2 结 果
2.1 TAVI术后传导阻滞发生情况
本研究共入组重度主动脉狭窄患者45例,均成功行TAVI手术,采用第一代国产自膨瓣膜,瓣膜型号见表1.术后新发心脏传导阻滞14例,其中Ⅰ度心脏传导阻滞1例,Ⅲ度心脏传导阻滞2例,左束支传导阻滞11例,起搏器植入2例.
2.2 TAVI术后发生心脏传导阻滞组和未发生心脏传导组临床特征比较
TAVI术后发生心脏传导阻滞组(14例)合并糖尿病、陈旧性心肌梗死、术前主动脉瓣重度钙化、术前右束支传导阻滞、术前QRS波增宽分别为6例(42.9%)、5例(35.7%)、4例(28.6%)、8例(57.1%)、7例(50.0%),而未发生心脏传导阻滞组(31例)分别为9例(29.0%)、7例(22.6%)、3例(9.6%)、7例(22.6%)、6例(14.6%),两组差异均具有统计学意义(P<0.05),见表1.

表1 TAVI术后发生心脏传导阻滞组和未发生心脏传导阻滞组临床特征比较
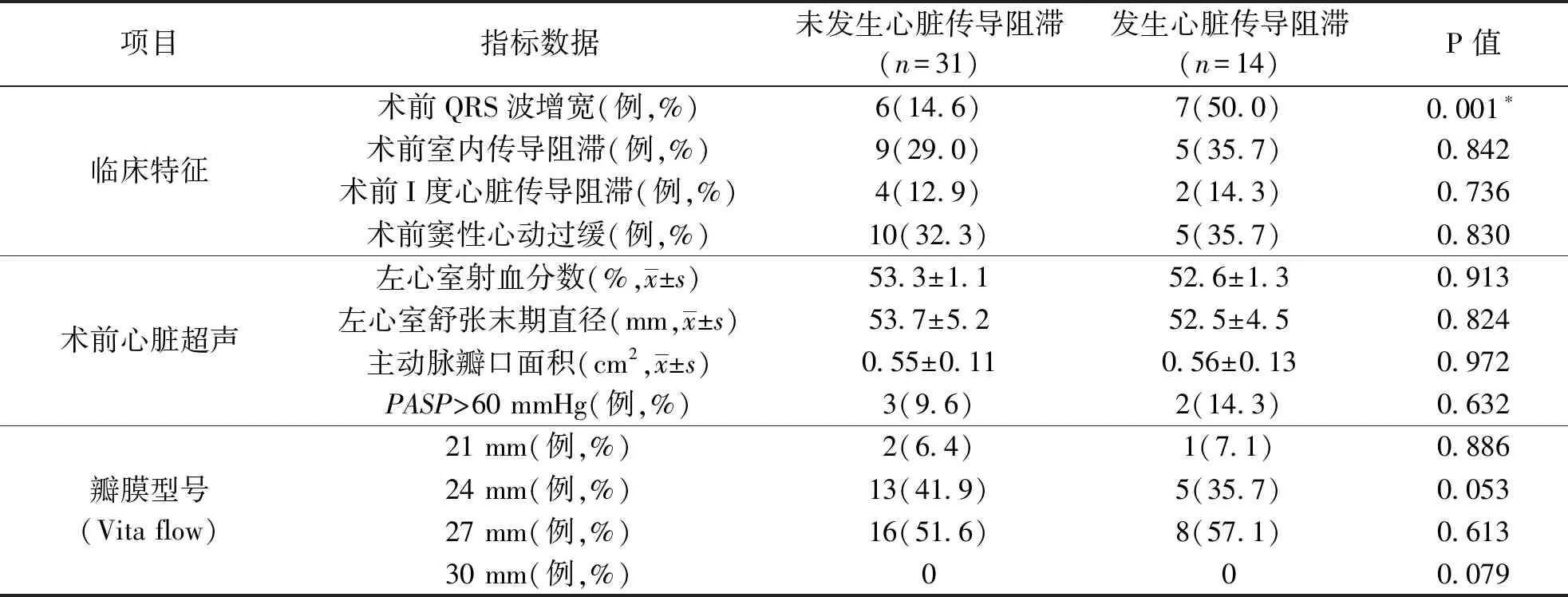
续表1
2.3 TAVI术后发生心脏传导阻滞相关因素的Logistic回归分析
TAVI术后发生心脏传导阻滞相关因素logistic回归分析显示(见表2),主动脉严重钙化(OR值为2.837,95%CI2.251~10.803,P值为0.003),术前QRS波增宽(OR值为1.425,95%CI1.352~3.264,P值0.042)及合并糖尿病(OR值1.018,95%CI1.053~6.514,P值0.010)是TAVI术后发生心脏传导阻滞的相关因素.

表2 TAVI术后发生心脏传导阻滞相关因素Logistic回归分析Tab.2 Logistic regression analysis of factors related to heart block after TAVI operation
2.4 TAVI术后早期并发症情况

图1 未发生心脏传导阻滞组与发生心脏传导阻滞组左室射血分数比较Fig.1 Comparison of left ventricular ejection fraction between the two groups with and without heart block after TAVI operation
发生心脏传导阻滞组:瓣周漏(轻中度)3例,低心排血量综合征1例,心肌梗死2例,使用IABP1例,I型呼吸衰竭1例,辅助通气时间延长1例,肺部感染2例.未发生传导阻滞组:瓣周漏(轻度)2例,持续性心房颤动2例,卒中1例,心肌梗死1例,上消化道出血1例,辅助通气时间延长1例,肺部感染1例.
2.5 TAVI术后左室心功能随访情况
术后平均随访3个月,两组患者心功能较术前均有改善,未发生心脏传导阻滞的患者整体左室射血分数高于发生心脏传导阻滞组,但两组差异无统计学意义(P>0.05).见图1.
3 讨 论
据多中心研究估计,目前TAVI手术的成功率近95%左右,术后30天病死率已由最初的22%下降至10%左右[7].但由于治疗对象多为高龄患者,术后并发症发生率仍较高.随着TAVI技术的迅速发展,瓣周漏、出血、血管并发症、卒中、冠脉动脉阻塞等并发症较之前大幅降低,但新发左束支阻滞(LBBB)及高度房室阻滞(AVB)在临床上发生率仍较高[8],对患者预后造成不良影响.
近90%的新发LBBB在TAVI术中或术后24 h出现[9],其中有19%~34%的患者会在术后数天之内恢复,有少数患者可以持续1年及以上[10].研究表明,LBBB 可以影响心脏的血流动力学和生物电传导,最终导致心室收缩和舒张功能受损.有关学者在TAVI术后1年的随访中,发现新发 LBBB 患者的LVEF并没有改善[11-12],这与本次研究结果相似,其中,新发LBBB患者术后3月心功能较之前略有改善,但其差异无统计学意义.在第一代瓣膜中,LBBB发生率约为4%~65%[13].其中,应用自膨瓣膜与球囊扩张瓣膜后LBBB的发生率分别为18%~65%、4%~30%[14].相比LBBB,新发AVB发生率较小,约10%~25%[15],因这类患者1年内心力衰竭及再住院风险增加,在临床与研究中也受到较多关注.一项多中心研究结果表明TAVI术后永久起搏器植入率约为19.8%[16],另一荟萃分析指出其起搏器植入率为2.3%~36.1%[8].本研究采用国产新一代自膨瓣膜,LBBB的发生率在24.4%,与国际研究中自膨瓣膜TAVI术后LBBB发生率无明显差别,而起搏器植入率为4.4%,相比上述研究很低.
目前,左室流出道瓣膜推荐植入深度小于 6 mm,瓣膜植入深度每增加 1 mm,LBBB风险增加 15%~40%[17].除植入深度外,研究表明TAVI术后新发心脏传导的相关因素包括男性、术前右束支阻滞、主动脉瓣钙化、糖尿病、瓣膜尺寸过大及经心尖途径[18-21]等,这与本研究结果部分相似.本研究还发现,TAVI术前QRS波增宽在发生心脏传导阻滞组和未发生心脏传导阻滞组患者中有显著性差异,且是TAVI术后新发传导阻滞的相关因素,这可能是因为QRS波增宽本身由束支传导阻滞引起.从解剖上看,希氏束处于心脏传导系统的核心部位,其左束支更是邻近主动脉瓣无冠瓣和右冠瓣底部,增加了术中传导束支水肿、炎症和缺血等机械损伤的风险.如果TAVI术前已存在右束支传导阻滞,术中又损伤到左束支,发生高度传导阻滞的概率就大大增加[22].因此,当患者主动脉瓣钙化越严重时,球囊预扩张次数增多,术中左束支损伤机率增大,新发心脏传导阻滞和起搏器植入风险也越大.
4 结 论
经过以上的统计分析,可以得到如下结论:
1)TAVI术后发生心脏传导阻滞组合并糖尿病、陈旧性心肌梗死、主动脉瓣重度钙化及术前右束支传导阻滞、术前QRS波增宽发生率高于未发生心脏传导阻滞组(P<0.05).
2)对TAVI术后发生心脏传导阻滞的相关因素进行单因素分析,将有统计学差异的因素进行多因素logistic回归分析,结果显示:主动脉严重钙化(OR值2.837,95%CI2.251-10.803,P值0.003),术前QRS波增宽(OR值1.425,95%CI1.352-3.264,P值0.042)及合并糖尿病(OR值1.018,95%CI1.053-6.514,P值0.010)是TAVI术后发生心脏传导阻滞的相关因素.
3)术后3月随访发现,两组患者心功能较前均有改善,且未发生心脏传导阻滞的患者整体左室射血分数高于发生心脏传导阻滞组,但差异无统计学意义(P>0.05).
综上所述,主动脉瓣严重钙化、术前QRS波增宽及合并糖尿病是TAVI术后发生心脏传导阻滞的独立危险因素.术前应重视发生传导阻滞的高危因素,同时注意瓣膜型号的选择及术中球囊预扩张次数,积极预防和治疗术后新发心脏传导阻滞.
