鸭疫里氏杆菌1型流行株的生物学特性及免疫原性
2022-09-07张敬峰董永毅卢凤英刘青涛孙华伟张小飞
张敬峰, 董永毅, 卢凤英, 刘青涛, 徐 彬, 赵 莎, 孙华伟, 吴 坤, 张小飞
(1.江苏省农业科学院兽医诊断检测中心,江苏 南京 210014; 2.江苏省动物疫病预防控制中心,江苏 南京 210036)
鸭传染性浆膜炎是由鸭疫里氏杆菌(Rimerellaanatipestifer,RA)引起的一种接触性传染病,多发于1~8周龄鸭,可导致大批鸭发病死亡以及生长迟缓[1]。鸭传染性浆膜炎不但常见于肉鸭各个生长阶段,还会引起成年蛋(种)鸭发病,造成较大的经济损失,是目前危害中国鸭养殖业的主要细菌性疾病之一。RA在自然界尤其是鸭场广泛分布,其血清型较为复杂,在世界范围内存在20余种[2],不同血清型及同型的不同毒株间毒力与免疫保护率有较大差异。中国目前流行的RA血清型主要以1型为主,也有2型、3型等报道。由于一般的鸭场、设施以及饲养方式相对落后,加之RA易形成耐药性,而上市的含某些RA血清型灭活疫苗因不同地区流行菌株的不同往往临床应用效果不佳,导致该病的防控较为困难。
本研究对2019年7月-2020年6月在江苏省、山东省等不同地区32个规模鸭场采集分离的RA菌株进行相关生物学特性研究,了解上述地区RA感染的优势血清型情况,并针对分离的1型RA流行菌株进行交叉攻毒保护等免疫原性研究,以期对RA的疫苗研发以及科学免疫防控提供参考依据。
1 材料与方法
1.1 样品来源与实验动物
病料样品为无菌采集的发病/死亡鸭脑、肝脏等组织。7日龄健康非免疫鸭(经间接血凝法测定血清1型RA抗体为阴性)来自江苏省农业科学院句容黄梅动物实验基地。
1.2 主要试剂
TSA、TSB培养基购自美国BD公司,马丁氏汤培养基购自北京奥博星公司,新生牛血清购自呼和浩特草原绿野公司,DNA提取试剂盒、PCR相关试剂均购自TaKaRa公司,SS、MAC培养基、微量生化发酵管等均购自杭州微生物试剂公司。1型、2型RA标准阳性血清由南京农业大学提供,矿物油佐剂由南京兆丰华生物科技公司提供。
1.3 细菌分离及形态观察
无菌操作挑取病死鸭脑组织、心血等病料接种于MAC平板、TSA平板(含2%新生牛血清)以及SS平板,置于5% CO2培养箱37 ℃培养48 h。观察细菌生长及菌落特征,选取典型菌落分别进行纯培养,挑取符合特征的单菌落,革兰氏染色并观察其形态。
1.4 分离菌PCR鉴定
参照文献[3]方法合成RA 16S rRNA鉴定引物,对各分离菌DNA进行 PCR 扩增,电泳观察分析PCR产物后由南京金斯瑞公司测序。运用BLAST将测序结果与GenBank上登录的RA进行基因序列比对分析[4]。
1.5 分离菌生化试验
按照微量生化反应试剂盒说明书,对各株分离纯培养物进行生化试验。
1.6 细菌血清型鉴定
载玻片上各滴加生理盐水20 μl,用接种环分别挑取方法1.3中纯化培养的各菌株菌落2~3个,在水中混匀后,滴加1型或2型RA阳性血清20 μl,混匀,进行凝集法血清分型鉴定。
1.7 分离株致病性试验
1.7.1 菌液制备 分别挑取5株RA1分离株(JP01、JP02、SD02、GY01、XZ01)单菌落各接种于5 ml改良马丁汤培养基,置37 ℃恒温箱振荡培养24 h。对培养物进行活菌计数后用无菌生理盐水稀释成约2.0×109CFU/ml菌液备用。
1.7.2 动物回归试验 取上述配制好的菌液,颈部皮下注射15日龄健康非免疫鸭各10只,每只注射1 ml,另设空白对照5只。连续观察10日,记录试验鸭发病、死亡等情况,剖检观察病理变化。参照方法1.3~1.6分别对回收细菌进行鉴定。
1.7.3 最小致病剂量的测定 根据方法1.7.2结果,选择其中3株致病力较强的RA1分离菌株,将其培养物分别稀释为2.0×109CFU/ml,再作2倍、5倍、20倍、100倍稀释,各稀释液分别取1 ml皮下注射15日龄健康非免疫鸭。其中试验组鸭分为4组,每组5只,另5只作为阴性对照。接种后连续观察10 d,根据各组鸭发病及死亡情况统计出致实验鸭全部发病的最小剂量。
1.8 不同分离株免疫原性测定
1.8.1 疫苗制备 将RA1分离株JP01、SD02、GY01分别接种含2%新生牛血清的TSB培养基,振荡培养24 h,进行菌落计数。按体积加入0.2%甲醛,37 ℃灭活24 h,经灭活检验合格后做为水相,按水相∶油相为1.0∶2.5(体积比)分别制备疫苗,使3个菌株疫苗的最终含菌量均为3.0×109CFU/ml左右。
1.8.2 分组与免疫 将60只7日龄健康非免疫鸭平均分为4组,其中3个组为免疫组,1个组为对照组,每组15只。分别颈背部皮下注射JP01、SD02、GY01菌株灭活疫苗,每羽0.3 ml。另设一组注射同剂量生理盐水作为对照。
1.8.3 交叉攻毒保护试验 上述实验鸭免疫后14 d,进行交叉攻毒试验。将每一组实验鸭(包括免疫组和对照组)平均分为3组,每组5只,分别用JP01、SD02、GY01菌株最小致病剂量菌液(1只1 ml)进行皮下接种攻毒。在攻毒后10 d内,连续观察,记录发病和死亡情况。
2 结果与分析
2.1 病料样品的细菌分离及形态鉴定
病料样品接种培养24 h后,23株分离菌中有16株在MAC平板、SS平板上未见细菌生长,但在含2%新生牛血清TSA培养基上生长出大小均匀的小菌落,呈圆形、微突起,直径约1~2 mm。16株细菌均为革兰氏阴性菌,菌体呈杆状,多为单个排列,培养及形态符合RA菌落特征[1]。
2.2 分离菌株的PCR鉴定
16S rRNA特异性引物PCR结果显示,16个菌株均可扩增出与目的片段800 bp大小一致的条带。将扩增产物测序结果在GenBank中进行比对分析,结果表明与登录的RA相应基因序列同源性均≥99%。根据分类标准,确定该16株分离菌为 RA。
2.3 分离菌株的生化特性
16个RA分离株均不发酵葡萄糖、甘露醇、果糖、蔗糖等多种碳水化合物,不产生靛基质,产生硫化氢,甲基红(MR)试验阴性,触酶试验阳性。生化特性均符合RA特征[1]。
2.4 分离菌株的血清型
16个分离株中有11株与1型RA标准阳性血清出现凝集现象,与2型RA标准阳性血清均不出现凝集现象,表明该11株分离菌为血清1型RA(表1)。

表1 16株RA分离鉴定结果
2.5 RA分离株的致病性
动物回归试验结果(表2)显示,5株RA1分离株菌液(约2.0×109CFU/ml)分别皮下接种15日龄非免疫鸭后24 h均引起实验鸭发病和死亡。其中有3株RA1分离株JP01、GY01、SD02发病率和死亡率较高,达到80%~100%,为强毒力菌株;2株RA1分离株JP02、XZ01引起部分鸭发病和死亡,死亡率为40%~60%,为中等毒力菌株。发病鸭死亡前期可见精神沉郁、卧地不起、食欲废绝、眼睑流泪等症状。死亡鸭剖检观察显示:24 h内死亡的实验鸭无明显病理变化;24~72 h死亡鸭部分肝脏出血,大部分死亡鸭心脏、肝脏表面有灰白色纤维素性渗出物,形成包膜;从病死鸭脑部、肝脏均分离回收到 1 型 RA。

表2 RA1动物回归试验结果
5株RA1分离株最小致病剂量测定结果(表3)显示,3株分离强毒力菌株(JP01株、GY01株、SD02株)引起实验鸭全部发病的最小致病剂量分别为1.0×108CFU、4.0×108CFU、1.0×109CFU,JP01株毒力最强,其次为GY01、SD02株。

表3 RA1对鸭的最小致病剂量
2.6 RA1分离株的交叉免疫保护特性
将制备的JP01、GY01、SD02株灭活疫苗免疫7日龄实验鸭14 d后,连同对照组鸭分别用各菌株的最小致病剂量菌液进行交叉攻毒。结果(表4)显示:各对照组鸭于攻毒后24 h均陆续出现发病、死亡;各免疫组整体精神状态良好,于攻毒后48 h出现部分实验鸭发病及死亡。统计结果表明:以JP01株灭活疫苗免疫组保护率最高,为100%保护;GY01株灭活疫苗保护率为60%~80%,SD02株灭活疫苗保护率为40%~80%。由此可见,JP01株灭活疫苗免疫交叉攻毒保护性能优于GY01、SD02株灭活疫苗,对RA1具有良好的免疫原性。
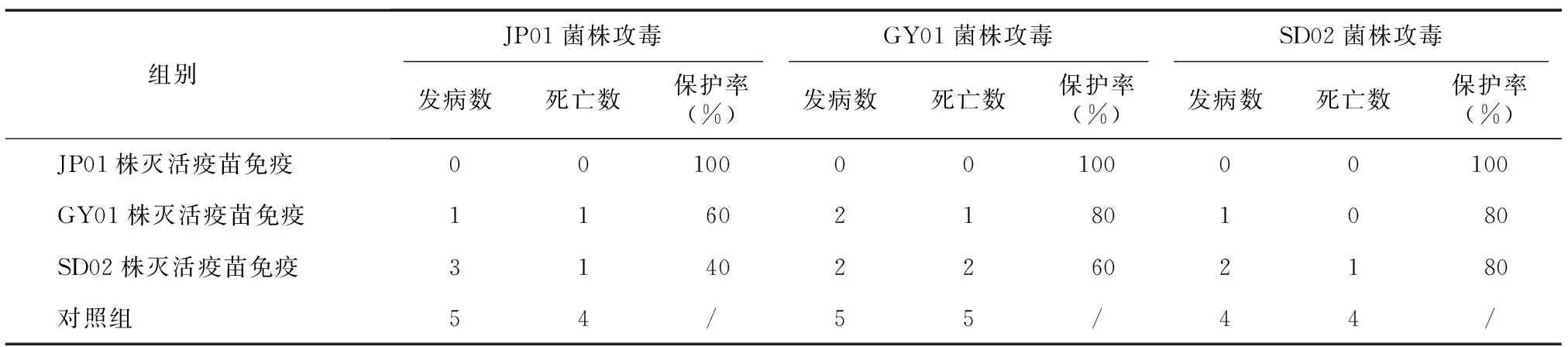
表4 3株RA1分离株灭活疫苗免疫攻毒保护试验结果
3 讨 论
本研究自2019年7月至2020年6月从江苏省、山东省等同地区规模鸭场分离到16株RA,其中11株为RA1型,占RA分离株的68.7%。中国在1997年之前,除了RA1型外,几乎没有关于其他血清型的报道[5]。随后几年间,张大丙等[6]在中国部分地区分离到2型、6型、10型、11型、13型等多种血清型。2003年程安春等[7]报道在全国29个省(市、自治区)病死鸭中分离到1 842株RA,包括17个血清型,其中RA1型占比为34.9%,为主要血清型。至今鲜见国内大范围的RA血清型调查研究报道。2013年刘运镇等[8]报道在江苏省多地分离的41株RA菌株中29株为1型,占分离RA的70.7%。2015-2016年袁小远等[9]在山东省等地分离的18株RA菌株全部为1型。2018-2019年王昊等[10]在江苏省苏北及周边地区分离的30株RA菌株中15株为1型,占分离RA的50%。以上三者报道与本研究RA1分离情况相似,说明RA1仍然是江苏省、山东省等省份鸭场流行的优势血清型。
RA血清型的准确鉴定对于获取流行病学资料以及免疫防治极其重要。自Harry[11]采用凝集试验进行RA血清型鉴定至今,该方法已成为RA菌株分型的主要手段。国际上虽就RA血清型的命名形成了统一认识[12],但因国内近年来缺乏系统性的标准血清相关研究,传统的分型方法受标准血清来源以及抗原差异等影响,导致存在某些血清分型上的混淆现象,给RA的免疫防控等造成了一定干扰。随着分子生物学技术的发展,关于RA分子学分型等方法研究也逐渐丰富[13],期望能够尽快得到广泛应用。
鸭传染性浆膜炎在中国被发现以来,已成为危害鸭乃至水禽养殖业最主要的细菌性疾病。2019年张敬峰等[14]报道显示鸭疫里氏杆菌阳性率占所检测的水禽5种主要细菌性病原的36.01%,其感染发病在临床最为常见。由于近年来水禽养殖过程中抗菌药的频繁使用以及耐药菌株不断产生等因素,导致在鸭细菌性疾病尤其是鸭传染性浆膜炎的临床药物治疗效果越来越差,而药物残留也威胁人类健康,影响公共卫生安全[15]。防控该病除加强生物安全管理等措施外,疫苗免疫是较为有效的手段,但RA血清型众多且各血清型之间的交叉保护作用差[16],血清型的多样化分布也直接制约了疫苗的免疫效果发挥。本研究选取RA1流行株对雏鸭进行免疫保护试验,从结果可看出各受试菌株制备的灭活疫苗免疫实验鸭后,各菌株对同型同源的交叉保护率均为80%以上,部分菌株对同型不同源的交叉免疫保护率相对较低,其中SD02菌株灭活疫苗保护率仅40%~80%,也有如JP01菌株灭活疫苗对同型菌株的攻击显示出良好的免疫保护率(100%)。提示在商品化RA灭活疫苗制备时除应考虑不同血清型RA的存在与分布差异,还应在地区优势血清型中选择对同型菌株免疫率较高的代表性菌株灭活疫苗。
